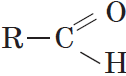
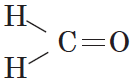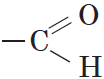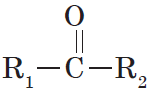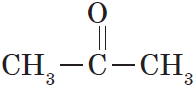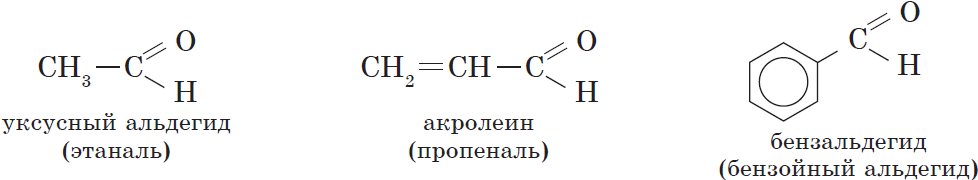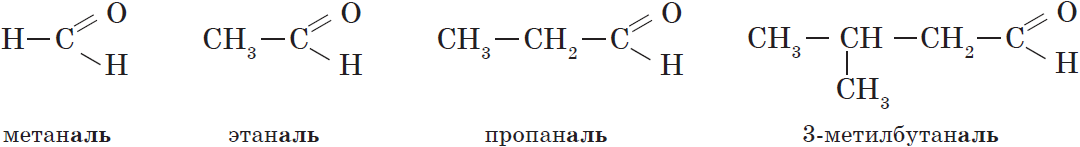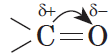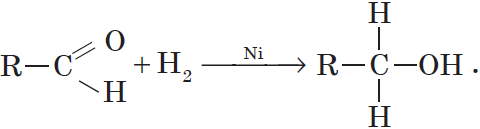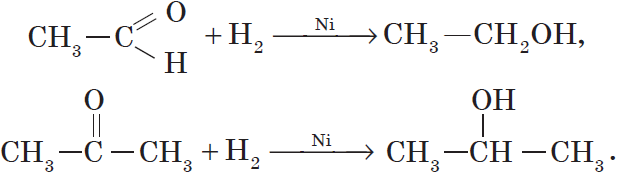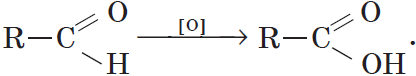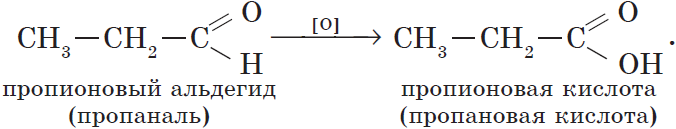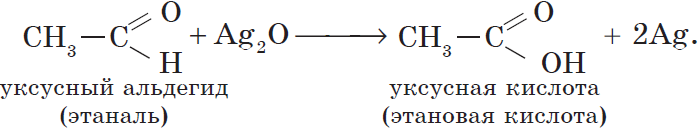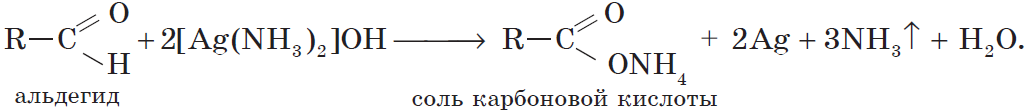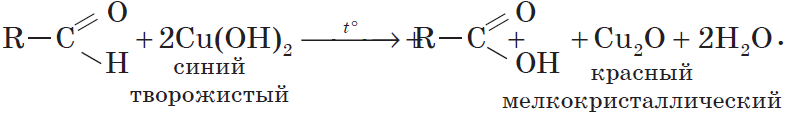Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
- Тривиальные названия альдегидов и кетонов приведены в таблице.
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
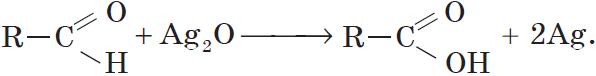
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Получение карбонильных соединений
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид
Например, при окислении изопропанола оксидом меди образуется ацетон
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь
В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон
4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь
5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:
6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:
Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:
Суммарное уравнение реакции:
7. Каталитическое окисление алкенов
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.
Электронное и пространственное строение альдегидов на примере этаналя


Оси X,Y,P,Q
и W лежат в плоскости
α. Оси ZC
и ZO
перпендикулярны этой плоскости. Атомы
водорода метильной группы свободно
вращаются вокругоси Х (оси связи
С – С ). Неподелённые пары электронов
атома кислорода находятся на sp2-орбиталях,
оси которых Р и W лежат в плоскости
α под углом 120О друг к другу
и к оси Y.
Способы получения альдегидов и кетонов
Есть много способов получения
альдегидов и кетонов путём окисления
углеводородов и их функциональных
производных. Ниже приведены примеры
таких реакций.
Газофазное каталитическое окисление
алканов:


Реакция малоселективна. Выход пропаналя
и ацетона около 70 %. Наряду с ними
получаются продукты недоокисления:
пропанол-1 и пропанол-2, а также продукты
деструкции: метаналь, этаналь, метанол
и этанол.
Озонолиз алкенов:

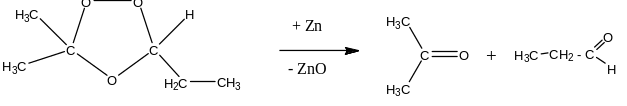
Кетоны можно получить из
алкенов путём их окисления сильными
окислителями в кислой среде:


Кетоны и дикетоны можно
также получить, окисляя алкадиены:


пентанон-3
2,5-гександион пропанон
Из нетерминальных алкинов можно
получить дикетоны путём окисления
их оксидом осмия (VIII):

Метильные производные аренов
можно окислить до альдегидов (а не
до карбоновых кислот) окислителями
средней силы – SeO2
и MnO2:

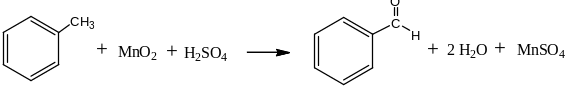
При пропускании паров первичных
спиртов над раскалённым оксидом меди
(II) получаются альдегиды, например:
Из вторичных спиртов в аналогичных
условиях получаются кетоны:

При окислении сложных эфиров со
вторичными радикалами в спиртовой части
получаются кетоны, например:



Наряду с окислением первичных
и вторичных спиртов альдегиды и кетоны
можно получить из них же путём
каталитического дегидрирования на
палладии, платине или никеле:

пропанол-1
пропаналь

пропанол-2
пропанон
Альдегиды могут быть получены
так же путём сложного
окислительного-восстановительного
процесса – взаимодействия алкинов
или алкенов с угарным газом и водородом
в присутствии катализатора –
тетракарбонилникеля при высоком давления
( 150 – 200 атм ) и высокой температурые(
150 – 200ОС ):
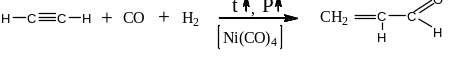
этин (ацетилен)
пропеналь
(акролеин)
этен (этилен)
пропаналь
При взаимодействии ароматических
соединений с угарным газом так же
образуются альдегиды. Реакция идёт
в условиях аналогичных условиям
протекания реакции Фриделя- Крафтса:

анизол (метоксибензол)
о— и п-метоксибензальдегиды
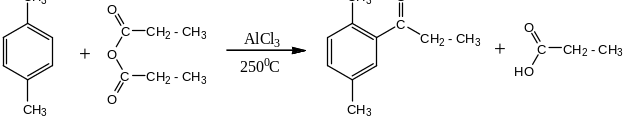
Альдегиды и кетоны можно получать
способами не связанными с окислением
и восстановлением. Из аренов, например,
можно получить кетоны путём реакции
ацилирования по Фриделю- Крафтсу
действвием галогенангидридов кислот:

толуол ацетилхлорид
о— и п-метилацетофеноны
При более высокой температуре
проходит так же реакция с ангидридами
кислот:
Из галоидных алкилов можно при
низкой температуре действием магниевой
стружки в эфире получить магнийорганическое
соединение:
Путём их реакции с галогенангидридами
карбоновых кислот можно получить
кетоны:

Альдегиды из карбоновых кислот
в одну стадию не получаются, но можно
их получить в две стадии: первая –
перевод в хлорангидрид действием
либо пентахлорида фосфора, либо
оксидадихлорида серы, и вторая –
восстановление полученного
хлорангидрида по Розенмунду, то
есть водородом на палладии, отравленном
соединениями серы, например,
тетраметилтиомочевиной:

Кетоны можно получить из
карбоновых кислот через их кальциевые
соли. Первая стадия — получение
кальциевой соли по реакции либо с
гидроксидом кальция, либо с его оксидом,
либо с карбонатом, например:

или
,
или

На второй стадии кальциевую соль
греют выше 200оС и она разлагается
с образованием симметричного кетона
и карбоната кальция, например:

Если смешать кальциевые соли
муравьиной кислоты и любой другой
карбоновой кислоты, то получатся
три органических продукта: формальдегид,
другой альдегид и симметричный
кетон, например:

Кетоны можно получить так же,
пропуская пары карбоновых кислот над
нагретыми катализаторами, такими
как BaCO3, MnCO3
или ThO2:

Если пропускать пары двух кислот
одновременно, то получаются два
симметричных кетона и один
несимметричный, например:

уксусная кислота
2-метилпропановая кислота
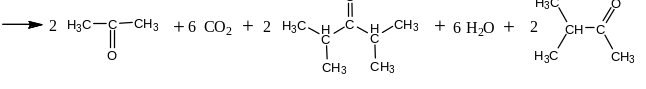
ацетон
2,4-диметилпентанон-3
3-метилбутанон-2
Если одна из двух кислот муравьиная,
то получаются формальдегид, другой
альдегид и симметричный кетон:

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу 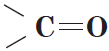
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
По этой причины альдегиды обладают высокой реакционной способностью, активно вступают в реакции присоединения.
Химические свойства альдегидов
1) Реакции присоединения:
а) реакция гидрирования (Pt/Ni, t0)
СН3 – СН=О + Н2 → СН3 – СН2 – ОН
б) реакция присоединения гидросульфита натрия NaHSO3
СН3 – СН=О + NaHSO3 → СН3 – СНОН –SO3Na
в) реакция полимеризации
nR – СН=О → –[–CH – O –]n–
׀
R
В водных растворах формальдегид образует полимер, называемый параформом.
nН – СН=О + Н2О → Н –[–СН2 – О–]n– ОН
формальдегид полиоксиметилен или параформ
2) Реакции окисления:
а) горение
2CH3CHO + 5O2 → 4CO2 + 4H2O
б) реакция «серебряного зеркала»
2[Ag (NH3)2](OH) + СН3 – СН=О → 2Ag↓ + СH3COONH4 + 3NH3 + H2O
в) окисление (Cu(OH)2, KMnO4, K2Cr2O7 и др.)
2Cu(OH)2 + СН3 – СН=О → Cu2O↓ + СH3COOH + 2H2O
Муравьиный альдегид (формальдегид) занимает особое место в ряду альдегидов. В связи с отсутствием у муравьиного альдегида радикала, ему присущи некоторые специфические свойства. Окисление формальдегида осуществляется до углекислого газа СО2.
Реакции с аммиачным раствором оксида серебра (I) и гидроксидом меди (II) могут
являются качественными реакциями на альдегиды.
3) Реакция поликонденсации
Особое практическое значение имеет реакция поликонденсации формальдегида с фенолом с образованием фенолформальдегидных смол (см. химические свойства фенола).
Получение
1) Окисление первичных спиртов
СН3 — СН2 — ОН + CuO → Cu + H2O + CH3 — CH=O
2) Дегидрирование первичных спиртов. Реакцию проводят, пропуская пары спирта над нагретым до 200-300°С катализатором, в качестве которого используются медь, никель, кобальт и др.
СН3 — СН2 — ОН → H2 + CH3 — CH=O
3) Гидролиз дигалогенопроизводных углеводородов, однако только тех, у которых оба атома галогена расположены у одного из концевых атомов углерода.
СН3 — СНCl2 + 2NaOHводн. → СН3 – СОН + 2NaCl + Н2О
4) Получение этаналя
а) окисление этилена кислородом воздуха в присутствии солей меди и палладия
2СН2 = СН2 + О2 → 2CH3 — CH=O
б) гидратация ацетилена (реакция Кучерова)
СН ≡ СН + Н2О → СН3 – СОН
5) Получение метаналя
Окисление метана при 500oС в присутствии оксидов азота
CH4 + O2 → HCHO + H2O
Применение альдегидов
Из альдегидов наибольшее применение имеет формальдегид. Используется обычно в виде водного раствора – формалина.
1) Получение фенолформальдегидных и мочевино-формальдегидных (карбамидных) смол, полиоксиметиленовых полимеров.
2) Синтез лекарственных средств (уротропин).
3) Дезинфицирующее средство (40% водный раствор — формалин).
4) Консервант биологических препаратов (благодаря способности свертывать белок).
5) В сельском хозяйстве формалин необходим для протравливания семян.
6) В кожевенном производстве формалин оказывает дубящее действие на белки кожи, делает их более твердыми, негниющими.
7) В мебельной и деревообрабатывающей промышленности
Уксусный альдегид применяется в широких масштабах в промышленности органического синтеза: для получения уксусной кислоты, этанола, бутадиена, ацетатного волокна, альдегидных полимеров.
gstreve
Вопрос по химии:
СРОЧНО!!! Напишите электронную формулу уксусного альдегида
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
ghanca892
Решение в фото…………….)))

Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.