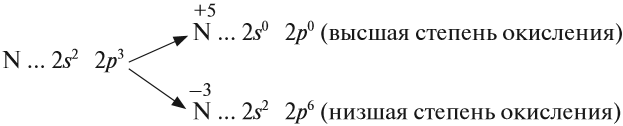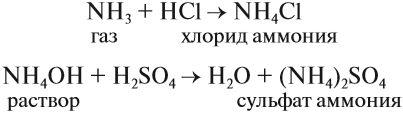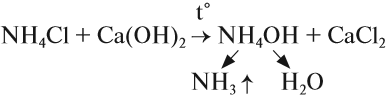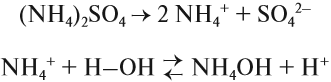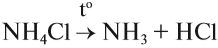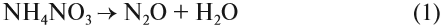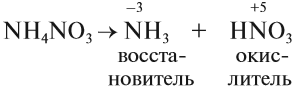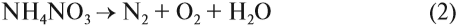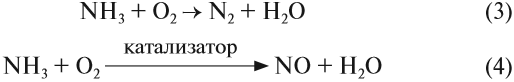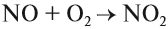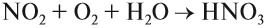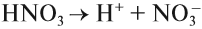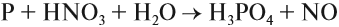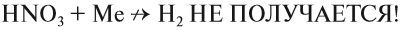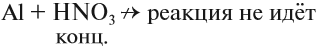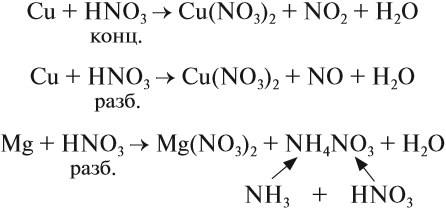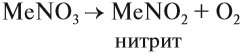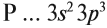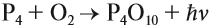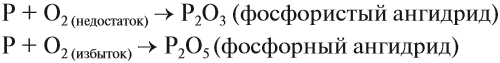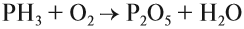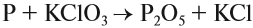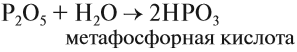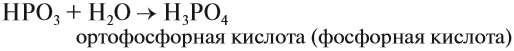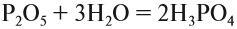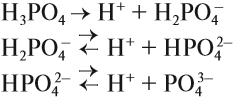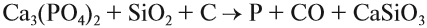Аммиак

4.7
Средняя оценка: 4.7
Всего получено оценок: 482.
4.7
Средняя оценка: 4.7
Всего получено оценок: 482.
Аммиак является газообразным веществом с резким неприятным запахом. Какими свойствами он обладает, и с какими веществами вступает в реакции?
Строение молекулы
Электронная формула аммиака выглядит следующим образом:
Из четырех электронных пар при атоме азота – три общие и одна неподеленная. В образовании молекулы NH3 участвуют три неспаренных p-электрона атома азота, электронные орбитали которых взаимно перпендикулярны, и 1s-электроны трех атомов водорода. Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями H-N-H равен 107,78 градусов.
Физические свойства
Аммиак – газ не имеющий цвета с характерным резким запахом. Температура кипения аммиака – -33,4 градуса по Цельсию, плавления – -77,8 градусов.
Аммиак хорошо растворяется в воде (при 20 градусах в 1 объеме воды растворяется до 700 объемов аммиака). Концентрированный раствор имеет плотность аммиака 0,91 г/см3.
Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворенный аммиак улетучивается из раствора.
Несколько хуже аммиак растворим в органических растворителях (спирт, ацетон, хлороформ, бензол). Аммиак хорошо растворяет многие азотосодержащие вещества.
Жидкий аммиак имеет большую теплоту испарения (при -50 градусах 145 кДж/кг, при 0 градусах 1260 кДж/кг, при 50 градусах 1056 кДж/кг).
Молярная масса и молекулярная масса аммиака равна 17
Химические свойства
В химическом отношении аммиак довольно активен. реакции, в которых участвует аммиак, сопровождаются либо изменением степени окисления азота, либо образованием особого вида ковалентной связи. Большая растворимость химического вещества в воде обусловлена образованием водородных связей между их молекулами.
Аммиак способен реагировать со следующими веществами:
- при взаимодействии с кислотами аммиак нейтрализует их, образуя при этом соли аммония:
NH3+HCl=NH4Cl
- при взаимодействии с галогенами аммиак обычно окисляется до свободного азота:
8NH3+3Br2 =N2 +6NH4 Br
- в смеси с кислородом аммиак горит зеленовато-желтым пламенем:
4NH3+3O2=6H2O+2N2
- при нагревании аммиак восстанавливает оксид меди (II), а сам окисляется до свободного азота:
3CuO+2NH3=3Cu+N2+3H2O
– с помощью данной реакции можно получить кислород в лабораторных условиях.
Получение и применение
В лаборатории аммиак получают, нагревая хлоридом амония NH4Cl с гашеной известью Ca(OH)2 :
2NH4 Cl+Ca(OH)2 =CaCl+2NH3+2H2O
– выделяющийся аммиак содержит пары воды.
В промышленности аммиак получают из азота и водорода. Реакция синтеза аммиака протекает с выделением тепла и уменьшением объема:
N2+3H2=2NH3
Температура, необходимая для проведения синтеза аммиака, достигается путем предварительного подогрева азото-водородной смеси и за счет выделения реакционного тепла. Катализатором синтеза аммиака является губчатое железо, активированное некоторыми металлами. Сероводород, кислород, оксид и диоксид углерода, пары и другие смеси, содержащиеся в азото-водородной смеси, резко понижают активность катализатора. Синтез ведут при при температуре 500-550 градусов и давлении от 15 до 100 МПа.
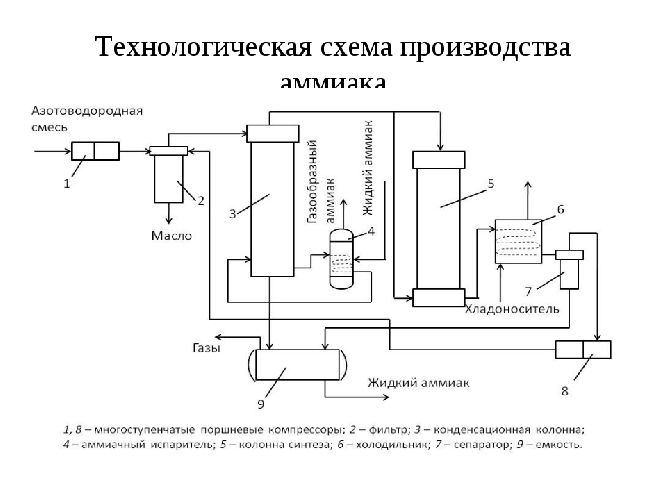
Схема установки синтеза аммиака выглядит так:
Большая часть синтезируемого в промышленности аммиака используется для получения азотной кислоты и других азотосодержащих веществ. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Водные растворы аммиака применяются в химических лабораториях и производствах в качестве слабого легколетучего основания. Также водные растворы используют в медицине и быту.
Что мы узнали?
Изучение аммиака входит в обязательный школьный курс химии. Аммиак – химическое соединение, в состав которого входит азот и водород. Газ является бесцветным веществом с ярко выраженным запахом и вступает в реакции с кислотами, водой, галогенами, кислородом и другими сложными и простыми веществами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 482.
А какая ваша оценка?
Содержание
- Строение атома и свойства азота
- Аммиак и соли аммония
- Азотная кислота и её соли
- Строение атома и свойства фосфора
- Свойства и значение соединений фосфора
- Выводы
Строение атома и свойства азота
Азот — элемент пятой группы второго периода Периодической системы Менделеева.
Задание 14.1. Опишите строение атома этого элемента.
Имея на внешнем энергетическом уровне пять электронов, азот является типичным неметаллом, т. е. способен и принимать и отдавать электроны:
Задание 14.2. Составьте формулы простейших соединений азота с высшей (+5) и низшей (–3) степенями окисления (в случае затруднений см. урок 3).
Задание 14.3. Определите степени окисления азота в соединениях:
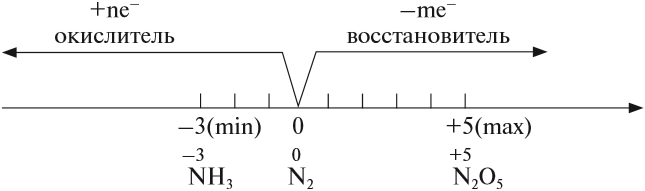
В своих соединениях атом азота может проявлять любые степени окисления от –3 до +5. Свойства некоторых из этих соединений будут рассмотрены ниже.
Простое вещество — азот N2 — составляет 4/5 Земной атмосферы. Азот в виде соединений (белков) входит в состав всех живых существ. Неорганических соединений азота в земной коре очень мало: 0,002 % по массе.
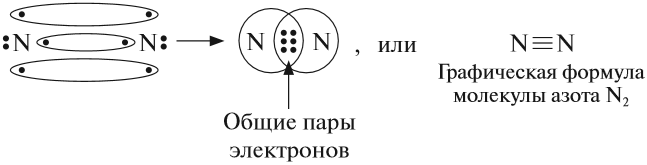
Вопрос. Какой тип химической связи соединяет атомы азота в его молекуле N2?
Поскольку в этой молекуле объединяются одинаковые атомы — связь ковалентная неполярная:
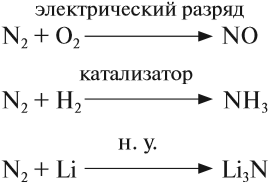
Кроме того, это — тройная связь, на разрыв которой требуется затратить очень много энергии. Поэтому при нормальных условиях азот не реагирует ни с одним веществом, кроме лития. При определённых условиях (нагревание, присутствие катализатора) азот реагирует с некоторыми металлами и неметаллами:
Задание 14.4. Расставьте коэффициенты. Определите, какие свойства (окислителя или восстановителя) проявляет азот в этих реакциях.
Поскольку атом азота в молекуле азота N2 имеет промежуточную степень окисления 0, в химических реакциях он может быть и окислителем и восстановителем:
Так как азот с трудом вступает в химические реакции, он относится к инертным газам и используется там, где нужно изолировать что-либо от окислительного действия кислорода: внутри баллона лампочки накаливания, атмосфера нефтехранилища и т. д.
Очень низкая температура кипения жидкого азота (–195,8 °C) позволяет быстро замораживать пищевые продукты и сохранять их в таком виде длительное время.
Важнейшими органическими соединениями азота являются белки, которые входят в состав любого живого организма. Но большинство живых существ не могут получать белки из атмосферного азота (связывать азот). Для этого нужны его соединения. Важнейшими неорганическими соединениями азота являются аммиак, азотная кислота и их соли.
Аммиак и соли аммония
Аммиак NH3 — бесцветный газ с резким запахом, ядовит.
Задание 14.5. Составьте электронную и графическую формулы аммиака и определите тип химической связи в этой молекуле.
Поскольку связь N-Н сильно полярна, аммиак очень хорошо растворяется в полярном растворителе (воде) и реагирует с нею:
Вопрос. Какую реакцию среды имеет полученный раствор?
В результате этой реакции в растворе появляется избыток ионов ОН–, поэтому раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную среду и проявляет свойства слабого основания. Называется это основание «гидроксид аммония», и ему приписывают формулу NH4OH. Поскольку это щёлочь (растворимое основание), получаемая из летучего вещества (газа), её называют «летучей щёлочью».
Вопрос. Будет ли аммиак, а также его водный раствор реагировать с кислотами? щелочами?
Проявляя основные свойства, аммиак реагирует только с кислотами и не реагирует со щелочами:
В результате таких реакций образуются соли аммония, в которых вместо катиона металла имеется одновалентный катион аммония NH4+. Соли аммония имеют ряд особенностей:
1. Соли аммония, как соли слабого основания, реагируют со щелочами:
Задание 14.6. Составьте уравнение этой реакции в ионномолекулярном виде. Не забудьте, что гидроксид аммония — слабое основание.
Если такая реакция идёт при нагревании, то получается аммиак в виде газа. Это лабораторный способ получения аммиака:
Кроме того, появляется характерный запах — качественный признак присутствия солей аммония в смеси. Эту реакцию используют для получения аммиака в лаборатории.
Вопрос. Будут ли соли аммония подвергаться гидролизу?
2. Соли аммония, как соли слабого основания, подвергаются гидролизу:
Вопрос. Какая реакция среды получается в результате данного процесса?
Задание 14.7. Составьте уравнение реакции гидролиза нитрата аммония. Какой цвет имеет лакмус в этом растворе?
3. Соли аммония, как соли летучего основания, разлагаются при нагревании. При этом может выделяться аммиак:
Но если соль образована кислотой, анион которой является сильным окислителем, аммиак не выделяется:
Почему в этом случае не выделяется аммиак? Возможно, что сначала процесс идёт как обычно:
Но поскольку азотная кислота — окислитель, а аммиак — восстановитель, они тут же реагируют друг с другом. При разложении нитрата аммония возможны и другие продукты реакции:
Задание 14.8. Составьте электронный баланс для реакций (1) и (2), укажите окислитель и восстановитель.
Вопрос. Почему атом азота в аммиаке проявляет восстановительные свойства? Может ли этот атом принимать электроны?
Атом азота в молекуле аммиака имеет низшую степень окисления –3 и поэтому способен только отдавать электроны и проявлять восстановительные свойства. Поэтому аммиак легко реагирует с окислителями, например с кислородом, и горит:
Реакция (3) практического смысла не имеет: зачем возвращать в атмосферу азот, который только что с таким трудом был превращён в аммиак? Зато реакция (4) каталитического окисления аммиака используется при получении азотной кислоты. Кроме того, аммиак и его соли применяются как азотные удобрения, а нитрат аммония входит в состав взрывчатых смесей.
Азотная кислота и её соли
Азотную кислоту получают в три стадии. Первая — каталитическое окисление аммиака. Полученный бесцветный газ NO окисляют в бурый газ NO2:
Эта реакция идёт даже при нормальных условиях. Полученный бурый газ NO2 очень ядовит, имеет резкий запах. Растворением его в воде в присутствии кислорода получают азотную кислоту:
Азотная кислота — очень сильный электролит, в растворе полностью диссоциирует на ионы:
Вопрос. Какие свойства проявляет атом азота азотной кислоты в окислительно-восстановительных реакциях?
Поскольку атом азота в азотной кислоте находится в высшей степени окисления +5, азотная кислота — сильный окислитель. Она окисляет и простые и сложные вещества:
Органические вещества, входящие в состав бумаги, хлопка, скипидара, могут загореться при соприкосновении с концентрированной азотной кислотой. Не удивительно поэтому, что при взаимодействии металлов с азотной кислотой не удаётся получить водород в качестве продукта реакции:
Действительно, водород — восстановитель, а азотная кислота — окислитель, и они легко реагируют друг с другом в момент выделения водорода. В результате таких реакций образуются оксиды азота или аммиак, который образует с азотной кислотой соль аммония:
Обратите внимание.
- Концентрированная азотная кислота не реагирует с алюминием, хромом и железом, так как образует на их поверхности прочную оксидную плёнку, которая предохраняет металл от дальнейшего окисления (пассивирует его).
- Азотная кислота реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода (водород и здесь НЕ выделяется!).
- Продукт реакции зависит и от активности металла и от разбавления кислоты: чем активнее металл и чем разбавленнее кислота, тем сильнее восстанавливается кислота, т. е. сильнее изменяется степень окисления атома азота (вплоть до –3).
Задание 14.9. Расставьте коэффициенты в этих уравнениях реакций, пользуясь методом электронного баланса.
В любой из этих реакций образуется соль азотной кислоты — нитрат. Нитраты — это хорошо растворимые соли, применяемые часто в качестве удобрений (KNO3, NH4NO3). Соединения азота используются в качестве удобрений, поскольку растения, как и человек, не способны усваивать азот воздуха, т. е. не способны превращать N2 в органические соединения азота. А без этих соединений — аминокислот, белков, нуклеиновых кислот — жизнь в принципе невозможна.
При использовании таких удобрений следует помнить, что избыток нитратов в почве и растениях опасен для жизни, так как нитраты ядовиты!
Нитраты легко разлагаются при нагревании, причём продукты разложения зависят от активности металла. Так, нитраты очень активных металлов — селитры — разлагаются по схеме:
Задание 14.10. Составьте уравнение реакции разложения нитрата натрия.
Селитры входят в состав взрывчатых веществ. Так, нитрат калия входит в состав чёрного пороха. Действием на сухие нитраты концентрированной серной кислотой можно получить азотную кислоту.
Строение атома и свойства фосфора
Фосфор был получен и назван алхимиком Брандом*, который пытался найти философский камень.
* БРАНД Хённинг (ок. 1630–после 1710) — немецкий алхимик без специального образования, профессиональный военный.
Этот камень, по убеждению алхимиков, мог превращать металлы в золото, обладал магическими свойствами. В 1669 году Бранд из остатков прозаической мочи выделил вещество, которое светилось в темноте. Безусловно, такими свойствами мог обладать только философский камень! Увы, никакими чудодейственными свойствами это вещество не обладало, но способность свечения в темноте подарило веществу и химическому элементу имя: его назвали фосфор, что означает «несущий свет».
Задание 14.11. Составьте электронную схему строения атома фосфора, укажите распределение валентных электронов, возможные степени окисления.
Распределение валентных электронов атома фосфора:
Поэтому фосфор проявляет в соединениях степени окисления –3, +3 и +5.
Задание 14.12. Составьте формулы водородных соединений, оксидов и гидроксидов фосфора, которые соответствуют этим степеням окисления.
Ниже мы рассмотрим свойства этих соединений, но вначале следует описать свойства простого вещества.
Как и для углерода, для фосфора характерно несколько аллотропных модификаций. В природе они не встречаются ввиду высокой активности этого неметалла. Почему, собственно, светился фосфор, полученный алхимиком? Потому что это был белый фосфор. Он имеет состав Р4. Это неполярное вещество, легко испаряется (возгоняется), причём пары белого фосфора окисляются на воздухе. При этом энергия химической реакции переходит в световую:
Появляется свечение.
Полученный оксид проявляет ярко выраженный кислотные свойства, так как фосфор — активный неметалл, а степень окисления атома фосфора — высшая. Поэтому при попадании на кожу белого фосфора появляются глубокие, плохо заживающие ожоги. Кроме того, белый фосфор, его пары — токсичное вещество. Белый фосфор — желтоватое мягкое вещество, растворимое в неполярных растворителях.
В противоположность ему — красный фосфор достаточно инертное вещество, безвредное для человека, но при условии, что оно — абсолютно чистое. Примеси белого фосфора, которые довольно часто встречаются, делают его ядовитым. В чём причина такого разительного изменения свойств? В том, что красный фосфор и другие аллотропные модификации фосфора — являются неорганическими полимерами. И чем выше степень полимеризации, тем инертнее вещество, тем темнее цвет. В настоящее время кроме чёрного фосфора описаны свойства жёлтого, алого, фиолетового, коричневого и даже стеклообразного.
Чаще всего встречаются и используются белый, красный и чёрный фосфор. Рассмотрим свойства красного фосфора.
Красный фосфор — это красно-бурый аморфный порошок практически нерастворимый в воде и неполярных растворителях, поскольку это полимер. Степень полимеризации установить невозможно, поэтому химическая формула Р. В зависимости от того, происходит ли горение в избытке или недостатке кислорода, образуются разные оксиды:
Кроме того, фосфор реагирует с активными металлами и неметаллами:
Задание 14.13. Составить уравнение реакции фосфора с кальцием. Назвать полученное вещество.
Фосфиды, как и нитриды, силициды, разлагаются водой и кислотами. В результате образуется фосфин — ядовитый газ с неприятным чесночным запахом. Он способен самовоспламеняться на воздухе:
Именно огоньки-вспышки этого газа пугают прохожих на кладбищах, поскольку фосфин образуется при гниении белковых тел. А это означает, что фосфор, как и азот, — биогенный элемент. Биологические свойства соединений фосфора будут рассмотрены ниже.
Вышеперечисленные реакции подтверждают ранее установленное правило: атомы с промежуточной степенью окисления проявляют свойства и окислителя, и восстановителя. Восстановительные свойства фосфора проявляются при взаимодействии с бертолетовой солью KClO3:
Эта реакция начинается при лёгком нагревании, трении, а иногда и без причин. В результате может произойти сильная вспышка. Мы её наблюдаем всякий раз, как только чиркаем спичкой о спичечный коробок. В состав спичечной головки входит бертолетова соль KClO3 и сера, а в состав намазки — красный фосфор и толчёное стекло.
Свойства и значение соединений фосфора
Как уже было показано выше, фосфор образует два вида оксидов Р2О3 и Р2О5. Это кислотные оксиды, образующие с водой фосфористую кислоту Н3РО3 и несколько фосфорных кислот. Состав фосфорных кислот отражает формула х Р2О5 · у Н2О:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
Или в суммарном виде:
Ортофосфорная кислота диссоциирует в три стадии:
Поэтому она образует три вида солей: КН2РО4 — дигидрофосфат, К2НРО4 — гидрофосфат, К3РО4 — фосфат. Эти соли, их растворы имеют разные свойства. Так, если большинство фосфатов нерастворимы в воде, кислые фосфаты имеют бОльшую растворимость.
Поскольку фосфор химически активен, в природе встречаются только нерастворимые соединения фосфора, в основном фосфаты. Они составляют основу таких минералов как апатиты и фосфориты. Основу фосфоритов составляет фосфат кальция, а в состав апатитов кроме него входят хлориды и фториды кальция.
Аналогичный состав имеют наши кости (фосфориты) и зубы (фторапатиты). В теле взрослого человека до 1,5 кг этого химического элемента. Таким образом, фосфор — биогенный элемент. Атомы фосфора входят в состав ДНК и РНК (нуклеиновых кислот), которые хранят и воспроизводят генетическую информацию. Кроме того, атомы фосфора входят в состав АТФ (аденозинтрифосфорной кислоты), при гидролизе которой выделяется аккумулированная в этой молекуле энергия.
Фосфор в чистом виде получают при нагревании измельчённых фосфоритов с песком и коксом:
Полученный фосфор используется при изготовлении спичек и пиротехнических составов, ядохимикатов, СМС (синтетических моющих средств) и многого другого.
Выводы
Азот — это элемент жизни, поскольку он входит в состав любого живого организма в виде белков, нуклеиновых кислот. С другой стороны, газ азот обладает инертными свойствами, с трудом вступает в химические реакции, составляет основу атмосферы Земли. Фосфор совместно с азотом входит в состав ДНК, РНК, АТФ. Многочисленные соединения фосфора незаменимы в быту.
Цели: формирование общеучебных умений и
навыков.
Задачи:
образовательные: изучить строение и
свойства аммиака; изучить новый вид связи –
водородную; рассмотреть донорно-акцепторный
механизм образования химической связи; развить
умения по составлению
окислительно-восстановительного баланса
уравнений реакций, уравнивание МЭБ.
воспитательные: формирование умений
работать с учебной и дополнительной литературой
по составлению конспекта; провести
профориентационную информацию.
познавательные: развивать интерес к
предмету, умение высказывать свои мысли,
логически рассуждать, соблюдать технику
безопасности при встрече с аммиаком в быту.
Оборудование:
Технологическая карта урока на столах учащихся
(Приложение № 1); оборудование для
химического эксперимента (аммиачная вода,
кристаллические хлорид аммония и гидроксид
кальция, фенолфталеин, лакмусовая бумажка,
прибор для получения газов, стеклянные палочки,
соляная кислота конц.); компьютерная презентация
(Приложение № 2).
Ход урока
1. Организационный момент.
Вначале урока необходимо настроить учащихся на
наиболее сложный тип урока-лекцию. Объяснить, что
урок проходит строго по плану на столах учащихся
и требует от них большой концентрации. Все
вопросы, которые необходимо рассмотреть
зафиксированы в технологической карте, и в ходе
лекции они всегда будут перед глазами и не
требуют запоминания. Для лучшего усвоения
составляется конспект в технологической карте. В
ходе лекции используются различные формы:
компьютерная презентация, работа с учебной
литературой, демонстрационные опыты.
2. Изучение нового материала.
План лекции (слайд № 2)
1. Состав молекулы аммиака
2. Строение молекулы аммиака
3. Водородная связь
4. Физические свойства аммиака
5. Химические свойства аммиака
а) аммиак-комплексообразователь.
б) аммиак-восстановитель
6. Получение аммиака
7. Применение аммиака
8. Закрепление
9. Домашнее задание
1. Состав молекулы аммиака
Учитель начинает свой рассказ об аммиаке с
обращения внимания на несоответствие написания
химической формулы аммиака принятым правилам
степени окисления.
- запишите молекулярную формулу аммиака;
- укажите степень окисления элементов;
- дайте химически верное название и запись
формулы аммиака.
NH3 = H3 +1N-3 нитрид
водорода (слайд № 3)
2. Строение молекулы аммиака
Учащиеся самостоятельно определяют тип
химической связи в молекуле аммиака.
Представляют схему образования химической связи
в молекуле.
- запишите молекулярную, электронную,
структурную формулы молекулы аммиака. - укажите вид химической связи в молекуле и
способы образования, - укажите смещение электронной плотности к более
электроотрицательному элементу.
NH3 — молекулярная формула
ковалентная полярная связь, одинарная, по
обменному механизму.
электронная
формула (слайд № 4)
3. Водородная связь
Учитель акцентирует внимание ребят на
неподеленной электронной паре атома азота,
сдвиге электронной плотности в сторону гораздо
более электроотрицательного атома азота и
возникновении в молекуле аммиака на атоме азота
частично отрицательного заряда, а на атоме
водорода частично положительного.
структурная
формула (слайд № 5)
Учитель знакомит учащихся с новым для них видом
химической связи – водородной связью, которая
возникает между молекулами аммиака.
Отметьте особенности водородной связи:
1) между какими атомами возникает связь;
2) силу связи по сравнению с другими видами
связи;
3) условное обозначению водородной связи;
4) следствие образования водородной связи в
соединении.
Водородной называется связь между атомами
водорода и атомами очень ЭО элементов, имеющих
свободные электронные пары;
- слабее ковалентной связи в 10 – 20 раз;
- условно обозначается тремя точками;
- вещества с водородной связью обладают хорошей
растворимостью в воде, повышается их температура
кипения и плавления. (слайд № 6)
4. Физические свойства аммиака
С физическими свойствами аммиака учитель
предлагает познакомиться учащимся
самостоятельно по учебнику.
- изучите физические свойства аммиака по
учебнику; - рассчитайте его плотность по воздуху Dвозд
= 29/МNН3; - предложите способ собирания газа в
лабораторных условиях.
NH3 – газ без цвета, с резким запахом, почти
в два раза легче воздуха, при охлаждении до -33,6оС
он сжижается, а при температуре -77,8оС
превращается в твердое белое вещество, хорошо
растворим в воде. (слайд № 7)
Учитель разъясняет ребятам, что поскольку
аммиак легче воздуха, то при выделении он будет
улетать вверх. Поэтому, для того чтобы собрать
аммиак, пробирку необходимо держать
перевернутой дном. (слайд № 
Учащиеся делают вывод, что при растворении
аммиака в воде образовалась щелочь, т.к.
фенолфталеин окрасился в малиновый цвет.
NH3 + H2O <—> NH3 * H2O
<—> NH4+ + OH— (слайд № 9)
Учитель демонстрирует учащимся аммиачную воду
(25% раствор аммиака) и нашатырный спирт (10% раствор
аммиака). Напоминает, как правильно обращаться с
растворами сильно пахнущих веществ.
5. Химические свойства аммиака
Особое внимание уделяется химическим
свойствам аммиака:
а) аммиак – комплексообразователь
необходимо рассказать об особом ионе – ионе
аммония NH4+. Отметить его
уникальность: ион, образованный только
неметаллами, играет роль металла. Разъяснить, что
ион аммония, так же как ионы металлов образует
свои соли. (слайд № 10)
• Запишите уравнение реакции взаимодействия
аммиака с соляной кислотой:
аммиак + соляная кислота = хлорид
аммония,
• Рассмотрите механизм реакции.
• Отметьте образование ковалентной полярной
связи по донорно-акцепторному механизму (по
учебнику)
Аммиак – комплексообразователь. (слайд
№ 11)
б) Аммиак – восстановитель (в реакциях
окисления).
• Запишите уравнение реакции горение аммиака:
аммиак + кислород = азот + вода
• Составьте электронный баланс к этому
уравнению.
1) Окисление аммиака без катализатора. (слайд
№ 12)
2) Окисление аммиака в присутствии катализатора
• Запишите уравнение реакции
каталитического окисления аммиака:
аммиак + кислород = оксид азота (II) + вода.
Составьте электронный баланс к этому
уравнению. (слайд № 13)
6. Получение аммиака
В промышленности аммиак получают прямым
синтезом из простых веществ – азота и водорода.
Реакция идет только в присутствии катализатора,
при температуре 500о и повышенном давлении.
• Запишите уравнение реакции получение
аммиака:
а) в промышленности (дайте классификацию
реакции по всем известным признакам и предложите
оптимальные условия проведения реакции);
б) в лаборатории (отметьте способы
распознавания аммиака).
а) в промышленности
Р соединения, экзотермическая, гомогенная,
обратимая, окислительно-восстановительная,
каталитическая. (слайд № 14)
б) в лаборатории получают действием щелочей на
соли аммония
NH4+ + OH— = NH3 + H2O
Собирание — в перевернутую кверху дном
пробирку. (слайды № 15, 16)
Распознавание аммиака:
а) по запаху;
б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной
стеклянной палочки, смоченной HCl (конц.) (слайд №
17)
7. Применение аммиака
Учитель предлагает учащимся самостоятельно
ознакомиться с применением аммиака по схеме в
учебнике.
Применение:
1) в холодильных установках;
2) в медицине и быту;
3) для производства азотной кислоты, солей
аммония;
4) как удобрение (слайд № 18)
Профориентационная информация. Растворы
аммиака довольно широко используются в медицине.
Разведенный раствор аммиака, издавна называемый
нашатырным спиртом, дают нюхать при обморочных
состояниях и алкогольном опьянении; при этом
происходит рефлекторное возбуждение сердечной
деятельности и центра дыхания. При тяжелом
алкогольном отравлении практикуют прием внутрь
слабых растворов аммиака (3 капли на полстакана).
Более слабые растворы аммиака дают
отхаркивающий эффект (нашатырно-анисовые капли).
Местнораздражающее действие аммиака
используют для приготовления препаратов,
применяемых как отвлекающие средства (при
артритах, невралгиях и т.п.).
Хлористый аммоний – белый кристаллический
порошок. Слегка гигроскопичен. Имеет солоноватый
вкус, легко растворим в воде. Применяется в
качестве диуретического и отхаркивающего
средства.
8. Закрепление.
Для закрепления предлагается решить
фронтально ряд задач:
1) При синтезе аммиака промышленном способом
азот объемом 56 л. (н.у.) прореагировал с водородом
взятом в избытке. Массовая доля выхода аммиака
составила 50%. Рассчитайте объем и массу
полученного аммиака.
2) Какая масса хлорида аммония получится при
взаимодействии 3 моль аммиака с соляной кислотой?
3) Какой объем кислорода потребуется для
сжигания 34 г. аммиака? (слайд № 19)
9. Домашнее задание
П. 25, упр. 1-6 (устно), 7-8 (письменно), повторить
конспект (слайд № 20)
Список литературы
1. Габриелян О.С. Настольная книга учителя химии
9 класс, М., 2001, “Блик и Ко”.
2. Горковенко М.Ю. Поурочные разработки по химии
, М., 2004, “Вако”.
3. Габриелян О.С., учебник химии 9 класс, М., Дрофа,
2008 г.
4. Виртуальная школа Кирилла и Мефодия, ООО “Нью
Медиа Дженерейшн”.
5. Интернет ресурсы.
Формула аммиака —
NH3
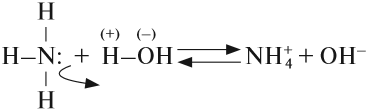
. Степень окисления азота равна (–3). В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.
Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а в основании — три атома водорода.
Рис. (1). Молекула аммиака
Общие электронные пары в молекуле смещены к более электроотрицательному атому азота. Он заряжен отрицательно, а атомы водорода — положительно. Поэтому молекула полярна и представляет собой диполь. Благодаря высокой полярности молекулы аммиака способны образовывать водородные связи между собой и с молекулами воды. Образование водородных связей влияет на физические свойства вещества.
При обычных условиях аммиак представляет собой бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
Аммиак очень хорошо растворяется в воде — при (20) °С в одном объёме воды может раствориться до (700) объёмов аммиака. Раствор с содержанием газа (25) % называется аммиачной водой, а (10)%-ный раствор используется в медицине как нашатырный спирт.
Аммиак легко сжижается при пониженной температуре или при повышенном давления. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
1. Восстановительные свойства.
Степень окисления азота в аммиаке — (–3), поэтому в окислительно-восстановительных реакциях он выступает в роли сильного восстановителя.
Аммиак окисляется кислородом с образованием азота или оксида азота((II)). Результат реакции зависит от условий её протекания.
При горении аммиака в чистом кислороде образуется азот:
Если реакция проводится с катализатором, то образуется оксид азота((II)):
.
2. Основные свойства.
Если в водный раствор аммиака добавить несколько капель фенолфталеина, то его окраска станет малиновой. Значит, раствор содержит гидроксид-ионы. Образование этих ионов происходит в результате реакции между водой и молекулами аммиака:
.
Образующийся в реакции неустойчивый гидрат аммония частично диссоциирует на ионы аммония и гидроксид-ионы.
Аммиак реагирует с кислотами. При этом образуются соли аммония. Так, с соляной кислотой образуется хлорид аммония, а с серной — сульфат аммония:
В промышленности аммиак синтезируют из азота и водорода:
Рис. (2). Производство аммиака
Лабораторный способ получения — реакция между солью аммония и гидроксидом кальция:
.
В больших количествах аммиак применяется для производства азотной кислоты и минеральных удобрений, а также красителей и взрывчатых веществ. Используется в холодильных установках. Нашатырный спирт находит применение в медицине и в быту.
Источники:
Рис. 1. Молекула аммиака https://upload.wikimedia.org/wikipedia/commons/1/11/Ammonia-2D-dimensions.png
Рис. 2. Производство аммиака https://cdn.pixabay.com/photo/2014/07/31/21/42/industry-406905_960_720.jpg
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно — возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.

Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем
охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 + H2O → H3AsO4 + NO↑
As2O3 + HNO3 + H2O → H3AsO4 + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислоте — HNO2, соли которой называются нитриты (NO2—).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.