На чтение 11 мин Просмотров 13 Опубликовано 9 апреля 2023 Обновлено 9 апреля 2023
Содержание
- Бериллий Be
- Электронная схема бериллия
- Степень окисления бериллия
- Ионы бериллия
- Валентность Be
- Квантовые числа Be
- Соединения бериллия
- Энергия ионизации
- Электронная формула бериллия и описание элемента
- Характеристика бериллия
- Открытие и использование
- Электронная формула бериллия
- Изотопы
- Атом бериллия
- Строение атома
- Электронная формула бериллия и описание элемента
- Характеристика бериллия
- Открытие и использование
- Электронная формула бериллия
- Изотопы
Бериллий Be
Бериллий в таблице менделеева занимает 4 место, в 2 периоде.
| Символ | Be |
| Номер | 4 |
| Атомный вес | 9.0121831 |
| Латинское название | Beryllium |
| Русское название | Бериллий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
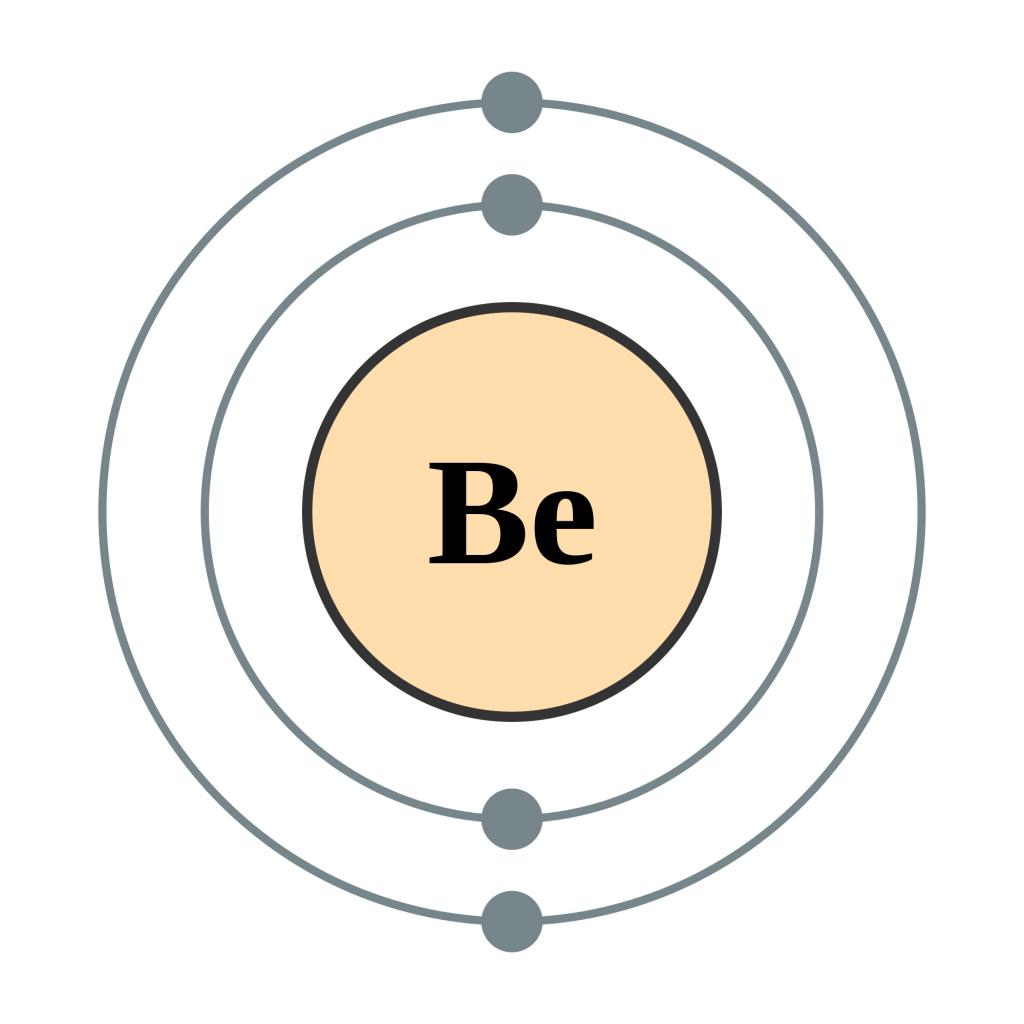
Электронная схема бериллия
Одинаковую электронную конфигурацию имеют атом бериллия и Li -1 , B +1 , C +2 , N +3
Порядок заполнения оболочек атома бериллия (Be) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Бериллий имеет 4 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
Степень окисления бериллия
Атомы бериллия в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы бериллия
Валентность Be
Атомы бериллия в соединениях проявляют валентность II.
Валентность бериллия характеризует способность атома Be к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Be
Квантовые числа определяются последним электроном в конфигурации, для атома Be эти числа имеют значение N = 2, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения бериллия
| Тип | Формула | Название |
|---|---|---|
| Соль | BeHPO4 | Гидроортофосфат бериллия |
| Be(H2PO4)2 | Дигидроортофосфат бериллия | |
| Основание | Be(OH)2 | Гидроксид бериллия |
| Оксид | BeO | Оксид бериллия |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник
Электронная формула бериллия и описание элемента
Уникально прочный и легкий бериллий используется при изготовлении сотовых телефонов, ракет и самолетов. Но при обращении с этим металлом следует быть осторожным, он считается очень токсичным.
Современное его название связано с минералом берилл, раньше он был известен как глюциниум, от греческого glykys — «сладкий», что отражало его характерный вкус. Но химики, которые обнаружили это уникальное свойство бериллия, также обнаружили, что он на самом деле очень токсичен. Также его классифицируют как канцероген, он может вызывать рак легких у людей, которые ежедневно подвергаются воздействию этого элемента из-за работ по его добыче или обработке. Но несмотря на это, он очень полезен из-за своих уникальных качеств. Например, он чрезвычайно легкий и имеет одну из самых высоких температур плавления.
Характеристика бериллия
Кратко информацию о нем можно представить следующим образом:
Открытие и использование
Бериллий был обнаружен в 1798 году французским химиком Луи Николасом Вокленом в форме оксида в берилле и его разновидности, изумруде зеленого цвета. Металл был выделен в 1828 году двумя химиками — Фридрихом Веллером из Германии и Антуаном Бюсси из Франции, который независимо восстановил хлорид бериллия (BeCl2) с калием в платиновом тигле. В наши дни его обычно получают из минералов берилла и бертрандита в химическом процессе или путем электролиза смеси расплавленного хлорида бериллия и хлорида натрия.
Он содержится примерно в 30 минеральных веществах. Включая бертрандит, берилл, хризоберилл и фенацит. Первые два являются наиболее важными источниками элемента и его соединений.
Он легко легируется медью или никелем при изготовлении пружин, гироскопов, электрических контактов, электродов для точечной сварки. Другие бериллиевые сплавы используются в высокоскоростных самолетах и ракетах, а также на космических кораблях и спутниках связи. Бериллиевая медь также применяется в раме ветрового стекла, тормозных дисках, опорных балках и других конструктивных элементах космического челнока.
Благодаря низкому сечению поглощения тепловых нейтронов он используется в ядерных реакторах в качестве отражателя или замедлителя.
Электронная формула бериллия
В атоме электроны вращаются вокруг центра, называемого ядром. Они находятся на отдельных орбитах. Первая может содержать только 2 электрона, вторая – 8, а для первых восемнадцати элементов оболочка 3 может содержать максимум 8. Атомный номер говорит об их количестве в электронной формуле. Бериллий имеет четвертый номер. Соответственно, в его атоме 4 электрона.
При записи электронной формулы бериллия первые два электрона перейдут на орбиту 1s. Поскольку она может содержать только два, оставшиеся 2 переходят в орбиту 2s. Такое обозначение конфигурации предоставляет ученым простой способ отображения того, как электроны расположены вокруг ядра атома. Это облегчает понимание и прогнозирование взаимодействия их при образовании химических связей.
Таким образом, электронная формула бериллия будет выглядеть следующим образом: 1s 2 2s 2.
Изотопы
Элемент бериллий имеет только один стабильный изотоп 9Be. 10Be образуется в атмосфере путем расщепления космическими лучами кислорода и азота. Поскольку бериллий имеет тенденцию существовать в растворе при уровнях рН менее 5,5 (а большая часть дождевой воды имеет рН менее 5), он попадает на поверхность земли именно таким способом. Поскольку осадки быстро становятся более щелочными, элемент выпадает из раствора. Постепенно он накапливается на поверхности почвы, где период его полураспада составляет около полутора миллионов лет. 10Be используется для изучения эрозии почвы, образования реголита, развития латеритных почв, а также изменений солнечной активности и возраста ледяных кернов.
Нестабильность изотопов 7Be и 8Be означает, что они, будучи более тяжелыми, чем бериллий, не могли быть получены в результате ядерного синтеза как следствие Большого взрыва. Более того, уровень ядерной энергии бериллия-8 таков, что делает возможным образование внутри звезд углерода и, соответственно, жизни.
Источник
Атом бериллия
Атом бериллия. +4 Be )2 )2 это схема строения атома. 1s2 2s2 это электронная формула. В этом атоме имеется два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном. 16.
Картинка 16 из презентации «Электронное строение атома» к урокам химии на тему «Строение атома»
Размеры: 960 х 720 пикселей, формат: jpg. Чтобы бесплатно скачать картинку для урока химии, щёлкните по изображению правой кнопкой мышки и нажмите «Сохранить изображение как. ». Для показа картинок на уроке Вы также можете бесплатно скачать презентацию «Электронное строение атома.ppt» целиком со всеми картинками в zip-архиве. Размер архива — 776 КБ.
Строение атома
«Строение атома» — Составьте электронную формулу химического элемента № 17. Число нейтронов = число нуклонов — число протонов. Масса mn? mр. В ядре атома изотопа углерода 12С находится нейтронов. Темы: Атом состоит из трёх видов частиц: Электрон — (е) — заряд отрицательный, . q=-1,6 . 10-19Кл. 11.
«Электронное строение атома» — 1 уровень-2. 1. 2?. 9. 1 уровень: 2?. Электронное строение атомов элементов. 3 уровень-18. 2 уровень:8?. 2.
«Заряжённые частицы» — Ядра и частицы. Изотопы. Камера Вильсона. Методы наблюдения и регистрации элементарных частиц. Атомы изотопов водорода. Счетчик Гейгера. Камера Вильсона позволяет регистрировать траектории заряженных частиц. Пузырьковая камера. Применение изотопов. Ядра изотопов водорода. Метод толстослойных фотоэмульсий позволяет регистрировать редкие явления.
«Состав атома» — Состав атома. Ядро. Демокрит утверждал, что атомы движутся под влиянием господства необходимости. Демокрит (460–371гг. н.э.). Все вещества электронейтральны. Демокрит — ученик Левкиппа. Эрнст — английский физик, с 1903г. член Лондонского королевского общества. Электроны. Массы атомов одного элемента могут быть различными.
«Строение электронной оболочки» — 2. 1. n = 1, N = 2 . 12 = 2. Повторение. Тема: Строение электронных оболочек атомов. Общее число электронов е =. 8. Нижневартовский район. N – главное квантовое число – определяет число энергетических уровней . Номер группы совпадает с числом электронов на последнем энергетическом уровне. Hе.
«Строение электронных оболочек атомов» — 2р. Далее: 1s. Письменно. — Энергетический уровень состоит из подуровней. Какая формула расчета максимального количества электронов на энергетическом уровне? I. Строение электронной оболочки. Как определить количество электронов на последнем уровне у элемента по периодической системе? 3р.
Всего в теме «Строение атома» 12 презентаций
Источник
Электронная формула бериллия и описание элемента
Уникально прочный и легкий бериллий используется при изготовлении сотовых телефонов, ракет и самолетов. Но при обращении с этим металлом следует быть осторожным, он считается очень токсичным.
Современное его название связано с минералом берилл, раньше он был известен как глюциниум, от греческого glykys — «сладкий», что отражало его характерный вкус. Но химики, которые обнаружили это уникальное свойство бериллия, также обнаружили, что он на самом деле очень токсичен. Также его классифицируют как канцероген, он может вызывать рак легких у людей, которые ежедневно подвергаются воздействию этого элемента из-за работ по его добыче или обработке. Но несмотря на это, он очень полезен из-за своих уникальных качеств. Например, он чрезвычайно легкий и имеет одну из самых высоких температур плавления.
Характеристика бериллия
Кратко информацию о нем можно представить следующим образом:
Открытие и использование
Бериллий был обнаружен в 1798 году французским химиком Луи Николасом Вокленом в форме оксида в берилле и его разновидности, изумруде зеленого цвета. Металл был выделен в 1828 году двумя химиками — Фридрихом Веллером из Германии и Антуаном Бюсси из Франции, который независимо восстановил хлорид бериллия (BeCl2) с калием в платиновом тигле. В наши дни его обычно получают из минералов берилла и бертрандита в химическом процессе или путем электролиза смеси расплавленного хлорида бериллия и хлорида натрия.
Он содержится примерно в 30 минеральных веществах. Включая бертрандит, берилл, хризоберилл и фенацит. Первые два являются наиболее важными источниками элемента и его соединений.
Он легко легируется медью или никелем при изготовлении пружин, гироскопов, электрических контактов, электродов для точечной сварки. Другие бериллиевые сплавы используются в высокоскоростных самолетах и ракетах, а также на космических кораблях и спутниках связи. Бериллиевая медь также применяется в раме ветрового стекла, тормозных дисках, опорных балках и других конструктивных элементах космического челнока.
Благодаря низкому сечению поглощения тепловых нейтронов он используется в ядерных реакторах в качестве отражателя или замедлителя.
Электронная формула бериллия
В атоме электроны вращаются вокруг центра, называемого ядром. Они находятся на отдельных орбитах. Первая может содержать только 2 электрона, вторая – 8, а для первых восемнадцати элементов оболочка 3 может содержать максимум 8. Атомный номер говорит об их количестве в электронной формуле. Бериллий имеет четвертый номер. Соответственно, в его атоме 4 электрона.
При записи электронной формулы бериллия первые два электрона перейдут на орбиту 1s. Поскольку она может содержать только два, оставшиеся 2 переходят в орбиту 2s. Такое обозначение конфигурации предоставляет ученым простой способ отображения того, как электроны расположены вокруг ядра атома. Это облегчает понимание и прогнозирование взаимодействия их при образовании химических связей.
Таким образом, электронная формула бериллия будет выглядеть следующим образом: 1s 2 2s 2.
Изотопы
Элемент бериллий имеет только один стабильный изотоп 9Be. 10Be образуется в атмосфере путем расщепления космическими лучами кислорода и азота. Поскольку бериллий имеет тенденцию существовать в растворе при уровнях рН менее 5,5 (а большая часть дождевой воды имеет рН менее 5), он попадает на поверхность земли именно таким способом. Поскольку осадки быстро становятся более щелочными, элемент выпадает из раствора. Постепенно он накапливается на поверхности почвы, где период его полураспада составляет около полутора миллионов лет. 10Be используется для изучения эрозии почвы, образования реголита, развития латеритных почв, а также изменений солнечной активности и возраста ледяных кернов.
Нестабильность изотопов 7Be и 8Be означает, что они, будучи более тяжелыми, чем бериллий, не могли быть получены в результате ядерного синтеза как следствие Большого взрыва. Более того, уровень ядерной энергии бериллия-8 таков, что делает возможным образование внутри звезд углерода и, соответственно, жизни.
Источник
Be (бериллий) — элемент с прядковым номером 4 в периодической системе.
Находится во II периоде. Температура плавления: 1278 ℃. Плотность: 1.85 г/см3.
Электронная формула атома бериллия:
1s2 2s2
Сокращенная электронная конфигурация Be:
[He] 2s2
Ниже приведена электронно-графическая схема атома бериллия
Распределение электронов по энергетическим уровням в атоме Be
1-й уровень (K): 2
2-й уровень (L): 2
Валентные электроны бериллия
Количество валентных электронов в атоме бериллия — 2.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
Степени окисления, которые может проявлять бериллий: +1, +2
Электронное строение атома бериллия
Электронное строение нейтрального атома бериллия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме бериллия.
Be
+4
2
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме бериллия.
| 2 | ↑↓ | |
| 1 | ↑↓ | |
| s |
Валентные орбитали атома бериллия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома бериллия.
4Be 1s2 2s2
Сокращённая электронная конфигурация атома бериллия.
4Be [He] 2s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома бериллия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
| -½ |
Бериллий в таблице менделеева занимает 4 место, в 2 периоде.
| Символ | Be |
| Номер | 4 |
| Атомный вес | 9.0121831 |
| Латинское название | Beryllium |
| Русское название | Бериллий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема бериллия
Be: 1s2 2s2
Короткая запись:
Be: [He]2s2
Одинаковую электронную конфигурацию имеют
атом бериллия и
Li-1, B+1, C+2, N+3
Порядок заполнения оболочек атома бериллия (Be) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Бериллий имеет 4 электрона,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
Степень окисления бериллия
Атомы бериллия в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы бериллия
Валентность Be
Атомы бериллия в соединениях проявляют валентность II.
Валентность бериллия характеризует способность атома Be к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Be
Квантовые числа определяются последним электроном в конфигурации,
для атома Be эти числа имеют значение N = 2, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения бериллия
| Тип | Формула | Название |
|---|---|---|
| Соль | BeHPO4 | Гидроортофосфат бериллия |
| Be(H2PO4)2 | Дигидроортофосфат бериллия | |
| Основание | Be(OH)2 | Гидроксид бериллия |
| Оксид | BeO | Оксид бериллия |
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Be:
Eo = 900 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Be в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Строение атома бериллия
Общие сведения о строении атома бериллия
Порядковый номер равен 4. Заряд ядра равен +4. Атомный вес – 9,0122 а.е.м.
Электронное строение атома бериллия
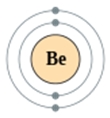
Бериллий расположен во втором периоде, значит, он имеет две оболочки, одна из которых внешняя, содержащая валентные электроны. Атом бериллия имеет положительно заряженное ядро (+4), в котором имеется 4 протона и 5 нейтронов (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 4 электрона.
Рис. 1. Схематичное изображение строения атома бериллия.
Электронную конфигурацию атома бериллия можно записать двояко:
+3 Be)2)2;
1s22s2.
Бериллий относится к семейству s-элементов. Энергетическая диаграмма атома бериллия (на ней изображаются только валентные электроны) имеет вид:

В результате химического взаимодействия бериллий теряет свои валентный электроны, т.е. является их донором, и превращается в положительно заряженный ион (Be2+):
Be0 –2e → Be2+;
В соединениях бериллий проявляет степень окисления +2.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |