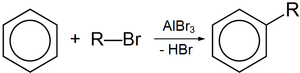| Бромид алюминия | ||
|---|---|---|
|
||
| Систематическое наименование |
Бромид алюминия | |
| Хим. формула | AlBr3, Al2Br6 | |
| Рац. формула | AlBr3 | |
| Состояние | твёрдое | |
| Молярная масса | 266,69 г/моль | |
| Плотность | 3,205 | |
| Температура | ||
| • плавления | 97,5 | |
| • кипения | 255 °C | |
| Энтальпия | ||
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
|
| Кристаллическая структура | моноклинная | |
| Рег. номер CAS | 7727-15-3 | |
| PubChem | 24409 | |
| Рег. номер EINECS | 231-779-7 | |
| SMILES |
[Al](Br)(Br)Br |
|
| InChI |
1S/Al.3BrH/h;3*1H/q+3;;;/p-3 PQLAYKMGZDUDLQ-UHFFFAOYSA-K |
|
| RTECS | BD0350000 | |
| Номер ООН | 1725 | |
| ChemSpider | 22818 | |
| Пиктограммы ECB |  |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Бромид алюминия (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула Al+3Br3−1. Вещество представляет собой соль алюминия и бромоводородной кислоты. В твердом и жидком состоянии существует в форме димера: Al2Br6.
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
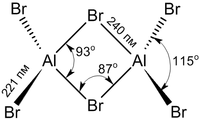
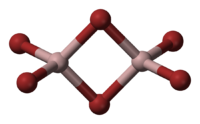
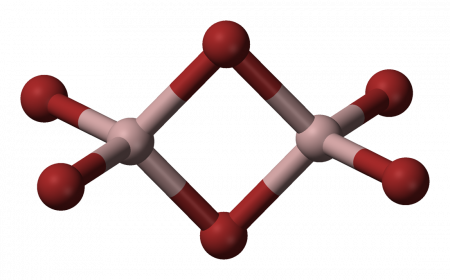
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- AlBr3 + 4 H2O ⇆ [Al(H2O)4]3+ + 3Br−
- [Al(H2O)4]3+ + H2O ⇆ [Al(H2O)3(OH)]2+ + H3O+
- При нагревании водного раствора гидролиз можно провести полностью:
- AlBr3 + 3 H2O = Al(OH)3 ↓ + 3 HBr ↑
- Вступает в реакцию со щелочами:
- AlBr3 + 3 NaOH = Al(OH)3 ↓ + 3 NaBr
- AlBr3 + 4 NaOH = Na[Al(OH)4] + 3 NaBr
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения:
- AlBr3 + H2S = AlBr3 ⋅ H2S
- При высокой температуре разлагается:
- 2 AlBr3 = 2 Al + 3 Br2
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия:
- AlBr3 + 2 Al ⇆ 3 AlBr
- С гидридом лития образует алюмогидрид:
- AlBr3 + 4 LiH = Li[AlH4] + 3 LiBr
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы-доноры (на этом, в частности, основано его применение в органическом синтезе):
- AlBr3 + C2H5Br → [C2H5]+[AlBr4]−
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
2 Al + 3 Br2 = Al2Br6
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
2 Al + 6 HBr = 2 AlBr3 + 3 H2 ↑
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий.
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например:
CH3−CH2−CH2Br →AlBr3 CH3−CHBr−CH3
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
CHCl3 + HBr →90oC; AlBr3 CHBrCl2 + HCl
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД 50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
From Wikipedia, the free encyclopedia

|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Aluminium bromide |
|
| Other names
Aluminic bromide Aluminium(III) bromide Aluminium tribromide |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.891 |
| EC Number |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1725 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
AlBr3 Al2Br6 AlBr3·6H2O (hexahydrate) |
| Molar mass | 266.694 g/mol (anhydrous) 374.785 g/mol (hexahydrate)[1] |
| Appearance | white to pale yellow powder[1] |
| Odor | pungent |
| Density | 3.2 g/cm3 (anhydrous) 2.54 g/cm3 (hexahydrate)[1] |
| Melting point | 97.5 °C (anhydrous) 93 °C (hexahydrate)[1] |
| Boiling point | 255 (anhydrous)[1] |
|
Solubility in water |
very soluble, partially hydrolyses indicated by a fuming solution and an optional appearance of white precipitate |
| Solubility | slightly soluble in methanol, diethyl ether, acetone |
| Structure[2] | |
|
Crystal structure |
Monoclinic, mP16 (anhydrous) |
|
Space group |
P21/c, No. 14 |
|
Lattice constant |
a = 0.7512 nm, b = 0.7091 nm, c = 1.0289 nm α = 90°, β = 96.44°, γ = 90° |
|
Formula units (Z) |
4 |
| Thermochemistry[1] | |
|
Heat capacity (C) |
100.6 J/(mol·K) |
|
Std molar |
180.2 J/(mol·K) |
|
Std enthalpy of |
-572.5 kJ/mol |
| Hazards | |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H302, H314 |
|
Precautionary statements |
P260, P264, P270, P280, P301+P312, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P321, P330, P363, P405, P501 |
| NFPA 704 (fire diamond) |
3 1 1 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1598 mg/kg (oral, rat) |
| Related compounds | |
|
Other anions |
aluminium trichloride aluminium triiodide |
|
Other cations |
boron tribromide |
|
Related compounds |
iron(III) bromide |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Aluminium bromide is any chemical compound with the empirical formula AlBrx. Aluminium tribromide is the most common form of aluminium bromide.[3] It is a colorless, sublimable hygroscopic solid; hence old samples tend to be hydrated, mostly as aluminium tribromide hexahydrate (AlBr3·6H2O).
Structure[edit]
The dimeric form of aluminium tribromide (Al2Br6) predominates in the solid state, in solutions in noncoordinating solvents (e.g. CS2), in the melt, and in the gas phase. Only at high temperatures do these dimers break up into monomers:
- Al2Br6 → 2 AlBr3 ΔH°diss = 59 kJ/mol
The species aluminium monobromide forms from the reaction of HBr with Al metal at high temperature. It disproportionates near room temperature:
- 6/n «[AlBr]n» → Al2Br6 + 4 Al
This reaction is reversed at temperatures higher than 1000 °C. Aluminium monobromide has been crystallographically characterized in the form the tetrameric adduct Al4Br4(NEt3)4 (Et = C2H5). This species is electronically related to cyclobutane. Theory suggest that the diatomic aluminium monobromide condenses to a dimer and then a tetrahedral cluster Al4Br4, akin to the analogous boron compound.[4]
Al2Br6 consists of two AlBr4 tetrahedra that share a common edge. The molecular symmetry is D2h.
The monomer AlBr3, observed only in the vapor, can be described as trigonal planar, D3h point group. The atomic hybridization of aluminium is often described as sp2. The Br-Al-Br bond angles are 120 °.
Synthesis[edit]
Experiment showing synthesis of aluminium bromide from the elements.
By far the most common form of aluminium bromide is Al2Br6. This species exists as hygroscopic colorless solid at standard conditions. Typical impure samples are yellowish or even red-brown due to the presence of iron-containing impurities. It is prepared by the reaction of HBr with Al:
- 2 Al + 6 HBr → Al2Br6 + 3 H2
Alternatively, the direct bromination occurs also:
- 2 Al + 3 Br2 → Al2Br6
Reactions[edit]
A demonstration of the reaction of the exothermic reaction of the strong Lewis acid (Al2Br6) and strong Lewis base (H2O).
Al2Br6 dissociates readily to give the strong Lewis acid, AlBr3. Regarding the tendency of Al2Br6 to dimerize, it is common for heavier main group halides to exist as aggregates larger than implied by their empirical formulae. Lighter main group halides such as boron tribromide do not show this tendency, in part due to the smaller size of the central atom.
Consistent with its Lewis acidic character, Al2Br6 is hydrolyzed by water with evolution of HBr and formation of Al-OH-Br species. Similarly, it also reacts quickly with alcohols and carboxylic acids, although less vigorously than with water. With simple Lewis bases (L), Al2Br6 forms adducts, such as AlBr3L.
Aluminium tribromide reacts with carbon tetrachloride at 100 °C to form carbon tetrabromide:
- 4 AlBr3 + 3 CCl4 → 4 AlCl3 + 3 CBr4
and with phosgene yields carbonyl bromide and aluminium chlorobromide:[citation needed]
- AlBr3 + COCl2 → COBr2 + AlCl2Br
Al2Br6 is used as a catalyst for the Friedel-Crafts alkylation reaction.[3] Related Lewis acid-promoted reactions include as epoxide ring openings and decomplexation of dienes from iron carbonyls. It is a stronger Lewis acid than the more common Al2Cl6.
Safety[edit]
Aluminium tribromide is a highly reactive material.[5]
References[edit]
- ^ a b c d e f Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.45. ISBN 1-4398-5511-0.
- ^ Troyanov, Sergey I.; Krahl, Thoralf; Kemnitz, Erhard (2004). «Crystal structures of GaX3(X= Cl, Br, I) and AlI3«. Zeitschrift für Kristallographie. 219 (2–2004): 88–92. doi:10.1524/zkri.219.2.88.26320. S2CID 101603507.
- ^ a b Paquette, Leo A. (2001). Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X. hdl:10261/236866. ISBN 0471936235.
- ^ Dohmeier, Carsten; Loos, Dagmar; Schnöckel, Hansgeorg (1996). «Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions». Angewandte Chemie International Edition in English. 35 (2): 129. doi:10.1002/anie.199601291.
- ^ Renfew, Malcom M. (1991). «Hazardous laboratory chemicals: Disposal guide (Armour, M.A.)». Journal of Chemical Education. 68 (9): A232. Bibcode:1991JChEd..68Q.232R. doi:10.1021/ed068pA232.2.
Содержание
- Физические свойства
- Химические свойства
- Получение
- Опасность для здоровья
Бромид алюминия — это неорганическое бинарное соединение. Химическая формула 
| Бромид алюминия | |
|---|---|
| Общие | |
| Систематическое наименование |
Бромид алюминия |
| Хим. формула | AlBr3, Al2Br6 |
| Рац. формула | AlBr3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205 |
| Термические свойства | |
| Температура | |
| • плавления | 97,5 |
| • кипения | 255 °C |
| Энтальпия | |
| • образования | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ) кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| PubChem | 24409 |
| Рег. номер EINECS | 231-779-7 |
| SMILES |
[Al](Br)(Br)Br |
| InChI |
1S/Al.3BrH/h;3*1H/q+3;;;/p-3 PQLAYKMGZDUDLQ-UHFFFAOYSA-K |
| RTECS | BD0350000 |
| Номер ООН | 1725 |
| ChemSpider | 22818 |
| Безопасность | |
| Пиктограммы ECB |    |
| NFPA 704 |
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома.
Координационное число алюминия в молекуле бромида равно 4.
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль.
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор).
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- При нагревании водного раствора гидролиз можно провести полностью:
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия:
Получение
Безводный бромид алюминия получают взаимодействием простых веществ (Al и Br2):
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом:
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно).
| Бромид алюминия | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Бромид алюминия |
| Химическая формула | AlBr3, Al2Br6 |
| Эмпирическая формула | AlBr3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 266,69 г/моль |
| Плотность | 3,205[1] г/см³ |
| Термические свойства | |
| Температура плавления | 97,5[1] °C |
| Температура кипения | 255[2] °C |
| Энтальпия образования (ст. усл.) | − 514; − 422 (AlBr3, газ); − 971(Al2Br6, газ)[3] кДж/моль |
| Структура | |
| Кристаллическая структура | моноклинная |
| Классификация | |
| Рег. номер CAS | 7727-15-3 |
| Рег. номер EINECS | 231-779-7 |
Броми́д алюми́ния (бромистый алюминий) — это неорганическое бинарное соединение. Химическая формула 
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 4 Применение
- 5 Опасность для здоровья
- 6 Литература
- 7 Примечания
Физические свойства
Безводный бромид алюминия представляет собой бесцветное кристаллическое вещество, плавящееся при температуре 97,5 °C; температура кипения: 255 °C.
В твёрдой и жидкой фазе существует в форме димера Al2Br6, частично диссоциирующего в AlBr3, в газовой фазе масс-спектры показывают наличие ди-, тетра- и гексаформ: Al2Br6, Al4Br12, Al6Br18 соответственно.
Структура молекулы бромида алюминия Al2Br6 представляет собой сдвоенные тетраэдры, в центре которых расположены атомы алюминия, ковалентно связанные с атомами брома[4].
Координационное число алюминия в молекуле бромида равно 4[5].
Энергия разрыва связи Al—Br в молекуле бромида алюминия составляет примерно 358 кДж/моль[6].
Вещество очень гигроскопично: на воздухе расплывается, легко поглощая влагу с образованием гексагидрата AlBr3•6H2O[7]. Хорошо растворимо в воде, спирте, сероуглероде, ацетоне[8]; плотность водного раствора при 20 °C составляет: 1079,2 кг/м³ (10%-ный раствор), 1172,5 кг/м³ (20%-ный раствор)[9].
Химические свойства
- Безводный бромид алюминия очень энергично реагирует с водой выделяя при растворении много тепла и, частично гидролизуясь:
- При нагревании водного раствора гидролиз можно провести полностью:
- Вступает в реакцию со щелочами:
- При пропускании безводного сероводорода через раствор бромида алюминия в сероуглероде выпадает осадок комплексного соединения[10]:
- При высокой температуре разлагается:
- При нагревании бромида алюминия с алюминием в газовой фазе (1000 °C) образуется нестабильный монобромид алюминия[2]:
- С гидридом лития образует алюмогидрид:
- Бромид алюминия — сильный акцептор электронных пар (кислота Льюиса) — легко присоединяет молекулы доноры (на этом, в частности, основано его применение в органическом синтезе)[7]:
Получение
Безводный бромид алюминия получают взаимодействием элементов (Al и Br2) при нагревании:
Водный раствор можно получить реакцией алюминиевой стружки с бромоводородной кислотой:
Применение
Коммерческое применение бромида алюминия в настоящий момент относительно небольшое.
Бромид алюминия входит как основной компонент в состав ксилольных электролитов для электроосаждения алюминиевых покрытий[11].
Безводный бромид алюминия используется в органическом синтезе, в частности, в реакции алкилирования по Фриделю-Крафтсу, по аналогии с хлоридом алюминия.
Соединение может выступать катализатором в реакции изомеризации бромалканов, например[12]:
Также бромид алюминия может выступать в качестве бромирующего агента, например в реакции с хлороформом[13]:
Опасность для здоровья
При контакте с кожей бромид алюминия может вызывать ожоги.
Соединение умеренно ядовито: ЛД50 (крысы) ≈ 1600 мг/кг (перорально); ЛД50 (крысы) ≈ 815 мг/кг (внутрибрюшинно)[14].
Литература
- Downs A.J. Chemistry of aluminium, gallium, indium, and thallium. — First edition. — London: Chapman & Hall, 1993. — 526 p. — ISBN 0-7514-0103-X
Примечания
- ↑ 1 2 Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 74. — ISBN 5-7107-8085-5
- ↑ 1 2 Турова Н.Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 67.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть IV. Термодинамика. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 441. — ISBN 5-7107-8085-5
- ↑ Chambers C., Holliday A.K. Modern inorganic chemistry. — Chichester: Butterworth & Co (Publishers) Ltd, 1975. — P. 153.
- ↑ Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 86. — ISBN 5-7695-1436-1
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Глава 6. Энергия связи для многоатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 384. — ISBN 5-7107-8085-5
- ↑ 1 2 Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. — 4-е изд., исправленное. — М.: «Высшая школа», 2001. — С. 498. — ISBN 5-06-003363-5
- ↑ Алюминий // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 207.
- ↑ Лидин Р.А., Андреева Л.Л., Молочко В.А. Часть VII. Плотность воды и водных растворов. Глава 3. Соли // Константы неорганических веществ: справочник / Под редакцией проф. Р.А.Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 641. — ISBN 5-7107-8085-5
- ↑ Гофман У., Рюдорф В., Хаас А. и др. Руководство по неорганическому синтезу. — Пер. с нем., под ред. Г.Брауэра. — М.: «Мир», 1985. — Т. 3. — С. 899.
- ↑ Спиридонов Б.А., Федянин В.И. Исследование процесса электроосаждения алюминия из пара-ксилольных электролитов.. Российское общество гальванотехников и специалистов в области обработки поверхности.(недоступная ссылка — история) Проверено 26 октября 2009.
- ↑ Douwes H.S.A. The kinetics of the aluminium bromide catalyzed isomerization of 1-propyl bromide (англ.) // Journal of Molecular Catalysis A: Chemical. — 2005. — Т. 240. — № 1-2. — С. 82-90.
- ↑ Unated States Patent 2553518. Production of Organic Bromides (англ.) (pdf). FreePatentsOnline (May, 1951). Архивировано из первоисточника 9 апреля 2012. Проверено 26 октября 2009.
- ↑ Safety data for aluminium bromide (англ.). The Physical and Theoretical Chemistry Laboratory Oxford University. Архивировано из первоисточника 9 апреля 2012. Проверено 26 октября 2009.
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Соединения алюминия |
|---|
|
Алюминат лития (LiAlO2) • Алюминат натрия (NaAlO2) • Алюмогидрид кальция (Ca[AlH4]2) • Алюмогидрид лития (LiAlH4) • Алюмосиликаты • Антимонид алюминия (AlSb) • Арсенид алюминия (AlAs) • Ацетат алюминия (Al(CH3COO)3) • Бромид алюминия (AlBr3) • Гексафтороалюминат аммония ((NH3)3[AlF6]) • Гексафтороалюминат натрия (Na3[AlF6]) • Гидрид алюминия (AlH3) • Гидроксид алюминия (Al(OH)3) • Диборид алюминия (AlB2) • Додекаборид алюминия (AlB12) • Иодид алюминия (AlI3) • Карбид алюминия (Al4C3) • Метагидроксид алюминия (AlO(OH)) • Молибдат алюминия (Al2(MoO4)3) • Монооксид алюминия (AlO) • Монофторид алюминия (AlF) • Монохлорид алюминия (AlCl) • Нитрат алюминия (Al(NO3)3) • Нитрид алюминия (AlN) • Оксид алюминия (Al2O3) • Оксинитрид алюминия (AlON) • Селенид алюминия (Al2Se3) • Силикат алюминия (Al2SiO5) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюминия-калия (KAl(SO4)2) • Сульфид алюминия (Al2S3) • Тетрагидридоалюминат лития (Li[AlH4]) • Тетрагидридоалюминат натрия (Na[AlH4]) • Тетрагидридоалюминат калия (K[AlH4]) • Тетрагидридоалюминат цезия (Cs[AlH4]) • Триизобутилалюминий (Al(C4H9)3) • Триметилалюминий (Al(CH3)3) • Трифенилалюминий (Al(C6H5)3) • Трифторид алюминия (AlF3) • Триэтилалюминий (Al(C2H5)3) • Фосфат алюминия (AlPO4) • Фосфид алюминия (AlP) • Хлорид алюминия (AlCl3) |
|
Соединения брома |
|---|
|
Бромат калия (KBrO3) • Бромат кальция (Ca(BrO3)2) • Бромат натрия (NaBrO3) • Бромат серебра (AgBrO3) • Бромат стронция (Sr(BrO3)2) • Броматы • Бромид алюминия (AlBr3) • Бромид бора(III) (BBr3) • Бромид диртути(2+) (Hg2Br2) • Бромид магния (MgBr2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромиды • Бромистая кислота (HBrO2) • Бромистоводородная кислота (HBr) • Бромная кислота (HBrO4) • Бромноватая кислота (HBrO3) • Бромноватистая кислота (HBrO) • Бромопентакарбонилрений(I) (Re(CO)5Br) • Броморганические соединения • Гипобромистая кислота (HOBr) • Диоксид брома (BrO2) • Оксид брома (Br2O) • Пербромат калия (KBrO4) • Фторид брома(I) (BrF) • Фторид брома(III) (BrF3) • Фторид брома(V) (BrF5) • Хлорид брома (BrCl) |
Как написать формулу бромида алюминия?
В случае бромида алюминия нам нужен один ион алюминия и три иона бромида. Таким образом, формула бромида алюминия: AlBr3.
Как назвать бромид алюминия?
Химическая формула бромида алюминия: AIBr3. Бромид алюминия имеет один ион алюминия в сочетании с тремя ионами брома.
Что такое AlBr2?
дибромид алюминия | АлБр2 | ХимПаук.
Как вы пишете AlBr3?
Какова формула бромида цинка?
ZnBr₂
Смотрите также, когда в Кентукки освободили рабов.
Как написать формулу алюминия?
Какова формула фосфата натрия?
Na₃PO₄
Какова формула хлорида бария?
Хлорид бария/Формула
Хлорид бария представляет собой неорганическое соединение с формулой BaCl2. Это одна из наиболее распространенных водорастворимых солей бария. Как и большинство других солей бария, она белая, токсичная и придает пламени желто-зеленый цвет. Он также гигроскопичен, сначала превращаясь в дигидрат BaCl2(H2O)2. 24 июня 2015 г.
Какова формула оксида натрия?
Na₂O
Как можно рассчитать молярную массу?
Как рассчитать молярную массу AlBr3?
266,69 г/моль
Какова формула карбоната алюминия?
Карбонат алюминия | Ал2(СО3)3 – ПабХим.
Какова валентность алюминия в фосфате алюминия?
Фосфат алюминия — это AlPO4, потому что Al имеет валентность. +3 и РО4 валентность -3. … Теперь карбонат нестабилен, потому что CO3 имеет 3 атома кислорода, что делает валентность -6, а C имеет только +4, поэтому он нестабилен.
Как рассчитать формульный вес?
Чтобы вычислить вес формулы для соединения, мы будем выберите атомную массу каждого из элементов в соединении из таблицы Менделеева, умножьте на количество атомов и просуммируйте результат.
Как вы вычисляете массу формулы?
Чтобы рассчитать формулу массы, умножьте нижний индекс каждого элемента в формуле на атомный вес элемента (относительную атомную массу), найденный в периодической таблице. Единицей для формульной массы является либо u, либо Da (дальтоны). Аму был заменен на у, хотя он все еще широко используется.
Что такое молекулярная формула массы?
Формула массы вещества сумма средних атомных масс каждого атома, представленного в химической формуле и выражается в атомных единицах массы. Формула массы ковалентного соединения также называется молекулярной массой.
Посмотрите также, чем эллинистическая культура отличалась от более ранней греческой культуры.
Какова массовая доля алюминия в бромиде алюминия?
Массовая доля элементов в составе
| Элемент | Символ | Массовый процент |
|---|---|---|
| Алюминий | Аль | 10.118% |
| Бром | бр | 89.883% |
Какова молярная масса HBR?
80,91 г/моль
Какова молярная масса fe2o3?
159,69 г/моль
Какова валентность и формула фосфата?
В ионе фосфата имеется четыре атома кислорода. … Чистая валентность иона фосфата 8-5=3. ∴ Валентность иона фосфата равна 3.
Какова формула и валентность алюминия?
Валентность алюминия (Al) это +3 а у оксида -2. Следовательно, химическая формула оксида алюминия — Al2О3.
Как найти валентность PO4?
Для определения валентности ионной молекулы тетраоксида фосфора (PO4, четыре атома кислорода и один атом фосфора) следует умножьте общую валентность четырех атомов кислорода
(валентность 2) и вычесть это из валентности атома фосфора (валентность 5), это показывает, что валентность (PO4) равна 3.
Какова формула веса соединения?
формула веса, по химии, сумма атомных весов всех атомов, входящих в данную химическую формулу. Обычно он применяется к веществу, которое не состоит из отдельных молекул, например к ионному соединению хлорида натрия.
Какова формула веса nacl?
58,44 г/моль
Как рассчитать молярную концентрацию?
Для расчета молярной концентрации найдем молярная концентрация путем деления молей на литры воды, использованные в растворе. Например, уксусная кислота здесь полностью растворена в 1,25 л воды. Затем разделите 0,1665 моль на 1,25 л, чтобы получить молярную концентрацию, которая будет равна 0,1332 М.
Как рассчитать RFM соединения?
Относительные атомные массы можно использовать для нахождения относительной массы формулы соединения. Чтобы найти относительную формулу массы (M р) соединения, вы складываете относительные значения атомной массы (A р значения) для всех атомов в его формуле.
Каково общее MR H2O?
Молекулярная масса H2O=2 Атомная масса H+Атомная масса O=2+16=18 а.е.м. ИЛИ H2O: Молекулярная масса воды, H2O = (2 Атомная масса водорода) + (1 Атомная масса кислорода) = = 2,016 и + 16,00 и = 18,016 = 18.02 у.
Как рассчитать AR в химии?
Для расчета М р для вещества:
- определите, сколько атомов каждого элемента входит в химическую формулу.
- сложите А р значения для всех атомов каждого элемента.
Смотрите также, что вы видите на пляже
Какое массовое число алюминия?
26,981539 и
Какова молярная масса мгсо4?
120,366 г/моль
Какую массу бромида алюминия можно получить из 4,4 молей брома?
Если я правильно понял ваш вопрос, то ответ будет 197 г .
Сколько атомов имеет бромид алюминия?
В этом случае химический символ алюминия — Al, а брома — Br. Молекулярная формула также показывает, сколько атомов каждого элемента входит в состав молекулы. Молекулярная формула бромида алюминия показывает, что это соединение состоит из один атом алюминия и три атома брома.
Какова формула массы li2co3?
73,891 г/моль


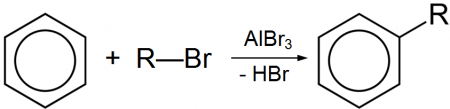

![mathsf{AlBr_3+4H_2Oleftrightarrows[Al(H_2O)_4]^{3+}+3Br^-}](https://dic.academic.ru/dic.nsf/ruwiki/4b4850934f1fecf0f7830b90b164b2f9.png)
![mathsf{[Al(H_2O)_4]^{3+}+H_2Oleftrightarrows[Al(H_2O)_3(OH)]^{2+}+H_3O^+}](https://dic.academic.ru/dic.nsf/ruwiki/51e539c3c99b08e5edf9857931a76ac0.png)


![mathsf{AlBr_3+4NaOH=Na[Al(OH)_4]+3NaBr}](https://dic.academic.ru/dic.nsf/ruwiki/411fb48a9f778abdf77899ceb50e49c1.png)



![mathsf{AlBr_3+4LiH=Li[AlH_4]+3LiBr}](https://dic.academic.ru/dic.nsf/ruwiki/a1ae581c91cd2fb06aba3e5ca5d6683b.png)
![mathsf{AlBr_3+C_2H_5Br}rightarrowmathsf{[C_2H_5]^+[AlBr_4]^-}](https://dic.academic.ru/dic.nsf/ruwiki/451e23f43e27bf26f1f5d4be76e0a970.png)