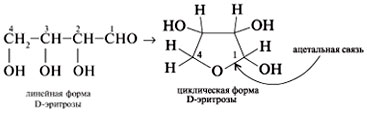
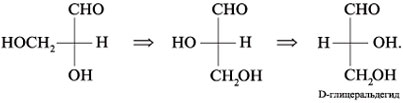
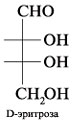При
помощи проекций Фишера изображаются,
в основном, моносахариды, имеющие
открытое, незамкнутое строение. Однако
моносахариды могут иметь и циклическое
строение. Причиной образования циклических
форм является возможность пространст-венного
сближения двух функциональных групп
молекулы моносаха-рида: карбонильной
и гидроксильной. Действительно,
карбонильный атом углерода имеет
частичный положительный заряд (+)
и является объектом нуклеофильной
атаки. Атом кислорода гидроксильной
группы имеет неподеленную электронную
пару и проявляет свойства нуклеофила.
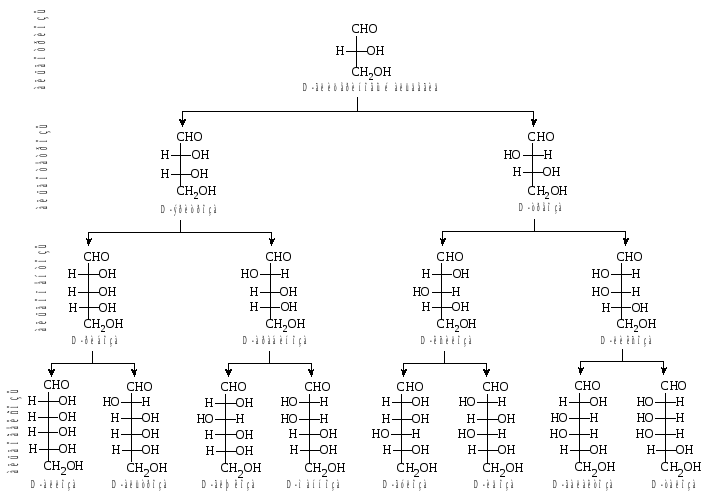
Рис.
1. Семейство D-альдоз.
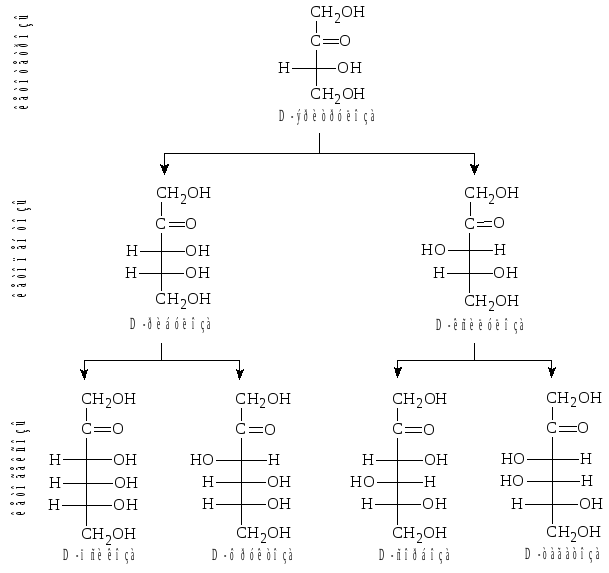
Рис.
2. Семейство D-кетоз.
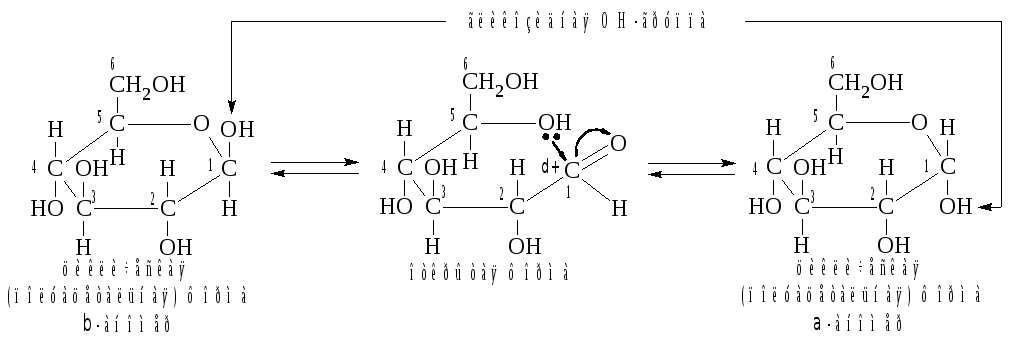
В
результате этого взаимодействия в
водном растворе моносаха-рида происходит
разрыв связи С = О и образуется
циклический полуацеталь:
Отметим,
что далеко не все гидроксильные группы
моносахарида могут участвовать в
образовании циклического полуацеталя.
Это связано с тем, что образующийся
полуацеталь должен быть термодинамически
устойчив, а наиболее устойчивы, как
известно, пяти- и шестичленные циклы. В
альдогексозе такие циклы могут
образовываться только с участием
гидроксильных групп у С-4 и С-5. Остальные
OH-группы
устойчивых циклов с С-1 не образуют.
Отсюда следует, что существовать в виде
циклических форм могут только моносахариды,
содержащие четыре и более атомов углерода
в цепи. Триозы и тетрулозы циклических
структур не образуют и в водном растворе
существуют только в виде открытой формы.
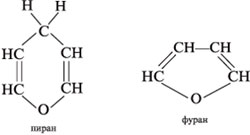
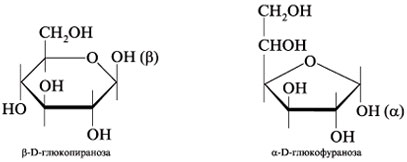
Пятичленные
циклы называют фуранозами,
шестичленные
пиранозами.
Названия происходят от соответствующих
гетеро-циклов
фурана и пирана:
Образующуюся
в результате циклизации OH-группу
у атома С-1 называют полуацетальной
или гликозидной.
Сам атом С-1 приобретает свойства
хирального центра, что приводит к
появлению двух дополнительных оптических
изомеров, называемых аномерами.
У -аномера
гликозидная OH-группа
расположена по одну сторону с гидроксильной
группой, определяющей принадлежность
моносахари-да к стереохимическому ряду,
у -аномера
они находятся по разные стороны. Появление
аномеров обусловлено свободным вращением
заместителей вокруг связи С1-С2, что
позволяет осуществлять нуклеофильную
атаку как сверху, так и снизу по отношению
к плоскости расположения альдегидной
группы. Таким образом, реакция
нуклеофильного взаимодействия
гидроксильной и альдегид-ной групп не
является стереоселективной.
В
проекциях Фишера это выглядит следующим
образом:
Благодаря
наличию в молекуле моносахарида других
хиральных центров, -
и -аномеры
по отношению друг к другу являются
диастереомерами и, как следствие,
различаются по физико-химичес-ким
характеристикам. Так, -аномер
D-глюкозы
имеет температуру плавления 1460С,
а -аномер
плавится при 1500С.
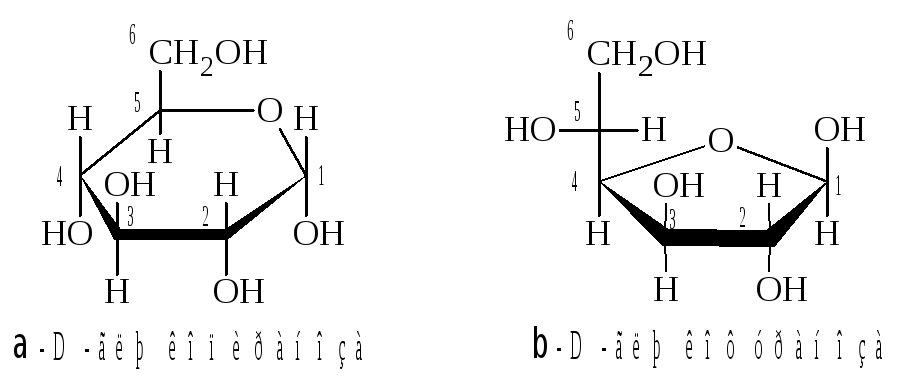
Использование
проекций Фишера для описания строения
циклических форм не очень удобно, так
как они не отражают в полной мере
геометрию цикла. Пространственное
строение циклических форм принято
описывать при помощи формул
Хеуорса.
Переход
от проекционных формул Фишера к формулам
Хеуорса осуществляется по следующим
правилам:
1. В
формуле Фишера производится четное
число перестановок заместителей у атома
углерода, чья гидроксильная группа
участвует в образовании циклического
полуацеталя. Перестановка осущест-вляется
таким образом, чтобы данная OH-группа
располагалась на одной вертикали с
карбонильной группой и находилась
внизу.
Например,
в образовании пиранозного цикла D-глюкозы
участвует OH-группа
при С-5. Осуществляем две перестановки
и записываем циклическую форму в проекции
Фишера:
Аналогичным
образом поступаем в случае образования
фуранозного цикла. Теперь в образовании
цикла участвует OH-группа
при С-4:
2. В
зависимости от структуры цикла берется
соответствующая «заготовка»:
|
|
|
|
для |
для |
Все
заместители, находящиеся в фишеровской
проекции справа от линии углеродной
цепи, располагаются под плоскостью
цикла; соответственно заместители,
находящиеся слева
над плоскостью.
Отметим,
что у пиранозных форм моносахаридов
D-ряда
группа CH2OH
всегда
располагается над плоскостью цикла. У
-аномеров
гликозидная OH-группа
располагается под плоскостью цикла, а
у
-аномера
над плоскостью.
Названия
циклических форм строятся следующим
образом: сначала указывают положение
полуацетального гидроксила (-
или
-),
затем принадлежность сахарида к
стереохимическому ряду
(D-
или L-),
далее в корень тривиального названия
сахарида вставляют смысловую часть
названия цикла (-фуран- или -пиран-),
заканчивая название суффиксом -оза.
В
случаях, когда аномеризация не уточняется
или речь идет о равновесной смеси
аномеров, положение гликозидной группы
обозначается волнистой линией:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
РАБОЧИЕ ТЕТРАДИ
Продолжение. Начало см. в № 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 26,
28, 29, 30, 31, 32, 33, 34, 35, 36,
37, 38, 39, 40, 41, 42/2004
Урок 34. Циклические формы моносахаридов
Известно, что альдегиды и кетоны реагируют со
спиртами, образуя полуацетали и кетали.
Циклические полуацетали образуются особенно
легко. Для этого необходимыми условиями
являются: 1) гидроксил и карбонильная группа
должны быть частями одной молекулы; 2) при их
взаимодействии может образоваться пяти- или
шестичленное кольцо.
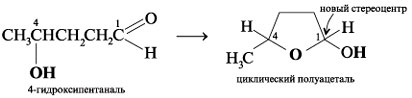
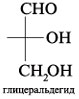
Например, 4-гидроксипентаналь образует
пятичленный циклический полуацеталь. При этом
создается новый стереоцентр при углероде С-1 (все
четыре заместителя при С-1 разные):
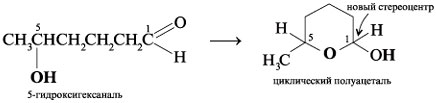
Подобным образом 5-гидроксигексаналь формирует
шестичленный циклический полуацеталь, в котором
также генерируется новый стереоцентр при С-1:
Гидроксильная и карбонильная группы
содержатся в одной молекуле моносахаридов,
поэтому моносахариды существуют почти
исключительно в форме циклических полуацеталей.
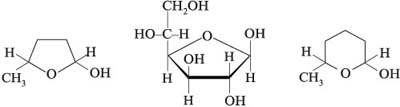
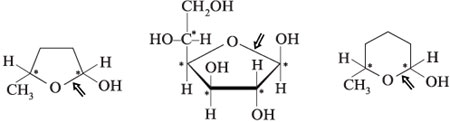
Циклические проекции Фишера. Размер
полуацетального кольца моносахарида сравнивают
с гетероциклическими молекулами – пираном и
фураном:
Шестичленные полуацетальные кольца обозначают
словом «пиран», а пятичленные – «фуран».
При кристаллизации из этанола D-глюкоза дает -D-глюкопиранозу, tпл
= 146 °С, удельное оптическое вращение []D = +112,2°.
Кристаллизация из водного этанола дает -D-глюкопиранозу, tпл
= 150 °С, []D
= +18,7°. Эти — и
-изомеры –
шестичленные циклические полуацетали –
образуются при реакции гидроксила ОН при
углероде С-5 с карбонильной группой в положении 1.
Новый стереоцентр, возникающий при получении
полуацеталя, называют аномерным углеродом.
Образующиеся таким образом диастереомеры* имеют специальное название – аномеры.
Конфигурация аномерного углерода обозначается
приставкой ,
когда его гидроксильная группа находится с той
же стороны фишеровской проекции, что и ОН-группа
при стереоцентре с высшим номером. При
противоположной ориентации этих гидроксилов
конфигурация аномерного углерода – .
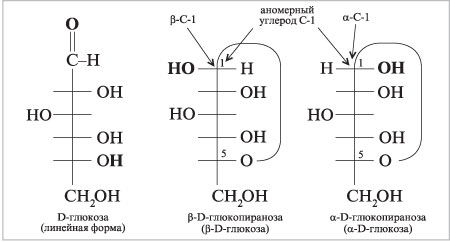 |
Циклические проекции Фишера
|
По данным метода ЯМР 13С D-глюкозы
в водном растворе, существуют: -пираноза (38,8%),
-пираноза (60,9%),
-фураноза (0,14%),
-фураноза (0,15%),
гидрат открытой линейной формы (0,0045%).
Приводим — и
-формы
глюкофуранозы в сравнении с циклическими
формами фруктозы –
-фруктофуранозы
и -фруктофуранозы.
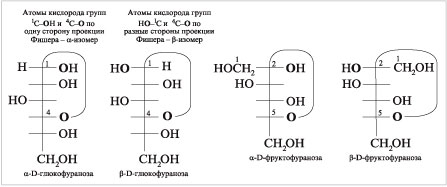 |
Проекции Фишера
|
В альдозах замыкание цикла
возможно за счет 1-го (альдегидного) углерода и
гидроксила при 4-м (или 5-м) атоме С, а в кетозах –
за счет 2-го (карбонильного) углерода и гидроксила
в 5-м или 6-м положении цепи.
Формулы Хеуорса. Альтернативный
способ изображения циклических структур
моносахаридов известен как проекции Хеуорса
и назван так в честь английского химика Уолтера
Хеуорса (нобелевский лауреат, 1937 г.). В формулах
Хеуорса пяти- и шестичленные циклические
полуацетали представляют в виде плоских пяти-
или шестиугольников, расположенных как бы
перпендикулярно плоскости листа бумаги. Группы,
присоединенные к углеродам кольца, располагают
над или под плоскостью кольца и параллельно
плоскости листа бумаги. В формулах Хеуорса
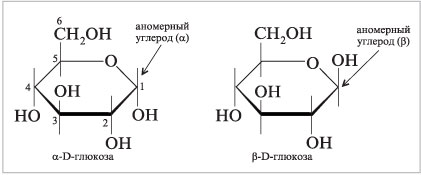
аномерный углерод обычно записывают справа, а
полуацетальный кислород – сзади него. Проекции
Хеуорса — и
-пиранозных форм
D-глюкозы показаны ниже.
 |
Проекции Хеуорса
|
УПРАЖНЕНИЯ.
1. Что означает понятие
«циклические формы углеводов»?
2. Приведите структурные и
проекционные формулы Фишера для: а) триозы; б)
тетрозы;
в) пентозы.
3. Как по химическим формулам
различить L— и D-изомеры (на примере
эритрозы)?
4. Укажите ацетальные связи и
асимметрические атомы углерода (стереоцентры) в
соединениях:
5. Напишите структурные формулы
гетероциклов пирана и фурана, указывая каждый
атом.
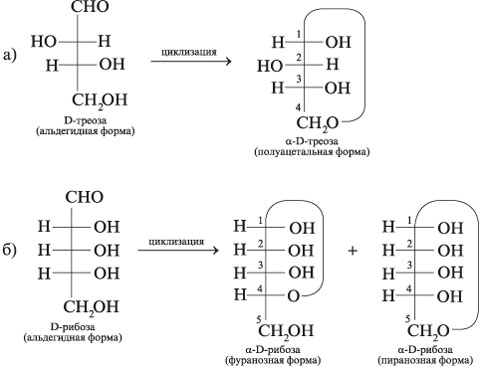
6. Составьте схемы образования
циклических полуацетальных форм из:
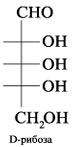
а) D-треозы; б) D-рибозы (фуранозная и
пиранозная формы).
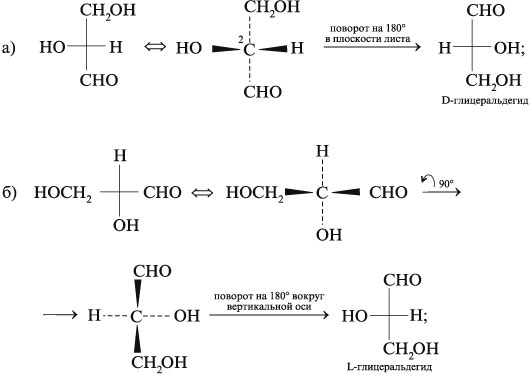
7. Преобразуйте графические формулы
соединений а)–в) в фишеровские проекции и
сделайте отнесение этих проекций к D— или L-глицеральдегиду:
8. Сколько возможно кетотетроз? Для
каждой нарисуйте проекции Фишера.
9. Составьте формулы Хеуорса:
1) -D-глюкопиранозы;
2) -D-глюкофуранозы.
Ответы на упражнения к теме 2
Урок 34
1. Циклические формы углеводов
содержат цикл с кислородом в кольце. Обычно это
циклический полуацеталь. В его молекуле нет
свободной альдегидной группы, зато имеется
ацетальная связь. Например, для эритрозы:
2.
| Моносахарид | Триоза | Тетроза | Пентоза |
|---|---|---|---|
| Структурная формула | 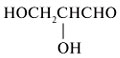 |
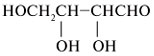 |
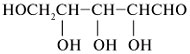 |
| Проекционная формула Фишера и название |
|
|
|
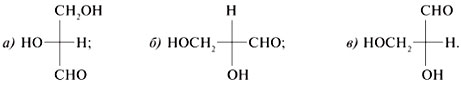
3. Чтобы по химическим
формулам различить D- и L-изомеры эритрозы,
следует представить их в виде проекций Фишера.
Ориентация гидроксила вправо при высшем
стереоцентре С*-3 означает
D-изомер. Направление группы НО влево от С*-3
свойственно L-изомеру:
4. Ацетальные связи отмечены стрелкой (), а стереоцентры –
звездочкой (*):
5.
6.
7.
в) две последовательные перестановки
заместителей не изменяют конфигурацию (D или L)
при стереоцентре:
8. Возможны две энантиомерные
кетотетрозы, для которых проекции Фишера
следующие:
9. Формулы Хеуорса:
* Диастереомеры –
стереоизомеры, молекулы которых не являются
зеркальным отображением друг друга.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.