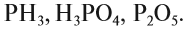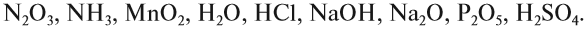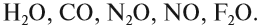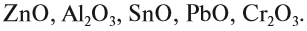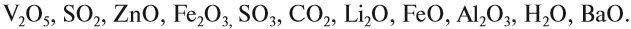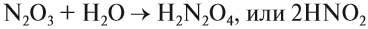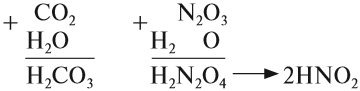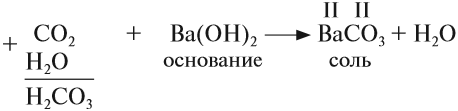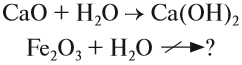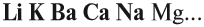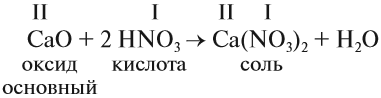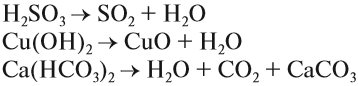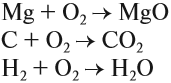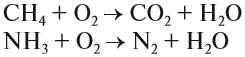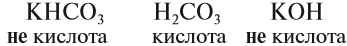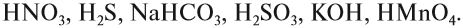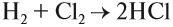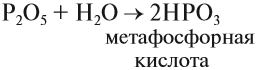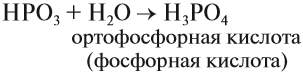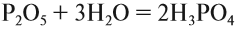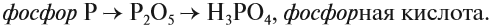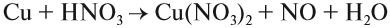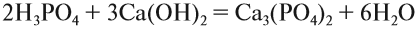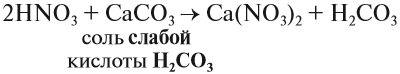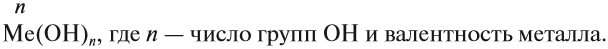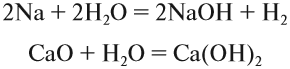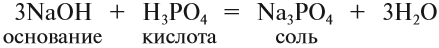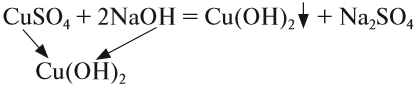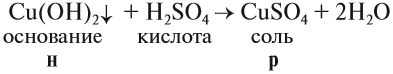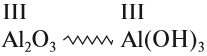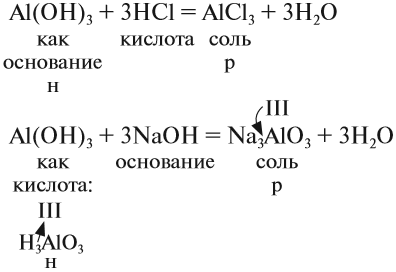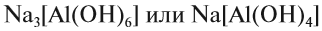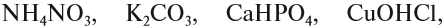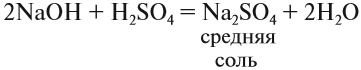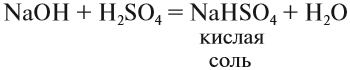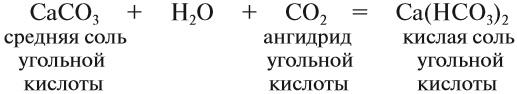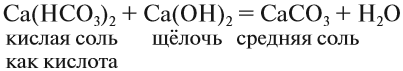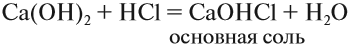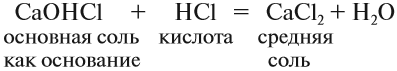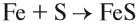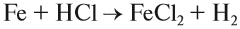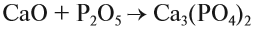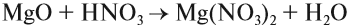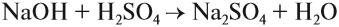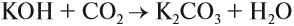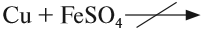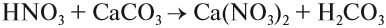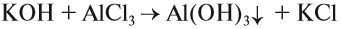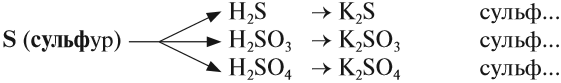Кислотные оксиды

4.5
Средняя оценка: 4.5
Всего получено оценок: 1559.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1559.
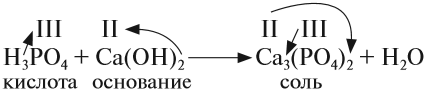
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
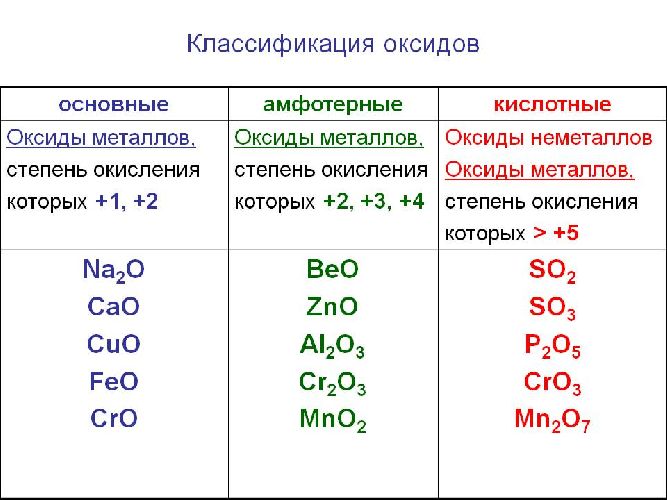
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Владимир Мартынов
7/10
-
Polina Malchikova
9/10
-
Дима Кулагин
10/10
-
Сергей Ефремов
9/10
-
Артём Макушенко
10/10
-
Наталия Григорьева
10/10
-
Данила Волков
9/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1559.
А какая ваша оценка?
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
«Оксид» |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: «оксид углерода два»);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
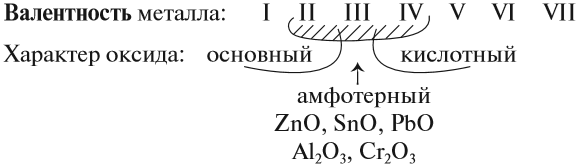
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



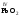
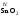
V,
VI,
VII
.являются
кислотными:
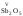


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
Содержание
- Оксиды
- Свойства кислотных оксидов
- Свойства основных оксидов
- Свойства амфотерных оксидов
- Способы получения оксидов
- Выводы
- Кислоты
- Свойства кислот
- Выводы
- Основания
- Свойства и способы получения щелочей
- Свойства и способы получения нерастворимых в воде оснований
- Свойства амфотерных гидроксидов
- Выводы
- Соли
- Способы получения солей
- Названия солей
- Выводы
Оксиды
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
Определите, какое из следующих соединений — оксид:
Оксидом является последнее соединение — P2O5 (в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов: H, Р, O).
Оксиды называют по схеме:
оксид чего? (название элемента).
Например: СаО — оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность.
Например: Fe2О3 — оксид железа III, FеО — оксид железа II.
Задание 2.1. Среди следующих соединений найдите оксиды и назовите их:
Задание 2.2. Составьте формулы следующих оксидов: оксид хрома III, оксид углерода IV, оксид магния, оксид серы VI, оксид азота V, оксид калия, оксид марганца VI.
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими:
Задание 2.3. Назовите эти несолеобразующие оксиды.
Некоторые оксиды имеют особые (тривиальные) названия:
Солеобразующие оксиды делятся на три группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только изучая его химические свойства. Например, кислотные оксиды реагируют с основаниями и не реагируют с кислотами. Основные оксиды реагируют с кислотами и не реагируют с основаниями. Амфотерные оксиды могут реагировать и с кислотами, и с основаниями, причём, реагируя с кислотами, они проявляют свойства основных оксидов, а реагируя с основаниями, — кислотных.
Отсюда вывод: в химических реакциях участвуют вещества с противоположными свойствами:
- основание и кислота;
- металл и неметалл;
- окислитель и восстановитель.
Впрочем, последние два случая мы рассмотрим позднее (см. уроки 2.4 и 7).
Поэтому, если определить по формуле оксида, какими свойствами он обладает, — можно предсказать, возможна ли эта реакция или нет! Но КАК это сделать? Вот некоторые правила:
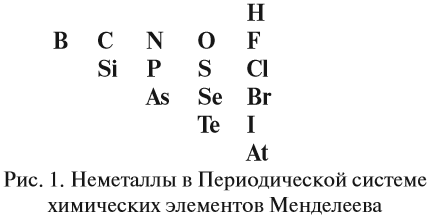
- неметаллы образуют только кислотные оксиды*;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
* Обратите внимание, что и безразличные оксиды образуются только неметаллами.
Предсказать свойства оксида металла может помочь эта схема.
Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
Задание 2.4. Назовите эти амфотерные оксиды.
Задание 2.5. Классифицируйте нижеприведённые оксиды:
Упражнение рекомендуется выполнить по схеме:
1. Определить, не является ли данный оксид несолеобразующим;
2. Определить, какой элемент входит в состав оксида: металл или неметалл, для чего выписать из таблицы Менделеева символы элементов – неметаллов: они расположены в главных подгруппах выше линии БОР — АСТАТ и на этой линии. Это:
3. Если в состав оксида входит атом неметалла — то оксид кислотный;
4. Для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сr2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- СrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Зная характер оксида, можно описать его свойства.
Свойства кислотных оксидов
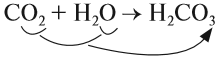
1. Кислотные оксиды, кроме SiО2, реагируют c водой, образуя кислоту:
Чтобы составить формулу кислоты, нужно «сложить» все атомы исходных веществ, записывая на первом месте символ водорода, на втором — символ элемента, образующего оксид, и на последнем — символ кислорода. Если индексы получились чётными, их можно сократить:
Эти же реакции можно записать в виде «арифметического примера»:
Задание 2.6. Составьте уравнения реакций с водой для кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + вода → кислота
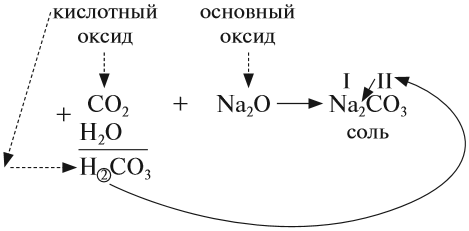
2. Кислотные оксиды реагируют с основными оксидами, образуя соль соответствующей кислоты, т. е. кислоты, которая образуется при взаимодействии этого оксида с водой (см. выше):
Для того чтобы составить такое уравнение, нужно:
- составить формулу кислоты («прибавив» к молекуле оксида молекулу воды);
- определить валентность кислотного остатка (это часть молекулы кислоты без атомов водорода). В данном случае кислотный остаток имеет состав СО3, его валентность равна числу атомов водорода в кислоте, т. е. II;
- составить формулу соли, записав вместо атомов водорода атом металла из основного оксида с его валентностью (в данном случае — натрий);
- составить формулу соли по валентности металла и кислотного остатка.
Задание 2.7. Составьте уравнения реакций с оксидом кальция кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основный оксид → соль
3. Кислотные оксиды реагируют с основаниями, образуя соль соответствующей кислоты и воду:
Принципы составления уравнения те же, что и для реакций с основными оксидами (см. пункт 2).
Задание 2.8. Составьте уравнения реакций с гидроксидом натрия NаОН кислотных оксидов из задания 2.5, зная, что реакции идут по схеме:
кислотный оксид + основание → соль + вода
ЗАПОМНИТЕ! Кислотные оксиды и с кислотами и кислотными оксидами НЕ РЕАГИРУЮТ!
Свойства основных оксидов
1. Основные оксиды реагируют с водой, образуя основание. Реакция происходит, если получающееся основание растворимо в воде.
Общая формула оснований Ме(ОН)х, где х — валентность металла, равная числу ОН групп.
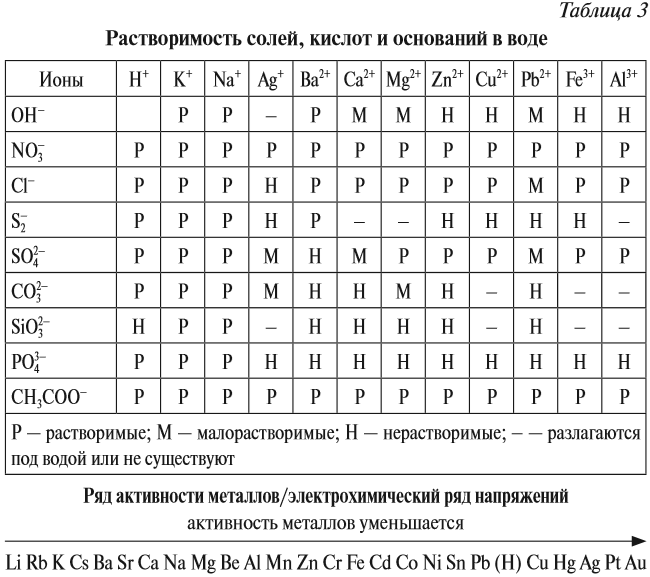
Последняя реакция не идет, так как основание Fe(ОН)3 нерастворимо в воде. Растворимость веществ в воде можно определить по таблице растворимости (рис. 2).
При определении возможности протекания данной реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он образован активным металлом. Такие металлы стоят в ряду напряжений до магния (см. табл. 3).
Задание 2.9. Составьте уравнения реакций с водой для основных оксидов из задания 2.5, зная, что реакции идут по схеме:
основный оксид + вода → основание
2. Основные оксиды реагируют с кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы соли нужно вместо атомов водорода в формуле кислоты написать символ металла, а затем составить полученную формулу по валентности.
Задание 2.10. Составьте уравнения реакций с Н2SО4 для основных оксидов из задания 2.5, зная, что реакции идут по схеме:
основный оксид + кислота → соль + вода
3. Основные оксиды реагируют с кислотными оксидами, образуя соль (см. задание 2.7).
4. Некоторые основные оксиды реагируют при нагревании с водородом, при этом образуется металл и вода:
ЗАПОМНИТЕ! Основные оксиды с основаниями и основными оксидами НЕ РЕАГИРУЮТ!
ВЫВОД. В реакцию легче всего вступают вещества с противоположными свойствами, и не вступают в реакцию вещества со сходными свойствами.
Свойства амфотерных оксидов
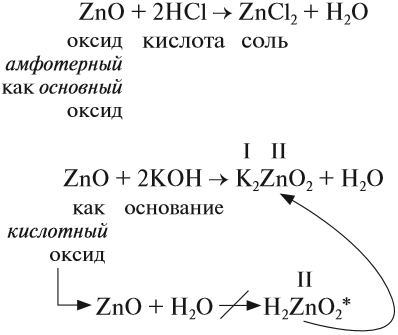
Амфотерные оксиды (от греч. amphi — двойной) проявляют двойственные свойства: они могут реагировать и с кислотами, и с основаниями (точнее, со щелочами). При этом образуются соль и вода.
Например,
* Такая реакция не происходит, но эта схема позволяет определить состав «кислотного остатка» и его валентность, а затем составить химическую формулу соли.
Задание 2.11. Составьте уравнения реакций с КОН и с НNО3 для амфотерных оксидов из задания 2.5.
Задание 2.12. С какими веществами (Н2О, NаОН, НСl) могут реагировать оксиды: Cr2O3, CrO, SO3, V2O5?
Составьте уравнения необходимых реакций. При составлении уравнений реакций помните:
- реагируют вещества с противоположными свойствами;
- сначала определите, какой это оксид (см. задание 2.5);
- затем, исходя из свойств этого оксида, составьте уравнения, пользуясь схемами заданий 2.6–2.10 и вышеприведенными уравнениями реакций для амфотерных оксидов.
Способы получения оксидов
Оксиды могут быть получены при разложении некоторых кислот, оснований, солей:
Оксиды обычно получают при сгорании в кислороде простых и сложных веществ:
Обратите внимание! При сгорании сложных веществ образуются оксиды элементов, которые входят в его состав. Исключение составляют только азот и галогены (F, Cl, Br, I), которые выделяются в виде простых веществ. Например:
Выводы
Молекулы оксидов состоят из атомов двух элементов. Один из этих элементов — кислород. Оксиды, образующие соли, бывают кислотные, амфотерные и основные. Оксиды реагируют с веществами, которые проявляют противоположные свойства.
- Основные оксиды — с кислотными оксидами или кислотами.
- Кислотные оксиды — с основными оксидами или основаниями.
- Амфотерные — и с кислотами, и с основаниями (щелочами).
В каждой из таких реакций образуется соль и вода.
Кислоты
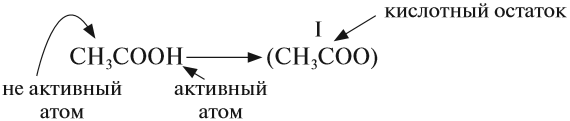
Кислоты — это сложные вещества, в состав молекул которых входит активный атом водорода и кислотный остаток. Этот активный атом водорода в химических реакциях способен замещаться на атом металла, в результате чего всегда получается соль.
В формулах неорганических кислот этот атом водорода записывается на первом месте*:
* В химических формулах органических кислот атом водорода стоит в конце, например, CH3–COOH уксусная кислота
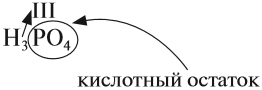
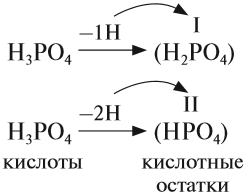
В состав любой кислоты кроме атомов водорода входит кислотный остаток. Кислотный остаток — это часть молекулы кислоты без атомов водорода (которые могут быть замещены на атом металла). Валентность кислотного остатка равна числу таких атомов водорода:
При определении валентности кислотного остатка учитываются те атомы водорода, которые участвовали в реакции или могут участвовать в ней. Так, фосфорной кислоте Н3РО4, в зависимости от условий, могут соответствовать кислотные остатки иного состава:
У органических кислот не все атомы водорода в молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность кислотных остатков для кислот, учитывая, что все атомы водорода кислот участвуют в реакции:
По числу атомов водорода кислоты делят на одноосновные и многоосновные:
- НСl — одноосновная, так как один атом водорода;
- Н2СО3 — двухосновная, так как два атома водорода.
По составу кислоты делят на:
- бескислородные: НСl, Н2S;
- кислородсодержащие: НСlO, Н2SO4.
Бескислородные кислоты представляют собой растворы некоторых газов в воде, при этом и растворённому газу, и полученному раствору приписывают одинаковые свойства, хотя это не так. Например, из простых веществ водорода и хлора получается газ хлороводород:
Этот газ не проявляет кислотных свойств, если он сухой: его можно перевозить в металлических ёмкостях, и никакой реакции не происходит. Но при растворении хлороводорода в воде получается раствор, который проявляет свойства сильной кислоты, её перевозить в металлических ёмкостях нельзя! Этот раствор называется «соляная кислота».
Названия бескислородных кислот составляют по принципу:
«ЭЛЕМЕНТ» + «ВОДОРОД»ная кислота
- H2S — сероводородная кислота (это раствор газа сероводорода в воде);
- НСl — хлороводородная (соляная) кислота (это раствор газа хлороводорода в воде);
- НF — фтороводородная (плавиковая) кислота (это раствор газа фтороводорода в воде).
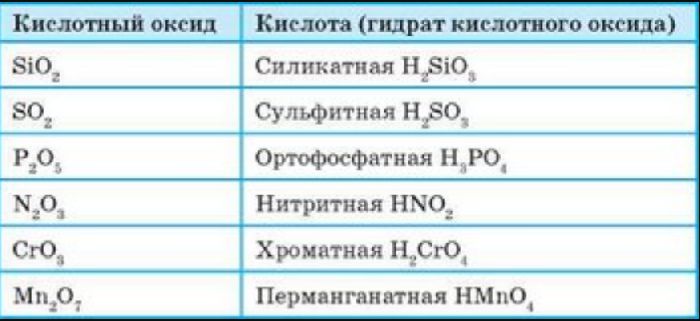
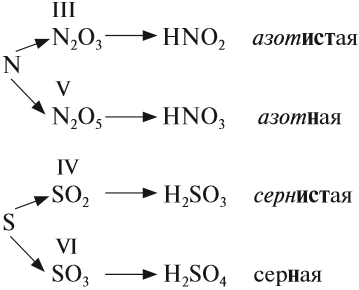
Кислородсодержащие кислоты могут быть получены при действии воды на кислотные оксиды (см. задание 2.6). Исходные кислотные оксиды называются «АНГИДРИДЫ кислот»:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
или в суммарном виде:
Таким образом, Р2O5 — ангидрид фосфорной кислоты, а также некоторых других, менее устойчивых кислот.
Обратите внимание! Название кислородосодержащей кислоты содержит в виде корня название элемента, входящего в состав ангидрида:
Если элементу соответствуют несколько кислот, то для кислоты с большей валентностью элемента, входящего в состав ангидрида, в названии употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ».
Валентность элемента проще всего определять по формуле ангидрида:
Обратим внимание, что в названии сернистой кислоты основной суффикс -ИСТ-, а суффикс -Н- введён дополнительно для благозвучия.
Сведём всё известное о названиях кислот в таблицу 4.
Задание 2.14. Заполнить табл. 4, заменив знаки вопросов формулами и названиями соответствующих кислот.
Задание 2.15. Напишите НА ПАМЯТЬ формулы кислот: кремниевой, сернистой, серной, сероводородной, азотистой, азотной, соляной, фосфорной, угольной. Укажите ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их способность образовывать соли. Соли образуются в любой реакции, в которой участвует кислота, при этом замещаются активные атомы водорода (один, все или несколько).
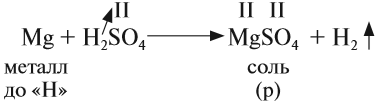
1. Кислоты реагируют с металлами, при этом атом водорода кислоты замещается на атом металла — в результате образуется растворимая соль* и водород:
* Если образуется нерастворимая соль, то эта соль закрывает поверхность металла и реакция останавливается.
Не все металлы способны вытеснять водород из растворов кислот: этот процесс возможен только для тех металлов, которые стоят в ряду напряжений ДО водорода (рис. 3 или таблица 3).
Задание 2.16. Составьте уравнения возможных реакций:
- серная кислота + алюминий →
- соляная кислота + серебро →
- бромоводородная кислота + цинк →
При составлении уравнений пользуйтесь рядом напряжений и схемой реакции:
кислота + металл (до водорода) → соль + водород
Не забывайте, составляя формулы солей, учитывать валентность металла и кислотного остатка.
Некоторые кислоты могут растворять металлы, которые стоят в ряду напряжения после водорода, но водород при этом не выделяется:
2. Кислоты реагируют с основаниями, образуя соль и воду*. Это реакция обмена, и поэтому валентность составных частей в результате реакции не меняется:
* Реакция между кислотой и основанием называется реакцией нейтрализации.
Расставим коэффициенты:
Задание 2.17. Составьте аналогичные уравнения реакций по схеме:
кислота + основание → соль + вода
для:
- серной кислоты и Fe(ОН)3;
- соляной кислоты и Ва(ОН)2;
- сернистой кислоты и NаОН.
Не забудьте:
- составить формулу соли по валентности металла и кислотного остатка;
- расставить коэффициенты.
3. Кислоты могут реагировать с солями. При этом сильная кислота вытесняет более слабую из её соли.
- К сильным кислотам относятся: серная, азотная, соляная и др.
- К слабым кислотам относятся: угольная, кремниевая, сероводородная, азотистая.
Происходит реакция обмена: образуется новая соль и новая кислота.
Более подробно о подобных реакциях см. в уроке 6.
Задание 2.18. Составьте НА ПАМЯТЬ формулы: а) сильных, б) слабых кислот.
Задание 2.19. Составьте уравнения реакций по схеме:
(более сильная) кислота + соль → соль + кислота (более слабая):
- соляная кислота + FeS →
- азотная кислота + Na2SiO3 →
- серная кислота + K2CO3 →
4. И, наконец, выяснив свойства кислот, зададим себе вопрос: а можно ли обнаружить кислоту в растворе? Например, в одном стакане налита вода, а в другом — раствор кислоты. Как определить, где кислота? Хотя многие кислоты кислые на вкус, пробовать их НЕЛЬЗЯ — это опасно! Выручают особые вещества — ИНДИКАТОРЫ. Это соединения, которые изменяют цвет в присутствии кислот:
- синий ЛАКМУС становится красным;
- оранжевый МЕТИЛОРАНЖ тоже становится красным.
Выводы
Кислоты классифицируются:
- по числу атомов водорода на одноосновные, двухосновные и т. д.,
- по наличию атома кислорода в составе молекулы на бескислородные и кислородсодержащие,
- по силе на сильные и слабые,
- по устойчивости на устойчивые и неустойчивые.
Кислоты реагируют:
- с активными металлами (до «Н»),
- с основаниями,
- с основными и амфотерными оксидами,
- с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой («красной») области.
Основания
Основания — это сложные соединения, в состав молекул которых входит атом металла и гидроксогруппа ОН:
Валентность ОН-группы равна I.
Основания называют по схеме:
гидроксид (чего?) металла (n),
где n — переменная валентность металла.
Например:
- Са(ОН)2 — гидроксид кальция,
- Fе(OH)3 — гидроксид железа (III),
- NH4OH — гидроксид аммония.
Обратите внимание. В состав последнего основания не входит атом металла. Это исключение. Валентность группы NН4 (аммоний) равна I.
Основания бывают растворимые в воде и нерастворимые в воде. Это легко определить по таблице растворимости.
Растворимые в воде основания называются ЩЕЛОЧАМИ. В состав щелочей входят атомы активных металлов (они находятся в начале ряда напряжений, до магния). Гидроксид аммония тоже относится к щелочам, так как существует только в растворах.
Задание 2.20. Составьте, пользуясь таблицей растворимости или рядом напряжений, химические формулы 2–3 щелочей.
Свойства и способы получения щелочей
Щёлочи можно получить действием активного металла (К, Nа, Cа, Ва) или его оксида на воду:
1. Растворы щелочей реагируют с кислотными и амфотерными оксидами (см. урок 2.1) и с кислотами (см. урок 2.2). Последняя реакция называется реакцией НЕЙТРАЛИЗАЦИИ:
Реакция нейтрализации характерна для всех кислот!
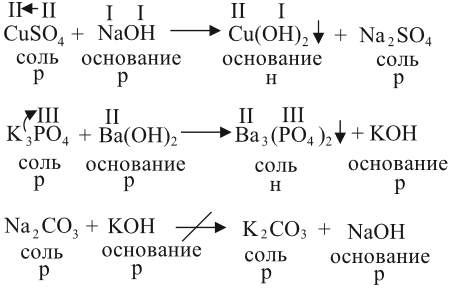
2. Растворы щелочей реагируют с растворами солей. Реакция происходит, если образуется хотя бы одно нерастворимое соединение. Эта реакция относится к реакциям обмена, т. е. в результате получается новая соль и новое основание:
- Последняя реакция не происходит, так как оба полученных вещества растворимы в воде.
- Валентности составных частей исходных молекул определяйте по кислотному остатку или по числу групп ОН.
- Полученные значения валентностей используйте при составлении формул полученных веществ.
- Растворимость получаемых веществ определяйте по таблице растворимости.
Задание 2.21. Расставьте коэффициенты в вышеприведённых уравнениях реакций.
Задание 2.22. Составьте уравнения реакций обмена:
- Fe(NO3)3 + гидроксид калия →
- Na2SO3 + гидроксид кальция →
- K3PO4 + гидроксид аммония →
Определите, какая из реакций не происходит и почему.
3. Растворы щелочей, как и растворы кислот, способны изменять окраску индикаторов:
- фиолетовый лакмус синеет,
- оранжевый метилоранж желтеет,
- бесцветный фенолфталеин краснеет.
Все изменения окрасок индикаторов можно свести в таблицу 5.
Обратите внимание: если к воде добавить кислоты, то в растворе будет кислая среда; если добавить щелочь — щелочная; в чистой воде среда нейтральная.
Вопрос 1. Можно ли при помощи фенолфталеина узнать, что налито в стакане: вода? НCl? КОН? А при помощи лакмуса?
Вопрос 2. Почему реакция между кислотой и щелочью названа реакцией нейтрализации?
Свойства и способы получения нерастворимых в воде оснований
Среди нерастворимых в воде оснований следует выделить особую группу веществ — амфотерные гидроксиды. Их свойства будут рассмотрены ниже. Способы получения их такие же, как и для нерастворимых оснований.
Нерастворимые основания получают, действуя на раствор соли, в состав которой входит нужный атом металла, раствором щёлочи:
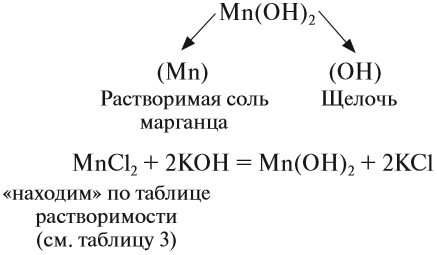
Попробуем определить, какие вещества нужно взять для того, чтобы получить гидроксид марганца (II):
Задание 2.23. Напишите уравнения реакций, при помощи которых можно получить: а) гидроксид железа (III), б) гидроксид железа (II).
Свойства нерастворимых в воде оснований во многом отличаются от свойств щелочей: нерастворимые в воде основания не могут реагировать с растворами солей, а также с амфотерными и некоторыми кислотными оксидами. Они не изменяют окраску индикатора.
1. Нерастворимые основания могут реагировать с кислотами, если при этом происходит растворение исходного нерастворимого вещества (осадка):
Таким образом, эта реакция возможна, если образуется растворимая соль (см. таблицу 3).
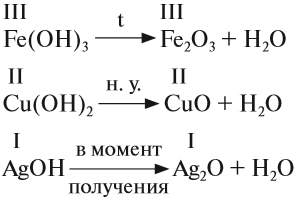
2. Нерастворимые основания разлагаются при нагревании. При этом, чем меньше активность металла (см. ряд напряжений), тем легче разлагается основание на оксид и воду:
Свойства амфотерных гидроксидов
Амфотерные гидроксиды соответствуют амфотерным оксидам. Это означает, что в состав амфотерного гидроксида входит тот же атом металла и с той же валентностью, что и в состав амфотерного оксида:
Как вы думаете, почему эти вещества называются амфотерными? (Если ответить не можете — загляните в урок 2.1.)
Ответ простой — амфотерные соединения проявляют двойственные свойства, т. е. реагируют) и с кислотами, и со щелочами (и растворяются при этом):
Если эта реакция происходит с растворами щелочей, то вместо вещества состава Na3AlO3 (или NaAlO2)* образуется сложное комплексное соединение:
* Ортоалюминиевая кислота H3AlO3 теряет молекулу H2O, и образуется метаалюминиевая кислота HAlO2, в которой кислотный остаток AlO2 имеет валентность I.
Задание 2.24. Составьте уравнения реакций с кислотой и со щёлочью для амфотерных гидроксидов: а) гидроксида цинка; б) гидроксида хрома (III).
Выводы
Молекулы неорганических оснований содержат гидроксогруппу ОН. Все неорганические основания, кроме NH4OH, содержат атом металла. Основания делят на растворимые в воде (щёлочи) и нерастворимые в воде.
Растворы щёлочей реагируют:
- с кислотами (реакция нейтрализации),
- с кислотными и амфотерными оксидами,
- с растворами солей.
Щёлочи обнаруживаются индикаторами в щелочной («синей») области. Нерастворимые в воде основания не изменяют окраску индикатора, могут реагировать с некоторыми кислотами и кислотными оксидами, а также термически неустойчивы.
Соли
Соли — это продукт реакции между кислотой и основанием, например реакции нейтрализации. Даже если такая реакция невозможна, ЛЮБОЙ соли можно поставить в соответствие основание и кислоту. Поэтому в состав любой соли входит остаток основания (обычно атом металла или группа NH4) и остаток кислоты (кислотный остаток).
Задание 2.25. Попробуйте определить для каждой из этих солей
где в её молекуле остаток кислоты, а где — остаток основания. Определите валентности составных частей.
Обратите внимание, что в состав некоторых солей входят атомы водорода или группы ОН. Такое различие подсказывает, что соли могут быть разных типов. Рассмотрим три вида солей.
Средние соли. Такие соли получаются, если кислота и основание полностью прореагировали:
Кислые соли. Такие соли получаются, если не все атомы водорода кислоты были замещены на атом металла:
Кислотные остатки таких солей содержат атом водорода. Кислые соли образуются в результате гидролиза некоторых солей, а также при взаимодействии средней соли с ангидридом «своей» кислоты:
Кислые соли могут проявлять некоторые свойства кислот, например они могут реагировать с щелочами:
Основные соли. Такие соли образуются, если не все группы ОН основания замещены на кислотный остаток:
Такие соли содержат гидроксогруппу ОН. Основные соли образуются в результате гидролиза некоторых солей. Основные соли могут проявлять некоторые свойства оснований. Например, они могут реагировать с кислотами:
Способы получения солей
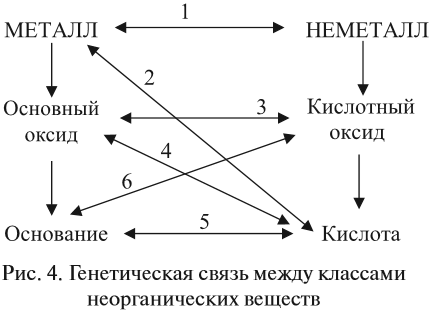
Вспомните, во многих примерах, которые иллюстрировали свойства оксидов, кислот, оснований, — продуктом реакции была соль. Попробуем обобщить эти сведения и выяснить, в результате каких процессов можно получить СОЛЬ заданного состава. Прежде всего, отметим, что способы получения солей можно условно разбить на 2 группы:
- I — получение солей из веществ, которые не являются солями;
- II — получение солей из других солей.
Реакции I группы основаны на том, что в реакцию вступают противоположные по свойствам вещества (рис. 4).
Приведём конкретные примеры:
1. Металл + неметалл (галоген или сера):
2. Металл + кислота:
3. Основный оксид + кислотный оксид:
4. Основный оксид + кислота:
5. Основание + кислота:
6. Основание + кислотный оксид:
Задание 2.26. Расставьте коэффициенты в этих уравнениях. Приведите свои примеры каждого типа.
Реакции II группы являются реакциями обмена или замещения. В каждой из таких реакций участвует соль, и поэтому способы получения солей по группе II фактически являются химическими свойствами солей:
7. Более активный металл вытесняет менее активный из растворов его солей:
обратный процесс не идёт:
Активность металлов можно определять по ряду напряжений:
В этом ряду любой металл активнее всех металлов, стоящих после него (правее него).
8. Сильная кислота вытесняет более слабую кислоту из её соли:
9. Щёлочь, реагируя с солью, образует новое основание и новую соль
Эта реакция происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ — нерастворимо.
10. Соль, вступая в реакцию обмена с другой солью, образует две новые соли
Эта реакция также происходит, если оба исходных вещества растворимы, а хотя бы одно из полученных веществ — нерастворимо.
Например, эта реакция:
невозможна, так как обе полученные соли растворимы. А этот процесс:
невозможен потому, что СаСО3 (мел) нерастворим в воде.
Названия солей
Названия солей происходят от латинского названия химического элемента, который входит в состав кислотного остатка (исключая кислород):
- S — сульфур;
- N — нитрогениум;
- С — карбонеум;
- Si — силициум.
Например:
Очевидно, что для солей разного состава должны быть разные названия. Это достигается введением суффиксов:
- для солей бескислородных кислот -ИД-;
- для солей кислородсодержащих кислот -ИТ- (меньшая валентность элемента), АТ- (бОльшая валентность элемента).
Задание 2.27. Составьте названия вышеприведённых солей серусодержащих кислот.
При правильной работе должно получиться:
Аналогично составляют названия остальных солей (табл. 6).
Задание 2.28. Дополните таблицу 6, составив химические формулы солей тех металлов, которые указаны в таблице.
При составлении названий кислых солей используют частицу «гидро»:
При составлении названий основных солей используют частицу «гидроксо»:
Задание 2.29. Назовите все соли, которые встречаются в тексте и уравнениях реакций этого раздела.
Задание 2.30. Составьте по 3–4 уравнения реакций получения:
- бромида магния;
- сульфата цинка.
Выводы
Соли состоят из остатков веществ, которые проявляют противоположные свойства: кислоты и основания.