Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Скачиваний:
171
Добавлен:
18.03.2015
Размер:
2.27 Mб
Скачать

Итак, каждое из четырех квантовых чисел «отвечает» за определенный аспект характеристики электронного состояния. Набор всех четырех квантовых чисел позволяет полностью охарактеризовать состояние электрона в атоме с позиций квантово-механической модели.
Существует очень простая и наглядная система обозначений, в которой принято символически изображать каждую орбиталь клеткой (так называемой квантовой ячейкой) (рис. 1.5.), а значения спинового квантового числа ото-
ждествлять с направлением стрелки: ↑ (ms = + ½), ↓ (ms = — ½).
Согласно правилу Хунда (принципу максимальной мультиплетности)
абсолютное значение суммарного спинового числа электронов данного энергетического подуровня должно быть максимальным.
s-подуровень
p-подуровень
d-подуровень
f-подуровень
Рис. 1.5. Квантовые ячейки
Другими словами, в основном состоянии атома (такое состояние отвечает его минимальной энергии) максимальное число квантовых ячеек должно быть занято электронами, поэтому при построении схемы распределения электронов по квантовым ячейкам следует сначала помещать по одному электрону в каждую из них (спины всех электронов данного подуровня должны быть па-
29

раллельными), и только после того, как одиночные электроны заполнят все ячейки, в них помещается второй электрон с антипараллельным спином.
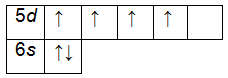
Например, единственно верным вариантом распределения четырех электронов на d-энергетический подуровень является следующий:
↑↑ ↑ ↑
d-подуровень
т.к. именно в этом случае суммарное спиновое число достигает максимального значения: +½+½+½+½ = +4/2.
Электроны с одинаковыми значениями квантового числа ms (т.е. электроны с параллельными спинами) называют неспаренными. Именно эти электроны играют решающую роль в процессе образования химической связи между атомами, определяя их валентные состояния.
Если же число электронов превышает количество квантовых ячеек, то нахождение электронов в одной и той же квантовой ячейке возможно лишь в том случае, если значения спиновых квантовых чисел этих электронов противоположны (такие электроны с антипараллельными спинами называют спаренными). Например, семь электронов заполняют ячейки d-состояния следующим образом:
|
↑↓ |
↑↓ |
↑↓ |
↑ |
|
d-подуровень
При получении атомом дополнительной энергии он переходит из основного в возбужденное состояние. При этом электроны из полностью заполненных орбиталей переходят на вакантные орбитали того же энергетического подуровня. Число неспаренных электронов при этом увеличивается, и валентные возможности атома изменяются.
Из принципа Паули следует, что в одной и той же квантовой ячейке (квантовые числа n, ℓ, mℓ для таких электронов уже совпадают) могут находиться максимум два электрона с противоположными значениями спинового
30
квантового числа ms. Это позволяет установить предельную емкость каждого энергетического подуровня (рис. 1.6.).
|
s-подуровень |
↑ ↓ |
2 |
электрона |
||||||
|
p-подуровень |
6 |
электронов |
|||||||
|
↑ ↓ |
↑ ↓ |
↑ ↓ |
|||||||
|
d-подуровень |
10 электронов |
||||||||
|
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
|||||
|
f-подуровень |
14 электронов |
||||||||
|
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
|||
Рис. 1.6. Максимальная емкость энергетических подуровней
Итак, каждый энергетический подуровень имеет ограничения по количеству электронов, которые его заполняют.
1.8. Электронные формулы атомов
Представить электронное строение многоэлектронного атома – это значит в условной форме дать распределение электронов этого атома по энергетическим уровням и подуровням, т.е. составить так называемую электронную формулу атома. Электронная формула – это своего рода шифр, основу которого составляют квантовые числа. Электронная формула атома строится из блоков вида:
nℓx,
где: n – главное квантовое число (номер энергетического уровня, его зна чение указывается цифрой 1,2,3, 4,5,…), ℓ – орбитальное квантовое число (его значение обозначается соответствующей латинской буквой s, p, d, f), x – число электронов, находящихся в данном квантовом состоянии.
31

Например, запись 4d7 означает, что семь электронов занимают четвертый энергетический уровень, d-подуровень, т.е. для этих семи электронов n=4 и ℓ=2.
Электронная формула атома составляется для его основного состояния, т.е. для состояния, которому отвечает минимальная энергия. При составлении электронных формул следует производить заполнение энергетических подуровней в порядке роста их энергии, низшие по энергии подуровни всегда заполняются первыми (принцип наименьшей энергии).
Энергия подуровней растет в соответствии с ростом суммарного значения квантовых чисел n + ℓ, а в случае их равенства первым заполняется подуровень с меньшим значением n.
Порядок заполнения легко вывести из диаграммы, представленной на рис. 1.7.
|
1s |
Ó |
||||||
|
2s |
Ó |
2p Ó |
|||||
|
3s |
Ó |
3p Ó |
3d |
Ó |
|||
|
4s |
Ó |
4p Ó |
4d |
Ó |
4f |
Ó |
|
|
5s |
Ó |
5p |
Ó |
5d |
Ó |
5f |
Ó |
|
6s |
Ó |
6p |
Ó |
6d |
Ó |
6f |
|
|
7s |
Ó |
7p |
Ó |
7d |
7f |
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f,…
энергия
Рис. 1.7. Диаграмма энергетических подуровней
32
В этой диаграмме в столбик выписаны энергетические подуровни каждого из семи уровней. При движении справа налево по диагонали данной диаграммы Вы получаете порядок, в котором следует заполнять энергетические подуровни электронами при составлении электронных формул атомов.
Учитывая рассмотренные выше закономерности, электронные формулы атомов алюминия (порядковый номер элемента 13, атом содержит 13 электронов) и скандия (порядковый номер элемента 21, атом содержит 21 электрон) можно представить в виде:
13Al 1s2 2s2 2p6 3s2 3p1
21Sc 1s2 2s2 2p6 3s2 3p6 4s2 3d1 или 21Sc 1s2 2s2 2p6 3s2 3p6 3d1 4s2,
если чисто формально скомпоновать подуровни третьего энергетического уровня вместе.
Электронные формулы многоэлектронных атомов можно представить в более краткой форме, если учесть, что полностью застроенные оболочки характеризуют электронное состояние благородных газов – элементов, завершающих каждый период периодической системы Д. И. Менделеева:
He (1s2),
Ne (1s22s22p6),
Ar (1s22s22p63s23p6),
Kr (1s22s22p63s23p63d104s24p6),
Xe (1s22s22p63s23p63d104s24p64d105s25p6),
Rn (1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6).
Поэтому в электронных формулах можно указать символ соответствующего благородного газа в квадратных скобках, а далее привести рас-
33
пределение тех электронов атома, число которых превышает число электронов в атоме этого благородного газа. Для рассмотренных выше полных электронных формул алюминия и скандия такая модификация дает следующий результат:
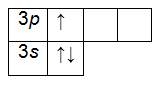
13Al [Ne] 3s2 3p1
21Sc [Ar] 3d1 4s2
Электроны внешнего (последнего) энергетического уровня и, как правило, предвнешнего (предпоследнего) уровня d-подуровня, если он застроен не-
полностью, называют валентными электронами.
Так, валентными электронами Al считаются 3s2 3p1, а Sc — 3d14s2.
Наряду с электронными формулами атомов используют и так называемые электронно-графические формулы, основанные на рассмотренных выше представлениях о квантовых ячейках. В этом случае каждый энергетический подуровень представляется набором соответствующих квантовых ячеек, которые заполняют электронами согласно требованиям принципа Паули и правила Хунда.
Например, электронно-графические формулы атомов алюминия и скандия выглядят так:
|
13Al |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
||||||
|
1s2 |
2s2 |
2p 6 |
3s2 |
3p1 |
|
21Sc |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||||||||||||
|
1s2 |
2s2 |
2p6 |
3s2 |
3p6 |
||||||||||||||||||
|
↑ |
↑↓ |
|||||||||||||||||||||
|
3d1 |
4s2 |
34
Соседние файлы в папке Доп материалы
- #
- #
18.03.20150 б3Смолова К практич зан по химии.pdf
Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45o к соответствующим осям.
- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
Ответ: Электронная конфигурация 2s22p5. Главное квантовое число для всех электронов равно 2. Для s электронов l = 0, для р-электронов l = 1.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 |
0 |
0 | — 1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | — 1 | +1/2 |
| 6 | 2 | 1 | 1 | — 1/2 |
| 7 | 2 | 1 | 0 |
— 1/2 |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
Содержание
- Электронная и электронно-графическая формула
- Что такое электронная и электронно-графическая формула
- Составление электронной и электронно-графической формулы
- Примеры решения задач
- Электронная формула элемента.
- Химия. Строение атома и составление электронно-графических формул.
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
Электронная формула алюминия выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Источник
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Источник
Химия. Строение атома и составление электронно-графических формул.
Прежде, чем перейти непосредственно к составлению электронно-графических формул, стоит кратко сказать о природе электрона. Дело в том, что электрон не представляет собой материальную частицу, и сказать, где он находится в данный момент времени нельзя. Вместо этого оперируют таким понятием, как атомная орбиталь.
Атомная орбиталь — область вокруг ядра атома, в которой вероятность нахождения электрона максимальна (более 90%).
В настоящее время достоверно известно о четырех видах орбиталей: s, p, d, f. Элементы, в которых превалирует та или иная орбиталь изображены в периодической системе.
Как правило, s-элементы обозначают красным, p-элементы — желтым, d-элементы — синим или зеленым, f-элементы — зеленым или фиолетовым.
У каждой орбитали имеется своя форма. s — шар, p — «восьмерка», d — две перекрещенные «восьмерки», f — «восьмерка» с описанной торой (фигура, похожая на бублик).
Для описания состояния конкретного электрона используются так называемые квантовые числа. Всего их четыре:
1) главное квантовое число (N) — описывает энергию, которую имеет электрон, и принимает значения от 1 до бесконечности. Когда N равно бесконечности, электрон отрывается от атома.
2) побочное квантовое число (l) — отвечает за количество подуровней. Принимает значения, равные N-1.
3) магнитное квантовое число(m(l)) — отвечает за форму орбитали и принимает значения от -l до l, включая l=0. Также это число отвечает за число возможных положений орбитали в пространстве.
Эти положения изображаются в виде так называемых квантовых ячеек, и их количество равно числу положений.
4) Спиновое число (m(s)) — отвечает за направление вращения электрона (спин). Принимает значения +1/2 или -1/2.
Переходим непосредственно к заполнению атома электронами. Оно выполняется по следующим правилам:
1) Принцип наименьшей энергии — сначала заполняются уровни, энергия которых минимальна. 1s
2) Правило Гунда — суммарный спин электронов должен быть максимальным. Высчитать его просто: нужно сложить спин всех электронов. Стрелка, направленная вверх обозначает спин +1/2, вниз — -1/2.
3) Принцип Паули — в атоме не може быть двух электронов, обладающих одинаковым набором квантовых чисел.
Источник
Атом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Электроны располагаются в атоме, образуя энергетические уровни и подуровни.
Электронная формула атома – это распределение электронов в атоме по энергетическим уровням и подуровням в соответствии с принципом наименьшей энергии (Клечковского), принципом Паули, правилом Гунда.
Электронные формулы атомов
Состояние электрона в атоме описывается с помощью квантово-механической модели – электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения электрона. Обычно под электронным облаком понимают область околоядерного пространства, которая охватывает примерно 90% электронного облака. Эта область пространства называется также орбиталью.
Атомные орбитали образуют энергетический подуровень. Орбиталям и подуровням присвоены буквенные обозначения. Каждый подуровень имеет определенное число атомных орбиталей. Если атомную орбиталь изобразить в виде магнитно-квантовой ячейки, то атомные орбитали, находящиеся на подуровнях, можно представить следующим образом:
| энергетический подуровень | s | p | d | f |
| атомные орбитали | . |
На каждой атомной орбитали могут находиться одновременно не более двух электронов, различающихся спином (принцип Паули). Это различие обозначается стрелками ¯.
Зная, что на s-подуровне одна s-орбиталь, на р-подуровне три р-орбитали, на d-подуровне пять d-орбиталей, на f-подуровне семь f-орбиталей, можно найти максимальное количество электронов на каждом подуровне и уровне.
Так, на s-подуровне, начиная с первого энергетического уровня, 2 электрона; на р-подуровне, начиная со второго энергетического уровня, 6 электронов; на d-подуровне, начиная с третьего энергетического уровня, 10 электронов; на f-подуровне, начиная с четвертого энергетического уровня, 14 электронов. Электроны на s-, p-, d-, f-подуровнях называются соответственно s-, р-, d-, f-электронами.
Согласно принципу наименьшей энергии, последовательное заполнение энергетических подуровней электронами происходит таким образом, что каждый электрон в атоме занимает подуровень с наиболее низкой энергией, отвечающей его прочной связи с ядром. Изменение энергии подуровней может быть представлено в виде ряда Клечковского или шкалы энергии:
Источник: https://megaobuchalka.ru/9/32691.html
Электронная формула химических элементов
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p и т.д.
Так, значению n + l = 5 соответствуют энергетические подуровни 3d (n = 3, l=2), 4d (n=4, l=1) и 5s (n=5, l =0). Первым из этих подуровней заполняется тот, у которого ниже значение главного квантового числа.
Поведение электронов в атомах подчиняется принципу запрета, сформулированному швейцарским ученым В. Паули: в атоме не может быть двух электронов, у которых были бы одинаковыми все четыре квантовых числа.
Согласно принципу Паули, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел (главное, орбитальное и магнитное), могут находиться только два электрона, отличающиеся значением спинового квантового числа.
Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа.
Электронная формула атома
Электронную формулу атома изображают следующим образом: каждому энергетическому уровню соответствует определенное главное квантовое число n, обозначаемое арабской цифрой; за каждой цифрой следует буква, соответствующая энергетическому подуровню и обозначающая орбитальное квантовое число. Верхний индекс у буквы показывает число электронов, находящихся в подуровне. Например, электронная формула атома натрия имеет следующий вид:
11N 1s22s22p63s1.
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным (это наиболее наглядно отражается при составлении электронно-графических формул).
Источник: http://ru.solverbook.com/spravochnik/formuly-po-ximii/elektronnaya-formula/
В электронной формуле главное квантовое число n показывается цифрой,
орбитальное, L, буквой, соответственно: 0 — s, 1 — p, 2 — d, 3 — f … и т.д.
поэтому первый электрон — это 2s-электрон, и второй точно такой же, а вместе их в электронной формуле можно записать как 2s2,
Аналогично можно разобраться и с тремя оставшимися электронами.
Магнитное и спиновое квантовое число в электронной формуле не указываются, но если рисуется электронная схема, то надо учитывать, что каждому значению ml отвечает отдельная орбиталь, что на схемах показывается отдельной ячейкой, клеточкой. Поэтому 3,4,5 электроны находятся по одному на отдельных орбиталях.
На схемах электроны изображаются стрелками и спиновое число ms показывает рисуется стрелка вверх (+1/2) или вниз (-1/2)