Nitrate compounds are water-soluble in most cases. The oxidizing agents are known to be nitrate compounds. The nitrate compounds have the potential to generate a combustible mixture when mixed with hydrocarbons. Nitrates are good precursors for the creation of ultra-pure chemicals, as well as specific catalyst and nanoscale materials. The inorganic salts of a given metal cation and the nitrate anion are known to be all metallic nitrates.
Magnesium Nitrate
Magnesium nitrate, also known as Mg(NO3)2, is an inorganic nitrate salt of the element magnesium with the chemical name magnesium nitrate. Magnesium nitrate, also known as magnesian, magnesium dinitrate, or Nntromagnesite, is a mineral composed of magnesium and nitrogen. In the field of pyrotechnics, it is commonly employed. Magnesium dinitrate is a crystalline, hygroscopic solid that is white in color. It occurs naturally in caverns and mines and is extremely soluble in water and ethanol.
Structure of Magnesium Nitrate
Magnesium Nitrate has the chemical formula Mg(NO3)2. Furthermore, the same has a molar mass of 148.32 gmol-1. The hydrated forms of this salt are dihydrate (Mg (NO3)2.H2O) and hexahydrate (Mg(NO3)2.6H2O). These have molar masses of 184.35 and 256.41 g mol-1, respectively. This salt is made up of one magnesium cation (Mg2+) and two nitrate anions (NO3–).
Physical Properties of Magnesium Nitrate
- Magnesium nitrate is a crystalline white substance.
- It is water-soluble and ethanol and ammonia soluble to a lesser extent.
- It has a hygroscopic property. That is, it has a proclivity for absorbing moisture from the atmosphere.
- Magnesium nitrate has a melting point of 362 degrees Celsius.
- Magnesium nitrate has a density of 2.3g/cm3.
Chemical Properties of Magnesium Nitrate
- Thermal Decomposition of Magnesium Nitrate: When magnesium nitrate is heated, it decomposes into nitrogen oxides.
2Mg(NO3)2 → 2MgO + 4NO2 + O2
- The Reaction of Magnesium Nitrate with Sodium Carbonate: Magnesium nitrate forms magnesium carbonate and sodium nitrate when it combines with sodium carbonate.
Mg(NO3)2+Na2CO3→MgCO3+2NaNO3
- The Reaction of Magnesium Nitrate with Sodium Hydroxide: When magnesium nitrate reacts with sodium hydroxide, sodium nitrate and magnesium hydroxide are formed.
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
- The Reaction of Magnesium Nitrate with Sulfuric Acid: Magnesium nitrate becomes magnesium sulfate and nitric acid when it interacts with sulfuric acid.
H2SO4 + Mg(NO3)2 → MgSO4 + 2HNO3
- The Reaction of Magnesium Nitrate with Sodium Phosphate: When magnesium nitrate interacts with sodium phosphate, sodium nitrate and magnesium phosphate is produced.
3Mg(NO3)2 + 2Na3PO4 → 6NaNO3 + Mg3(PO4)2
Uses of Magnesium Nitrate
- Magnesium nitrate is utilized as a desiccant because of its hygroscopic properties.
- It is employed as a dehydrating agent in the production of nitric acid.
- It’s also found in fertilizers.
- Magnesium nitrate is a common ingredient in hair conditioners.
- Preservatives and antioxidants contain it.
- It is employed as a catalyst in the production of petrochemicals and desensitizers.
- Magnesium nitrate is used instead of sulfuric acid in the purification of nitric acid.
- Magnesium nitrate is used in ink, toner, and colorant products as a dehydrating agent.
- As a binding agent, magnesium nitrate is utilized.
- Textiles, paints, and plastics all employ it as a filler.
Sample Questions
Question 1: What type of compound is magnesium nitrate?
Answer:
The ionic compound Magnesium Nitrate is made up of the cation Magnesium Mg2+ and the polyatomic anion Nitrate NO3–. In order for these two ions to bind, their charges must be equal and opposing. To balance the one + 2 magnesium ion, two -1 nitrate ions are required.
Question 2: What metal will react with magnesium nitrate?
Answer:
Zinc, copper, and lead do not react with magnesium nitrate because magnesium is more reactive than the other metals in the activity sequence. As a result, none of the zinc, copper, or lead ions will displace magnesium ions from solution, and so no reaction will occur.
Question 3: How is Magnesium Nitrate Prepared?
Answer:
Magnesium nitrate, which is very soluble in water, only occurs naturally as nitromagnesite in the hexahydrate form in mines and caves. The commercially available magnesium nitrate is created by reacting nitric acid with a variety of magnesium salts.
Question 4: Is magnesium nitrate safe for skin?
Answer:
No, magnesium nitrate irritates the skin. As a result, it might cause skin irritation and is not skin-friendly. Hence, it can be said that magnesium nitrate is not at all safe for skin.
Question 5: What will happen when Magnesium Nitrate reacts with Sodium Carbonate?
Answer:
When magnesium nitrate reacts with sodium carbonate, it produces magnesium carbonate and sodium nitrate.
Mg(NO3)2 + Na2CO3 → MgCO3 + 2NaNO3
Question 6: What will happen when Magnesium Nitrate reacts with Sulfuric Acid?
Answer:
When magnesium nitrate reacts with sulfuric acid, it forms magnesium sulfate and nitric acid.
H2SO4 + Mg(NO3)2 → MgSO4 + 2HNO3
Question 7: What is the thermal decomposition of Magnesium Nitrate?
Answer:
Magnesium nitrate decomposes into nitrogen oxides when heated.
2Mg(NO3)2 → 2MgO + 4NO2 + O2
Last Updated :
01 May, 2022
Like Article
Save Article
- Справочник
- Справочник структурных формул
- н
- Нитрат магния
Нитрат магния
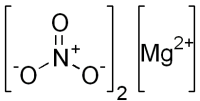
Mg(NO3)2
Mg(+2)(N(+5)O(-2)3)2
O`^-/N^+`|O|O^-/0Mg^2+O`^-/N^+`|O|O^-
Брутто-формула: MgN2O6
raringha
Вопрос по химии:
Напишите формулу нитрата магния
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
xthwitexat686
Mg(NO3)2
Это формула
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Физические свойства
Нитрат магния Mg(NO3)2 — соль магния и азотной кислоты. Белый. При нагревании разлагается. Хорошо растворяется в воде (гидролиз по катиону).
Относительная молекулярная масса Mr = 148,31; относительная плотность для тв. и ж. состояния d = 1,636;
Способ получения
1. Нитрат магния можно путем взаимодействия магния и разбавленной азотной кислоты, образуется нитрат магния, оксид азота (I) и вода:
4Mg + 10HNO3 = 4Mg(NO3)2 + 2N2O↑ + 5H2O
Качественная реакция
Качественная реакция на нитрат магния — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат магния образует сульфат магния, нитрат меди, бурый газ оксид азота и воду:
Cu + 2Mg(NO3)2 + 2H2SO4 = Cu(NO3)2 + 2MgSO4 + 2NO2 ↑ + 2H2O
Химические свойства
1. Hитрат магния разлагается при температуре выше 300º С с образованием оксида магния, оксида азота (IV) и кислорода:
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2. Возможны реакции между нитратом магния и сложными веществами:
2.1. Нитрат магния вступает в реакцию с основаниями:
2.1.1. В результате реакции между нитратом магния и разбавленным раствором гидроксида натрия образуется гидроксид магния и нитрат натрия:
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Admin2
| Нитрат магния | |
|---|---|
 |
|
| Систематическое наименование |
Нитрат магния |
| Хим. формула | Mg(NO3)2 |
| Рег. номер CAS | 10377-60-3 |
| PubChem | 25212 |
| Рег. номер EINECS | 233-826-7 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Mg+2] |
| InChI |
1S/Mg.2NO3/c;2*2-1(3)4/q+2;2*-1 YIXJRHPUWRPCBB-UHFFFAOYSA-N |
| ChEBI | 64736 |
| ChemSpider | 23415 |
| ГОСТ | ГОСТ 11088-75 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат магния Mg(NO3)2 — бесцветные гигроскопичные кристаллы с кубической решеткой (а = 0,748 нм, пространств. группа Ра3); температура плавления 426 °C (с разложением); С°р 141,9 Дж/(моль. К); DH0обр −792,8 кДж/моль, DG0обр −591,4 кДж/моль. Выше 300 °C начинает разлагаться на MgO и оксиды азота. Растворимость в воде (г в 100 г): 73,3 (20 °C), 81,2 (40 °C), 91,9 (60 °C). Растворим также в этаноле, метаноле, жидком NH3. Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса- и дигидраты.
Известен также метастабильный тетрагидрат. Гексагидрат — бесцветные кристаллы. Существует в трех модификациях. При —13-66 °C устойчива форма с моноклинной решеткой (а = 0,619 нм, b = 0,127 нм, с = 0,666 нм, b = 93°, пространств. группа P21/c); т. пл. 90 °C; плотность 1,46 г/см3; DH0пл 41,0 кДж/моль, DH0обр −2614,7 кДж/моль; S0298 427 Дж/(моль. К); уравнение температурной зависимости давления пара Н2О над твердым веществом: lgр(мм рт. ст.) = 10,0372 — 3088/Т (293—323 К); выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO. Дигидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,581 нм, b = 0,599 нм, с = 0,865 нм, b = 90,7°, пространств. группа Р21/с); т. пл. 130 °C; плотн. 2,02 г/см3; DH0обр −1411,4 к Дж/моль; S0298 251 Дж/(моль. К).
Магния нитрат образует с N2O4 аддукт состава Mg(NO3)2.N2O4, разлагающийся выше 50 °C, а также аммины [Mg(NH3)J(NO3)2 и двойные соли с нитратами др. металлов. Безводный магния нитрат получают взаимодействием Mg с N2O4 с последующим отщеплением N2O4, гидратированный — реакцией MgCO3 или MgO с разбавлением HNO3. Гексагидрат — исходное соединение при синтезе MgO особой чистоты, нитратов др. металлов, а также разложении соединений Mg;
30-40% растворы нитрата магния технической чистоты, получаемые азотнокислотным разложением магнийсодержащего сырья (чаще, каустического магнезита или брусита) нашли применение в производстве концентрированной азотной кислоты (как обезвоживающий агент) и гранулированной аммиачной селитры (как модифицирующая добавка).
Компонент сложных удобрений, поскольку магний входит в состав хлорофилла, который необходим для фотосинтеза, способствует повышению активности многих ферментов и выступает в роли транспортера фосфора. Высокая растворимость и низкая электропроводность делают продукт исключительно подходящим для листовой подкормки и фертигации, особенно при использовании оросительных вод с высокой концентрацией солей. Удобрение используется для корневого и некорневого питания овощных, ягодных, плодовых культур, винограда; окислитель в пиротехнических составах. Применение нитрата магния, как удобрения, в кристаллической или гранулированных формах, несмотря на содержание в его составе двух питательных компонентов в водорастворимой форме — собственно, магния и азота ( в виде нитрат-иона), и высокую агрохимическую эффективность, существенно ограничивается значительной гигроскопичностью продукта и повышенной склонностью к слеживаемости при хранении и транспортировке.
|
Нитраты |
|---|
|




