Физические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода:
4Li + O2 = 2Li2O
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
Li2CO3 = Li2O + CO2
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
4LiNO3 = 2Li2O + 4NO2 + O2
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами:
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой. Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид лития взаимодействует с кислотами. При этом образуются соль и вода.
Например, оксид лития с соляной кислотой образует хлорид лития и воду:
Li2O + 2HCl = 2LiCl + H2O.
Li2O + H2S = Li2S + H2O
2.3. При взаимодействии лития с оксидами образуются соли:
Li2O + CO2 = Li2CO3
Li2O + SiO2 = Li2SiO3
Admin2
Опубликовано 13.06.2017 по предмету Химия от Гость
>> <<
Напишите формулы оксидов и гидроксидов следующих химических элементов: лития, бария, алюминия. Запишите степени окисления и заряды ионов.
Ответ оставил Гость
+1-2
Li₂O оксид лития
+2-2
BaO оксид бария
+3-2
Al₂O₃ оксид алюминия
LiOH гидроксид лития
Li¹⁺, OH¹⁻
Ba(OH)₂ гидроксид бария
Ba²⁺, OH¹⁻
Al(OH)₃ гидроксид алюминия
Al³⁺, OH¹⁻
Оцени ответ
Подпишись на наш канал в телеграм. Там мы даём ещё больше полезной информации для школьников!

Найти другие ответы
Загрузить картинку
Оксид лития: способы получения и химические свойства
Оксид лития — это белое, гигроскопичное, тугоплавкое вещество, при нагревании не разлагается.
Относительная молекулярная масса = 29,88; относительная плотность для тв. и ж. состояния = 2, 013; tпл = 1453º C; tкип ≈ 2600º C.
Способ получения
1. Оксид лития можно получить путем взаимодействия лития и кислорода :
2. Оксид лития получается при разложении гидроксида лития:
2LiOН → Li2O + Н2O
3. Путем термического разложения карбоната лития с образованием оксида лития и оксида углерода:
4. При термическом разложении нитрата лития образуется оксид лития, оксид азота и кислород:
Химические свойства
1. Литий вытесняется из оксида в результате взаимодействия с другими металлами :
1.1. Оксид лития взаимодействует с металлами и некоторыми неметаллами с образованием лития и оксида металла:
Li2O + Si = 4Li + SiO2
Li2O + Mg = 2Li + MgO
3Li2O + 2Al = 6Li + Al2O3
2. Оксид лития взаимодействует со сложными веществами:
2.1. Оксид лития реагирует с водой . Образуется гидроксид лития:
Li2O + H2O = 2LiOH
2.2. Оксид л ития взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид лития с соляной кислотой образует хлорид лития и воду:
2.3. При взаимодействии лития с оксидами образуются соли:
Оксид лития
| Оксид лития | |
|---|---|
 |
|
| Систематическое наименование |
Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Температура | |
| • плавления | 1570 [1] |
| • кипения | 2600 [1] °C |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Рег. номер CAS | 12057-24-8 |
| PubChem | 166630 |
| Рег. номер EINECS | 235-019-5 |
| SMILES | |
| RTECS | OJ6360000 |
| ChemSpider | 145811 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Оксид лития (окись лития) — бинарное неорганическое вещество, имеющее химическую формулу Li2O. Относится к классу основных оксидов.
Содержание
- 1 Описание
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 См. также
Описание
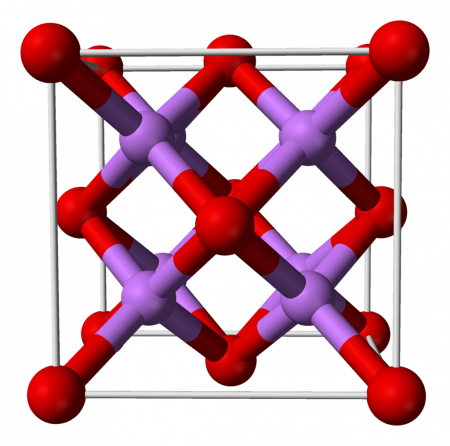
Оксид лития при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы с кубической решёткой. Пространственная группа F m3m, a = 0,4628 нм, Z = 4.
При температуре выше 1000 °C возгоняется, в присутствии паров воды возгонка ускоряется. В газообразном состоянии при температуре выше 1500 °C оксид лития частично диссоциирует на Li и O2. Диамагнитен. С водородом, кислородом, углеродом и монооксидом углерода не взаимодействует даже при нагревании. При высоких температурах реагирует с большинством металлов, за исключением золота, платины и никеля. При действии магния, алюминия или марганца при температуре выше 1000 °C оксид лития восстанавливается до металлического лития. С оксидами ряда металлов дает оксометаллаты, двойные и тройные оксиды. Оксид лития — единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития). [2]
Получение
- Взаимодействие металлического лития с кислородом:
4 Li + O2 ⟶ 2 Li2O
- Разложение пероксида лития при температуре 195 °C:
2 Li2O2 → 195∘C 2 Li2O + O2↑
Химические свойства
- Взаимодействует с водой, образуя щёлочь:
Li2O + H2O → 2 LiOH
- с кислотами:
Li2O + 2 HCl → 2 LiCl + H2O
- литий из оксида вытесняется некоторыми металлами и неметаллами:
Li2O + Mg → 800∘C 2 Li + MgO 2 Li2O + Si → 1000∘C 4 Li + SiO2
- с кислотообразующими оксидами образует соли:
Li2O + CO2 → 500∘C Li2CO3
Применение
Оксид лития применяют в качестве добавки к смесям реагентов при твердофазном синтезе двойных и тройных оксидов для понижения температуры процесса; как компонент в производстве специальных стёкол (в частности, с небольшим температурным коэффициентом линейного расширения и прозрачных для рентгеновских лучей), глазурей и эмалей, повышающий их химическую и термическую стойкость, прочность и снижающий вязкость расплавов. Также используется в термобарьерных покрытиях вместе с оксидами иттрия и циркония для повышения стойкости.
Формула оксида лития, свойства, риски и использование
оксид лития неорганическое химическое соединение формулы Li2Или это образуется вместе с небольшими количествами пероксида лития, когда металлический литий сжигается в воздухе и соединяется с кислородом.
До 1990-х годов на рынке металлов и лития доминировало производство в США из месторождений полезных ископаемых, но в начале 21-го века большая часть производства была получена из неамериканских источников; Австралия, Чили и Португалия были самыми важными поставщиками в мире. У Боливии есть половина месторождений лития в мире, но это не большой производитель.
Наиболее важной коммерческой формой является карбонат лития, Li2Колорадо3, производится из минералов или рассолов несколькими различными процессами.
Когда литий сжигается в воздухе, основным продуктом является белый оксид лития, Li2О. Кроме того, некоторое количество перекиси лития производится, Li2О2, также белый.
Это также можно сделать путем термического разложения гидроксида лития, LiOH или пероксида лития, Li2O2.
2LiOH (s) + тепло → Li2O (s) + H2O (г)
Физико-химические свойства
Оксид лития представляет собой белое твердое вещество, известное как лития, которому не хватает аромата и соленого вкуса. Его внешний вид показан на рисунке 2 (Национальный центр биотехнологической информации, 2017).
Рисунок 2: внешний вид оксида лития
Оксид лития — это кристаллы с геометрией антифлорита, подобной геометрии хлорида натрия (кубический с центром на гранях) Его кристаллическая структура представлена на рисунке 3 (Марк Уинтер [Университет Шеффилда и WebElements Ltd, 2016].
Рисунок 3: кристаллическая структура оксида лития.
Его молекулярная масса составляет 29,88 г / моль, его плотность составляет 2,013 г / мл, а температуры плавления и кипения составляют 1438 ° С и 2066 ° С соответственно. Это соединение очень хорошо растворяется в воде, спирте, эфире, пиридине и нитробензоле (Royal Society of Chemistry, 2015).
Оксид лития легко реагирует с водяным паром с образованием гидроксида и с диоксидом углерода с образованием карбоната; следовательно, он должен храниться и обрабатываться в чистой и сухой атмосфере.
Оксидные соединения не приводят к электричеству. Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат по меньшей мере один кислородный анион и один металлический катион (American Elements, S.F.).
Реактивность и опасности
Оксид лития является стабильным соединением, несовместимым с сильными кислотами, водой и углекислым газом. Насколько нам известно, химические, физические и токсикологические свойства оксида лития не были исследованы и подробно представлены.
Токсичность соединений лития зависит от их растворимости в воде. Ион лития обладает токсичностью для центральной нервной системы. Соединение обладает сильным коррозионным раздражающим действием при попадании в глаза или на кожу при вдыхании или проглатывании (ESPI METALS, 1993).
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
Во всех случаях вам следует немедленно обратиться к врачу (SIGMA-ALDRICH, 2010).
приложений
Оксид лития используется в качестве флюса в керамической глазури и создает синий с медью и розы с кобальтом. Оксид лития реагирует с водой и паром, образуя гидроксид лития и должен быть изолирован от них.
Оксид лития (Li2O) с его высоким потенциалом трития является привлекательным кандидатом на твердый культуральный материал термоядерной электростанции DT из-за его высокой плотности атомов лития (по сравнению с другими литиевыми или металлическими литиевыми керамиками) и его проводимости относительно высокая термическая (ОКСИД ЛИТИЯ (Li2O), SF).
Li2Или он будет подвергаться воздействию высоких температур под действием нейтронного излучения во время работы термоядерных покрытий. В этих условиях большое количество дефектов облучения будет происходить в Li2Или, например, вызванное гелием набухание, относительно высокое тепловое расширение, рост зерна, образование и осаждение LiOH (T) при низких температурах и перенос массы LiOH (T) при высоких температурах.
Кроме того, Ли2Или это будет предметом напряжений, возникающих из-за различий в тепловом расширении между Li2О и конструкционные материалы. Эти характеристики Ли2Или они приводят к сложным инженерным проблемам как при изготовлении, так и при проектировании одеял..
Возможное новое применение — замена кобальта и оксида лития в качестве катода в литий-ионных батареях, используемых для питания электронных устройств от мобильных телефонов до ноутбуков, а также автомобилей с батарейным питанием (Reade International Corp, 2016).
http://chem.ru/oksid-litija.html
http://ru.thpanorama.com/articles/qumica/xido-de-litio-frmula-propiedades-riesgos-y-usos.html
Оксид лития, характеристика, свойства и получение, химические реакции.
Оксид лития – неорганическое вещество, имеет химическую формулу Li2O.
Краткая характеристика оксида лития
Физические свойства оксида лития
Получение оксида лития
Химические свойства оксида лития
Химические реакции оксида лития
Применение и использование оксида лития
Краткая характеристика оксида лития:
Оксид лития – неорганическое вещество, без цвета.
Так как валентность лития равна одному, то оксид лития содержит один атом кислорода и два атома лития.
Химическая формула оксида лития Li2O.
В воде не растворяется, а вступает в реакцию с ней.
Обладает гигроскопичностью.
Оксид лития – единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).
Физические свойства оксида лития:
| Наименование параметра: | Значение: |
| Химическая формула | Li2O |
| Синонимы и названия иностранном языке | lithium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2013 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,013 |
| Температура кипения, °C | 2600 |
| Температура плавления, °C | 1570 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 29,8774 |
* Примечание:
— нет данных.
Получение оксида лития:
Оксид лития получается в результате следующих химических реакций:
- 1. путем разложения пероксида лития:
2Li2О2 → 2Li2О + О2 (t = 195 oC).
- 2.путем взаимодействия лития с кислородом:
4Li + О2 → 2Li2О.
Химические свойства оксида лития. Химические реакции оксида лития:
Химические свойства оксида лития аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида лития с магнием:
Li2O + Mg → 2Li + MgO (t > 800 oC).
В результате реакции образуется оксид магния и литий.
2. реакция оксида лития с магнием и водородом:
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 oC).
В результате реакции образуется оксид магния и гидрид лития.
3. реакция оксида лития с алюминием:
3Li2O + 2Al → 6Li + Al2O3 (t > 1000 oC).
В результате реакции образуется оксид алюминия и литий.
4. реакция оксида лития с алюминием и водородом:
3Li2O + 2Al + 3H2 → 6LiH + Al2O3 (t = 600-700 oC).
В результате реакции образуется оксид алюминия и гидрида лития.
5. реакция оксида лития с кремнием:
2Li2O + Si → 4Li + SiO2 (t = 1000 oC).
В результате реакции образуется оксид кремния и литий.
6. реакция оксида лития с водой:
Li2О + Н2О → 2LiОН.
Оксид лития медленно реагирует с водой, образуя гидроксид лития.
7. реакция оксида лития с оксидом углерода (углекислым газом):
Li2О + СО2 → Li2СО3.
Оксид лития на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат лития.
8. реакция оксида лития с оксидом кремния:
Li2О + SiО2 → Li2SiО3 (t = 1200-1300 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – метасиликат лития.
9. реакция оксида лития с оксидом серы:
Li2О + SО2 → Li2SО3.
Оксид серы также является кислотным оксидом. В результате реакции образуется соль – сульфит лития.
10. реакция оксида лития с оксидом азота (IV) и оксидом азота (II):
Li2O + NO2 + NO → 2LiNO2 (t = 300 oC).
В результате реакции образуются соль – нитрит лития.
11. реакция оксида лития с оксидом ванадия:
V2O3 + Li2O → 2LiVO2 (t = 1200 oC).
В результате реакции образуется диоксованадат лития.
12. реакция оксида лития с оксидом теллура:
TeO2 + Li2O → Li2TeO3 (to).
В результате реакции образуется теллурит лития.
13. реакция оксида лития с оксидом марганца:
Mn2O3 + Li2O → 2LiMnO2 (t = 800-900 oC).
В результате реакции образуется оксид марганца-лития.
14. реакция оксида лития с йодоводородом:
Li2O + 2HI → 2LiI + H2O.
В результате химической реакции получается соль – йодид лития и вода.
15. реакция оксида лития с сероводородом:
Li2O + H2S → Li2S + H2O (t = 900-1000 oC).
В результате химической реакции получается соль – сульфид лития и вода.
16. реакция оксида лития с плавиковой кислотой:
Li2O + 2HF → 2LiF + H2O.
В результате химической реакции получается соль – фторид лития и вода.
17. реакция оксида лития с азотной кислотой:
Li2O + 2HNO3 → 2LiNO3 + H2O.
В результате химической реакции получается соль – нитрат лития и вода.
Аналогично проходят реакции оксида лития и с другими кислотами.
18. реакция оксида лития с бромистым водородом (бромоводородом):
Li2O + 2HBr → 2LiBr + H2O.
В результате химической реакции получается соль – бромид лития и вода.
Применение и использование оксида лития:
Оксид лития используется как компонент в производстве стекол, а также в химической промышленности.
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида лития
реакции с оксидом лития
Коэффициент востребованности
5 034
Оксид лития, характеристика, свойства и получение, химические реакции
Оксид лития – неорганическое вещество, имеет химическую формулу Li2O.
Краткая характеристика оксида лития
Физические свойства оксида лития
Получение оксида лития
Химические свойства оксида лития
Химические реакции оксида лития
Применение и использование оксида лития
Краткая характеристика оксида лития:
Оксид лития – неорганическое вещество, без цвета.
Так как валентность лития равна одному, то оксид лития содержит один атом кислорода и два атома лития.
Химическая формула оксида лития Li2O.
В воде не растворяется, а вступает в реакцию с ней.
Обладает гигроскопичностью.
Оксид лития – единственный среди оксидов щелочных металлов, образующийся в качестве основного продукта при нагревании металла выше 200 °C на воздухе (присутствуют только следы пероксида лития).
| Наименование параметра: | Значение: |
| Химическая формула | Li2O |
| Синонимы и названия иностранном языке | lithium oxide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кубические кристаллы |
| Цвет | бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2013 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,013 |
| Температура кипения, °C | 2600 |
| Температура плавления, °C | 1570 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 29,8774 |
* Примечание:
— нет данных.
Получение оксида лития:
Оксид лития получается в результате следующих химических реакций:
- 1. путем разложения пероксида лития:
2Li2О2 → 2Li2О + О2 (t = 195 oC).
- 2.путем взаимодействия лития с кислородом:
4Li + О2 → 2Li2О.
Химические свойства оксида лития аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида лития с магнием:
Li2O + Mg → 2Li + MgO (t > 800 oC).
В результате реакции образуется оксид магния и литий.
2. реакция оксида лития с магнием и водородом:
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 oC).
В результате реакции образуется оксид магния и гидрид лития.
3. реакция оксида лития с алюминием:
3Li2O + 2Al → 6Li + Al2O3 (t > 1000 oC).
В результате реакции образуется оксид алюминия и литий.
4. реакция оксида лития с алюминием и водородом:
3Li2O + 2Al + 3H2 → 6LiH + Al2O3 (t = 600-700 oC).
В результате реакции образуется оксид алюминия и гидрида лития.
5. реакция оксида лития с кремнием:
2Li2O + Si → 4Li + SiO2 (t = 1000 oC).
В результате реакции образуется оксид кремния и литий.
6. реакция оксида лития с водой:
Li2О + Н2О → 2LiОН.
Оксид лития медленно реагирует с водой, образуя гидроксид лития.
7. реакция оксида лития с оксидом углерода (углекислым газом):
Li2О + СО2 → Li2СО3.
Оксид лития на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат лития.
8. реакция оксида лития с оксидом кремния:
Li2О + SiО2 → Li2SiО3 (t = 1200-1300 oC).
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – метасиликат лития.
9. реакция оксида лития с оксидом серы:
Li2О + SО2 → Li2SО3.
Оксид серы также является кислотным оксидом. В результате реакции образуется соль – сульфит лития.
10. реакция оксида лития с оксидом азота (IV) и оксидом азота (II):
Li2O + NO2 + NO → 2LiNO2 (t = 300 oC).
В результате реакции образуются соль – нитрит лития.
11. реакция оксида лития с оксидом ванадия:
V2O3 + Li2O → 2LiVO2 (t = 1200 oC).
В результате реакции образуется диоксованадат лития.
12. реакция оксида лития с оксидом теллура:
TeO2 + Li2O → Li2TeO3 (to).
В результате реакции образуется теллурит лития.
13. реакция оксида лития с оксидом марганца:
Mn2O3 + Li2O → 2LiMnO2 (t = 800-900 oC).
В результате реакции образуется оксид марганца-лития.
14. реакция оксида лития с йодоводородом:
Li2O + 2HI → 2LiI + H2O.
В результате химической реакции получается соль – йодид лития и вода.
15. реакция оксида лития с сероводородом:
Li2O + H2S → Li2S + H2O (t = 900-1000 oC).
В результате химической реакции получается соль – сульфид лития и вода.
16. реакция оксида лития с плавиковой кислотой:
Li2O + 2HF → 2LiF + H2O.
В результате химической реакции получается соль – фторид лития и вода.
17. реакция оксида лития с азотной кислотой:
Li2O + 2HNO3 → 2LiNO3 + H2O.
В результате химической реакции получается соль – нитрат лития и вода.
Аналогично проходят реакции оксида лития и с другими кислотами.
18. реакция оксида лития с бромистым водородом (бромоводородом):
Li2O + 2HBr → 2LiBr + H2O.
В результате химической реакции получается соль – бромид лития и вода.
Применение и использование оксида лития:
Оксид лития используется как компонент в производстве стекол, а также в химической промышленности.
Примечание: © Фото //www.pexels.com, //pixabay.com
карта сайта
оксид лития реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида лития
реакции с оксидом лития
by HyperComments
№3 Литий
Окраска пламени солями лития
Р’ 1817 Рі.
шведский С…РёРјРёРє Рё минералог РђРІРіСѓСЃС‚ Арфведсон, анализируя природный минерал петалит, установил, что РІ нем содержится «РѕРіРЅРµРїРѕСЃС‚оянная щелочь РґРѕ СЃРёС… РїРѕСЂ неизвестной РїСЂРёСЂРѕРґС‹». Позднее РѕРЅ нашел аналогичные соединения РІ составе РґСЂСѓРіРёС… минералов. Арфведсон предположил, что это соединения РЅРѕРІРѕРіРѕ элемента Рё дал ему название литий (РѕС‚ греческого liqoz – камень).
Металлический литий был выделен в 1818 году английский химиком Гемфри Дэви электролизом расплава гидроксида лития.
Нахождение в природе и получение:
Природный литий состоит РёР· РґРІСѓС… стабильных изотопов — 6Li (7,42%) Рё 7Li (92,58%).
Литий — сравнительно мало распространенный элемент (массовая доля РІ земной РєРѕСЂРµ 1,8*10-3%, 18 Рі/тонну).
РљСЂРѕРјРµ петалита LiAl[Si4O10], основными минералами лития являются слюда, лепидолит — KLi1,5Al1,5[Si3AlO10](F,OH)2 Рё пироксен сподумен — LiAl[Si2O6].
В настоящее время для получения металлического лития его природные минералы или обрабатывают серной кислотой, или спекают с CaO или CaCO3, а затем выщелачивают водой.
Получают растворы сульфата или гидроксида лития, из которых осаждают плохо растворимый карбонат Li2CO3, который затем переводят в хлорид LiCl.
Рлектролизом расплава хлорида лития РІ смеси СЃ хлоридом калия или бария получают металлический литий.
Физические свойства:
Простое вещество литий — РјСЏРіРєРёР№ щелочной металл серебристо-белого цвета.
�з всех щелочных металлов он самый твердый, высокоплавкий (Ткип=180,5 и Тпл=1340° С).
Рто самый легкий металл (плотность 0,533 Рі/СЃРј3), РѕРЅ плавает РЅРµ только РІ РІРѕРґРµ, РЅРѕ Рё РІ керосине. Литий Рё его соли окрашивают пламя РІ карминно-красный цвет.
Химические свойства:
Литий проявляет типичные свойства щелочных металлов, взаимодействуя с водой, кислородом, другими неметаллами.
Хранить его приходится под слоем под слоем минерального масла, придавливая сверху, чтобы не всплывал.
Р’ соответствии СЃ положением РІ РџРЎРҐР, литий наименее активный щелочной металл.
Так в реакции с кислородом он образует в основном оксид лития, а не пероксиды как другие металлы. Подобно натрию литий растворяется в жидком аммиаке, образуя синий раствор с металлической проводимостью.
Растворенный литий постепенно реагирует с аммиаком: 2Li + 2NH3 = 2LiNH2 + H2.
Литий отличается повышенной активностью при взаимодействии с азотом, образуя с ним уже при обычной температуре нитрид Li3N.
По некоторым свойствам литий и его соединения напоминают соединения магния (диагональное сходство в таблице Менделеева).
Важнейшие соединения:
РћРєСЃРёРґ лития, Li2O — белое кристаллическое вещество, основный РѕРєСЃРёРґ, СЃ РІРѕРґРѕР№ образует РіРёРґСЂРѕРєСЃРёРґ
Гидроксид лития — LiOH — белый порошок, обычно моногидрат, LiOH*H2O, сильное основание
Соли лития — бесцветные кристаллические вещества, гигроскопичны, образуют кристаллогидраты состава LiX*3H2O.
Карбонат и фторид лития подобно аналогичным солям магния малорастворимы.
Карбонат и нитрат лития при нагревании разлагаются, образуя оксид лития:
Li2CO3 = Li2O + CO2; 4LiNO3 = 2Li2O + 4NO2 + O2
Пероксид лития — Li2O2 — белое кристаллическое вещество, получают реакцией РіРёРґСЂРѕРєСЃРёРґР° лития СЃ пероксидом РІРѕРґРѕСЂРѕРґР°: 2LiOH + H2O2 = Li2O2 + 2H2O Р�спользуют РІ космических аппаратах Рё подводных лодках для получения кислорода:
2Li2O2 + 2CO2 = 2Li2CO3 +O2
Гидрид лития LiH получают взаимодействием расплавленного лития с водородом. Бесцветные кристаллы, реагирует с водой и кислотами с выделением водорода. �сточник водорода в полевых условиях.
Применение:
Металлический литий — высокопрочные Рё сверхлегкие сплавы СЃ магнием Рё алюминием для авиационной Рё космической техники. Легирующая добавка РІ металлургии (связывает азот, кремний, углерод). Теплоноситель (расплав) РІ ядерных реакторах.
�з лития изготовляют аноды химических источников тока и гальванических элементов с твёрдым электролитом.
Соединения: специальные стекла, глазури, эмали, керамика.
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров
LiOH как добавка в электролит щелочных аккумуляторов.
Карбонат лития – добавка в расплав при производстве алюминия: снижает температуру плавления электролита, увеличивает силу тока, уменьшает нежелательное выделение фтора.
Металлоорганические соединения лития (например бутиллитий LiРЎ4Рќ9) — широко применяются РІ промышленном Рё лабораторном органическом синтезе Рё как катализаторы полимеризации.
Дейтерид лития-6: как источник дейтерия и трития в термоядерном оружии (водородная бомба). См. Ядерные реакции дейтерида лития. (анимированные модели).
Содержание лития в организме человека составляет около 70 мг. В течение суток в организм взрослого человека поступает около 100 мкг лития.
Литий способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, ингибируя проводимость нервной системы.
Соли лития применяются психотропные лекарственные средства, оказывая успокаивающий эффект при лечении шизофрении и депрессии.
Однако передозировка может привести к тяжелым осложнениям и летальному исходу.
Нурмаганбетов Т.
ТюмГУ, 582 группа, 2011 г.








