Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Разложение перманганата калия
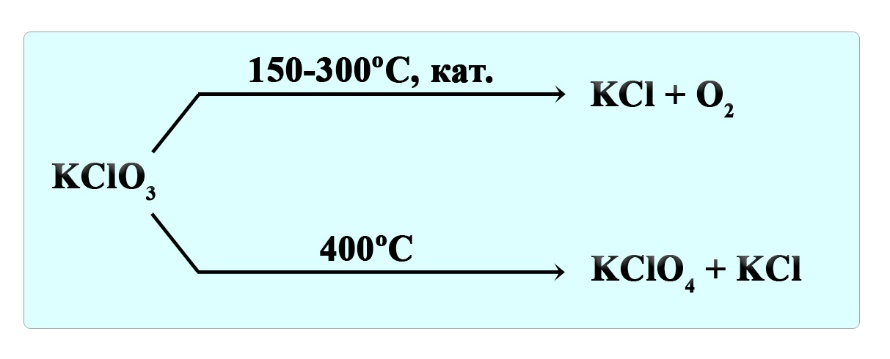
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Как составить уравнение химической реакции: пошаговая инструкция
Превращение одних веществ в другие — обычное явление, которое происходит в ходе химических реакций. Для того чтобы обозначить, как протекают такие процессы, используют специальную систему уравнений. Так, например, горение метана (мы можем наблюдать его каждый день, когда зажигаем газовую плиту) протекает по следующей схеме:
СН4 + 2О2 → СО2 + Н2О
Расшифровать уравнение реакции можно следующим образом. Две молекулы кислорода соединяются с молекулой метана и в результате формируют две молекулы воды и молекулу углекислого газа. Можно отметить, что во время протекания реакции связи между некоторыми атомами (например, водорода и углерода) разрываются. Вместо них появляются новые, благодаря которым и формируются углекислород и вода.
Особенности записи формул химических реакций
Уравнения химических реакций: способы решения заданий
Для удобства записи уравнения химических реакций делают предельно схематичными: их записывают только при помощи латинских букв и цифр. В левой части уравнения указываются реагенты (те вещества, которые взаимодействуют между собой), а в правой — так называемые продукты реакции (те вещества, которые формируются после завершения процесса). При записи уравнения важно помнить о двух правилах.
- Атомы не исчезают никуда и не появляются из ниоткуда (соответственно, их число в обоих частях формулы должно быть одинаковым).
- Общая масса реагентов не может отличаться от итоговой массы продуктов реакции (именно по этой причине записи протекания реакций называют уравнениями).
Какими бывают химические реакции
Выделяют четыре варианта взаимодействия химических веществ друг с другом.
| Тип реакции | Пример | Особенности |
| Соединения | Формула образования воды:
2H2 + O2 = 2H2O |
Несколько реагентов (простых или сложных веществ) создают один продукт. |
| Разложения | При нагревании известняка он разделяется на углекислый газ и негашеную известь:
Стрелка, направленная вверх, показывает, что сформировавшийся газ улетучился и больше не участвует в процессе. |
Одно вещество распадается на несколько простых компонентов. |
| Замещения | При образовании хлорида цинка атомы цинка встают на место атомов водорода, который включен в состав хлороводорода:
Zn + 2HCl = H2↓ + ZnCl2 Направленная вниз стрелка показывает, что вещество осталось в осадке. |
В таких реакциях обязательно участвуют простое и сложное вещества. При более активные атомы простого вещества вытесняют (замещают) компоненты сложного. |
| Обмена | CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl | В таких реакциях обязательно участвуют два сложных вещества, которые обмениваются атомами. Важно помнить: в уравнениях обмена обязательно формируются газ, осадок или вода. |
Как расставить коэффициенты в химических уравнениях
Чтобы уравнение реакции было верным, крайне важно правильно расставить в нем коэффициенты. С помощью этих цифр указывается, какое число молекул необходимо для протекания реакции. Внешне коэффициент выглядит как число, поставленное перед формулой вещества (например, 2NaCl). Важно не перепутать их с индексами: последние как раз ставятся под символом химического элемента и указывают на количество атомов (например, H2).
Если вам требуется узнать, сколько атомов конкретного вещества участвует в реакции, следует индекс умножит на коэффициент. Например, при использовании двух молекул воды (2H₂O) речь идет о четырех атомах водорода и двух атомах кислорода. При решении уравнения реакции задача ученика — подобрать коэффициент и узнать, сколько молекул участвует в процессе.
Помочь разобраться в этом нелегком деле могут наши репетиторы по химии в Москве. Ведь, согласитесь, поспеть за школьной программой порой непросто и некоторые темы требуют более детального изучения, чем отведенные несколько школьных уроков.
Как составить уравнение химической реакции: пошаговая инструкция
- Подготовьте схему реакции. Для этого потребуется выделить реагенты и продукты реакции. Например, для формирования оксида магния схема будет выглядеть так: Mg + O2 → MgO.
- Расставьте коэффициенты. Из предыдущего примера видно, что в левой части уравнения представлено два атома кислорода, а в правой — только один. Поэтому в продукте реакции нужно увеличить количество молекул: Mg + O2 → 2MgO. Теперь у нас есть равное количество атомов кислорода, а вот с магнием возникла проблема. Уравняем и его число: 2Mg + O2 = 2MgO. Обратите внимание, что знак равно можно ставить только после того, как уравнение решено, до этого используется символ горизонтальной стрелки.
Уравнения химических реакций: способы решения заданий
В качестве завершающего примера предложим реакцию разложения нитрата калия. Он образует два вещества: кислород и нитрит калия. Схема реакции выглядит следующим образом: KNO₃ → KNO₂ + О₂. Если с атомами азота и калия все в порядке, то кислорода до момента начала реакции было три, а вот по завершении разложения стало уже четыре. Чтобы уравнять части поставим перед реагентом удвоенный коэффициент: 2KNO₃ → KNO₂ + О₂.
Теперь нужно разобраться с цифрами. До реакции мы имеем по два атома азота и калия и шест атомов кислорода. После же разложения атомов азота и калия по одному, а атомов кислорода всего четыре. Чтобы создать равенство, потребуется поставить удвоенный коэффициент перед нитритом калия в продуктах реакции: 2KNO₃ = 2KNO₂ + О₂. В итоге мы получили равное количество атомов в обеих частях: по два калия и азота и шесть кислорода. Важность уравнений состоит в том, что они не только дают определить, какие вещества получатся в ходе протекания реакции, но и позволяют понять количественное соотношение используемых реагентов.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
http://egevpare.ru/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B9-%D1%81%D0%BF%D0%BE%D1%81%D0%BE%D0%B1/
http://nauka.club/khimiya/khimicheskie-uravneniya.html
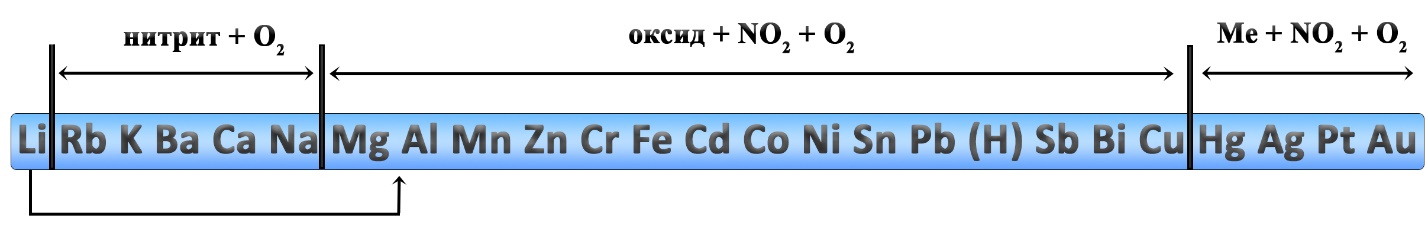
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2Ag2O = 4Ag + O2
2HgO = 2Hg + O2
4CrO3 = 2Cr2O3 + O2
2Mn2O7 = 4MnO2 + 3O2
Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
2Cr(OH)3 = Cr2O3 + 3H2O
Mn(OH)2 = MnO + H2O
Fe(OH)2 = FeO + H2O
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
2Fe(OH)3 = Fe2O3 + 3H2O
2Al(OH)3 = Al2O3 + 3H2O
Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например, кремниевая кислота:
H2SiO3 = H2O + SiO2
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
H2SO3 = H2O + SO2↑
H2CO3 = H2O + CO2↑
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
K2CO3 + H2O + CO2 = 2KHCO3
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
2HNO2 = H2O + NO2↑ + NO↑
При нагревании выше 100оС продукты распада несколько отличаются:
3HNO2 = H2O + HNO3↑ + 2NO↑
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
4HNO3 = 2H2O + 4NO2 + O2
Разложение солей
Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 оС разлагается:
NH4Cl → NH3 + HCl
Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например, разложение нитрата калия:
2KNO3 → 2KNO2 + O2
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 оС:
Ca(NO3)2 → Ca(NO2)2 + O2
Mg(NO3)2 → Mg(NO2)2 + O2
Ba(NO3)2 → Ba(NO2)2 + O2
Sr(NO3)2 → Sr(NO2)2 + O2
При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
2Ca(NO3)2 → 2CaО + 4NO2 + O2
2Mg(NO3)2 → 2MgО + 4NO2 + O2
2Sr(NO3)2 → 2SrО + 4NO2 + O2
2Ba(NO3)2 → 2BaО + 4NO2 + O2
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
2Cu(NO3)2 → 2CuО + 4NO2 + O2
2Pb(NO3)2 → 2PbО + 4NO2 + O2
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
4LiNO3 → 2Li2O + 4NO2 + O2
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
2AgNO3 → 2Ag + 2NO2 + O2
Hg(NO3)2 → Hg + 2NO2 + O2
Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
NH4NO3 → N2O + 2H2O
При более высокой температуре образуются азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
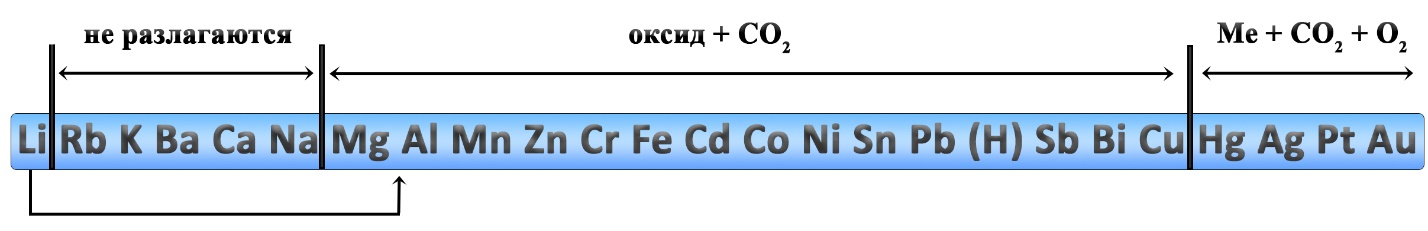
Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Li2CO3 → Li2O + CO2
CaCO3 → CaO + CO2
MgCO3 → MgO + CO2
Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
(NH4)2CO3 → NH4HCO3 + NH3
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
NH4HCO3 → NH3 + CO2 + H2O
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
2NaHCO3 → Na2CO3 + H2O + CO2
2KHCO3 → K2CO3 + H2O + CO2
Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + H2O + CO2
При нагревании до 1200оС образуются оксиды:
Ca(HCO3)2 → CaO + H2O + 2CO2
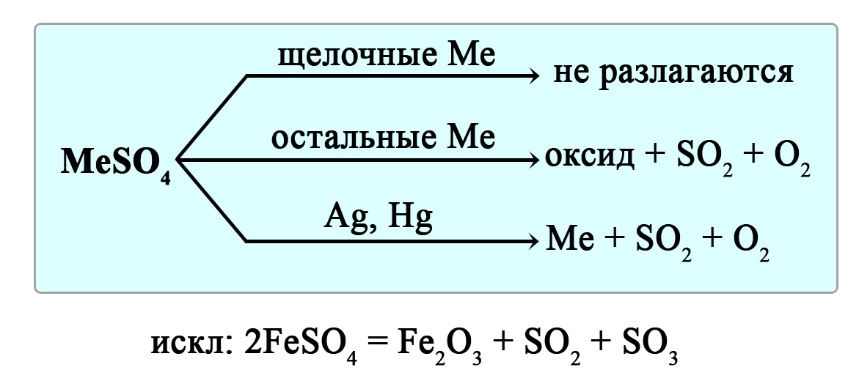
Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
2MgSO4 → 2MgO + 2SO2 + O2
2CuSO4 → 2CuO + 2SO2 + O2
2BaSO4 → 2BaO + 2SO2 + O2
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Ag2SO4 → 2Ag + SO2 + O2
2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
2Na2HPO4 → H2O + Na4P2O7
2K2HPO4 → H2O + K4P2O7
2CaHPO4 → H2O + Ca2P2O7
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
NH4Cl → NH3 + HCl
NH4Br → NH3 + HBr
NH4l → NH3 + Hl
NH4H2PO4 → NH3 + H3PO4
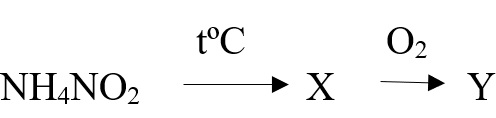
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
KClO4 → KCl + 2O2
Разложение веществ
Материал по химии
- Реакции разложения солей
- Разложение нитратов
- Особые реакции разложения нитратов
- Разложение солей аммония
- Разложение карбонатов
- Разложение гидрокарбонатов
- Разложение гидросульфитов
- Разложение сульфитов
- Разложение сульфатов
- Уравнения реакций разложения комплексных солей
- Реакция разложения дихромата калия и перманганата калия
- Разложение бертолетовой соли
- Разложение гидроксидов
- Разложение органических веществ
- Разложение кислот
Реакции разложения солей
Термическому разложению подвергаются многие соли – карбонаты, нитраты, нитриты, сульфаты, кислые, основные и комплексные соли. Рассмотрим наиболее популярные уравнения разложения солей. Разложение солей часто встречается в ЕГЭ по химии в линии заданий 31, это задание считается одним из самых сложных заданий экзамена.
Разложение нитратов
При установлении продуктов термического разложения нитратов удобно пользоваться рядом активности металлов, однако к нему следует добавить некоторые уточнения: литий и магний, обычно относятся к активным металлам, но разложение нитратов этих двух металлов происходит как у металлов средней активности. Медь относится к неактивным металлам, но разложение нитрата меди II идёт как разложение нитрата металла средней активности. Данные реакции являются весьма популярными в химии. На ЕГЭ задачи по разложению нитратов встречаются в заданиях линии 7 и 31.
Уравнения разложения нитратов активных металлов (кроме лития и магния):
- 2KNO3 → 2KNO2 + O2↑ ‒ разложение нитрата калия
- 2NaNO3 → 2NaNO2 + O2↑ ‒ разложение нитрата натрия
- 2CsNO3 → 2CsNO2 + O2↑ ‒ разложение нитрата цезия
- 2RbNO3 → 2RbNO2 + O2↑ ‒ разложение нитрата рубидия
- Ca(NO3)2 → Ca(NO2)2 + O2↑ ‒ разложение нитрата кальция
- Ba(NO3)2 → Ba(NO2)2 + O2↑ ‒ разложение нитрата бария
- Sr(NO3)2 → Sr(NO2)2 + O2↑ ‒ разложение нитрата стронция
Уравнения разложения нитратов металлов средней активности, нитрата лития и нитрата меди II:
- 4LiNO3 → 2Li2O + 4NO2↑ + O2↑ ‒ разложение нитрата лития
- 2Mg(NO3)2 → 2MgO + 4NO2↑ + O2↑ ‒ разложение нитрата магния
- 2Zn(NO3)2 → 2ZnO + 4NO2↑ + O2↑ ‒ разложение нитрата цинка
- 2Cu(NO3)2 → 2CuO + 4NO2↑ + O2↑ ‒ разложение нитрата меди II
- 4Al(NO3)3 → 2Al2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата алюминия
- 4Fe(NO3)3 → 2Fe2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата железа III
- 4Cr(NO3)3 → 2Cr2O3 + 12NO2↑ + 3O2↑ ‒ разложение нитрата хрома III
Во всех приведенных реакциях степень окисления металла не изменяется. Это характерно для нитратов, содержащих металл в высшей или наиболее устойчивой степени окисления. Если же нитрат образован переходным металлом в низшей степени окисления, то при разложении этого нитрата происходит окисление еще и металла.
Особые реакции разложения нитратов
Разложение нитрата железа II:
- 4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
В данной реакции два восстановителя – железа поднимает степень окисления с +2 до +3, кислород с ‒2 до 0. Окислитель – азот +5.
Аналогично идет реакция термического разложения нитрата хрома II:
- 4Cr(NO3)2 → 2Cr2O3 + 8NO2↑ + O2↑
Разложение нитрата марганца II идет иначе, так как для марганца следующей после +2 устойчивой степенью окисления является не +3, а +4:
- Mn(NO3)2 → MnO2 + 2NO2↑
Обратите внимание на то, что кислород в этой реакции не выделяется!
Задание в формате ЕГЭ с ответом:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрат железа II
- нитрат меди II
- нитрат ртути II
- нитрат магния
- нитрат калия
- нитрат серебра
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O3 + NO2 + O2
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- LiNO3
- Cu(NO3)2
- RbNO2
- Zn(NO3)2
- Hg(NO3)2
- Al(NO2)3
- MeNO2 + O2
- MeO + NO2 + O2
- Me + NO2 + O2
- Me2O + NO2 + O2
- Me2O3 + NO2 + O2
Разложение нитрата аммония будет рассмотрено ниже, в реакциях разложения солей аммония.
Разложение солей аммония
При разложении солей аммония чаще всего образуется аммиак, исключения составляют соли, в которых анион проявляет окислительные свойства. Например, хлорид, бромид, йодид, сульфиды, карбонаты и фосфаты разлагаются без изменения степеней окисления (без ОВР). Процессы идут при нагревании:
- NH4Cl → NH3↑ + HCl↑ ‒ разложение хлорида аммония
- NH4Br → NH3↑ + HBr↑ ‒ разложение бромида аммония
- NH4I → NH3↑ + HI↑ ‒ разложение йодида аммония
- (NH4)2S → 2NH3↑ + H2S↑ ‒ разложение сульфида аммония
- NH4HS → NH3↑ + H2S↑ ‒ разложение гидросульфида аммония
- (NH4)3PO4 → 3NH3↑ + H3PO4 ‒ разложение фосфата аммония
- (NH4)2HPO4 → 2NH3↑ + H3PO4 ‒ разложение гидрофосфата аммония
- NH4H2PO4 → NH3↑ + H3PO4 ‒ разложение дигидрофосфата аммония
- (NH4)2CO3 → 2NH3↑ + CO2↑ + H2O↑ ‒ разложение карбоната аммония
- NH4HCO3 → NH3↑ + CO2↑ + H2O↑ ‒ разложение гидрокарбоната аммония
Разложение солей аммония с изменением степени окисления:
Разложение нитрита и нитрата аммония легко запомнить вместе, отнимите от этих солей всю воду и получите нужный продукт:
- NH4NO3 → 2H2O + N2O ‒ разложение нитрата аммония
- NH4NO2 → 2H2O + N2 ‒ разложение нитрита аммония
Задание по образцу ФИПИ:
Задана следующая схема превращений веществ. Определите, какие из указанных веществ являются веществами X и Y. В ответ запишите соответствующую последовательность цифр без пробелов и дополнительных знаков, сначала вещество Х, затем вещество Y.
- NH3
- NO
- NH4NO3
- N2
- N2O
Азот окисляется до NO
Удобно запоминать вместе и разложение дихромата и перманганата аммония, так как образуются сходные продукты – азот, оксид и соль:
- (NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O↑ ‒ разложение дихромата аммония
- 2NH4MnO4 → N2↑ + 2MnO2 + 4H2O↑ ‒ разложение перманганата аммония
Попробуйте решить задание ЕГЭ:
Установите соответствие между названием вещества и продуктами его разложения: к каждой позиции, обозначенной буквой подберите позицию, обозначенную цифрой.
- нитрит аммония
- нитрат аммония
- дихромат аммония
- хлорид аммония
- N2 + Cr2O3 + H2O
- NH3 + Cl2 + H2
- N2 + H2O
- NO2 + Cr2O3 + H2O
- NH3 + HCl
- N2O + H2O
Разложение карбонатов
Реакции разложения карбонатов также происходит при нагревании. Карбонаты щелочных металлов (IА-группа), кроме карбоната лития, не разлагаются. Большинство других карбонатов разлагаются до оксидов, карбонат серебра и карбонат ртути разлагаются с выделением свободного металла.
- Li2CO3 → Li2O + CO2↑ ‒ разложение карбоната лития
- MgCO3 → MgO + CO2↑ ‒ разложение карбоната магния
- CaCO3 → CaO + CO2↑ ‒ разложение карбоната кальция
- CuCO3 → CuO + CO2↑ ‒ разложение карбоната меди II
- 2HgCO3 → 2Hg + 2CO2↑ + O2↑ ‒ разложение карбоната ртути II
- 2Ag2CO3 → 4Ag + 2CO2↑ + O2↑ ‒ разложение карбоната серебра
Какие из перечисленных карбонатов разлагаются?
- Na2CO2
- MgCO3
- CaCO3
- K2CO3
- Cs2CO3
- CuCO3
При разложении каких карбонатов образуется оксид металла?
- Na2CO3
- HgCO3
- Li2CO3
- CaCO3
- Ag2CO3
- FeCO3
Разложение гидрокарбонатов
Гидрокарбонаты разлагаются до соответствующих карбонатов:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната натрия
- Ca(HCO3)2 → CaCO3 + CO2↑ + H2O↑ ‒ разложение гидрокарбоната кальция
При длительном нагревании происходит более глубокое разложение (это не качается гидрокарбонатов щелочных металлов, они в любом случае остаются карбонатами).
Например, в некоторых задачах может встретиться следующая фраза «гидрокарбонат нагревали до постоянной массы» или «смесь гидрокарбоната и карбоната нагревали до постоянной массы», какие реакции следует указать?
Если нагревают гидрокарбонат щелочного металла, то реакция одна:
- 2KHCO3 → K2CO3 + CO2↑ + H2O↑
Если нагревают другие гидрокарбонаты, то нужно писать две реакции:
- Ba(HCO3)2 → BaCO3 + CO2↑ + H2O↑ ‒ нагревание
- BaCO3 → BaO + CO2↑ ‒ при продолжении нагревания
Разложение гидросульфитов
Идет сходным с разложением гидрокарбонатов образом, при термическом размножении этих солеи образуются сульфиты и выделяется газ:
- 2KHSO3 → K2SO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита калия
- Ba(HSO3)2 → BaSO3 + SO2↑ + H2O↑ ‒ разложение гидросульфита бария
Разложение сульфитов
В отличие от реакция термического разложения карбонатов, большинство сульфитов разлагаются при нагревании со сменой степени окисления (происходит реакция самоокисления-самовосстановления или диспропорционирования). При нагревании сульфита образуется смесь сульфидов и сульфатов:
- 4Na2SO3 → 3Na2SO4 + Na2S ‒ термическое разложение сульфита натрия
- 4CaSO3 → 3CaSO4 + CaS ‒ термическое разложение сульфита кальция
Разложение сульфатов
Сульфаты щелочных металлов не разлагаются при нагревании. Сульфаты серебра и ртути разлагаются до свободного металла, сульфаты остальных металлов разлагаются до оксида металла, сернистого газа и кислорода.
Уравнения реакция разложения сульфатов:
- 2CaSO4 → 2CaO + 2SO2↑ + O2↑ ‒ реакция разложения сульфата кальция
- Ag2SO4 → 2Ag + 2SO2↑ + O2↑ ‒ реакция разложения сульфата серебра
Уравнения реакций разложения комплексных солей
При нагревании комплексные соли теряют воду, превращаясь в средние соли, степени окисления при этом не изменяются:
- Na[Al(OH)4] → NaAlO2 + 2H2O↑ ‒ разложение тетрагидроксоалюмината натрия
- K2[Zn(OH)4] → K2ZnO2 + 2H2O↑ ‒ разложение тетрагидроксоцинката калия
- Ca[Be(OH)4] → CaBeO2 + 2H2O↑ ‒ разложение тетрагидроксобериллата кальция
- Ba[Al(OH)4]2 → Ba(AlO2)2 + 4H2O↑ ‒ разложение тетрагидроксоалюмината бария
Реакция разложения дихромата калия и перманганата калия
На ЕГЭ по химии реакции разложения дихромата калия и перманганата калия часто встречаются в заданиях линии 29 и 31.Эти две реакции похожи, поэтому их удобно запоминать сразу парой:
- 4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2↑ ‒ уравнение термического разложения дихромата калия
- 2KMnO4 → K2MnO4 + MnO2 + O2↑ ‒ уравнение термического разложение перманганата калия
Разложение бертолетовой соли
Бертолетова соль или хлорат калия разлагается на разные продукты в зависимости от условий. При нагревании до 150-300ºС в присутствие катализатора образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2↑
Сходным образом разлагается перхлорат калия:
- KClO4 → KCl + 2O2↑
При температуре 400ºС бертолетова соль разлагается на перхлорат калия и хлорид калия:
- 4KClO3 → 3KClO4 + KCl
Флэш-карточки с разложением солей. Перед Вами лицевая сторона карточки с формулой соли, попробуйте вспомнить основные продукты разложения этой соли и нажмите на карточку, чтобы проверить реакцию:
-
KClO3 (400 градусов)
KClO4 + KCl
-
(NH4)2Cr2O7
N2 + Cr2O3 + H2O
-
-
-
-
-
K2Cr2O7
K2CrO4 + Cr2O3 + O2
-
-
-
Разложение гидроксидов
Еще одна популярная тема в разложении веществ – термическое разложение гидроксидов. Большинство нерастворимых гидроксидов неустойчивы, разлагаются на оксид и воду. При этом степень окисления металла не меняется. Растворимые гидроксиды (щелочи) не разлагаются, за исключением неустойчивого гидроксида аммония (который не является щелочью).
- 2Al(OH)3 → Al2O3 + 3H2O ‒ разложение гидроксида алюминия
- Zn(OH)2 → ZnO + H2O ‒ разложение гидроксида цинка
- Cu(OH)2 → CuO + H2O ‒ разложение гидроксида меди II
- 2Fe(OH)3 → Fe2O3 + 3H2O ‒ разложение гидроксида железа III
- NH4OH → NH3↑ + H2O или NH3·H2O → NH3↑ + H2O ‒ разложение гидроксида аммония
Разложение органических веществ
Сходным образом происходит и разложение органических веществ – гидроксидов метиламмония, диметиламмония, триметиламмония и некоторых других.
- [CH3-NH3]OH → CH3-NH2↑ + H2O ‒ разложение гидроксида метиламмония
- [(CH3)2-NH2]OH → (CH3)2-NH↑ + H2O ‒ разложение гидроксида диметиламмония
- [(CH3)3-NH]OH → (CH3)3-N↑ + H2O ‒ разложение гидроксида триметиламмония
Разложение кислот
Неустойчивыми кислотами являются угольная, сернистая кислота и азотистая кислота, они разлагаются даже при небольшом нагревании:
- H2CO3 → CO2↑ + H2O ‒ разложение угольной кислоты
- H2SO3 → SO2↑ + H2O ‒ разложение сернистой кислоты
- 2HNO2 → NO↑ + NO2↑ + H2O ‒ разложение азотистой кислоты без нагревания
- 3HNO2 → HNO3 + 2NO↑ + H2O – разложение азотистой кислоты при нагревании
Разложение остальных кислот требует нагревания:
- 4HNO3 → 4NO2 + O2↑ + 2H2O ‒ разложение азотной кислоты
- H2SiO3 → SiO2 + H2O – разложение кремниевой кислоты
Часто от приличных на вид людей можно услышать о вреде для здоровья какого-то продукта или средства. Причем главным аргументом в пользу такого утверждения будет фраза: «Это химия!». Однако так говорить могут лишь те, кто в школе явно прогуливал уроки по данному предмету. Дело в том, что человеческий, да и любой биологический организм, сам по себе состоит из множества органических и неорганических веществ. При этом поддерживать его жизнеспособность помогают различные процессы, непрерывно происходящие внутри него. Одним из главных среди них — является химическая реакция разложения. Давайте узнаем больше о ней и особенностях ее протекания с органическими и неорганическими веществами.
Что за процесс называется химической реакцией
Прежде всего, стоит узнать значение понятия «химическая реакция». Это словосочетание означает превращение одного и более исходных веществ (называются реагентами) в другие. В процессе подобной метаморфозы ядра атомов взаимодействующих соединений не поддаются изменениям, однако происходит перераспределение электронов. Таким образом, после превращения на выходе образуются новые атомные соединения.
Химические реакции имеют качественное отличие от физических и ядерных.
- В результате первых исходные реагенты никогда не меняют свой состав, хотя и способны образовывать смеси или переходить из одного агрегатного состояния в другое. В отличие от них, процессы химические сопровождаются образованием новых соединений, с совершенно иными свойствами.
- Результатом вторых является изменения изотопного состава и числа атомов. Таким образом, на выходе из одних элементов, образовываются другие. Однако для химических процессов, столь глубокие метаморфозы не характерны. Поскольку изменения, произошедшие из-за них, не влияют на внутреннюю структуру атомов.
Условия протекания химических реакций
Во многих случаях, для успешного протекания процессов такого рода, необходим просто физический контакт реагентов друг с другом или их смешивание. Но часто для начала химической реакции, ей необходимы катализаторы. В этой роли могут выступать как различные вещества, так и определенные внешние условия.
- Воздействие температуры. Для того чтобы запустить отдельные химические процессы, необходимо нагревать реагенты. К примеру, чтобы начать реакцию разложения карбоната кальция, это температуру этого соединений необходимо повысить до 900-1200 °C.
- Электромагнитные волны. Наиболее эффективно стимулирующей протекание любых процессов является воздействие на реагенты световыми волнами. Такие реакции носят название «фотохимические». Классическим примером такой реакции является фотосинтез.
- Ионизирующее излучение.
- Воздействие электрического тока.
- Разного рода механическое влияние на реагирующие вещества.
Какие виды химических реакций существуют
Классификация подобных процессов в основном производится по шести признакам.
- По наличию границы разделения фаз: гомо-/гетерогенные реакции.
- По выделению/поглощению тепла: экзотермически и эндотермические процессы.
- По наличию/отсутствию катализаторов: каталитические и некаталитические реакции.
- По направлению протекания: обратимые и необратимые процессы. В зависимости от данной категории находится тип знака между левой и правой частями химического уравнения. При необратимых — это две стрелки направленные в противоположные стороны, при обратимых — только одна, направленная слева на право.
- По изменению степени окисления. По этому принципу выделяют окислительно-восстановительную реакцию.
- Разложение (расщепление), соединение, замещение и обмен – это виды химических процессов по типу метаморфоз реагентов.
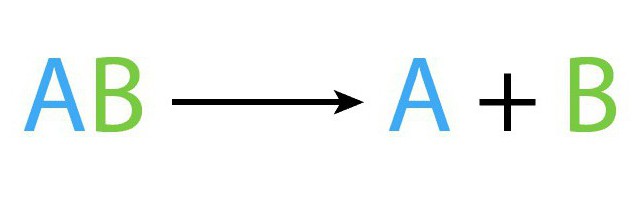
Реакция разложения (расщепления): что это
Под данным термином подразумевается процесс, в результате которого одно сложное вещество разделяется на два и более простых. В большинстве случаев катализатором для этого выступает высокая температура. По этой причине данный процесс еще называют реакцией термического разложения.
В качестве примера можно привести один из классических способов получения чистого кислорода (О2) в промышленности. Это происходит в следствии нагревании KMnO4 (более известен всем под бытовым названием «марганцовка»).
В результате расщепления образуется не только кислород, но и манганат калия (K2MnO4) , а также диоксид марганца (MnO2).
Уравнение реакции разложения
Любое химическое уравнение состоит из двух частей: левой и правой. В первой из них записываются реагирующие соединения, а во второй – продукты реакции. Между ними обычно ставится направленная вправо стрелка. Иногда она бывает двухсторонней, если речь идет об обратимом процессе. В отдельных случаях ее допустимо заменить знаком равенства (=).
Рассматриваемый процесс, как и остальные виды химических процессов, имеет собственную формулу. Схематически уравнение реакции разложения выглядит таким образом: AB (t) → A+B.
Стоит помнить, что преимущественное большинство таких процессов происходит под воздействием тепла. Чтобы сообщить об этом, над стрелкой или рядом с ней часто ставится либо литера t, либо треугольник. Однако, иногда вместо тепла, в роли катализаторов выступают различные вещества, излучения.
В рассмотренной выше формуле AB — то исходное сложное соединения, A, B – это новые вещества, образованные в результате реакции разложения.
Примеры практические такого процесса встречаются очень часто. Можно проиллюстрировать данную формулу, с помощью уравнения процесса, описанного в предыдущем пункте: 2KMnO4 (t) → K2MnO4 + MnO2 + O2↑.
Виды реакций разложения
В зависимости от типа катализатора (который способствует расщеплению сложного вещества на более простые) выделяют несколько видов разложения.
- Биодеградация – распад веществ вследствие деятельности живых организмов (микроорганизмы, грибы, водоросли). Более простым языком данный процесс можно назвать гниением. Именно из-за него портятся продукты. В одной стороны это препятствует их долгому хранению, с другой – помогает природе утилизировать все лишнее, восстанавливая таким образом экосистемы.
- Радиолиз – распад соединений при помощи воздействия на их молекулы ионизирующим излучением.
- Термолиз – повышение температуры для того, чтобы запустить реакцию разложения (примеры подобных процессов можно найти в пунктах 8-9).
Этот вид расщепления имеет подвид – пиролиз. От обычного термолиза он отличается тем, что помимо воздействия высокой температуры на молекулы вещества, также их лишают возможности взаимодействовать с кислородом (О2).
- Сольволиз – обменное разложения между растворенным веществом и непосредственно самим растворителем. В зависимости от типа последнего, выделяются такие виды этого процесса: гидролиз (вода), алколиз (спирты), аммонолиз (амиак).
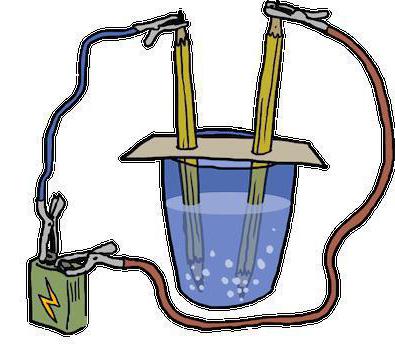
- Электролиз – разложение молекул с помощью воздействия на них электрического тока (пример в следующем пункте).
Расщепление Н2О
Разобравшись с теорией, касающейся реакции разложения, примеры практические ее проведения стоит рассмотреть. Поскольку Н2О сегодня является одним из наиболее доступных веществ для проведения химических опытов, стоит начать с нее.
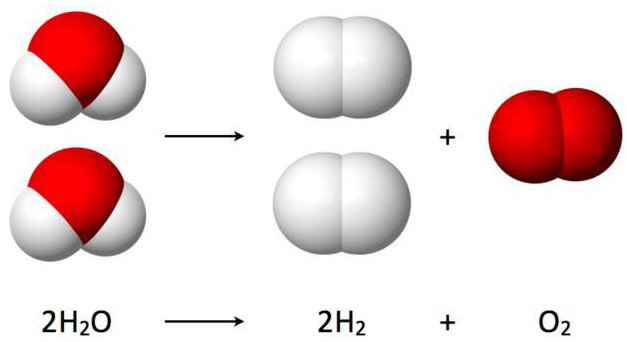
Данная реакция разложения воды именуется еще электролизом и выглядит таким образом: 2Н2О (электрический ток) → 2Н2↑ + О2↑.
Расшифровывается данное уравнение так: под воздействием на молекулы воды электрического тока, они расщепляют и образуют два газа – кислород и водород.
Стоит отметить, что этот метод активно используется на подводных лодках для получения кислорода. В современном мире он заменил более дорогой способ получения этого жизненно важного вещества из пероксида натрия (Na2O2), с помощью его взаимодействия с углекислым газом: Na2O2 + CO2↑ → Na2CO3 + O2↑.
В перспективе реакция разложения воды может иметь огромное значение для будущего планеты. Поскольку таким образом можно добывать не только кислород, но и водород, использующийся как ракетное топливо. Разработки в этой области уже ведутся многие годы, однако основной проблемой является необходимость снизить количество энергозатрат на расщепление молекул воды.
Расщепление Н2О2
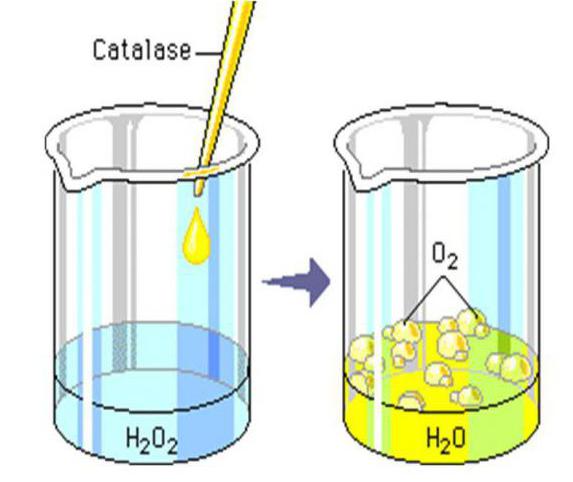
Среди других примеров реакции разложения стоит обратить внимание на образование воды и кислорода из пероксида водорода (перекись).
Выглядит она таким образом: Н2О2 (t) → 2Н2О + О2↑.
Данный процесс также является термическим, поскольку для его начала, необходимо, чтобы исходное веществ было нагрето до температуры в 150 °C.
Именно по этой причине, перекись водорода (которую большинство использует для обработки ран) не превращается в воду, стоя в домашних аптечках.
Однако стоит помнить, что реакция разложения пероксида водорода может происходить и при обычной комнатной температуре, если вещество контактирует с такими соединениями, как каустическая сода (NaOH) или диоксид марганца (MnO2). Также в роли катализаторов могут выступать платина (Pt) и купрум (Cu).
Реакция термического разложения CaCO3
Еще одним интересным примером может служить расщепление карбоната кальция. Данный процесс можно записать с помощью такого уравнения: CaCO3 (t) → CaO + CO2↑.
Продуктом этой реакции буде негашеная известь (оксид кальция) и углекислый газ.
Представленный выше процесс активно используется в промышленности для получения углекислого газа. Подобные реакции производятся в специализированных шахтах, поскольку расщепление карбоната кальция происходит лишь при температуре от 900 °C.
Химия – это наука о веществах, их свойствах и превращениях.
То есть, если с окружающими нас веществами ничего не происходит, то это не относится к химии. Но что значит, «ничего не происходит»? Если в поле нас вдруг застала гроза, и мы все промокли, как говорится «до нитки», то это ли не превращение: ведь одежда была сухой, а стала мокрой.
Если, к примеру взять железный гвоздь, обработать его напильником, а затем собрать железные опилки (Fe), то это ли так же не превращение: был гвоздь – стал порошок. Но если после этого собрать прибор и провести получение кислорода (О2): нагреть перманганат калия (КМпО4) и собрать в пробирку кислород, а затем в неё поместить раскалённые «до красна» эти железные опилки, то они вспыхнут ярким пламенем и после сгорания превратятся в порошок бурого цвета. И это так же превращение. Так где же химия? Несмотря на то, что в этих примерах меняется форма (железный гвоздь) и состояние одежды (сухая, мокрая) – это не превращения. Дело в том, что сам по себе гвоздь как был веществом (железо), так им и остался, несмотря на другую свою форму, а воду от дождя как впитала наша одежда, так потом его и испарила в атмосферу. Сама вода не изменилась. Так что же такое превращения с точки зрения химии?
Превращениями с точки зрения химии называются такие явления, которые сопровождаются изменением состава вещества. Возьмём в качестве примера тот же гвоздь. Не важно, какую форму он принял после обработки напильником, но после того как собранные от него железные опилки поместили в атмосферу кислорода — он превратился в оксид железа (Fe2O3). Значит, что-то всё-таки изменилось? Да, изменилось. Было вещество гвоздь, но под воздействием кислорода сформировалось новое вещество – оксид элемента железа. Молекулярное уравнение этого превращения можно отобразить следующими химическими символами:
4Fe + 3O2 = 2Fe2O3 (1)
Для непосвящённого в химии человека сразу возникают вопросы. Что такое «молекулярное уравнение», что такое Fe? Почему поставлены цифры «4», «3», «2»? Что такое маленькие цифры «2» и «3» в формуле Fe2O3 ? Это значит, наступило время во всём разобраться по порядку.
Знаки химических элементов.
Несмотря на то, что химию начинают изучать в 8-м классе, а некоторые даже раньше, многим известен великий русский химик Д. И. Менделеев. И конечно же, его знаменитая «Периодическая система химических элементов». Иначе, проще, её называют «Таблица Менделеева».
В этой таблице, в соответствующем порядке, располагаются элементы. К настоящему времени их известно около 120. Названия многих элементов нам были известны ещё давно. Это: железо, алюминий, кислород, углерод, золото, кремний. Раньше мы не задумываясь применяли эти слова, отождествляя их с предметами: железный болт, алюминиевая проволока, кислород в атмосфере, золотое кольцо и т.д. и т.д. Но на самом деле все эти вещества (болт, проволока, кольцо) состоят из соответствующих им элементов. Весь парадокс состоит в том, что элемент нельзя потрогать, взять в руки. Как же так? В таблице Менделеева они есть, а взять их нельзя! Да, именно так. Химический элемент – это абстрактное (то есть отвлечённое) понятие, и используется в химии, впрочем как и в других науках, для расчётов, составления уравнений, при решении задач. Каждый элемент отличается от другого тем, что для него характерна своя электронная конфигурация атома. Количество протонов в ядре атома равно количеству электронов в его орбиталях. К примеру, водород – элемент №1. Его атом состоит из 1-го протона и 1-го электрона. Гелий – элемент №2. Его атом состоит из 2-х протонов и 2-х электронов. Литий – элемент №3. Его атом состоит из 3-х протонов и 3-х электронов. Дармштадтий – элемент №110. Его атом состоит из 110-и протонов и 110-и электронов.
Каждый элемент обозначается определённым символом, латинскими буквами, и имеет определённое прочтение в переводе с латинского. Например, водород имеет символ «Н», читается как «гидрогениум» или «аш». Кремний имеет символ «Si» читается как «силициум». Ртуть имеет символ «Нg» и читается как «гидраргирум». И так далее. Все эти обозначения можно найти в любом учебнике химии за 8-й класс. Для нас сейчас главное уяснить то, что при составлении химических уравнений, необходимо оперировать указанными символами элементов.
Простые и сложные вещества.
Обозначая единичными символами химических элементов различные вещества (Hg ртуть, Fe железо, Cu медь, Zn цинк, Al алюминий) мы по сути обозначаем простые вещества, то есть вещества, состоящие из атомов одного вида (содержащие одно и то же количество протонов и нейтронов в атоме). Например, если во взаимодействие вступают вещества железо и сера, то уравнение примет следующую форму записи:
Fe + S = FeS (2)
К простым веществам относятся металлы (Ва, К, Na, Mg, Ag), а так же неметаллы (S, P, Si, Cl2, N2, O2, H2). Причём следует обратить
особое внимание на то, что все металлы обозначаются единичными символами: К, Ва, Са, Аl, V, Mg и т.д., а неметаллы – либо простыми символами: C,S,P или могут иметь различные индексы, которые указывают на их молекулярное строение: H2, Сl2, О2, J2, P4, S8. В дальнейшем это будет иметь очень большое значение при составлении уравнений. Совсем не трудно догадаться, что сложными веществами являются вещества, образованные из атомов разного вида, например,
1). Оксиды:
оксид алюминия Al2O3, 
оксид меди CuO,
оксид цинка ZnO,
оксид титана Ti2O3 ,
угарный газ или оксид углерода (+2) CO,
оксид серы (+6) SO3
2). Основания:
гидроксид железа (+3) Fe(OH)3,
гидроксид меди Cu(OH)2 ,
гидроксид калия или щёлочь калия КOH,
гидроксид натрия NaOH.
3). Кислоты:
соляная кислота HCl,
сернистая кислота H2SO3,
азотная кислота HNO3
4). Соли:
тиосульфат натрия Na2S2O3,
сульфат натрия или глауберова соль Na2SO4 ,
карбонат кальция или известняк СаCO3,
хлорид меди CuCl2
5). Органические вещества:
ацетат натрия СН3СООNa,
метан СН4,
ацетилен С2Н2 ,
глюкоза С6Н12О6
Наконец, после того как мы выяснили структуру различных веществ, можно приступать к составлению химических уравнений.
Химическое уравнение.
Само слово «уравнение» производное от слова «уравнять», т.е. разделить нечто на равные части. В математике уравнения составляют чуть ли не самую сущность этой науки. К примеру, можно привести такое простое уравнение, в котором левая и правая части будут равны «2» :
40 : (9 + 11) = (50 х 2) : ( 80 – 30 );
И в химических уравнениях тот же принцип: левая и правая части уравнения должны соответствовать одинаковым количествам атомов, участвующим в них элементов. Или, если приводится ионное уравнение, то в нём число частицтак же должно соответствовать этому требованию. Химическим уравнением называется условная запись химической реакции с помощью химических формул и математических знаков . Химическое уравнение по своей сути отражает ту или иную химическую реакцию, то есть процесс взаимодействия веществ, в процессе которых возникают новые вещества. Например, необходимо написать молекулярное уравнение реакции, в которой принимают участие хлорид бария ВаСl2 и серная кислота H2SO4. В результате этой реакции образуется нерастворимый осадок – сульфат бария ВаSO4 и соляная кислота НСl :
ВаСl2 + H2SO4 = BaSO4 + 2НСl (3)
Прежде всего необходимо уяснить, что большая цифра «2», стоящая перед веществом НСlназывается коэффициентом, а малые цифры «2», «4» под формулами ВаСl2, H2SO4 ,BaSO4 называются индексами. И коэффициенты и индексы в химических уравнениях выполняют роль множителей, а не слагаемых. Что бы правильно записать химическое уравнение, необходимо расставить коэффициенты в уравнении реакции. Теперь приступим к подсчёту атомов элементов в левой и правой частях уравнения. В левой части уравнения: в веществе ВаСl2 содержатся 1 атом бария (Ва), 2 атома хлора (Сl). В веществе H2SO4: 2 атома водорода (Н), 1 атом серы (S) и 4 атома кислорода (О) . В правой части уравнения: в веществе BaSO4 1 атом бария (Ва) 1 атом серы (S) и 4 атома кислорода (О), в веществе НСl: 1 атом водорода (Н) и 1 атом хлора (Сl). Откуда следует, что в правой части уравнения количество атомов водорода и хлора вдвое меньше, чем в левой части. Следовательно, перед формулой НСl в правой части уравнения необходимо поставить коэффициент «2». Если теперь сложить количества атомов элементов, участвующих в данной реакции, и слева и справа, то получим следующий баланс:
В обеих частях уравнения количества атомов элементов, участвующих в реакции, равны, следовательно оно составлено правильно.
Химические уравнение и химические реакции
Как мы уже выяснили, химические уравнения являются отражением химических реакций. Химическими реакциями называются такие явления, в процессе которых происходит превращение одних веществ в другие. Среди их многообразия можно выделить два основных типа:
1). Реакции соединения
2). Реакции разложения.
В подавляющем своём большинстве химические реакции принадлежат к реакциям присоединения, поскольку с отдельно взятым веществом редко могут происходить изменения в его составе, если оно не подвергается воздействиям извне (растворению, нагреванию, действию света). Ничто так не характеризует химическое явление, или реакцию, как изменения, происходящие при взаимодействии двух и более веществ. Такие явления могут осуществляться самопроизвольно и сопровождаться повышением или понижением температуры, световыми эффектами, изменением цвета, образованием осадка, выделением газообразных продуктов, шумом.
Для наглядности приведём несколько уравнений, отражающих процессы реакций соединения, в процессе которых получаются хлорид натрия (NaCl), хлорид цинка (ZnCl2), осадок хлорида серебра (AgCl), хлорид алюминия (AlCl3)
Cl2 + 2Nа = 2NaCl (4)
СuCl2+ Zn= ZnCl2 + Сu (5)
AgNO3 + КCl = AgCl+ 2KNO3 (6)
3HCl+ Al(OH)3 = AlCl3 + 3Н2О (7)
Cреди реакций соединения следует особым образом отметить следующие: замещения (5), обмена (6), и как частный случай реакции обмена – реакцию нейтрализации (7).
К реакциям замещения относятся такие, при осуществлении которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. В примере (5) атомы цинка замещают из раствора СuCl2 атомы меди, при этом цинк переходит в растворимую соль ZnCl2, а медь выделяется из раствора в металлическом состоянии.
К реакциям обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.В случае реакции (6) растворимые соли AgNO3 и КCl при сливании обоих растворов образуют нерастворимый осадок соли AgCl. При этом они обмениваются своими составными частями – катионами и анионами. Катионы калия К+ присоединяются к анионам NO3, а катионы серебра Ag+ – к анионам Cl—.
К особому, частному случаю, реакций обмена относится реакция нейтрализации. К реакциям нейтрализации относятся такие реакции, в процессе которых кислоты реагируют с основаниями, в результате образуется соль и вода. В примере (7) соляная кислота HCl, реагируя с основанием Al(OH)3 образует соль AlCl3 и воду. При этом катионы алюминия Al3+ от основания обмениваются с анионами Сl— от кислоты. В итоге происходит нейтрализация соляной кислоты.
К реакциям разложения относятся такие, при котором из одного сложного образуются два и более новых простых или сложных веществ, но более простого состава. В качестве реакций можно привести такие, в процессе которых разлагаются 1). Нитрат калия(КNO3) с образованием нитрита калия (КNO2) и кислорода (O2); 2). Перманганат калия (KMnO4): образуются манганат калия (К2МnO4), оксид марганца (MnO2) и кислород (O2); 3). Карбонат кальция или мрамор; в процессе образуются углекислый газ (CO2) и оксид кальция (СаО)
2КNO3 =2КNO2 + O2 (8)
2KMnO4 = К2МnO4 + MnO2 + O2 (9)
СаCO3 = CaO + CO2 (10)
В реакции (8) из сложного вещества образуется одно сложное и одно простое. В реакции (9) – два сложных и одно простое. В реакции (10) – два сложных вещества , но более простых по составу
Разложению подвергаются все классы сложных веществ:
1). Оксиды: оксид серебра 2Ag2O = 4Ag + O2 (11)
2). Гидроксиды: гидроксид железа 2Fe(OH)3 = Fe2O3 + 3H2O (12)
3). Кислоты: серная кислота H2SO4 = SO3 + H2O (13)
4). Соли: карбонат кальция СаCO3 = СаO + CO2 (14)
5). Органические вещества: спиртовое брожение глюкозы
С6Н12О6 = 2С2Н5ОH + 2CO2 (15)
Согласно другой классификации, все химические реакции можно разделить на два типа: реакции, идущие с выделением теплоты, их называют экзотермические, и реакции, идущие с поглощением теплоты – эндотермические. Критерием таких процессов является тепловой эффект реакции. Как правило, к экзотермическим реакциям относятся реакции окисления, т.е. взаимодействия с кислородом, например сгорание метана:
СН4 + 2O2 = СО2 + 2Н2О + Q (16)
а к эндотермическим реакциям – реакции разложения, уже приводимые выше (11) – (15). Знак Q в конце уравнения указывает на то, выделяется ли теплота в процессе реакции (+Q) или поглощается (-Q):
СаCO3 = СаO+CO2 — Q (17)
Можно так же рассматривать все химические реакции по типу изменения степени окисления, участвующих в их превращениях элементов. К примеру, в реакции (17) участвующие в ней элементы не меняют свои степени окисления:
Са+2C+4O3-2 = Са+2O-2+C+4O2-2 (18)
А в реакции (16) элементы меняют свои степени окисления:
2Mg0 + O20 = 2Mg+2O-2
Реакции такого типа относятся к окислительно-восстановительным. Они будут рассматриваться отдельно. Для составления уравнений по реакциям такого типа необходимо использовать метод полуреакцийи применять уравнение электронного баланса.
После приведения различных типов химических реакций, можно приступать к принципу составлений химических уравнений, иначе, подбору коэффициентов в левой и правой их частях.
СЛОЖНА-А-А 🙀 Ты же знаешь, что если не разобраться в теме сейчас, то потом придется исправлять оценки. Беги на бесплатное онлайн-занятие с репетитором (подробности тут + 🎁).
Механизмы составления химических уравнений.
К какому бы типу ни относилась та или иная химическая реакция, её запись ( химическое уравнение) должна соответствовать условию равенства количества атомов до реакции и после реакции.
Существуют такие уравнения (17), которые не требуют уравнивания, т.е. расстановки коэффициентов. Но в большинстве случаях, как в примерах (3), (7), (15), необходимо предпринимать действия, направленные на уравнивание левой и правой частей уравнения. Какими же принципами необходимо руководствоваться в таких случаях? Существует ли какая ни будь система в подборе коэффициентов? Существует, и не одна. К таковым системам относятся:
1). Подбор коэффициентов по заданным формулам.
2). Составление по валентностям реагирующих веществ.
3). Составление по степеням окисления реагирующих веществ.
В первом случае полагается, что нам известны формулы реагирующих веществ как до реакции, так и после. К примеру, дано следующее уравнение:
N2 + О2 →N2О3 (19)
Принято считать, что пока не установлено равенство между атомами элементов до реакции и после, знак равенства (=) в уравнении не ставится, а заменяется стрелкой (→). Теперь приступим к собственно уравниванию. В левой части уравнения имеются 2 атома азота (N2) и два атома кислорода (О2), а в правой – два атома азота (N2) и три атома кислорода (О3). По количеству атомов азота его уравнивать не надо, но по кислороду необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало три атома. Составим следующую схему:
до реакции после реакции
О2 О3
Определим наименьшее кратное между данными количествами атомов, это будет «6».
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение:
N2 + 3О2 →N2О3
Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
N2 + 3О2 → 2N2О3
Количества атомов кислорода и в левой и в правой частях уравнения стали равны, соответственно по 6 атомов:
3О2 → 2О3
Но количество атомов азота в обеих частях уравнения не будут соответствовать друг другу:
N2→ 2N2
В левой – два атома, в правой – четыре атома. Следовательно, что бы добиться равенства, необходимо удвоить количество азота в левой части уравнения, поставив коэффициент «2»:
2N2→ 2N2
Таким образом, равенство по азоту соблюдено и в целом, уравнение примет вид:
2N2 + 3О2 → 2N2О3
Теперь в уравнении можно вместо стрелки поставит знак равенства:
2N2 + 3О2 = 2N2О3 (20)
Приведём другой пример. Дано следующее уравнение реакции:
Р + Cl2→ РCl5
В левой части уравнения имеется 1 атом фосфора (Р) и два атома хлора (Cl2), а в правой – один атом фосфора (Р) и пять атомов кислорода (Cl5). По количеству атомов фосфора его уравнивать не надо, но по хлору необходимо добиться равенства, поскольку до реакции их участвовало два атома, а после реакции стало пять атома. Составим следующую схему:
до реакции после реакции
Cl2 Cl5
Определим наименьшее кратное между данными количествами атомов, это будет «10».
Cl2 Cl5
10 /
Разделим это число в левой части уравнения по хлору на «2». Получим число «5», поставим его в решаемое уравнение:
Р + 5Cl2→ РCl5
Так же разделим число «10» для правой части уравнения на «5». Получим число «2», так же поставим его в решаемое уравнение:
Р + 5Cl2→ 2РCl5
Количества атомов хлора и в левой и в правой частях уравнения стали равны, соответственно по 10 атомов:
5Cl2→ 2Cl5
Но количество атомов фосфора в обеих частях уравнения не будут соответствовать друг другу:
Р → 2Р
Следовательно, что бы добиться равенства, необходимо удвоить количество фосфора в левой части уравнения, поставив коэффициент «2»:
2Р → 2Р
Таким образом, равенство по фосфору соблюдено и в целом, уравнение примет вид:
2Р + 5Cl2= 2РCl5 (21)
При составлении уравнений по валентностям необходимо дать определение валентности и установить значения для наиболее известных элементов. Валентность – это одно из ранее применяемых понятий, в настоящее время в ряде школьных программ не используется. Но при его помощи легче объяснить принципы составления уравнений химических реакций. Под валентностью понимают число химических связей, которые тот или иной атом может образовывать с другим, или другими атомами. Валентность не имеет знака ( + или — ) и обозначается римскими цифрами, как правило, над символами химических элементов, например:
I II III IV V
H O N S Р
Откуда берутся эти значения? Как их применять при составлении химических уравнений? Числовые значения валентностей элементов совпадают с их номером группы Периодической системы химических элементов Д. И. Менделеева (Таблица 1).
Для других элементов значения валентностей могут иметь иные значения, но никогда не больше номера группы, в которой они расположены. Причём для чётных номеров групп (IV и VI ) валентности элементов принимают только чётные значения, а для нечётных – могут иметь как чётные, так и нечётные значения (Таблица.2).
Конечно же, в значениях валентностей для некоторых элементов имеются исключения, но в каждом конкретном случае эти моменты обычно оговариваются. Теперь рассмотрим общий принцип составления химических уравнений по заданным валентностям для тех или иных элементов. Чаще всего данный метод приемлем в случае составления уравнений химических реакций соединения простых веществ, например, при взаимодействии с кислородом (реакции окисления). Допустим, необходимо отобразить реакцию окисления алюминия. Но напомним, что металлы обозначаются единичными атомами (Al), а неметаллы, находящиеся в газообразном состоянии – с индексами «2» — (О2). Сначала напишем общую схему реакции:
Al + О2 →AlО
На данном этапе ещё не известно, какое правильное написание должно быть у оксида алюминия. И вот именно на данном этапе нам на помощь придёт знание валентностей элементов. Для алюминия и кислорода проставим их над предполагаемой формулой этого оксида:
III II
Al О
После чего «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III II
Al2 О3
Состав химического соединения Al2О3 определён. Дальнейшая схема уравнения реакции примет вид:
Al+ О2 →Al2О3
Остаётся только уравнять левую и правую его части. Поступим таким же способом, как в случае составления уравнения (19). Количества атомов кислорода уравняем, прибегая к нахождению наименьшего кратного:
до реакции после реакции
О2 О3
6 /
Разделим это число в левой части уравнения по кислороду на «2». Получим число «3», поставим его в решаемое уравнение. Так же разделим число «6» для правой части уравнения на «3». Получим число «2», так же поставим его в решаемое уравнение:
Al + 3О2 → 2Al2О3
Что бы добиться равенства по алюминию, необходимо скорректировать его количество в левой части уравнения, поставив коэффициент «4»:
4Al + 3О2 → 2Al2О3
Таким образом, равенство по алюминию и кислороду соблюдено и в целом, уравнение примет окончательный вид:
4Al + 3О2 = 2Al2О3 (22)
Применяя метод валентностей, можно прогнозировать, какое вещество образуется в процессе химической реакции, как будет выглядеть его формула. Допустим, в реакцию соединения вступили азот и водород с соответствующими валентностями III и I. Напишем общую схему реакции:
N2 + Н2 → NН
Для азота и водорода проставим валентности над предполагаемой формулой этого соединения:
III I
N Н
Как и прежде «крест»-на-«крест» у этих символов элементов поставим внизу соответствующие индексы:
III I
N Н3
Дальнейшая схема уравнения реакции примет вид:
N2 + Н2 → NН3
Уравнивая уже известным способом, через наименьшее кратное для водорода, равное «6»,получим искомые коэффициенты, и уравнение в целом:
N2 + 3Н2 = 2NН3 (23)
При составлении уравнений по степеням окисления реагирующих веществ необходимо напомнить, что степенью окисления того или иного элемента называется число принятых или отданных в процессе химической реакции электронов. Степень окисления в соединениях в основном, численно совпадает со значениями валентностей элемента. Но отличаются знаком. Например, для водорода валентность равна I, а степень окисления (+1) или (-1). Для кислорода валентность равна II, а степень окисления (-2). Для азота валентности равны I,II,III,IV,V, а степени окисления (-3), (+1), (+2), (+3), (+4), (+5) и т.д. Степени окисления наиболее часто применяемых в уравнениях элементов, приведены в таблице 3.
В случае реакций соединения принцип составления уравнений по степеням окисления такой же, как и при составлении по валентностям. Например, приведём уравнение реакции окисления хлора кислородом, в которой хлор образует соединение со степенью окисления +7. Запишем предполагаемое уравнение:
Cl2 + О2 →ClО
Поставим над предполагаемым соединением ClО степени окисления соответствующих атомов:
+7 -2
Cl О
Как и в предыдущих случаях установим, что искомая формула соединения примет вид:
+7 -2
Cl2О7
Уравнение реакции примет следующий вид:
Cl2 + О2 → Cl2О7
Уравнивая по кислороду, найдя наименьшее кратное между двумя и семи, равное «14», установим в итоге равенство:
2Cl2 + 7О2 = 2Cl2О7 (24)
Несколько иной способ необходимо применять со степенями окисления при составлении реакций обмена, нейтрализации, замещения. В ряде случаев предоставляется затруднительным узнать: какие соединения образуются при взаимодействии сложных веществ?
Как узнать: что получится в процессе реакции?
Действительно, как узнать: какие продукты реакции могут возникнут в ходе конкретной реакции? К примеру, что образуется при взаимодействии нитрата бария и сульфата калия?
Ва(NО3) 2 + К2SO4 → ?
Может быть ВаК2(NО3) 2 + SO4 ?Или Ва + NО3SO4 + К2? Или ещё что-то? Конечно же, в процессе этой реакции образуются соединения: ВаSO4 и КNО3 . А откуда это известно? И как правильно написать формулы веществ? Начнём с того, что чаще всего упускается из вида: с самого понятия «реакция обмена». Это значит, что при данных реакциях вещества меняются друг с другом составными частями. Поскольку реакции обмена в большинстве своём осуществляются межу основаниями, кислотами или солями, то частями, которыми они будут меняться, являются катионы металлов ( Na+, Mg2+,Al3+,Ca2+,Cr3+), ионов Н+ или ОН—, анионов – остатков кислот,(Cl—, NO32-,SO32-, SO42-, CO32-, PO43-). В общем виде реакцию обмена можно привести в следующей записи:
Kt1An1 + Kt2An1 = Kt1An2 + Kt2An1 (25)
Где Kt1 и Kt2 – катионы металлов (1) и (2), а An1 и An2 – соответствующие им анионы (1) и (2). При этом обязательно надо учитывать, что в соединениях до реакции и после реакции на первом месте всегда устанавливаются катионы, а анионы – на втором. Следовательно, если в реакцию вступит хлорид калия и нитрат серебра, оба в растворённом состоянии
KCl + AgNO3→
то в процессе её образуются вещества KNO3 и AgClи соответствующее уравнение примет вид:
KCl + AgNO3=KNO3 + AgCl (26)
При реакциях нейтрализации протоны от кислот (Н+) будут соединяться с анионами гидроксила (ОН—) с образованием воды (Н2О):
НCl + КОН = КCl + Н2O (27)
Степени окисления катионов металлов и заряды анионов кислотных остатков указаны в таблице растворимости веществ (кислот, солей и оснований в воде). По горизонтали приведены катионы металлов, а по вертикали – анионы кислотных остатков.
Исходя из этого, при составлении уравнения реакции обмена, необходимо вначале в левой его части установить степени окисления принимающих в этом химическом процессе частиц. Например, требуется написать уравнение взаимодействия между хлоридом кальция и карбонатом натрия.Составим исходную схему этой реакции:
СаCl + NаСО3 →
Над катионами и анионами проставим соответствующие заряды:
Са2+Cl— + Nа+СО32- →
Совершив уже известное действие «крест»-на-«крест», определим реальные формулы исходных веществ:
СаCl2 + Nа2СО3 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ:
СаCl2 + Nа2СО3 → СаСО3 + NаCl
Над их катионами и анионами проставим соответствующие заряды:
Са2+СО32- + Nа+Cl—
Формулы веществ записаны правильно, в соответствии с зарядами катионов и анионов. Составим полное уравнение, уравняв левую и правую его части по натрию и хлору:
СаCl2 + Nа2СО3 = СаСО3 + 2NаCl (28)
В качестве другого примера приведём уравнение реакции нейтрализации между гидроксидом бария и ортофосфорной кислотой:
ВаОН + НРО4 →
Над катионами и анионами проставим соответствующие заряды:
Ва2+ ОН— + Н+РО43- →
Определим реальные формулы исходных веществ:
Ва(ОН)2 + Н3РО4 →
Исходя из принципа обмена катионами и анионами (25), установим предварительные формулы образующихся в ходе реакции веществ, учитывая, что при реакции обмена одним из веществ обязательно должна быть вода:
Ва(ОН)2 + Н3РО4 → Ва2+ РО43- + Н2O
Определим правильную запись формулы соли, образовавшейся в процессе реакции:
Ва(ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Уравняем левую часть уравнения по барию:
3Ва (ОН)2 + Н3РО4 → Ва3(РО4)2 + Н2O
Поскольку в правой части уравнения остаток ортофосфорной кислоты взят дважды, (РО4)2, то слева необходимо также удвоить её количество:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + Н2O
Осталось привести в соответствие количество атомов водорода и кислорода в правой части у воды. Так как слева общее количество атомов водорода равно 12, то справа оно так же должно соответствовать двенадцати, поэтому перед формулой воды необходимо поставить коэффициент «6» (поскольку в молекуле воды уже имеется 2 атома водорода). По кислороду так же соблюдено равенство: слева 14 и справа 14. Итак, уравнение имеет правильную форму записи:
3Ва (ОН)2 + 2Н3РО4 → Ва3(РО4)2 + 6Н2O (29)
Возможность осуществления химических реакций
Мир состоит из великого множества веществ. Неисчислимо так же количество вариантов химических реакций между ними. Но можем ли мы, написав на бумаге то или иное уравнение утверждать, что ему будет соответствовать химическая реакция? Существует ошибочное мнение, что если правильно расставить коэффициенты в уравнении, то оно будет осуществимо и на практике. Например, если взять раствор серной кислоты и опустить в него цинк, то можно наблюдать процесс выделения водорода:
Zn+ H2SO4 = ZnSO4 + H2 (30)
Но если в этот же раствор опустить медь, то процесс выделения газа наблюдаться не будет. Реакция не осуществима.
Cu+ H2SO4≠
В случае, если будет взята концентрированная серная кислота, она будет реагировать с медью:
Cu + 2H2SO4 = CuSO4 + SO2 + 2Н2O (31)
В реакции (23) между газами азотом и водородом наблюдается термодинамическое равновесие, т.е. сколько молекул аммиака NН3 образуется в единицу времени, столько же их и распадётся обратно на азот и водород. Смещение химического равновесия можно добиться повышением давления и понижением температуры
N2 + 3Н2 = 2NН3
Если взять раствор гидроксида калия и прилить к нему раствор сульфата натрия, то никаких изменений наблюдаться не будет, реакция будет не осуществима:
КОН + Na2SO4 ≠
Раствор хлорида натрия при взаимодействии с бромом не будет образовывать бром, несмотря на то, что данная реакция может быть отнесена к реакции замещения:
NаCl + Br2≠
В чём же причины таких несоответствий? Дело в том, что оказывается недостаточно только правильно определять формулы соединений, необходимо знать специфику взаимодействия металлов с кислотами, умело пользоваться таблицей растворимости веществ, знать правила замещения в ряду активности металлов и галогенов. В этой статье излагаются только самые основные принципы как расставить коэффициенты в уравнениях реакций, как написать молекулярные уравнения, как определить состав химического соединения.
Химия, как наука, чрезвычайно разнообразна и многогранна. В приведённой статье отражена лишь малая часть процессов, происходящих в реальном мире. Не рассмотрены типы окислительно-восстановительных реакций, термохимические уравнения, электролиз, процессы органического синтеза и многое, многое другое. Но об этом в следующих статьях.
Молодец! Раз ты дочитал это до конца, вероятно, ты все отлично усвоил. Но если вдруг что-то еще непонятно — попробуй онлайн-занятие с репетитором (подробности тут + 🎁).
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.