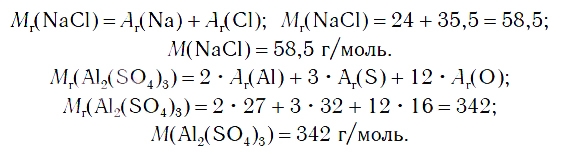Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте H3PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Как составить формулу вещества
Вам необходимо составить химическую формулу, но вы абсолютно забыли основы школьной химии? Поверьте, не стоит переживать. На сегодняшний день известно более 20 миллионов химических соединений, и, поверьте, никто не держит их формулы у себя в голове. Достаточно знать простой принцип их написания.
Вам понадобится
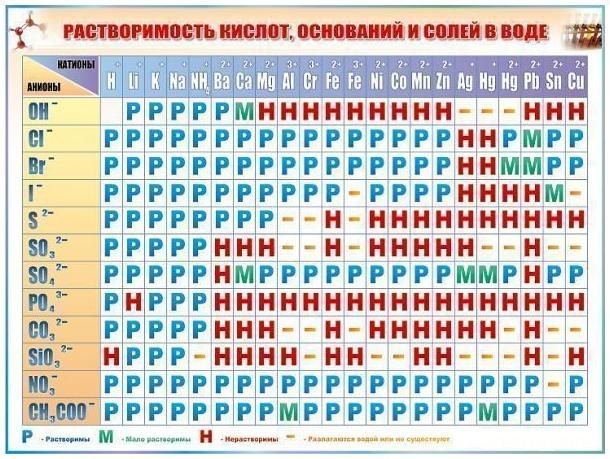
- периодическая таблица Менделеева, таблица растворимости солей
Инструкция
Задача составления химической формулы вещества сводится к созданию электронейтральной системы. Поэтому вам необходимо будет подобрать некоторое число электронов для каждого элемента соединения так, чтобы оно было уравновешено.Однако перед тем, как это сделать, вам следует вспомнить некоторые теоретические основы. Любой элемент периодической таблицы Менделеева обладает своей валентностью (степенью окисления), то есть способностью отдавать или принять некоторое количество электронов, с учетом своей валентности, не более восьми электронов. Валентность каждого химического элемента соответствует номеру группы в периодической таблице (верхняя строка, написанная римскими цифрами). Стоит заметить, что все элементы таблицы Менделеева можно условно разделить на два класса: окислители и восстановители. Первые, как правило, только забирают электроны, вторые – отдают.
Для составления химической формулы также необходимо знать, с каким типом соединений вы имеете дело. Их можно разделить на следующие группы:1. Бинарные;2. Основания, соли, кислоты.
Для составления формулы бинарных соединений вам потребуется таблица Менделеева, а для остальных групп – таблица растворимости солей. В формулах бинарных соединений на первом месте принято писать металл или элемент с меньшей валентностью, на втором – неметалл или элемент с большей валентностью. Допустим, необходимо составить формулу оксида тантала. Запишите рядом обозначения этих элементов и проставьте их валентность: Та5О6. Тантал, соответственно, способен отдать 3 электрона, а кислород – принять два, то есть: Та3+О2-. Таким образом, для создания уравновешенной системы методом «крест-на-крест» (меняя индексы химических элементов местами и отбрасывая их знаки) вы получаете следующую формулу: Та2О3.
Для составления формул оснований, солей и кислот необходимо воспользоваться таблицей растворимости солей. В верхней ее строке указаны катионы – вещества, отдающие электроны, а в левом столбце – анионы, то есть соединения, способные принимать электроны. Пользуясь таблицей растворимости солей, можно получить следующую формулу для сульфата алюминия: Al3+ SO42-. Используя принцип «крест-на-крест», окончательная формула вещества будет иметь вид: Аl2(SO4)3.Как видите, алгоритм составления химических формул очень прост. Он остается неизменным для любых других соединений.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
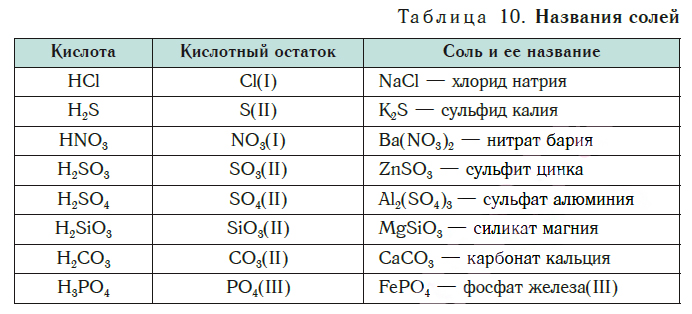
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
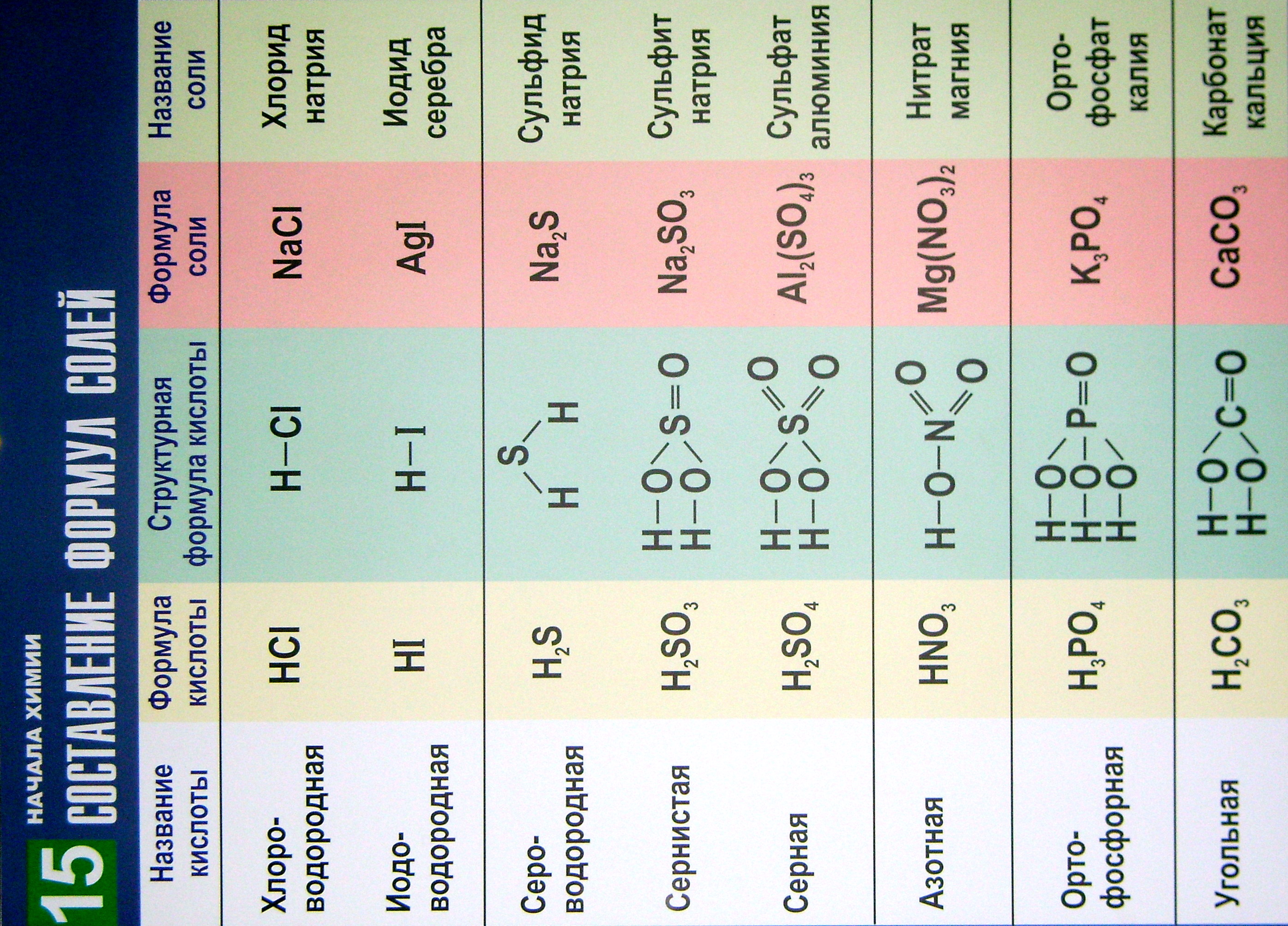
В таблице 15 приведены
названия часто встречающихся кислот,
их молекулярные и структурные формулы,
а также формульные единицы и названия
соответствующих солей.
Таблица помогает
составлять химические формулы солей
бескислородных и кислородсодержащих
кислот. Для образования химических
формул солей надо атомы водорода в
кислотах заменить на атомы металлов с
учётом их валентности.
Приведённые
названия кислот и солей соответствуют
принятой международной номенклатуре.
Название
бескислородных кислот образуются по
правилам для бинарных соединений.
Названия солей
начинаются с названия кислотного остатка
в именительном падеже. Это название
образуется из корня латинского названия
химического элемента, образующего
кислоту, и окончания «ат» или «ит»
в случае солей кислородсодержащих
кислот, для солей бескислородных кислот
– «ид».
Затем в солях бескислородных кислот
называется металл в родительном падеже.
Причём если атом металла может иметь
разную валентность, то её отмечают
римской цифрой (в скобках) после названия
химического элемента (без пробела).
Например, хлорид железа(II) и хлорид
олова(IV).
Включение в таблицу
названий молекулярных и структурных
формул часто встречающихся кислот
позволяет легко запомнить приведённые
в ней сведения.
Названия кислот
типа HnXOm
составляют с учётом валентности (степени
окисления) центрального атома:
-
атом X
имеет высшую (или единственную)
валентность (степень окисления): H2SО4
–
серная; HNО3
–
азотная; Н2СО3
– угольная; -
атом X
имеет промежуточные степени окисления:
H2SO3
–
сернистая; HNО2
–
азотистая; НСlО – хлорноватистая.
Таблица 15
Составление химических формул солей
16. Генетическая связь классов неорганических веществ
Таблица 16 показывает
в виде схемы взаимосвязь неорганических
веществ разных классов. Изучение свойств
веществ показывает, что можно при помощи
химических реакций переходить от простых
веществ к сложным и от одних сложных
веществ к другим. Связь между веществами
разных классов, основанная на их
взаимопревращениях и отражающая единство
их происхождения, называется
генетической.
Вещества по составу
подразделяются на простые и сложные.
Среди простых веществ различают
металлы и неметаллы. Эти две группы
веществ могут образовывать многочисленные
сложные вещества. К основным классам
неорганических соединений принадлежат
оксиды, гидроксиды и соли. Связь между
этими классами веществ обозначена при
помощи стрелок.
По таблице можно
проследить переходы металлов и неметаллов
в оксиды и гидроксиды:
|
металл |
+ |
О2 |
→ |
оксид, |
оксид металла |
+ |
Н2О |
→ |
гидроксид1 |
|
|
неметалл |
+ |
О2 |
→ |
оксид, |
оксид неметалла |
+ |
Н2О |
→ |
кислород |
Эти две цепочки
превращений аналогичны и роднят металлы
и неметаллы.
Однако надо
подчеркнуть, что простое вещество металл
является родоначальником сложных
веществ, обладающих оснóвными
свойствами (оснóвных оксидов и оснований).
Простое вещество неметалл выступает в
качестве родоначальника сложных
веществ, проявляющих кислотные свойства
(кислотных оксидов и кислот).
Различие свойств
кислотных и оснóвных оксидов, а также
свойств кислот и оснований приводит к
их взаимодействию друг с другом с
образованием солей. Таким образом, соли
генетически связаны с исходными
веществами – металлами и неметаллами
– посредством
их оксидов и гидроксидов.
Так как соли
представляют собой продукты реакций
кислот и оснований, то по составу
различают средние (нормальные), кислые
и оснóвные соли. Кислые соли содержат
в своём составе атомы водорода, оснóвные
– гидроксогруппы. Названия кислых солей
складываются из названий солей с
прибавлением слова «гидро», а
основных –
«гидроксо».
Существуют также
двойные соли (соли двух металлов), к ним
относят, например, алюмокалиевые квасцы
KA1(SО4)2
· 12Н2О,
смешанные соли NаСl · NаF, СаВrСl, комплексные
соли Nа2[Zn(ОН)4],
К3[Fе(СN)6],
К4[Fе(СN)6],
включая кристаллогидраты СuSО4
· 5Н2О
(медный купорос), Nа2SО4
· 10Н2О
(глауберова соль)
Необходимо научиться
составлять химические формулы гидроксидов
(кислородсодержащих кислот и оснований)
для атома элемента Э с валентностью
«n». Гидроксиды получают по реакции
присоединения воды к соответствующим
оксидам. При этом не имеет значение,
происходит ли эта реакция в реальных
условиях. Например, химическую формулу
угольной кислоты получают сложением
всех атомов по уравнению реакции
СО2
+ Н2О
= Н2СО3.
Химические формулы
метафосфорной,
пирофосфорной
и ортофосфорной
кислот составляют из формулы оксида
фосфора(V)1
и соответственно одной, двух и трёх
молекул воды:
Р2О5
+ Н2О
= 2НРО3;
Р2О5
+ 2Н2О
= Н4Р2О7;
Р2О5
+ 3Н2О
= 2Н3РО4.
Приведённая схема
взаимосвязи между классами неорганических
веществ не охватывает всего многообразия
химических соединений. В этой схеме в
качестве бинарных веществ выступают
оксиды,
Таблица 16
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #