CuSO4, Na2CO3, AlCl3, K3(PO4)
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию.
еакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-. Реагирует со щелочами с образованием гидроксида.

Напишите формулы веществ: сульфат меди (2),
иодид ртути (2), сульфид железа (3),
фосфат серебра, фторид марганца (2).
Светило науки — 215 ответов — 2559 раз оказано помощи
сульфат меди (II) СuSO4
иодид ртути (II) HgI2
Сульфид железа (III) Fe2S3
Фосфат серебра Ag3PO4
Фторид марганца (II) MnF2
Светило науки — 145 ответов — 1377 раз оказано помощи
1.сульфат меди(2) или медная соль серной кислты-CuSO4
2.иодид ртути (2) или соль металла ртути и иодистоводородной кислоты-HgI2
3.сульфид железа (3) или нестабилен-Fe2S3
4.фосфат серебра или соль металла серебра и ортофосфорной кислоты-Ag3PO4
5.фторид марганца (2)-MnF2
Найдите правильный ответ на вопрос ✅ «1) Запишите формулы солей: сульфата меди (2), карбоната натрия, хлорида алюминия, фосфата кальция Распредилите названные соли на …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » 1) Запишите формулы солей: сульфата меди (2), карбоната натрия, хлорида алюминия, фосфата кальция Распредилите названные соли на расстворимые и не расстворимые 2) Охарактерезуйте химические свойства солей на пример сульфат меди (2)
У этого термина существуют и другие значения, см. Сульфат меди.
| Сульфат меди(II) | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Меди(II) сульфат |
| Традиционные названия | Медный купорос |
| Химическая формула | CuSO4 |
| Физические свойства | |
| Молярная масса | 159,61 г/моль |
| Плотность | 3,60 г/см³ |
| Термические свойства | |
| Химические свойства | |
| pKa | 5·10−3 |
| Растворимость в воде | 31,6 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | Триклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| RTECS | GL8800000 |
Кристаллогидрат сульфата меди CuSO4 · 5H2O
Сульфат меди(II) (CuSO4) — медная соль серной кислоты, белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос.
Содержание
- 1 Получение
- 1.1 Очистка
- 2 Физические свойства
- 2.1 Строение кристаллогидрата
- 2.2 Термическое воздействие
- 2.3 Растворимость
- 3 Химические свойства
- 3.1 Диссоциация
- 3.2 Реакция замещения
- 3.3 Реакция с растворимыми основаниями (щелочами)
- 3.4 Реакция обмена с другими солями
- 3.5 Прочее
- 4 Применение
- 5 Токсикология
- 5.1 Токсикологические данные
- 5.2 Первая помощь при отравлении
- 5.3 Безопасность
- 6 Производители и поставщики
- 7 Нахождение в природе
- 8 См. также
- 9 Примечания
Получение
В промышленности получают растворением Cu и медных отходов в разб. H2SO4 при продувании воздуха; растворением CuO в H2SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.
В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Температура не должна превышать 60 градусов Цельсия, так как образуется побочный продукт:
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди (II) серной кислотой:
Очистка
Обычно технический сульфат меди загрязнен сульфатом железа (II). Реактив Ч. Д. А. не содержит ионов Fe2+. Реактив загрязнен изоморфически и его невозможно очистить простой перекристаллизацией. В нашем случае можно окислить Fe2+ до Fe3+ кипячением полученного раствора сульфата меди с PbO2. Fe2(SO4)3 не формирует изоморфическую смесь с сульфатом меди. После кипячения раствор фильтруют. А потом кристаллизацией получают чистый сульфат меди.
Физические свойства
Строение кристаллогидрата
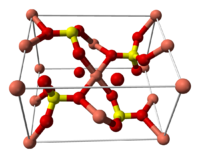
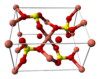
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
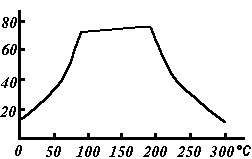
Растворимость CuSO4, г/100 г H2O
Термическое воздействие
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
Растворимость
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80-200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5·10−3.
Химические свойства
Диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu2+ окрашивает пламя в зеленый цвет.
Применение
Кристаллы сульфата меди (II), выращенные в домашних условиях
Монокристалл сульфата меди (II), выращенный в домашних условиях
Сульфат меди(II) — наиболее важная соль меди — часто служит исходным сырьём для получения других соединений. Например, гидроксида меди (II) — Cu(OH)2 — вещества, необходимого для качественных реакций на глюкозу, глицерин.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят обезвоживание этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордоской смеси с известковым молоком — от грибковых заболеваний и виноградной тли. Для этих целей сульфат меди (II) имеется в розничной торговле.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Токсикологические данные
Сульфат меди (II) относится к классу опасности 1 (малоопасное вещество), как вещество, содержащее сульфат-ион. С другой же стороны, на стограммовой упаковке сульфата меди, поступающей в розничную продажу, указан класс опасности 2 (высокоопасное вещество). Смертельная доза медного купороса составляет от 8 до 30 граммов для взрослого человека перорально (через рот)[1][2] . Летальная доза зависит от состояния здоровья человека, от его массы, от иммунитета именно к данному веществу и от других факторов.
Первая помощь при отравлении
При попадании вещества на кожу необходимо снять его ватой или куском ткани, затем обмыть прохладной водой с мылом. При попадании в глаза необходимо обильно промыть их проточной водой. При попадании через дыхательные пути нужно вывести пострадавшего на свежий воздух, прополоскать рот водой. При попадании в желудочно-кишечный тракт необходимо промыть желудок пострадавшего 0,1%-ым раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1-2 ложки, вызвать рвоту, дать мочегонное.
Безопасность
При обращении с сульфатом меди (II) в бытовых условиях стоит быть очень осторожным, иначе можно нанести непоправимый вред здоровью[3]. При приготовлении растворов желательно использовать резиновые или одноразовые полиэтиленовые перчатки, очки, резиновые сапоги и также настоятельно рекомендуется использовать респиратор. Ни в коем случае не использовать пищевую посуду. Приготовление раствора и использование медного купороса стоит производить в отсутствие детей и животных. Во время использования нельзя пить, курить, принимать пищу. После работы лицо и руки вымыть с мылом, прополоскать рот.
Хранить в сухом прохладном месте при температуре от −30 до +30 °C, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте. Запрещается хранение вещества в поврежденной упаковке.
Производители и поставщики
Сульфат меди (II), как средство от гниения, сорняков и т. д. находится в розничной продаже в супермаркетах и хозяйственных магазинах. Чаще всего на прилавках можно найти упаковку весом в 100 граммов. Производство данной продукции осуществляется компанией ЗАО Фирма «Август». Также медный купорос можно найти в химических магазинах разной фасовки. Обычно это пластиковые банки весом в 1 кг или полиэтиленовые мешки весом в 500 г.
Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO4 ∙ 5H2O
См. также
- Халькантит
- Сульфаты
- Медь
- Соединения меди
- Купорос
- Пищевые добавки
- Сульфат меди(I)
Примечания
- ↑ http://chemister.ru/Toxicology/toxic_dose.htm
- ↑ http://dna.com.ua/83-med.html
- ↑ http://vredno-ili-net.ru/ostalnoe/vreden-li-mednyj-kuporos.html
|
Соединения меди |
|---|
|
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) • |
|
Купоросы |
|---|
|
Ванадиевый купорос (VSO4·7H2) • Железный купорос (FeSO4·7H2O) • Кобальтовый купорос (CoSO4·7H2O) • Медный купорос (CuSO4·5H2O) • Никелевый купорос (NiSO4·7H2O) • Свинцовый купорос (PbSO4) • Хромовый купорос (CrSO4·7H2O) • Цинковый купорос (ZnSO4·7H2O) |
|
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2) |
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Сульфат меди(II) | |
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Меди(II) сульфат |
| Традиционные названия | Медный купорос |
| Химическая формула | CuSO4 |
| Молярная масса | 159,61 г/моль |
| Физические свойства | |
| Плотность вещества | 3,60 г/см³ |
| Термические свойства | |
| Температура плавления | 110 °C |
| Химические свойства | |
| pKa | 5·10-3 |
| Растворимость в воде | 31.6 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | Триклинная |
| Классификация | |
| номер CAS | 7758-98-7 |
| RTECS | GL8800000 |
Сульфат меди(II) — (CuSO4) — бесцветные кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения.
Сульфат меди CuSO4 · 5H2O
Содержание
- 1 Строение кристаллогидрата
- 2 Свойства
- 3 Применение
- 4 См. также
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42- по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Свойства
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650°С:
CuSO4 →(t) CuO + SO2↑ + O2↑
Растворимость CuSO4, г/100 г H2O
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5·10-3.
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Окрашивает огонь в зелёный цвет.
Кристаллы сульфата меди (II), выращенные в домашних условиях
Применение
Сульфат меди(II) наиболее важная соль меди, часто служит исходным сырьём для получения других соединений.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят осушку этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордосской смеси с известковым молоком — от грибковых заболеваний и виноградной тли.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а так же для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519 (консервант).
В природе изредка встречается минерал Халькантит, состав которого близок к CuSO4*5H2O
См. также
- Халькантит
- Сульфаты
- Медь
- Соединения меди
- Купорос
- Пищевые добавки
- Сульфат меди(I)
Wikimedia Foundation.
2010.










![mathsf{2CuSO_4 xrightarrow[]{^ot} 2CuO + 2SO_2 + O_2}](https://dic.academic.ru/dic.nsf/ruwiki/3b263af760ea620184767f698f4678c0.png)