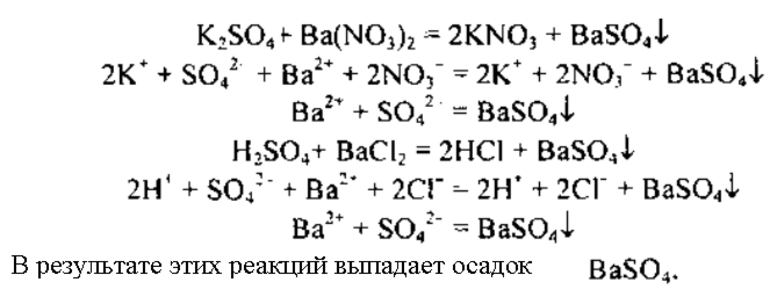| Сульфат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
сульфат калия |
| Традиционные названия | сернокислый калий |
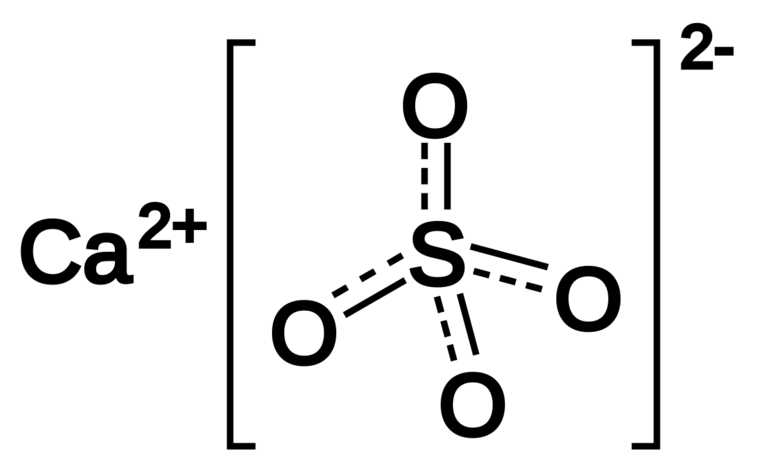
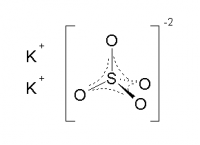
| Хим. формула | K2SO4 |
| Состояние | белое кристаллическое вещество |
| Молярная масса | 174.259 г/моль |
| Плотность | 2.66 г/см³ |
| Т. плав. | 1069 °C |
| Т. кип. | 1689 °C |
| Т. всп. | негорюч °C |
| Мол. теплоёмк. | 131,4 Дж/(моль·К) |
| Энтальпия образования | −1437,7 кДж/моль |
| Растворимость в воде |
(20 °C) 11.1 г/100 мл (25 °C) 12 г/100 мл (100 °C) 24 г/100 мл |
| Растворимость в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 |
| Кристаллическая структура | ромбическая |
| ГОСТ | ГОСТ 4568-95 ГОСТ 4145-74 |
| Рег. номер CAS | 7778-80-5 |
| PubChem | 24507 |
| Рег. номер EINECS | 231-915-5 |
| SMILES |
[O-]S(=O)(=O)[O-].[K+].[K+] |
| InChI |
1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 OTYBMLCTZGSZBG-UHFFFAOYSA-L |
| Кодекс Алиментариус | E515(i) |
| RTECS | TT5900000 |
| ChEBI | 32036 |
| ChemSpider | 22915 |
| ЛД50 | 6600 мг/кг |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Содержание
- 1 История
- 2 Нахождение в природе
- 3 Физические свойства
- 4 Получение
- 5 Химические свойства
- 6 Применение
- 7 Сведения о безопасности
История
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
Нахождение в природе
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Физические свойства
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный.
Получение
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
- Каинит — MgSO4·KCl·H2O
- Глазерит — 2K2SO4·Na2SO4
- Шёнит — K2SO4·MgSO4·6H2O
- Леонит — K2SO4·MgSO4·4H2O
- Лангбейнит — K2SO4·2MgSO4
- Полигалит — K2SO4·MgSO4·2CaSO4·2H2O
- Сингенит — K2SO4·CaSO4·H2O
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
- 2KCl + 2MgSO4 ⇄ K2SO4 ⋅ MgSO4 + MgCl2
- K2SO4 ⋅ MgSO4 + 2KCl ⇄ 2K2SO4 + MgCl2
- 2KCl + Na2SO4 ⇄ K2SO4+ 2NaCl
- 2KCl+ CaSO4 ⋅ 2H2O ⇄ K2SO4 + CaCl2 + 2H2O
- 2KCl + FeSO4 ⇄ K2SO4 + FeCl2
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
- 2KCl + H2SO4 →>100oC K2SO4 + 2HCl↑
Прокаливанием с углём минерала лангбейнита:
- K2SO4 ⋅ 2MgSO4 + 2C →>T K2SO4 + 2Mg↓ + 2CO2↑ + 2SO2↑
В лабораторной практике применяют следующие методы:
- из оксида калия:
- K2O + H2SO4 → K2SO4 + H2O
- вытеснением из слабых или неустойчивых кислот:
- K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O
- из щёлочи и разбавленной кислоты:
- 2KOH + H2SO4 → K2SO4 + 2H2O
- из гидросульфата калия:
- 2KHSO4 →240oC K2SO4 + H2SO4
- KHSO4 + KOH → K2SO4 + H2O
- 2KHSO4 + KCl →500oC K2SO4 + HCl↑
- окислением сульфида калия:
- K2S + 2O2 →>500oC K2SO4
- из надперекиси калия:
- 2KO2 + S →140oC K2SO4
- 2KO2 + SO2 →100oC K2SO4 + O2
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
- 4K2SO3 →600oC K2S + 3K2SO4
Окисление серы бихроматом калия:
- K2Cr2O7 + S →800−1000oC Cr2O3 + K2SO4
Взаимодействием сульфата аммония и гидроксид калия:
- (NH4)2SO4 + 2KOH → K2SO4 + 2NH3↑ + 2H2O
Химические свойства
Как соль двухосновной кислоты образует кислые соли:
- K2SO4 + H2SO4 ⇄ 2KHSO4
Как все сульфаты взаимодействует с растворимыми соединениями бария:
- K2SO4 + BaCl2 → 2KCl + BaSO4↓
Восстанавливается до сульфида:
- K2SO4 + 4H2 →600oC,Fe2O3 K2S + 4H2O
- K2SO4 + 4C →900oC K2S + 4CO
С оксидом серы образует пиросульфат:
- K2SO4+ SO3 → K2S2O7
Применение
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии. В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Сведения о безопасности
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
From Wikipedia, the free encyclopedia

Arcanite |
|

|
|
| Names | |
|---|---|
| Other names
Potassium sulphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.029.013 |
| EC Number |
|
| E number | E515(i) (acidity regulators, …) |
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
K2SO4 |
| Molar mass | 174.259 g/mol |
| Appearance | White solid |
| Odor | odorless |
| Density | 2.66 g/cm3[1] |
| Melting point | 1,069[2] °C (1,956 °F; 1,342 K) |
| Boiling point | 1,689 °C (3,072 °F; 1,962 K) |
|
Solubility in water |
111 g/L (20 °C) 120 g/L (25 °C) 240 g/L (100 °C) |
|
Solubility product (Ksp) |
1.32 (120 g/L) |
| Solubility | slightly soluble in glycerol insoluble in acetone, alcohol, CS2 |
|
Magnetic susceptibility (χ) |
−67.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.495 |
| Structure | |
|
Crystal structure |
orthorhombic |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Irritant |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H318 |
|
Precautionary statements |
P280, P305+P351+P338, P310 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
6600 mg/kg (oral, rat)[3] |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Other anions |
Potassium selenate Potassium tellurate |
|
Other cations |
Lithium sulfate Sodium sulfate Rubidium sulfate Caesium sulfate |
|
Related compounds |
Potassium hydrogen sulfate Potassium sulfite Potassium bisulfite Potassium persulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium sulfate (US) or potassium sulphate (UK), also called sulphate of potash (SOP), arcanite, or archaically potash of sulfur, is the inorganic compound with formula K2SO4, a white water-soluble solid. It is commonly used in fertilizers, providing both potassium and sulfur.
History[edit]
Potassium sulfate (K2SO4) has been known since early in the 14th century. It was studied by Glauber, Boyle, and Tachenius. In the 17th century, it was named arcanuni or sal duplicatum, as it was a combination of an acid salt with an alkaline salt. It was also known as vitriolic tartar and Glaser’s salt or sal polychrestum Glaseri after the pharmaceutical chemist Christopher Glaser who prepared it and used medicinally.[4][5]
Known as arcanum duplicatum («double secret») or panacea duplicata in pre-modern medicine, it was prepared from the residue (caput mortuum) left over from the production of aqua fortis (nitric acid, HNO3) from nitre (potassium nitrate, KNO3) and oil of vitriol (sulphuric acid, H2SO4) via Glauber’s process:
- 2 KNO3 + H2SO4 → 2 HNO3 + K2SO4
The residue was dissolved in hot water, filtered, and evaporated to a cuticle. It was then left to crystallise. It was used as a diuretic and sudorific.[6]
According to Chambers’s Cyclopedia, the recipe was purchased for five hundred thalers by Charles Frederick, Duke of Holstein-Gottorp. Schroder, the duke’s physician, wrote wonders of its great uses in hypochondriacal cases, continued and intermitting fevers, stone, scurvy, and more.[6]
Natural resources[edit]
The mineral form of potassium sulfate, arcanite, is relatively rare. Natural resources of potassium sulfate are minerals abundant in the Stassfurt salt. These are cocrystallizations of potassium sulfate and sulfates of magnesium, calcium, and sodium.
Relevant minerals are:
- Kainite, KMg(SO4)·Cl·3H2O
- Schönite (now known as picromerite), K2SO4·MgSO4·6H2O
- Leonite, K2SO4·MgSO4·4H2O
- Langbeinite, K2Mg2(SO4)3
- Aphthitalite (previously known as glaserite), K3Na(SO4)2
- Polyhalite, K2SO4·MgSO4·2CaSO4·2H2O
The potassium sulfate can be separated from some of these minerals, like kainite, because the corresponding salt is less soluble in water.
Kieserite, MgSO4·H2O, can be combined with a solution of potassium chloride to produce potassium sulfate.
Production[edit]
Approximately 1.5 million tons were produced in 1985, typically by the reaction of potassium chloride with sulfuric acid, analogous to the Mannheim process for producing sodium sulfate.[7] The process involves intermediate formation of potassium bisulfate, an exothermic reaction that occurs at room temperature:
- KCl + H2SO4 → HCl + KHSO4
The second step of the process is endothermic, requiring energy input:
- KCl + KHSO4 → HCl + K2SO4
Structure and properties[edit]
Two crystalline forms are known. Orthorhombic β-K2SO4 is the common form, but it converts to α-K2SO4 above 583 °C.[7] These structures are complex, although the sulfate adopts the typical tetrahedral geometry.[8]
-
Structure of β-K2SO4.
-
Coordination sphere of one of two types of K+ site.
-
SO4 environment in β-K2SO4.
It does not form a hydrate, unlike sodium sulfate. The salt crystallizes as double six-sided pyramids, classified as rhombic. They are transparent, very hard and have a bitter, salty taste. The salt is soluble in water, but insoluble in solutions of potassium hydroxide (sp. gr. 1.35), or in absolute ethanol.
Uses[edit]
The dominant use of potassium sulfate is as a fertilizer. K2SO4 does not contain chloride, which can be harmful to some crops. Potassium sulfate is preferred for these crops, which include tobacco and some fruits and vegetables. Crops that are less sensitive may still require potassium sulfate for optimal growth if the soil accumulates chloride from irrigation water.[9]
The crude salt is also used occasionally in the manufacture of glass. Potassium sulfate is also used as a flash reducer in artillery propellant charges. It reduces muzzle flash, flareback and blast overpressure.
It is sometimes used as an alternative blast media similar to soda in soda blasting as it is harder and similarly water-soluble.[10]
Potassium sulfate can also be used in pyrotechnics in combination with potassium nitrate to generate a purple flame.
A 5% solution of potassium sulfate was used in the beginning of the 20th century as a topical mosquito repellent.[citation needed]
Reactions[edit]
Acidification[edit]
Potassium hydrogen sulfate (also known as potassium bisulfate), KHSO4, is readily produced by reacting K2SO4 with sulfuric acid. It forms rhombic pyramids, which melt at 197 °C (387 °F). It dissolves in three parts of water at 0 °C (32 °F). The solution behaves much as if its two congeners, K2SO4 and H2SO4, were present side by side of each other uncombined; an excess of ethanol the precipitates normal sulfate (with little bisulfate) with excess acid remaining.
The behavior of the fused dry salt is similar when heated to several hundred degrees; it acts on silicates, titanates, etc., the same way as sulfuric acid that is heated beyond its natural boiling point does. Hence it is frequently used in analytical chemistry as a disintegrating agent. For information about other salts that contain sulfate, see sulfate.
References[edit]
- ^ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0-07-049439-8.
- ^ Windholtz, M; Budavari, S, eds. (1983). The Merck Index. Rahway, New Jersey: Merck & Co.
- ^ Chambers, Michael. «Potassium sulfate RN: 7778-80-5». ChemIDplus. United States National Library of Medicine.
- ^ De Milt, Clara (1942). «Christopher Glaser». Journal of Chemical Education. 19 (2): 53. Bibcode:1942JChEd..19…53D. doi:10.1021/ed019p53.
- ^ van Klooster, H. S. (1959). «Three centuries of Rochelle salt». Journal of Chemical Education. 36 (7): 314. Bibcode:1959JChEd..36..314K. doi:10.1021/ed036p314.
- ^ a b
Chambers, Ephraim, ed. (1728). «Arcanum duplicatum». Cyclopædia, or an Universal Dictionary of Arts and Sciences. Vol. 1 (1st ed.). James and John Knapton, et al. p. *125.
- ^ a b Schultz, H.; Bauer, G.; Schachl, E.; Hagedorn, F.; Schmittinger, P. (2005). «Potassium Compounds». Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
- ^ Gaultier, M.; Pannetier, G. (1968). «Structure cristalline de la forme ‘basse température’ du sulfate de potassium K2SO4-beta» [Crystal structure of the «low temperature» β-form of potassium sulfate]. Bulletin de la Société Chimique de France (in French). 1: 105–112.
- ^ United Nations Industrial Development Organization; International Fertilizer Development Center (1998). Fertilizer manual (3rd ed.). Dordrecht, Netherlands: Kluwer Academic. ISBN 978-0-7923-5032-3.
- ^ «Super K (Potassium Sulphate)». American Surface Prep. Archived from the original on 9 December 2014. Retrieved 7 December 2014.
External links[edit]
- mindat.org: Arcanite
- webmineral: Arcanite
Физические свойства
Сульфат калия K2SO4 — соль щелочного металла калия и серной кислоты. Белый, термически устойчивый. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 174,26; относительная плотность для тв. и ж. состояния d = 2,662; tпл = 1074º C; tкип > 2000º C
Способ получения
1. В результате взаимодействия при надпероксида калия и серы образуется сульфат калия:
2KO2 + S = K2SO4
2. Оксид калия реагирует с оксидом серы. В результате реакции образуется сульфат калия:
K2O + SO3 = K2SO4
3. В результате реакции между гидроксидом калия и серной кислотой происходит образование сульфата калия и воды:
2KOH + H2SO4 = K2SO4 + 2H2O
4. Гидросульфат калия при 240 ºС разлагается с образованием сульфата калия и серной кислоты:
2KHSO4 = K2SO4 + H2SO4
5. При взаимодействии концентрированного гидроксида калия и гидросульфата калия образуется сульфат калия и вода:
KHSO4 + KOH = K2SO4 + H2O
6. Сульфат калия взаимодействует с хлоридом калия при 450–700º C с образованием сульфата калия и соляной кислоты:
KHSO4 + KCl = K2SO4 + HCl
7. Твердый хлорид калия реагирует с концентрированной серной кислотой в состоянии кипения. В результате реакции образуется сульфат калия и газ хлороводород:
2KCl + H2SO4 = K2SO4 + 2HCl↑
8. При температуре выше 500º С твердый сульфид калия взаимодействует с кислородом, образуя сульфат калия:
K2S + 2O2 = K2SO4
Качественная реакция
Качественная реакция на сульфат калия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат калия образует сульфат бария и хлорид калия:
K2SO4 + BaCl2 = BaSO4↓ + 2KCl
Химические свойства
1. Сульфат калия может реагировать с простыми веществами:
1.1. Сульфат калия реагирует с углеродом при температуре 900º C. При этом образуются сульфид калия и угарный газ:
K2SO4 + 4C = K2S + 4CO
1.2. С водородом сульфат калия реагирует при температуре 600º C, в присутствии катализатора Fe2O3 с образованием сульфида калия и воды:
K2SO4 + 4H2 = K2S + 4H2O
2. Сульфат калия вступает в реакцию со многими сложными веществами:
2.1. Сульфат калия взаимодействует с гидроксидами:
2.1.1. Сульфат калия реагирует с гидроксидом бария с образованием гидроксида калия и сульфата бария:
K2SO4 + Ba(OH)2 = BaSO4↓ + 2KOH
2.2. Сульфат калия может реагировать с кислотами:
2.2.1. При взаимодействии с концентрированной серной кислотой твердый сульфат калия образует гидросульфат калия:
K2SO4 + H2SO4 = 2KHSO4
2.3. Сульфат калия может взаимодействовать с оксидами:
2.3.1. Сульфат калия реагирует с оксидом серы (VI). Взаимодействие сульфата калия с оксидом серы (VI) приводит к образованию пиросульфата калия:
K2SO4 + SO3 = K2S2O7
2.4. Сульфат калия реагирует с солями:
2.4.1. Сульфат калия взаимодействует с хлоридом бария. При этом образуются хлорид калия и осадок сульфат бария:
K2SO4 + BaCl2 = BaSO4↓ + 2KCl
Описание вещества
Это соединение было известно еще в Средние века. Представляет собой соль калия и серной кислоты. Основные свойства:
- Молярная масса (численно равна относительной молекулярной массе) — 174,26 г/моль.
- Плотность — 2,66 г/см3.
- Температура плавления — 1069 °C.
- Растворимость в воде — 12г/100г (при нормальных условиях).
- Структурная формула (графическое строение) — ромбическая сингония.
Сингония — определенные элементы симметрии, описывающие порядок и расположение атомов в молекуле.
Сульфат калия (химическая формула K2SO4) — бесцветные кристаллы, хорошо растворимые в воде. В чистом виде (без примесей) в природе встречается редко — есть только несколько месторождений, расположенных в Польше и США (Калифорния). Также в небольших количествах его обнаруживали и в России (Крым, Северо-Восточный регион).
Калия сульфат содержится в водах соленых озер. Примеси этого вещества есть во многих минералах:
- леонит;
- глазерит;
- полигалит, и некоторых других.
Сернокислый калий не подвержен гидролизу. Он не растворяется в спирте (C2H5OH — этанол) и в концентрированных щелочах.
Получение соединения
Из-за того, что вещество в природе встречается редко, но имеет большое промышленное значение, методам получения K2SO4 уделяется значительное внимание. Основные производственные способы синтеза заключаются в проведении обменных реакций хлорида кальция с солями серной кислоты:
2KCl + 2MgSO4 → K2SO4 + 2MgCl2.
2KCl + Na2SO4 → K2SO4 + 2NaCl.
2KCl + FeSO4 → K2SO4 + FeCL2.
Химически чистое соединение получают воздействием серной кислотой на твердый хлорид:
2KCl + H2SO4 → K2SO4 + HCl.
В лабораториях пользуются немного другими способами, позволяющими получить нужное соединение. Основные из них:
- При взаимодействии оксида и серной кислоты: K2O + H2SO4 → k2so4 + H2O.
- Воздействием на щелочь разбавленной кислоты: 2KOH + H2SO4 → K2SO4 + 2H2O.
- Горением сульфида: K2S + 2O2 → K2SO4. Эта реакция — окисление — проводится при высоких температурах (500°C).
- Взаимодействие кислых солей с серной кислотой (реакция вытеснения): K2CO3 + H2SO4 → K2SO4 + CO2 (газ) + H2O.
- Разложение гидросульфата калия: 2KHSO4 → k2so4 + h2o. Реакция протекает при температуре порядка 240 °C.
- При окислении соли сернистой кислоты: 4K2SO3 → K2S + 3K2SO4. Реакция проводится в условиях высоких температур (около 600°C).
- Реакцией взаимодействия диоксида серы с надперекисью калия при температуре 100°C: KO2 + SO2 → R2SO4.
- Окисление серы бихроматом: S + K2Cr2O7 → K2SO4 + Cr2O3. Реакция протекает при t = 1000 °C.
- Окисление сульфита перманганатом калия (марганцовка) и серной кислотой: 5K2SO3 + 2KMnO4 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O.
- Взаимодействие сульфата аммония и гидроксида калия: (NH4)2SO4 + 2KOH → K2SO4 + 2NH3 (газ) + 2H2O.
Существует достаточно большое количество реакций, в результате которых будет образовываться сернокислый калий (другое название соединения). Преимуществом выбора того или иного метода будет химическая чистота получаемого вещества и экономическая целесообразность.
Химические свойства
С точки зрения химии, соединение ведет себя как типичная средняя соль. Для него характерны такие реакции:
- Взаимодействует с солями бария: BaCl2 + K2SO4 → 2KCl + BaSO4 (осадок).
- Реагирует с кислотами: K2SO4 + H2SO4 → 2KHSO4 (гидросульфат калия — кислая соль).
- Вступает в реакцию с ангидридом серной кислоты (серным газом — оксидом серы с валентностью 6): K2SO4 + SO3 → K2S2O7 (пиросульфат калия).
- Участвует в реакциях восстановления с образованием сульфида калия: K2SO4 + 4C → K2S + 4CO (угарный газ), реакция проводится при высокой температуре (900°C); K2SO4 + 4H2 → K2S + 4H2O — взаимодействие протекает при t = 600 °C и при участии катализатора, в качестве которого используется железный сурик (трехвалентный оксид железа Fe2O3).
Примечание: кислотный остаток SO4 (сульфат-анион — не путать с СО4) является двухвалентным, поэтому, чтобы правильно составить уравнения реакций, нужно этот момент учитывать — формула сернокислого калия пишется как K2SO4, а не KSO4.
Промышленное применение
Аграрная отрасль — основной потребитель калийной селитры (другое название соединения). Оно используется в качестве удобрения для подкормки почвы. Ценность продукта заключается в его способности ускорять обменные процессы в клетках растений, улучшать их сопротивляемость различным грибковым поражениям.
Недостаток калия (K) приводит к тому, что у растений нарушается углеводный баланс, это влечет за собой уменьшение образования крахмала и сахаров, снижение устойчивости растений к заболеваниям. Определить нехватку элемента можно и по внешним признакам:
- Края листьев приобретают желтоватую окраску, теряют свой естественный цвет и «выгорают».
- На нижней поверхности листьев появляются пятна.
- Стебель растения становится безжизненным, пожухлым, хрупким.
- Замедляется рост.
- Снижается урожайность.
- Ухудшаются вкусовые качества плода.
Причем недостаток K может возникнуть из-за самих растений: некоторые из них слишком активно «вытягивают» его из почвы. В таких случаях внесение удобрения — необходимость.
Еще один вариант применения сернокислого калия — в качестве исходного сырья при получении гидросульфата (KHSO4). Это соединение требуется во многих отраслях промышленности:
- Как составной компонент флюса в металлургии.
- При производстве красителей (сульфирующий компонент).
- В ювелирном деле (отбеливатель).
Незаменим он и для науки: химики-аналитики используют KHSO4, чтобы перевести некоторые соединения в легкорастворимые формы.
В странах Европейского союза сульфат калия используют как пищевую добавку биодобавку — регулятор кислотности (стабилизатор) при производстве алкогольных напитков, добавляют в дрожжевые закваски при хлебопечении и даже иногда заменяют им соль в диетических продуктах.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Сульфат калия
Брутто-формула:
K2O4S
CAS# 7778-80-5
Категории:
Неорганические соли
PubChem CID: 24507
| ChemSpider ID: 22915
| CHEBI:32036
| CHEMBL2021424
| CB9854321
Названия
Русский:
- Сернокислый калий
- Сульфат калия(IUPAC) [Wiki]
- калия сульфат
English:
- Dipotassium sulfate
- E 515
- Potassium sulfate [Wiki]
- Sulfuric acid dipotassium salt
- dipotassium;sulfate(IUPAC)
German:
- Kalium sulfuricum
- Kaliumsulfat [Wiki]
- Schwefelsaures Kalium
- Tartarus vitriolatus
العربية:
- كبريتات البوتاسيوم [Wiki]
Español:
- Arcanita
- Sulfato de potasio(IUPAC) [Wiki]
- Sulfato potásico
French:
- Dipotassium sulfate
- Sulfate de potassium(IUPAC) [Wiki]
Italiano:
- Solfato di potassio [Wiki]
日本語:
- 硫酸カリウム [Wiki]
中文:
- 硫酸钾 [Wiki]
Варианты формулы:
K2SO4
K(+)2S(+6)O(-2)4
K^+O`^-/S<_qq4O><_pp4O>/O^-K^+
Вещества, имеющие отношение…
Анион:
Сульфаты
Химический состав
Реакции, в которых участвует Сульфат калия
-
5SO2 + 2KMnO4 + 2H2O -> 2H2SO4 + 2MnSO4 + K2SO4
-
8SO3^2- + 2KMnO4 -> 5SO4^2- + 2MnSO4 + K2SO4
-
2Cu(OH)2 + K2S2O6(O2) + 2KOH -> Cu2O3 + 2K2SO4 + 3H2O
-
2K2S2O6(O2) + 2H2O «80°C»—> 2K2SO4 + 2H2SO4 + O2″|^»
-
2AgNO3 + {M}2SO4 -> Ag2SO4 + 2{M}NO3
, где M =
Na K
И ещё 134 реакции…