Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 26 июля 2016;
проверки требует 1 правка.
| Сульфат лития | |
|
|
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
Сульфат лития |
| Традиционные названия | Сернокислый литий |
| Хим. формула | Li2SO4 |
| Физические свойства | |
| Молярная масса | 109,94 г/моль |
| Плотность | 2,221 г/см³ |
| Термические свойства | |
| Т. плав. | 859 °C |
| Мол. теплоёмк. | 117,57 Дж/(моль·К) |
| Энтальпия образования | -1436,0 кДж/моль |
| Удельная теплота плавления | 9,3 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 34,320; 29,2100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10377-48-7 |
| PubChem | 66320 |
| Рег. номер EINECS | 233-820-4[1] |
| SMILES |
[Li+].[Li+].[O-]S(=O)(=O)[O-] |
| InChI |
1S/2Li.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 INHCSSUBVCNVSK-UHFFFAOYSA-L |
| RTECS | OJ6419000 |
| ChemSpider | 59698 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Сульфат лития — соль щелочного металла лития и серной кислоты. Химическая формула Li2SO4. Образует кристаллогидрат Li2SO4•H2O.
Получение[править | править вики-текст]
- Кристаллогидрат сульфата лития получают взаимодействием гидроксида или карбоната лития с серной кислотой с последующим упариванием:
- Безводную соль получают нагреванием моногидрата выше 500°С.
Физические свойства[править | править вики-текст]
Безводный сульфат лития образует три кристаллические модификации:
- α-форма — устойчивая при обычных условиях модификация с моноклинной решёткой, пространственная группа P 21/c, параметры a = 0,844 нм, b = 0,495 нм, c = 0,824 нм, β = 107,9°, Z = 4.
- β-форма — гексагональная решётка
- γ-форма — при температуре выше 575°С образует кубическую решётку, пространственная группа I 43m, a = 0,707 нм, Z = 4.
Кристаллогидрат образует кристаллы моноклинной сингонии, пространственная группа P 21, параметры a = 0,814 нм, b = 0,483 нм, c = 0,543 нм, β = 107,58°, Z = 4.
Химические свойства[править | править вики-текст]
- Взаимодействует с серной кислотой с образованием гидросульфата лития:
- Взаимодействием с соединениями бария удобно получать различные соединения лития:
- При нагревании с водородом, аммиаком или углеродом (кокс) восстанавливается до сульфида лития:
Применение[править | править вики-текст]
Сульфат лития используется для изготовления головок детекторов в ультразвуковой дефектоскопии и как компонент люминофоров. Также он используется как средство для лечения маниакально-депрессивного психоза. Это вещество — пьезоэлектрик.
Литература[править | править вики-текст]
- Patnaik, P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8.
- Tom Jackson. Lithium. — Marshall Cavendish, 2006. — P. 13. — 32 p. — ISBN 0761421998.
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • актиния(III) (Ac2(SO4)3) • алюминия (Al2(SO4)3) • алюмонатрия (NaAl(SO4)2) • аммония ((NH4)2SO4) • бария (BaSO4) • бериллия (BeSO4) • ванадила (VOSO4) • ванадия(III) (V2(SO4)3) • висмута (Bi2(SO4)3) • гидроксиаммония ((NH3OH)2SO4) • железа(II) (FeSO4) • железа(III) (Fe2(SO4)3) • индия(III) (In2(SO4)3) • иридия(III) (Ir2(SO4)3) • кадмия (CdSO4) • калия (K2SO4) • кальция (CaSO4) • кобальта(II) (CoSO4) • кобальта(III) (Co2(SO4)3) • лития (Li2SO4) • магния (MgSO4) • марганца(II) (MnSO4) • марганца(III) (Mn2(SO4)3) • меди(I) (Cu2SO4) • меди(II) (CuSO4) • натрия (Na2SO4) • никеля(II) (NiSO4) • олова(II) (SnSO4) • празеодима (Pr2(SO4)3) • ртути(I) (Hg2SO4) • ртути(II) (HgSO4) • свинца(II) (PbSO4) • серебра (Ag2SO4) • стронция (SrSO4) • сурьмы (Sb2(SO4)3) • таллия(I) (Tl2SO4) • таллия(III) (Tl2(SO4)3) • тетраамминмеди(II) (Cu(NH3)4SO4) • титана(III) (Ti2(SO4)3) • титана(IV) (Ti(SO4)2) • урана (U(SO4)2) • уранила (UO2SO4) • хрома(III) (Cr2(SO4)3) • хрома(III)-калия (KCr(SO4)2) цезия (Cs2SO4) • церия(IV) (Ce(SO4)2) • цинка (ZnSO4) • циркония (Zr(SO4)2) |
- ↑ LITHIUM SULFATE // FDA Substance Registration System — Unique Ingredient Identifier / Food and Drug Administration
From Wikipedia, the free encyclopedia

|
|
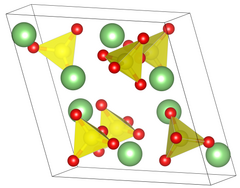
__ Li+ __ S6+ __ O2− |
|

|
|
| Names | |
|---|---|
| IUPAC name
Lithium sulfate |
|
| Other names
Lithium sulphate |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.734 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties[1] | |
|
Chemical formula |
Li2SO4 |
| Molar mass | 109.94 g/mol |
| Appearance | White crystalline solid, hygroscopic |
| Density | 2.221 g/cm3 (anhydrous) 2.06 g/cm3 (monohydrate) |
| Melting point | 859 °C (1,578 °F; 1,132 K) |
| Boiling point | 1,377 °C (2,511 °F; 1,650 K) |
|
Solubility in water |
monohydrate: 34.9 g/100 mL (25 °C) 29.2 g/100 mL (100 °C) |
| Solubility | insoluble in absolute ethanol, acetone and pyridine |
|
Magnetic susceptibility (χ) |
−-40.0·10−6 cm3/mol |
|
Refractive index (nD) |
1.465 (β-form) |
| Structure[2] | |
|
Crystal structure |
Primitive monoclinic |
|
Space group |
P 21/a, No. 14 |
|
Lattice constant |
a = 8.239 Å, b = 4.954 Å, c = 8.474 Å α = 90°, β = 107.98°, γ = 90°[2] |
|
Lattice volume (V) |
328.9 Å3 |
|
Formula units (Z) |
4 |
|
Coordination geometry |
Tetrahedral at sulfur |
| Thermochemistry | |
|
Heat capacity (C) |
1.07 J/g K |
|
Std molar |
113 J/mol K |
|
Std enthalpy of |
−1436.37 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
-1324.7 kJ/mol |
| Hazards | |
| NFPA 704 (fire diamond) |
2 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
613 mg/kg (rat, oral)[3] |
| Related compounds | |
|
Other anions |
Lithium chloride |
|
Other cations |
Sodium sulfate
Potassium sulfate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lithium sulfate is a white inorganic salt with the formula Li2SO4. It is the lithium salt of sulfuric acid.
Properties[edit]
Laboratory derivation of Lithium Sulfate
Physical properties[edit]
Lithium sulfate is soluble in water, though it does not follow the usual trend of increasing solubility of most salts with temperature. To the contrary, its solubility in water decreases with increasing temperature, as its dissolution is an exothermic process. This relatively unusual property, also called retrograde solubility, is shared with few inorganic compounds, such as calcium hydroxide (portlandite, an important mineral phase of hydrated cement paste), the calcium sulfates (gypsum, bassanite, and anhydrite) and lanthanoid sulfates whose dissolution reactions are also exothermic. The retrograde solubility is common for gases dissolution in water, but less frequently encountered for the dissolution of solids. Calcium carbonate also exhibits a retrograde solubility, but it also depends on the behavior of CO2 dissolution in the calco-carbonate equilibria.
Lithium sulfate crystals, being piezoelectric, are also used in ultrasound-type non-destructive testing because they are very efficient sound receivers. However, they do suffer in this application because of their water solubility.
Since it has hygroscopic properties, the most common form of lithium sulfate is lithium sulfate monohydrate. Anhydrous lithium sulfate has a density of 2.22 g/cm3 but, weighing lithium sulfate anhydrous can become cumbersome as it must be done in a water lacking atmosphere.
Lithium sulfate has pyroelectric properties. When aqueous lithium sulfate is heated, the electrical conductivity also increases. The molarity of lithium sulfate also plays a role in the electrical conductivity; optimal conductivity is achieved at 2 M and then decreases.[4]
When solid lithium sulfate is dissolved in water it has an endothermic disassociation. This is different from sodium sulfate which has an exothermic disassociation. However, the exact energy of disassociation is difficult to quantify as it seems also to depend on the quantity (number of mols) of the salt added to water. Small amounts of dissolved lithium sulfate induce a much greater temperature change per mol than large amounts.[5]
Crystal properties[edit]
Lithium sulfate has two different crystal phases. In common phase II form, Lithium sulfate has a sphenoidal monoclinic crystal system that has edge lengths of a = 8.23Å b = 4.95Å c = 8.47Å β = 107.98°. When lithium sulfate is heated passed 130 °C it changes to a water free state but retains its crystal structure. It is not until 575 °C when there is a transformation from phase II to phase I. The crystal structure changes to a face centered cubic crystal system, with an edge length of 7.07Å.[6] During this phase change, the density of lithium sulfate changes from 2.22 to 2.07 g/cm3.[7]
Uses[edit]
Lithium sulfate is used to treat bipolar disorder (see lithium pharmacology).
Lithium sulfate is researched as a potential component of ion conducting glasses. Transparent conducting film is a highly investigated topic as they are used in applications such as solar panels and the potential for a new class of battery. In these applications, it is important to have a high lithium content; the more commonly known binary lithium borate (Li₂O · B₂O₃) is difficult to obtain with high lithium concentrations and difficult to keep as it is hygroscopic. With the addition of lithium sulfate into the system, an easily produced, stable, high lithium concentration glass is able to be formed. Most of the current transparent ionic conducting films are made of organic plastics, and it would be ideal if an inexpensive stable inorganic glass could be developed.[8]
Lithium sulfate has been tested as an additive for Portland cement to accelerate curing with positive results. Lithium sulfate serves to speed up the hydration reaction (see Cement) which decreases the curing time. A concern with decreased curing time is the strength of the final product, but when tested, lithium sulfate doped Portland cement had no observable decrease in strength.[9]
Lithium-ion batteries[edit]
Primary lithium sulphate (PLS)[10] (Li
2SO
4 · H
2O) containing over 80% lithium is a useful chemical for the production of lithium hydroxide for the lithium-ion battery materials supply chain. It is a less reactive material than LiOH, and hence can be more easily stored and transported.[10][11]
Feedstock of hard-rock spodumene concentrate is processed by acid roasting, followed by water leaching, achieving a lithium recovery of 84-88%. Evaporation is then applied to the purified leach solution resulting in a primary lithium sulphate solid product made up mostly of lithium sulphate monohydrate (Li
2SO
4 · H
2O).
Medication[edit]
Lithium ion (Li+) is used in psychiatry for the treatment of mania, endogenous depression, and psychosis, and also for treatment of schizophrenia. Usually lithium carbonate (Li
2CO
3) is applied, but sometimes lithium citrate (Li
3C
6H
5O
7), lithium sulfate or lithium oxy-butyrate are used as alternatives.[12] Li+ is not metabolized. Because of Li+ chemical similarity to sodium (Na+) and potassium (K+) cations, it may interact or interfere with the biochemical pathways of these substances and displace these cations from intra- or extracellular compartments of the body. Li+ seems to be transported out of nerve and muscle cells by the active sodium pump, although less efficiently.
Lithium sulfate has a rapid gastrointestinal absorption rate (within a few minutes), and complete following oral administration of tablets or the liquid form.[12] It quickly diffuses into the liver and kidneys but requires 8–10 days to reach a body equilibrium. Li+ produces many metabolic and neuroendocrine changes, but no conclusive evidence favors one particular mode of action.[12] For example, Li+ interacts with neurohormones, particularly the biogenic amines, serotonin (5-hydroxy tryptamine) and norepinephrine, which provides a probable mechanism for the beneficial effects in psychiatric disorders, e.g. manias. In the central nervous system (CNS), Li+ affects nerve excitation, synaptic transmission, and neuronalmetabolism.[13] Li+ stabilizes serotoninergic neurotransmission.
Organic chemistry synthesis[edit]
Lithium sulfate is being used as a catalyst for the elimination reaction for transforming n-butyl bromide to 1-butene at close to 100% yields at a range of 320 °C to 370 °C. The yields of this reaction change dramatically if heated beyond this range as higher yields of 2-butene is formed.[14]
References[edit]
- ^
Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8. - ^ a b Nord, A. G. (1976). «Crystal structure of β-Li2SO4». Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 32 (3): 982–983. doi:10.1107/S0567740876004433.
- ^ Chambers, Michael. «ChemIDplus — 10377-48-7 — INHCSSUBVCNVSK-UHFFFAOYSA-L — Lithium sulfate — Similar structures search, synonyms, formulas, resource links, and other chemical information». chem.sis.nlm.nih.gov. Retrieved 12 October 2018.
- ^ Angel C.; Sobron F.; Jose I. (1995). Density, viscosity, and electrical conductivity of aqueous solutions of lithium sulfate. J. Chem. Eng., 40, 987–991.
- ^ Thomson T. P.; Smith D. E.; Wood R. H. (1974). Enthalpy of dilution of aqueous Na2SO4 and Li2SO4. J. Chem. Eng., 19, 386–388.
- ^ Rao C. N. R.; Prakash B. Crystal Structure Transformations in Inorganic sulfates, Phosphates, Perchlorates, and Chromates. NSRDS. 1975, 56, 2-12
- ^ Fordland, T.; Keogh, M. J. The structure of the High temperature Modification of lithium Sulfate. 1957, 565-567
- ^ E. I. Chemists; M. A. Karakassides; G. D. Chryssikos. A Vibrational Study of Lithium Sulfate Based Fast Ionic Conducting Borate Glasses. J. Phys. Chem. 1986, 90 4528-4533
- ^ Yuhai D.; Changing Z.; Xiaosheng W. Influence of lithium sulfate addition on the properties of Portland cement paste. Construction and Building 2014, 50, 457-462
- ^ a b «Metallurgical test work confirms Manono Primary Lithium Sulphate suitable for battery production feedstock» (PDF). AVZ Minerals Limited. 13 January 2021. Retrieved 25 March 2021. CS1 maint: url-status (link)
- ^ «AVZ Minerals Limited». AVZ Minerals. Retrieved 25 March 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ a b c Haddad, L.M., Winchester, J.F. Clinical Management of Poisoning and Drug Overdose. 1990 2nd ed, 656-665
- ^ Poisindex, Thomson Micromedex 2005
- ^ Noller, H., Rosa-Brusin, M. and Andréu, P. (1967), Stereoselective Synthesis of 1-Butene with Lithium Sulfate as Elimination Catalyst. Angew. Chem. Int. Ed. Engl., 6: 170–171. doi:10.1002/anie.196701702
| Сульфат лития | |
|---|---|
 |
|
| Систематическое наименование |
Сульфат лития |
| Традиционные названия | Сернокислый литий |
| Хим. формула | Li2SO4 |
| Молярная масса | 109,94 г/моль |
| Плотность | 2,221 г/см³ |
| Температура | |
| • плавления | 859 °C |
| Мол. теплоёмк. | 117,57 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1436,0 кДж/моль |
| Удельная теплота плавления | 9,3 кДж/моль |
| Растворимость | |
| • в воде | 34,320; 29,2100 г/100 мл |
| Рег. номер CAS | 10377-48-7 |
| PubChem | 66320 |
| Рег. номер EINECS | 233-820-4 |
| SMILES |
[Li+].[Li+].[O-]S(=O)(=O)[O-] |
| InChI |
1S/2Li.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 INHCSSUBVCNVSK-UHFFFAOYSA-L |
| RTECS | OJ6419000 |
| ChEBI | 53474 |
| ChemSpider | 59698 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат лития — соль щелочного металла лития и серной кислоты. Химическая формула Li2SO4.
Образует кристаллогидрат Li2SO4•H2O.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Физиологическое действие
Получение
- Кристаллогидрат сульфата лития получают взаимодействием гидроксида или карбоната лития с серной кислотой с последующим упариванием:
-
- 2 LiOH + H2SO4 → Li2SO4 + 2 H2O
- Безводную соль получают нагреванием моногидрата выше 500°С.
Физические свойства
Безводный сульфат лития образует три кристаллические модификации:
- α-форма — устойчивая при обычных условиях модификация с моноклинной решёткой, пространственная группа P 21/c, параметры a = 0,844 нм, b = 0,495 нм, c = 0,824 нм, β = 107,9°, Z = 4.
- β-форма — гексагональная решётка
- γ-форма — при температуре выше 575°С образует кубическую решётку, пространственная группа I 43m, a = 0,707 нм, Z = 4.
Кристаллогидрат образует кристаллы моноклинной сингонии, пространственная группа P 21, параметры a = 0,814 нм, b = 0,483 нм, c = 0,543 нм, β = 107,58°, Z = 4.
Химические свойства
- Взаимодействует с серной кислотой с образованием гидросульфата лития:
-
- Li2SO4 + H2SO4 → 2 LiHSO4
- Взаимодействием с соединениями бария удобно получать различные соединения лития:
-
- Li2SO4 + Ba(OH)2 → 2 LiOH + BaSO4↓
- Li2SO4 + Ba(N3)2 → 2 LiN3 + BaSO4↓
- При нагревании с водородом, аммиаком или углеродом (кокс) восстанавливается до сульфида лития:
-
- Li2SO4 + 4 C →800oC Li2S + 4 CO
Применение
Сульфат лития используется для изготовления головок детекторов в ультразвуковой дефектоскопии и как компонент люминофоров. Также он используется как средство для лечения маниакально-депрессивного психоза. Это вещество — пьезоэлектрик.
Физиологическое действие
Сульфат лития обладает средней токсичностью. Как и все соединения лития, влияет на ЦНС.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Физиологическое действие
Сульфат лития — соль щелочного металла лития и серной кислоты. Химическая формула 
| Сульфат лития | |
|---|---|
| Общие | |
| Систематическое наименование |
Сульфат лития |
| Традиционные названия | Сернокислый литий |
| Хим. формула | Li2SO4 |
| Физические свойства | |
| Молярная масса | 109,94 г/моль |
| Плотность | 2,221 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 859 °C |
| Мол. теплоёмк. | 117,57 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1436,0 кДж/моль |
| Удельная теплота плавления | 9,3 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 34,320; 29,2100 г/100 мл |
| Классификация | |
| Рег. номер CAS | 10377-48-7 |
| PubChem | 66320 |
| Рег. номер EINECS | 233-820-4 |
| SMILES |
[Li+].[Li+].[O-]S(=O)(=O)[O-] |
| InChI |
1S/2Li.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 INHCSSUBVCNVSK-UHFFFAOYSA-L |
| RTECS | OJ6419000 |
| ChEBI | 53474 |
| ChemSpider | 59698 |
| Безопасность | |
| NFPA 704 |
Образует кристаллогидрат состава .
Получение
Кристаллогидрат сульфата лития получают взаимодействием гидроксида или карбоната лития с серной кислотой с последующим упариванием раствора:
.
Безводную соль получают нагреванием моногидрата выше 500 °С.
Физические свойства
Безводный сульфат лития образует три кристаллические модификации:
- α-форма — устойчивая при обычных условиях модификация с моноклинной решёткой, пространственная группа P 21/c, параметры a = 0,844 нм, b = 0,495 нм, c = 0,824 нм, β = 107,9°, Z = 4.
- β-форма — гексагональная решётка
- γ-форма — при температуре выше 575 °С образует кубическую решётку, пространственная группа I 43m, a = 0,707 нм, Z = 4.
Кристаллогидрат образует кристаллы моноклинной сингонии, пространственная группа P 21, параметры a = 0,814 нм, b = 0,483 нм, c = 0,543 нм, β = 107,58°, Z = 4.
Химические свойства
Взаимодействует с серной кислотой с образованием гидросульфата лития:
.
Взаимодействием с соединениями бария удобно получать различные соединения лития:
;
.
При нагревании с водородом, аммиаком или углеродом восстанавливается до сульфида лития:
-
.
Применение
Сульфат лития пьезоэлектрик и используется для изготовления приёмников ультразвука в ультразвуковой дефектоскопии. Также применяется в качестве компонента люминофоров.
В медицине используется как средство для лечения маниакально-депрессивного психоза.
Физиологическое действие
Сульфат лития обладает средней токсичностью. Как и все растворимые соединения лития, влияет на ЦНС.








