Определение валентности химического элемента по формуле его соединения
Суммы единиц валентности каждого элемента в формуле бинарного соединения равны.
Пример:
определим валентность хлора в его соединении с кислородом —
Cl2O7
.
1. Записываем известную валентность кислорода над формулой. Неизвестную валентность обозначаем буквой (x):
2. Находим сумму единиц валентности каждого элемента. Для этого его валентность умножаем на число атомов:
3. Вычисляем (x):
2x=14,x=14:2=7.
Валентность хлора равна
VII
:
Составление формулы бинарного соединения по валентностям химических элементов
Если известны валентности двух элементов, то можно составить формулу их соединения.
Пример:
составим формулу соединения алюминия с углеродом, валентность которого равна
IV
.
1. Записываем символы химических элементов рядом. Указываем над ними валентности. Валентность алюминия постоянная и равна
III
.
2. Находим наименьшее общее кратное валентностей, записываем его над формулой.
Наименьшее общее кратное равно
3⋅4=12
.
3. Делим НОК на валентность каждого элемента:
12:3=4,12:4=3.
Получаем индексы в формуле соединения:
Содержание:
- § 1 Валентность химических элементов
- § 2 Определение валентности по формулам соединений
- § 3 Составление химических формул по валентности
- § 4 Определение названия вещества по химической формуле
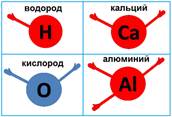
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
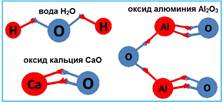
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia – «сила») – свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей – валентных возможностей.
Например, водород – одну, кислород и кальций – по две, алюминий – три, углерод – четыре, фосфор – пять, сера – шесть, хлор – семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
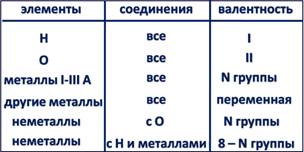
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая – разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная – 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая – в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую – соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента – фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
2. 2×3=6;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества – оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента – низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях – два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Источник
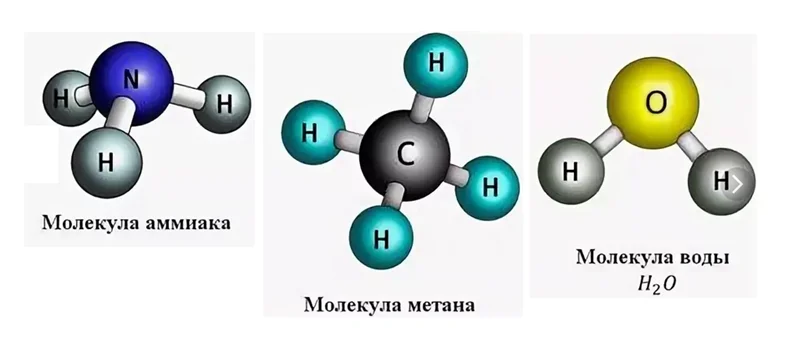
Определение валентности элементов по формулам
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
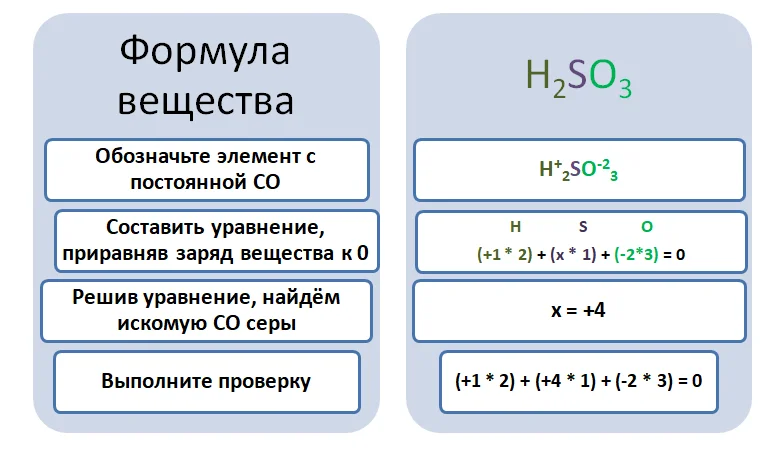
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.