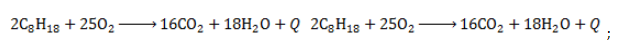Содержание
- 1 Формула и строение
- 2 Изомерия октана
- 2.1 Структурная изомерия
- 2.2 Оптическая изомерия
- 2.3 Наименования и формулы изомеров октана
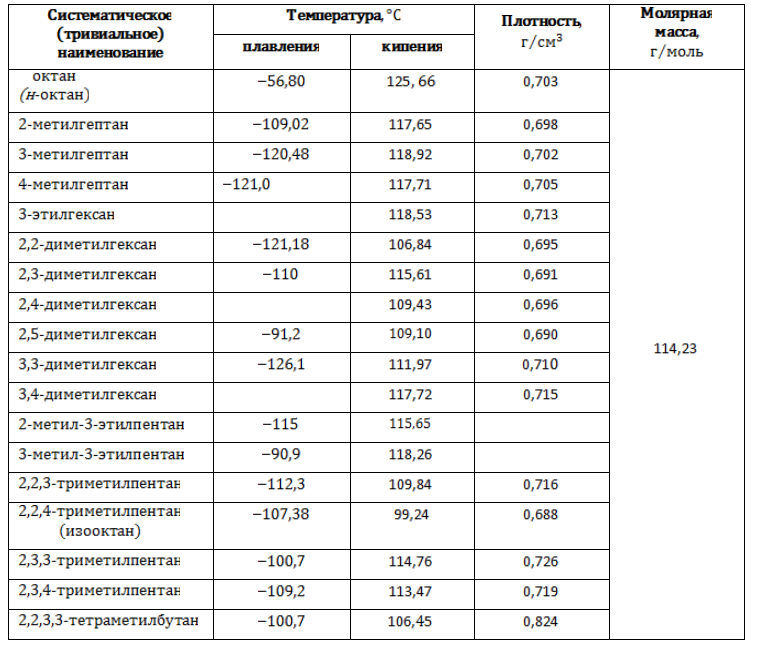
- 3 Физические свойства
- 4 Химические свойства
- 5 Получение октанов
- 6 Применение октанов
Октан – восьмой член в гомологическом ряду алканов. Изомеры октана характеризуются структурным разнообразием, вследствие чего свойства этих веществ различны. Они, в свою очередь, определяют сферу применения того или иного изомера. Главным источником для получения октанов служит нефть и продукты ее переработки.
Формула и строение
Являясь типичными предельными углеводородами ациклического строения, октаны содержат наибольшее возможное количество атомов водорода. Построение углеродного скелета и удержание на нем водородных атомов осуществляется только за счет прочных одинарных -связей.
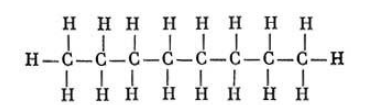
Состав октана выражается химической формулой С8H18. Простейшее строение молекулы октана представляет собой неразветвленную и не содержащую циклов цепь, так называемый нормальный, или н-октан. Она образована восемью углеродными атомами, валентности которых полностью насыщены.
Структурная формула октана:
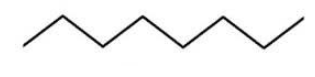
Строение молекулы можно также изобразить с помощью скелетной формулы, где символы водорода и углерода опускаются. Вершины и концы ломаной линии означают углеродные атомы:
Зигзагообразная форма линии точнее отражает молекулярную структуру углеводородов, так как углеродные атомы связываются между собой не линейно, а подчиняясь валентным углам, возникающим у атома в sp3-гибридизованном состоянии.
Поскольку вокруг -связей возможно вращение, молекула может образовывать ряд конформаций – вариантов расположения атомов по отношению друг к другу. Для линейных алканов наиболее энергетически выгодной и стабильной является конформация в виде зигзага.
Изомерия октана
У соединений состава С8H18 изомеры возникают не только вследствие вариантов ветвления цепочки. Октаны способны образовывать изомеры на основе оптических различий между структурно одинаковыми молекулами. Все изомеры октана являются насыщенными ациклическими углеводородами – кратные связи в них не появляются.
Структурная изомерия
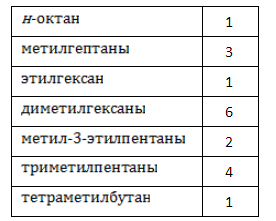
Алканы образуют структурные изомеры лишь по одному признаку – по порядку связывания атомов, формирующих углеродный скелет. Таких изомеров насчитывается 18, и их удобно разделить на группы по типу и количеству алкильных радикалов:
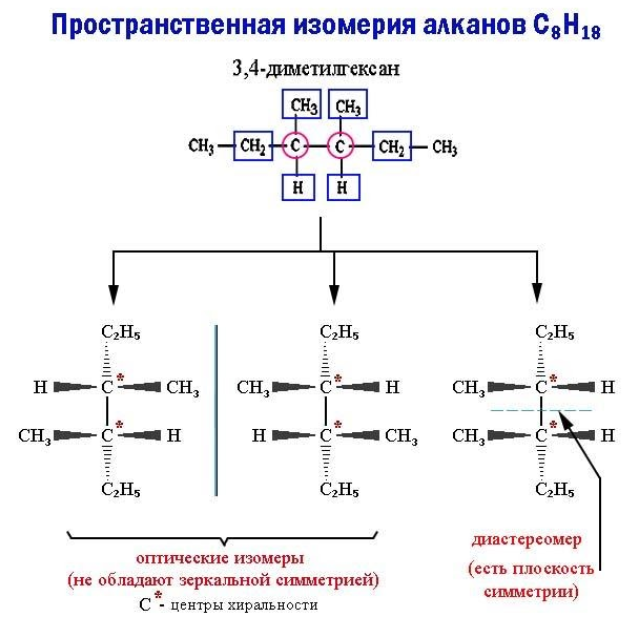
Оптическая изомерия
Пространственные изомеры данного типа, называемые также энантиомерами, при идентичной структуре не обладают зеркальной симметрией. Такие молекулы-энантиомеры представляют собой взаимные зеркальные отражения, которые не могут совпасть при вращении, – антиподы. Отсутствие зеркальной симметрии носит название хиральности (пример – правая и левая руки).
Хиральность возникает, если все четыре заместителя при каком-либо углеродном атоме оказываются разными. В этом случае в молекуле отсутствует плоскость симметрии. Как бы ни вращался этот атом (центр хиральности) вместе с радикалами, молекулу невозможно совместить с ее зеркальным отражением.
Если же молекула обладает плоскостью симметрии, она не является оптическим изомером. Возникает другой тип пространственной изомерии – диастереомерия.
Энантиомеры проявляют свои различия только в оптически активной среде. Так, являясь антиподами, они поворачивают в противоположных направлениях плоскость поляризации света. В химических взаимодействиях с хиральными соединениями (например, аминокислотами) оптические изомеры существенно различаются по реакционной способности.
Наименования и формулы изомеров октана

Физические свойства
Октаны – прозрачные жидкости без цвета, со слабо выраженным запахом. Появление боковых ветвей в молекулах изомерных форм прежде всего влияет на межмолекулярные связи, что приводит к изменению температур, при которых вещества совершают фазовые переходы.
Изомеры состава С8H18, подобно всем алканам, нерастворимы в воде, но растворяются в эфирах, бензоле и других органических растворителях.
Основные физические характеристики октанов приводятся в таблице.
Химические свойства
Изомерные октаны принадлежат к одному классу веществ – насыщенным ациклическим углеводородам. Поэтому в химических взаимодействиях они проявляют типичные для алканов свойства:
- не участвуют в реакциях присоединения;
- вступают в реакции замещения:
- при комнатной температуре устойчивы к действию окислителей;
- отличаются горючестью:
- разлагаются при температурах свыше 500 С без доступа воздуха на смесь низших алканов и алкенов (крекинг):
- дегидрируются при температуре
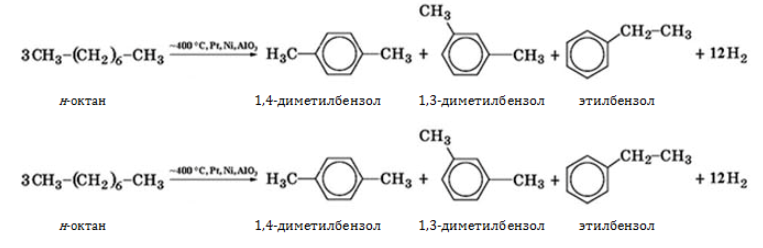
на катализаторе с образованием циклоалкана и последующим превращением в ароматический углеводород бензольного ряда:
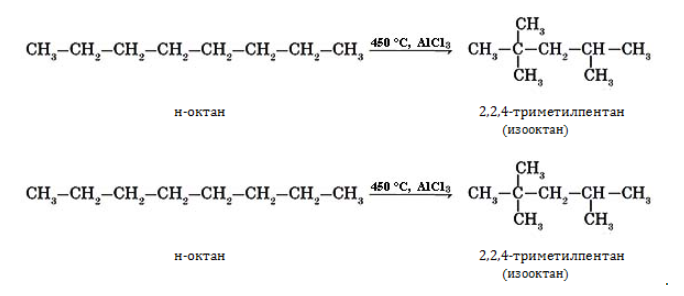
- изомеризуются с образованием разветвленной молекулы:
Получение октанов
Для лабораторного синтеза октана и его изомеров применяются следующие методы:
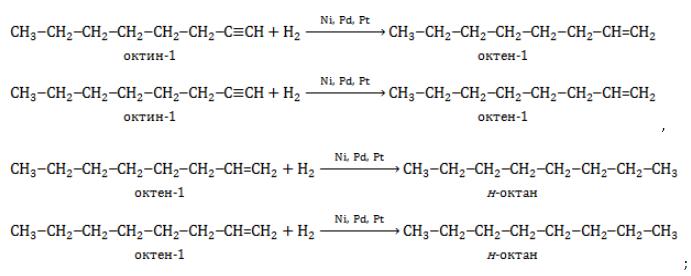
- гидрирование ненасыщенных линейных углеводородов – алкенов и алкинов:
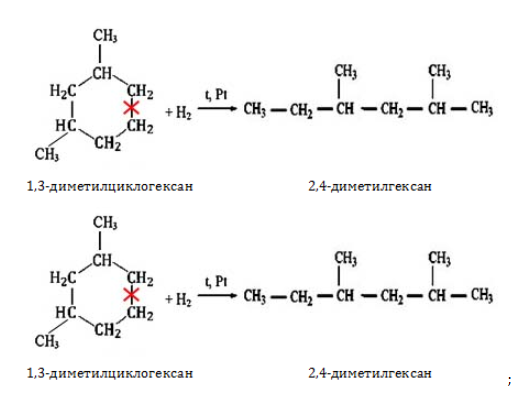
- гидрирование циклоалканов:
- восстановление галогеналканов:
- синтез низших галогеналканов с участием металлического натрия, отнимающего галоген (реакция Вюрца):
В промышленности октан и его изомеры получают в процессах бензиновой фракции нефти или в числе прочих углеводородов при синтезе по методу Фишера–Тропша:
Применение октанов
Как сырье или промежуточный продукт октан используется в органическом синтезе. С его помощью получают ароматические углеводороды бензольного ряда – этилбензол и ортоксилол – а также другие соединения. Октан также применяется в качестве растворителя. Как компонент топлива октан играет скорее отрицательную роль, так как понижает устойчивость горючего к детонации.
Изооктан благодаря разветвленной структуре молекулы не склонен к детонации, вследствие чего принят в качестве эталона для определения качества бензина. Изооктан входит в состав авиационного топлива. Как химическое сырье изооктан не находит применения. Сфера его использования ограничена топливной отраслью, в которой изооктан играет важную роль.
Это интересно:
Изомеры органических веществ
Галогеналканы
Гомологический ряд алкадиенов
Изомеры октана:
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3 — октан (нормальный октан, н-октан);
СН3-СН(СН3)-СН2-СН2-СН2-СН2-СН3 — 2-метилгептан;
СН3-СН2-СН(СН3)-СН2-СН2-СН2-СН3 — 3-метилгептан;
СН3-СН2-СН2-СН(СН3)-СН2-СН2-СН3 — 4-метилгептан;
СН3-С(СН3)2-СН2-СН2-СН2-СН3 — 2,2-диметилгексан;
СН3-СН(СН3)-СН(СН3)-СН2-СН2-СН3 — 2,3-диметилгексан;
СН3-СН(СН3)-СН2-СН(СН3)-СН2-СН3 — 2,4-диметилгексан;
СН3-СН(СН3)-СН2-СН2-СН(СН3)-СН3 — 2,5-диметилгексан;
СН3-СН2-С(СН3)2-СН2-СН2-СН3 — 3,3-диметилгексан;
СН3-СН2-СН(СН3)-СН(СН3)-СН2-СН3 — 3,4-диметилгексан;
СН3-СН2-СН(СН2-СН3)-СН2-СН2-СН3 — 3-этилгексан;
СН3-С(СН3)2-СН(СН3)-СН2-СН3 — 2,2,3-триметилпентан;
СН3-С(СН3)2-СН2-СН(СН3)-СН3 — 2,2,4-триметилпентан (этот изомер, неправильно называемый «изооктаном», является основным компонентом смесей для оценки «октанового числа» бензинов. Октановое число этого угдеводорода принято за 100;
СН3-СН(СН3)-С(СН3)2-СН2-СН3 — 2,3,3-триметилпентан;
СН3-СН(СН3)-СН(СН3)-СНСН3-СН3 — 2,3,4-триметилпентан;
СН3-СН(СН3)-СН(СН2-СН3)-СН2-СН3 — 2-метил-3 этилпентан;
СН3-С(СН3)2-С(СН3)2-СН3 — 2,2,3,3-тетраметилбутан.
Получилось 17 изомеров октана. Изомеры нонана и декана нарисуете сами.
Для этого в каждом изомере октана замените каждый атом водорода метильной группой, затем одинаковые формулы вычеркните. Уверяю Вас, что все равно количество изомеров нонана будет гораздо больше 17, возможно около 25. Аналогично, пририсовывая в формулах изомеров нонанов метильные группы взамен каждого атома водорода, и вычеркнув одинаковые формулы, получите наверное не менее 40 изомеров деканов.
Октан C8H18 – это предельный углеводород, содержащий восемь атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Гомологический ряд октана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение октана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
Например, в молекуле октана C8H18 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение.
Изомерия октана
Структурная изомерия
Для октана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для углеводородов состава С8Н18 существуют 18 изомеров углеродного скелета: н-октан, 2-метилгептан, 3 -метилгептан, 4-метилгептан, и др.
| Октан | 2-Метилгептан |
| CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH2-CH2-CH3 |
Для октана не характерна пространственная изомерия.
Химические свойства октана
Октан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для октана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для октана характерны радикальные реакции.
Октан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
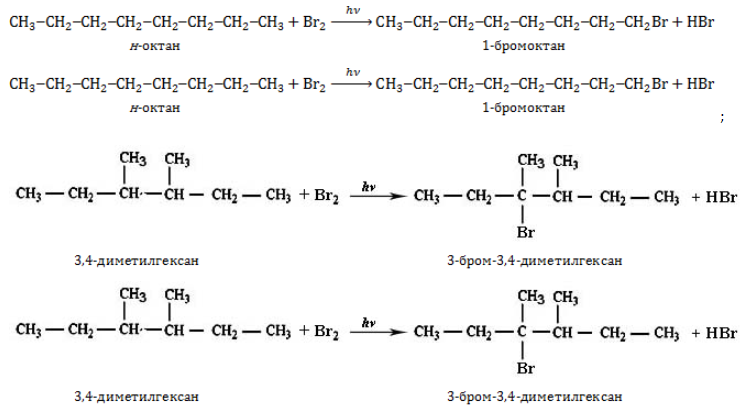
1.1. Галогенирование
Октан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании октана образуется смесь хлорпроизводных.
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH-CH2-CH2-CH2-CH2-CH2-CH2Cl + HCl
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CH2-CH2-CHCl-CH3 + HCl
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH2-CHCl-CH2-CH2-CH3 + HCl
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CH2-CH2-CHBr-CH3 + HBr
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CHBr-CH2-CH2-CH3 + HBr
1.2. Нитрование октана
Октан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в октане замещается на нитрогруппу NO2.
Например. При нитровании октана образуются преимущественно 2-нитрооктан, 4-нитрооктан и 3-нитрооктан.
2. Дегидрирование октана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Октан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать этилциклогексан и потом этилбензол.
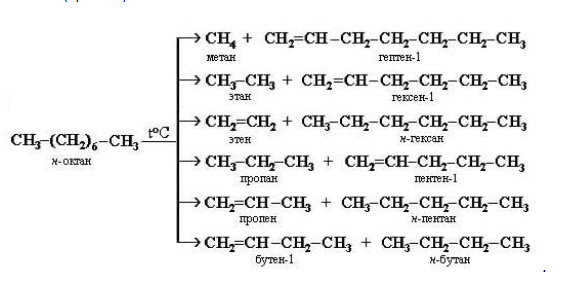
3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-октана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
4. Окисление октана
Октан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
Полное окисление – горение
Октан горит с образованием углекислого газа и воды. Реакция горения октана сопровождается выделением большого количества теплоты.
2C8H18 + 25O2 → 16CO2 + 18H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении октана в недостатке кислорода может образоваться угарный газ СО или сажа С.
5. Изомеризация октана
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Например, н-октан под действием катализатора хлорида алюминия и при нагревании образует 2-метилгептан, 3-метилгептан и другие изомеры.
Получение октана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Реакция больше подходит для получения симметричных алканов.
Октан можно получить из 1-хлорбутана и натрия:
2CH3-CH2-CH2-CH2-Cl + 2Na → CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + 2NaCl
2. Гидрирование алкенов и алкинов
Октан можно получить из октенов или октинов:
При гидрировании октена-1, октена-2 или октена-3 образуется октан:
CH2=CH-CH2-CH2-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
CH3-CH=CH-CH2-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
При полном гидрировании октина-1, октина-2 или октина-3 также образуется октан:
CH≡C-CH2-CH2-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
CH3-C≡C-CH2-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
4. Получение октана в промышленности
В промышленности октан получают из нефти и каменного угля. При переработке нефти используют ректификацию, крекинг и другие способы.
Напишите изомеры октана
|
Напишите изомеры октана |
|
| Просмотров: 22970 | Добавил: (17.04.2019) (Изменено: 17.04.2019) |
|
Всего ответов: 1 |
|
Обсуждение вопроса:Всего ответов: 1 Порядок вывода комментариев:
Kaif Октан (н-октан) — органическое соединение класса алканов. У октана больше 18 изомеров. Октан (н-октан) |
|
Октан имеет 18 структурых изомеров.
Октан (н-октан)
2-Метилгептан
3-Метилгептан
4-Метилгептан
3-Этилгексан
2,2-Диметилгексан
2,3-Диметилгексан
2,4-Диметилгексан
2,5-Диметилгексан
3,3-Диметилгексан
3,4-Диметилгексан
2-Метил-3-этилпентан
3-Метил-3-этилпентан
2,2,3-Триметилпентан
2,2,4-Триметилпентан
2,3,3-Триметилпентан
2,3,4-Триметилпентан
2,2,3,3-Тетраметилбутан