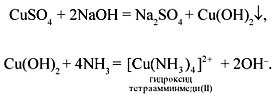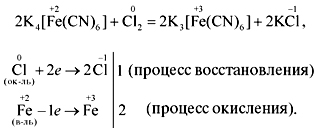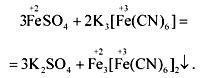Рассмотрим
сначала строение гидроксо-комплексных
солей.
Гидроксокомплексные
соли характерны для амфотерных металлов,
например, Zn, Al, Cr, Pb, Be и других. В своём
составе гидроксо-комплексные соли
содержат два разных металла, один из
которых амфотерный (входит во внутреннюю
сферу комплексной соли), а другой не
амфотерный (входит во внешнюю сферу
комплексной соли) и несколько гидроксо-групп
( ОН — гидроксо-группа ). Число гидроксо-групп,
называется координационным ( КЧ ) и
определяется свойствами атома
комплексообразователя (амфотерного
металла). Для наиболее часто встречающихся
гидроксо-комплексных солей КЧ
атомов-комплексообразователей имеют
значения:
-
Координационные
числа атомов-комплексообразователей
( КЧ ):Zn:
4Be:
4Pb:
4Al:
4, 6Cr:
4, 6
-
Пример
1: тетрагидроксоцинкат калия
— K2[Zn(OH)4]А
том-комплексообразователь
d-элемент — Zn(
записывается первымвнутри
квадратных скобок )Координационное
число ( КЧ ) —число
лигандов, — групп атомов, связанныхс
атомом комплексообразователем вовнутренней
сфере комплексной соли.K2[Zn(OH)4]
В
нешняя
сфера комплексной соли —металл
калий: К(
за квадратными скобками )Внутренняя
сфера комплексной соли —амфотерный
металл цинк: Znи
четыре ОН — группы(
внутри квадратных скобок )
-
Пример
2: гексагидроксохромат натрия
— Na3[Cr(OH)6]А
том-комплексообразователь
d-элемент — Cr(
записывается первымвнутри
квадратных скобок )Координационное
число ( КЧ ) —число
лигандов, — групп атомов, связанныхс
атомом комплексообразователем вовнутренней
сфере комплексной соли.Na3[Cr(OH)6]
В
нешняя
сфера комплексной соли —металл
натрий: Na(
за квадратными скобками )Внутренняя
сфера комплексной соли —амфотерный
металл хром: Crи
шесть ОН — групп(
внутри квадратных скобок )
¾
15 ¾
§ 6. Как составить формулу комплексной соли по названию ?
Правила
составления формул комплексных солей
по названию.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Пример
1: тетрагидроксоцинкат калияН
азвание
цинкат
означает,
чтоатом-комплексообразователь
— цинк: ZnЕго
записывают первымвнутри
квадратных скобок.Приставка
ТЕТРА означает, чтогидроксо-групп
четыреИх
берут в скобки и пишут индекс 4 за
скобкойK[Zn(OH)4]
С
лово
КАЛИЯ означает, что слева отквадратной
скобки надозаписать
символ калия: КНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— цинка ( Zn )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
цинка равна II ( постоянная ),поэтому,
заряд атома цинка равен ( + 2 )Заряд
ОН группы всегда равен ( -1 )+1 +2 -1
K[Zn(OH)4]
Валентность
калия
равна
I ( постоянная ),поэтому,
заряд атома калия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл калий — К+1
К
Заряд
первой части равен: +1+1 +2 -1
K[Zn(OH)4]
+1 -2
Вторая
часть:внутренняя
сфера комплексного соединения+2
-1[Zn(OH)4]
+2 + (-1) • 4 = — 2
Заряд
второй части равен: -2
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим определите
и проставьте индексы в формулу так,
чтобы эта закономерность была выполнена.
-
П
ервая
часть: металл калий — КЗаряд
первой части равен:+1
+1 +2 -1
K2[Zn(OH)4]
+1•2 + (-2) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+2
-1[Zn(OH)4]
+2 + (-1) • 4 = — 2
Заряд
второй части равен: -2
Ч
тобы
сумма зарядов составных частей стала
равна 0, необходимо увеличить положительный
заряд. Для этого число атомов калия
должно быть равно 2. Этот индекс надо
поставить в формулу справа внизу от
атома калия.
¾
16 ¾
-
Пример
2: тетрагидроксоалюминат натрияН
азвание
АЛЮМИНат
означает,
чтоатом-комплексообразователь
— алюминий: AlЕго
записывают первымвнутри
квадратных скобок.Приставка
ТЕТРА означает, чтогидроксо-групп
четыреИх
берут в скобки и пишутиндекс
4 за скобкойNa[Al(OH)4]
Слово
НАТРИЯ означает, что слева отквадратной
скобки надозаписать
символ натрия: NaНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— алюминия ( Al )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
алюминия равна III(
постоянная ),поэтому,
заряд атома алюминия равен ( + 3 )Заряд
ОН группы всегда равен ( -1 )
+1 +3 -1
Na[Al(OH)4]
Валентность
натрия равна I ( постоянная ),поэтому,
заряд атома натрия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл натрий — Na+1
Na
Заряд
первой части равен: +1+1 +3 -1
Na[Al(OH)4]
+1 -1
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Al(OH)4]
+3 + (-1) • 4 = — 1
Заряд
второй части равен: -1
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим определите
и проставьте индексы в формулу так,
чтобы эта закономерность была выполнена.
-
П
ервая
часть: металл натрий — NaЗаряд
первой части равен:+1
+1 +3 -1
Na[Al(OH)4]
+1 • 1 + (-1) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Al(OH)4]
+3 + (-1) • 4 = — 1
Заряд
второй части равен: -1
Cумма
зарядов составных частей равна 0, поэтому,
индексы ставить не требуется.
¾
17 ¾
-
Пример
3: гексагидроксохромат (III) натрияН
азвание
ХРОМат
означает,
чтоатом-комплексообразователь
— хром: CrЕго
записывают первымвнутри
квадратных скобок.Приставка
ГЕКСА означает, чтогидроксо-групп
ШеСТЬИх
берут в скобки и пишутиндекс
6 за скобкойNa[Cr(OH)6]
Слово
НАТРИЯ означает, что слева отквадратной
скобки надозаписать
символ натрия: NaНазвание
ГИДРОКСО означает, что справа откомплесообразователя
— хрома ( Cr )находятся
ОН — группы.
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и численно равен валентности металла.
Заряд ОН группы равен ( — 1 ):
-
В
алентность
хрома равна III(
указана в названии ),поэтому,
заряд атома хрома равен ( + 3 )Заряд
ОН группы всегда равен ( -1 )+1 +3 -1
Na[Cr(OH)6]
Валентность
натрия равна I ( постоянная ),поэтому,
заряд атома натрия равен ( + 1 )
3)
Формула комплексной соли делится на
две части: первая часть — внешняя сфера
(металл за квадратными скобками); вторая
часть — внутренняя сфера ( металл с ОН
группами внутри квадратных скобок).
Посчитайте суммы зарядов в составных
частях (за квадратными скобками и внутри
них).
-
П
ервая
часть: металл натрий — Na+1
Na
Заряд
первой части равен: +1+1 +3 -1
Na[Cr(OH)6]
+1 -3
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Cr(OH)6]
+3 + (-1) • 6 = — 3
Заряд
второй части равен: -3
4)
Суммарный заряд всех составных частей
молекулы равен 0. Пользуясь этим,
определите и проставьте индексы в
формулу так, чтобы эта закономерность
была выполнена.
-
П
ервая
часть: металл натрий — NaЗаряд
первой части равен:+1
+1 +3 -1
Na3[Cr(OH)6]
+1•3 + (-3) = 0
Вторая
часть:внутренняя
сфера комплексного соединения+3
-1[Cr(OH)6]
+3 + (-1) • 6 = — 3
Заряд
второй части равен: -3
Ч
тобы
сумма зарядов составных частей стала
равна 0, необходимо увеличить положительный
заряд. Для этого число атомов натрия
должно быть равно 3. Этот индекс надо
поставить в формулу справа внизу от
атома натрия.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
-
Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
-
Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
Комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu+2, Ag+, Pt+4, Fe+2, Fe+3, Co+2, Co+3, Co+2)
Лиганды – это ионы и молекулы, имеющие свободные электронные пары (OH—, CN—, Cl—, NH3, H2O)
Координационное число (КЧ) — это число лигандов в комплексном ионе
Координационное число зависит:
-
от природы центрального атома;
-
заряда комплексообразователя;
-
условий образования комплексов.
Виды комплексов
Катионные
[Co(NH3)6]3+
Анионные
[CoF6]3-
Нейтральные
[Al (H2O)3(OH)3]
Соединения с комплексными анионами
K2[PtCl4] — тетрахлороплатинат (II) калия
Na2[Zn(OH)4] — тетрагидроксоцинкат натрия
Na[Cr(H2O)2F4] — тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Al(H2O)5OH]SO4 – сульфат гидроксопентаакваалюминия
[Pt(H2O)(NH3)2OH] NO3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H2O)3(OH)3] — тригидроксотриакваалюминий
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Co(NH3)3Cl3] – трихлоротриамминкобальт (III)
Номенклатура
-
в названиях комплексных ионов сначала указываются лиганды;
-
название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
-
в названиях комплексных катионов используются русские названия металлов;
-
в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
-
названия лигандов:
NH3 – аммин
H2O – аква
CO – карбонил
F— – фторо
Cl— – хлоро
CN— – циано
OH— – гидроксо
CNS— – тиоцианато
NO3— – нитрато
NO2— – нитро
-
Умножающие приставки:
2 — ди
3 – три
4 – тетра
5 – пента
6 – гекса
Примеры
K4[Fe(CN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль)
K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль)
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Cu(H2O)4]SO4 ∙ H2O – сульфат тетрааквамеди (II) (медный купорос)
Диссоциация ступенчатая
Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2-
(первая ступень – необратимо)
[Zn(OH)4]2- ↔ Zn2+ + 4OH—
(вторая ступень – обратимо)
ИЗ ОПЫТА РАБОТЫ
Для самых смелых
Комплексные соединения
Материал данной статьи
может быть с успехом использован при проведении
уроков как по обычной программе в 10–11-х классах
(повторение и обобщение знаний по неорганической
химии, амфотерность), так и по программе с
углубленным изучением химии для отдельного
тематического занятия.
Все познается в сравнении.
Приступая к изучению вопроса о комплексных
соединениях, вспомним строение атома азота и
молекулы аммиака.
Азот имеет на внешнем электронном слое пять
электронов – одну пару и три неспаренных (рис. 1).
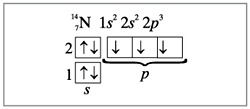 |
Рис. 1.
|
Аммиак: азот затрачивает эти три
неспаренных электрона на образование
ковалентных связей с атомами водорода –
образует с водородом три общие электронные пары.
Собственную неподеленную пару электронов азот
использует на образование донорно-акцепторной
связи, например, с протоном (рис. 2).
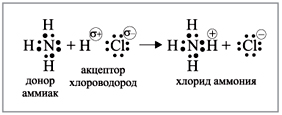 |
Рис. 2.
|
Соединения, образование которых не
связано с возникновением новых электронных пар
(общая электронная пара образовалась за счет
собственной электронной пары одного из
партнеров), называются комплексными.
Создатель теории комплексных соединений, она
называется еще координационной теорией, –
шведский ученый Альфред Вернер. В начале
прошлого столетия наибольший прогресс в этой
области химии достигнут в нашей стране благодаря
Льву Александровичу Чугаеву, который создал
уникальную школу химиков-комплексников.
Рассмотрим комплексное соединение на
конкретном примере: если, получив гидроксид меди,
добавить к осадку раствор аммиака в воде, то
осадок исчезнет, а раствор станет прозрачным и
темно-синим. Это образовалось комплексное
соединение. Запишем уравнения реакций:
Состав комплексного соединения (КС) [Cu(NH3)4](OH)2:
внешняя сфера – два иона ОН–;
внутренняя сфера – ион [Cu(NH3)4]2+;
комплексообразователь (центральный ион,
координатор) – Cu2+;
координационное число (КЧ) (число молекул или
ионов, соединенных непосредственно с
атомом-комплексообразователем) – 4;
лиганды (молекулы или ионы, расположенные около
комплексообразователя) – (NH3).
При написании формул комплексных солей
комплекс заключается в квадратные скобки.
Комплексы могут выполнять роль катионов, анионов
или быть нейтральными молекулами, например:
[Cu(NH3)4]2+ – катион;
[Fe(CN)6]4– – анион;
[Pt(NH3)2Cl4] – нейтральная
молекула.
Заряд комплексного иона равен сумме зарядов
комплексообразователя и лигандов.
Алгебраическая сумма зарядов внутренней и
внешней сферы равна нулю, например, в соединении
Na2[Zn(CN)4]: два иона 2Na+ – внешняя
сфера, ион [Zn(CN)4]2– – внутренняя
сфера, ее заряд складывается из двух
положительных зарядов иона Zn2+ и четырех
отрицательных зарядов четырех ионов CN–,
что в сумме дает минус два.
Образование внутренней сферы комплексов
происходит по донорно-акцепторному механизму.
Комплексообразователь – акцептор,
предоставляющий свободные орбитали. Лиганды –
доноры, предоставляющие свободные пары
электронов. Роль комплексообразователя обычно
выполняют положительно заряженные ионы, имеющие
небольшую величину ионного радиуса. Чаще всего
это катионы d-элементов, хотя известны и
комплексные соединения катионов s-, p- и f-элементов*.
Лигандами, как правило, являются ионы (анионы), к
названию которых прибавляется гласная «о»,
например: ионы F– – фторо, Cl– –
хлоро, I– – йодо, CN– – циано, OH–
– гидроксо, CNS– – роданидо; и нейтральные
молекулы: Н2O – аква, NH3 – амин и др.
Координационное число зависит от радиуса атома
комплексообразователя и его заряда (таблица).
Чем больше радиус комплексообразователя, тем
большее число лигандов может соединиться с ним.
Самостоятельная работа
Составьте комплексные соединения, обозначьте
составные части, заряды ионов.
2AgNO3
…………………….. .
(Ответ. Ag+[Ag+(NO3)2]–.)
Pt+4Cl4•2KCl (КЧ Pt = 6) …………………. . .
(Ответ. [Pt 4+(Cl–)6]2–.)
Таблица
Наиболее частые и возможные (в
скобках) координационные числа
в зависимости от заряда центрального иона
| Примеры соединений |
Заряд комплексообразователя |
КЧ (четное) |
| Na[Au(CN)2] | +1 | 2 |
| [Cu(NH3)4]SO4 | +2 | 4(6) |
| K3[Fe(CN)6] | +3 | 6(4) |
| K4[Mо(CN)8]?2H2O | +4 | 8(6) |
Названия комплексных
соединений
Формула комплексного соединения читается
справа налево. Сначала называется анион (если он
есть): Cl– – хлорид, ОН– – гидроксид,
SO4 – сульфат и т.д. Название комплексного
катиона записывают в одно слово, число лигандов
указывают греческими числительными: 1 – моно, 2
– ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Отрицательные лиганды (анионы) внутренней сферы
в названии приобретают суффикс «о» (см. выше),
затем перечисляют нейтральные лиганды, называют
центральный атом и римской цифрой обозначают его
степень окисления.
В комплексных анионах добавляется суффикс «ат»
к названию комплексообразователя. После
обозначения состава внутренней сферы называют
внешнесферные катионы (если такие имеются).
Cамостоятельная работа
Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3.
(Ответ. Хлорид гексаакваалюминия.)
K2[Pt(Cl)6].
(Ответ. Гексахлороплатинат(IV) калия.)
Na2[Zn(OH)4].
(Ответ. Тетрагидроксоцинкат натрия.)
[Cu(NH3)4](OH).
(Ответ. Гидроксид тетраамминмеди(II).)
NH4Cl.
(Ответ. Хлорид аммония.)
[Ag(NH3)2]Cl.
(Ответ. Хлорид диамминсеребра(I).)
K4[Мо(CN)8]•2H2O.
(Ответ. Дигидрат
октацианомолибдата(IV) калия.)
Свойства комплексных соединений
Свойства КС определяются их составом и
строением. В воде они диссоциируют на внешнюю
сферу и комплексный ион:
K3[Fe(CN)6] 3K+ + [Fe(CN)6]–3.
Важнейшим свойством комплексов в растворах
является их устойчивость. Количественно она
характеризуется константой устойчивости.
Внутренняя сфера комплекса в незначительной
степени подвергается электролитической
диссоциации, распадаясь на
комплексообразователь и лиганды, например:
[Fe(CN)6]3– Fe3+ + 6CN–.
Отношение концентрации недиссоциированного
комплекса к произведению концентраций
комплексообразователя и лигандов называется
константой устойчивости, а обратная ей величина
– константой нестойкости:
Чем больше константа устойчивости и чем меньше
константа нестойкости, тем прочнее комплекс.
Комплексные соли могут вступать в реакции
обмена и в реакции замещения, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4,
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au,
а также в окислительно-восстановительные
реакции:
Таким образом, комплексные соли в растворах
ведут себя так же, как и соли простые.
Объяснение амфотерности гидроксидов
с точки зрения химии комплексных соединений
Согласно протолитической теории амфотерные
соединения способны быть как донорами, так и
акцепторами протона. Типичным примером
амфотерного соединения может служить вода:
Н2О + Н2О Н3О+ + ОН–.
Из гидроксидов наиболее ярко выражены
амфотерные свойства у гидроксида галлия Ga(OH)3,
для которого константы диссоциации в водном
растворе по кислотному и основному типу почти
равны.
Преобладание кислотных или осно’вных свойств у
гидроксидов различных элементов связано с
положением элемента в периодической системе.
Ослабление осно’вных и усиление кислотных
свойств гидроксидов R(OH)n наблюдается с
увеличением поляризующего действия иона Rn+,
т.е.
с уменьшением его радиуса и возрастанием заряда.
Поэтому к сильным основаниям относят гидроксиды
щелочных и щелочно-земельных металлов.
Амфотерные гидроксиды образуют во II группе
периодической системы бериллий и цинк – элемент
II группы, но побочной подгруппы, а в III группе –
алюминий, галлий и индий.
Исследование влияния концентрации ионов Н+
в растворе на свойства различных гидроксидов
показало, что амфотерность обусловлена
устойчивостью гидроксокомплекса данного
металла. Приведем пример – гидроксид цинка
растворяется в кислотах и щелочах:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4],
или в ионной форме:
Zn(OH)2 + 2H+ = Zn2+ + 2H2O,
Zn(OH)2 + 2ОH– = [Zn(OH)4]2–.
В водном растворе свободные ионы не могут
существовать, они находятся в виде гидратов.
Энергия гидратации велика, и при этом образуются
аквакомплексы постоянного состава. Число
молекул воды обычно равно координационному
числу. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой-либо соли цинка
его аквакомплекс диссоциирует:
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+ + Н+.
В ряду аква-, аквагидроксо- и гидрокомплексов
цинка (цинк проявляет координационное число 4, а
лигандами являются молекулы воды или ионы ОН–):
[Zn(Н2О)4]2+ [Zn(Н2О)3ОН]+
[Zn(Н2О)2(ОН)2]
L [Zn(Н2О)(ОН)3]–
[Zn(OH)4]2–
каждый последующий член ряда по составу
отличается от предыдущего на один протон. При
переходе каждого предыдущего члена в
последующий первый ведет себя как кислота.
Обратный переход связан с притяжением протона, а
следовательно, с проявлением соединением
основных свойств. Равновесие взаимоперехода
одних комплексов в другие в указанном ряду
смещено вправо в щелочной среде и влево – в
кислой.
Рассмотрим образование аналогичных комплексов
у алюминия. При растворении алюминия в кислоте (в
сильнокислой среде) получается катион в виде
аквакомплекса:
2Al + 6Н+ + 6Н2О = 2[Аl(Н2О)6]3+
+ 3Н2,
При постепенном прибавлении раствора щелочи
происходит замена молекул воды в комплексе на
гидроксильные группы (переход от аквакомплексов
к гидроксокомплексам):
[Al(Н2О)6]3+ + ОН– =
[Al(Н2О)5ОН]2+ + Н2О,
[Al(Н2О)5ОН]2+ + ОН–
= [Al(Н2О)4(ОН)2]+ + Н2О,
[Al(Н2О)4(ОН)2]+ + ОН–
= [Al(Н2О)3(ОН)3] + Н2О.
Нейтральный гидроксид не растворяется в воде и
выпадает в осадок.
При дальнейшем прибавлении раствора щелочи
снова образуются ионы, но уже не катионы, а
анионы, и осадок растворяется:
[Al(Н2О)3(ОН)3] + ОН– =
[Al(Н2О)2(ОН)4]– + Н2О,
[Al(Н2О)2(ОН)4]– +
ОН– = А1[(Н2О)(ОН)5]2– + Н2О,
[Al(Н2О)(ОН)5]2– + ОН–
= [Al(ОН)6]3– + Н2О.
Таким образом, амфотерность трехвалентного
алюминия проявляется в возможности его
существования в водном растворе как в составе
катионов, так и анионов. Состав этих ионов
зависит от кислотности среды. В школьном курсе
химии принято для аниона использовать формулу
[Al(ОН)4]–, где координационное число
алюминия не 6, а 4.
Получение комплексных солей
Комплексные соли получаются в результате
реакций соединения, обмена,
окислительно-восстановительных реакций, а также
при электролизе.
Например:
HgI2 + 2KI (изб.) = K2[HgI4],
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4
+ 4H2O,
ZnCl2 + 4NaOH (изб.) = Na2[Zn(OH)4]
+ 2NaCl.
Применение комплексных соединений
• Гальванические покрытия – защита одного
металла другим. Например, медное покрытие крепко
соединяется с железом, если использовать в
процессе комплексные соединения.
• Электролитическое получение металлов.
Например, алюминий в расплаве криолита образует
комплекс Nа3[AlF6]. Из расплавов
соединений комплексных солей получают такие
металлы, как Nb, Tl, Th, Mg.
• Защита металлов от коррозии. Ингибиторы –
комплексные соли, где лигандами выступают и
органические вещества.
• Аналитическая химия. Многие индикаторы,
реактивы, которые помогают распознать вещества,
ионы и даже заряды ионов, – комплексные
соединения. Катион Fe2+ можно распознать в
реакции с гексацианоферратом(III) калия:
Образуется синий осадок (турнбулева синь).
Катион Fe3+ можно распознать
гексацианоферратом(II) калия:
Образуется темно-синий осадок (берлинская
лазурь).
• Получение металлов. Например золота: золотой
песок растворяется в растворе цианида натрия (NaCN)
в присутствии кислорода и воды, потому что
образуется очень устойчивое комплексное
соединение золота:
4Au + O2 + 2H2O + 8NaCN = 4Na[Au(CN)2]
+ 4NaOH.
Из полученного комплекса золото вытесняют
цинком:
Zn + 2Na[Au(CN)2] = Na2[Zn(CN)4] + 2Au.
Важнейшие органические соединения –
гемоглобин и хлорофилл – тоже соединения
комплексные (схему строения данных соединений
можно посмотреть в книге Л.А.Николаева «Металлы в
живых организмах» и др.) (рис. 3).
 |
Рис. 3.
|
Синтез многих лекарственных
препаратов, витаминов, биодобавок и многих
других веществ связан с комплексными
соединениями.
Л и т е р а т у р а
Гузей Л.С., Суровцева Р.П. Учебник. Химия. 10
класс. М.: Дрофа, 2002; Николаев Л.А. Металлы в
живых организмах. М.: Просвещение, 1983; Глинка Н.Л.
Общая химия. Л.: Химия, Ленингр. отд-ние, 1987; Хомченко
Г.П. Неорганическая химия. М.: Высшая школа, 1978;
Гликина Ф.Б., Ключников Н.Г. Химия комплексных
соединений. М.: Просвещение, 1982; Кукушкин Ю.Н.
Соединения высшего порядка. Л.: Химия. Ленингр.
отд-ние, 1991.
* В химии очень много
исключений. Вот и в комплексных соединениях есть
исключение – ион аммония, в котором
«координатором» является отрицательно
заряженный атом азота. Кроме того, существует еще
целая интересная группа соединений – карбонилы
металлов, в которых и комплексообразователь, и
лиганды (молекулы СО) не заряжены. Например,
карбонил железа
[Fe0(CO)5]0. – Прим. ред.
В.А.ЛУНЬКИНА,
учитель школы № 1
(р. п. Колышлей, Пензенская обл.)
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Номенклатура комплексных соединений
Для составления названия комплексной частицы (катиона, аниона, молекулы) указывают в следующем порядке: число лигандов, названия лигандов, центральный атом.
Номенклатура лигандов
Для указания числа лигандов используют греческие числовые приставки: ди-, три-, тетра-, пента-, гекса- и т.д. При наличии одного лиганда, приставка обычно опускается. Если в названии лиганда имеется числовая приставка, например этилендиамин, триметиламин и др.
, то перед названиями таких лигандов используют умножающие приставки бис- вместо ди-, трис- вместо три-, тетракис- вместо тетра- и т.д.
К названиям анионных лигандов добавляется гласная -о-: S2O32- — тиосульфато-, SO32- сульфито-, C2O42- оксалато-. Аналогично для анионов органических кислот: салицилато-, цитрато-, тартрато- и т.д.
Суффикс -ид в названиях анионов заменяется на гласную -о-: F- — фторо-, Cl- — хлоро-, CN- — циано-, ОН- — гидроксо-. Для гидросульфид-иона HS- применяется название меркапто-, для сульфид-иона S2- — тио-. Некоторые ионы, такие, как тиоцианат SCN-, нитрит NO2- и др.
, имеют по два разных донорных атома, их названия как лигандов зависят от способа координации и будут приведены ниже. Для нейтральных лигандов используются модифицированные названия: пиридин, метиламин, мочевина и др. Исключения составляют: вода — аква- и аммиак — аммин.
Группы CO и NO, если они связаны непосредственно с атомом металла, называются соответственно карбонил- и нитрозил-. В том случае если во внутренней координационной сфере находятся несколько лигандов, их перечисляют в алфавитном порядке, но сначала анионные, а затем — нейтральные.
Таблица наименований нейтральных и анионных лигандов
| Лиганд | Название |
| H- | гидридо |
| F- | фторо |
| Cl- | хлоро |
| Br- | бромо |
| I- | иодо |
| ClO- | гипохлорито |
| ClO2- | хлорито |
| ClO3- | хлорато |
| O2- | оксо |
| O22- | пероксо |
| O2- | надпероксо |
| OH- | гидроксо |
| HO2- | гидропероксо |
| H2O | аква |
| S2- | тио (или сульфидо) |
| HS- | тиоло (меркапто) |
| S22- | дисульфидо |
| SO32- | сульфито |
| HSO3- | гидросульфито |
| S2O32- | тиосульфато |
| SO42- | сульфато |
| Se2- | селено |
| SeO32- | селенито |
| SeO42- | селенато |
| Te2- | теллуро |
| N3- | нитридо |
| N3- | азидо |
| NH2- | имидо |
| NH2- | амидо |
| NH3 | аммин |
| NHOH- | гидроксиламидо |
| N2H3- | гидразидо |
| NO | нитрозил |
| NO2- | нитро |
| ONO- (NO2-) | нитрито |
| NO3- | нитрато |
| N2O22- | гипонитрито |
| P3- | фосфидо |
| PH2O2- (H2PO2-) | гипофосфито |
| PHO32- (HPO32-) | фосфито |
| PO43- | фосфато |
| AsO43- | арсенато |
| CO | карбонил |
| CH3O- | метоксо |
| C2H5O- | этоксо |
| CH3S- | метантиолато |
| C2H5S- | этантиолато |
| CN- | циано |
| OCN- | цианато |
| SCN- | тиоцианато |
| SeCN- | селеноцианато |
| TeCN- | теллуроцианато |
| CO32- | карбонато |
| HCO3- | гидрокарбонато |
| C2O42- | оксалато |
| C5H5- | циклопентадиенил |
Номенклатура комплексообразователей
Центральный атом в катионных и молекулярных комплексах называется так, как называется данный элемент в периодической системе и не имеет отличительного суффикса. Название центрального атома в анионных комплексах производят от латинского корня с добавлением суффикса — ат.
| Fe | феррат |
| Cu | купрат |
| Ag | аргентат |
| Au | аурат |
| Ni | никелат (николлат) |
| Sn | станнат |
| Mn | манганат |
| Hg | меркурат (гидраргират) |
После названия комплексообразователя в круглых скобках римской цифрой указывают степень его окисления. Для элементов с постоянной степенью окисления в соединениях (магний, цинк, алюминий и др.) этого не требуется.
Примеры
Используем приведенные номенклатурные правила, чтобы назвать комплексные соединения:
| K[Al(OH)4] | тетрагидроксоалюминат калия |
| [Zn(NH3)4](OH)2 | гидроксид тетраамминцинка |
| [Pt(NH3)2Cl2] | дихлородиамминплатина |
| [Fe(CO)5] | пентакарбонилжелезо |
| [ClO2][SbF6] | гексафторостибата(V) диоксохлора(V) |
| [H3O][SbF6] | гексафторостибат(V) гидроксония |
[Pt(NH3)2Cl2] — платина имеет переменную степень окисления, однако в данном случае она однозначно определяется как +2 из электронейтральности комплекса.Список использованной литературы
- Попков В. А., Пузаков С. А. Общая химия: учебник. — М.: ГЭОТАР-Медия, 2010. — 976 с.: ISBN 978-5-9704-1570-2. [с. 310-311]
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. — Мн.: Современная школа, 2005. — 608 с ISBN 985-6751-04-7. [c. 24-25]
Комплексные соединения
ч. 1
Методические материалы Лунькиной В.А. по теме:
Комплексные соединения.
“Все познается в сравнении”.
“Наиболее рациональный прием изучения нового — есть перенос знаний ранее изученного (известного) на новый изучаемый объект (на неизвестное)”.
Приступая к изучению вопроса о комплексных соединениях, вспомним строение азота и аммиака.
I. Азот. Аммиак. Азот затрачивает три неспаренных электрона на образование ковалентных связей с атомами водорода, т. е. образует с водородом три общие электронные пары. Собственную электронную пару азот использует на образование связи с протоном водорода.
N714 1S2 2S2 2P3 2 B=III иногда IV (при использовании
1 P пары s-электронов внешнего слоя).
S
Донорно-акцепторная связь
| ДОНОР H : N : H + H+: Cl- H акцептор | H+ H : N : H + Cl- Hхлорид аммония |
Комплексное соединение.
Соединения, образование которых не связано с возникновением новых электронных пар (общая электронная пара образовалась за счет собственной электронной пары одного из партнеров) – называются комплексными.
Создателем теории комплексных соединений, она называется координационной теорией, является шведский ученый Альфред Вернер. В начале прошлого столетия наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную школу химиков — комплесников.
Если, получив гидроксид меди, добавить к осадку раствор аммиака в воде, то осадок растворится и раствор станет прозрачным и темно-синим. Это образовалось комплексное соединение. Запишем уравнения реакций.
CuSO4+2NaOH=Na2SO4+Cu(OH)2
Cu(OH)2+4NH3= [Cu2+ (NH3) 4]2+*2OH-
Гидроксид тетрааммин меди II
На примере данного соединения рассмотрим состав комплексного соединения (КС). [Cu2+ (NH3) 4]2+*2OH-
Внешняя сфера – 2ОН- , внутренняя сфера -[Cu2+ (NH3) 4]2+
Комплексообразователь — Cu2+ (центральный ион, координатор).
Координационное число (кч) – 4 (число молекул или ионов, соединенных непосредственно с атомом-комплексообразователем).
Лиганды (или аденды) — (NH3) , молекулы или ионы, расположенные около комплексообразователя.
При написании формул комплексных солей, комплекс заключается в квадратные скобки. Комплексы могут выполнять роль катионов, анионов или нейтральных молекул, напимер:
[Cu2+ (NH3) 4]2+ — катион; [Fe+2(CN)6]-4 — анион; [Pt(NH3)2Cl4] – нейтральная молекула.
Заряд комплексного иона равен сумме зарядов комплексообразователя и лигандов. Алгебраическая сумма зарядов внутренней и внешней сферы равна нулю, например Na2[Zn(CN)4]. [Zn (CN)4]2- — внутренняя сфера, 2 Na+ — внешняя сфера.
Образование внутренней сферы комплексов происходит по донорно – акцепторному механизму. Комплексообразователь – акцептор, предоставляющий свободные ячейки.
Лиганды – доноры, предоставляющие свободные пары электронов. Роль комплексообразователя могут выполнять положительно заряженные ионы, имеющие небольшую величину ионного радиуса. Чаще всего это катионы d – металлов, т. е. элементов побочных подгрупп периодической таблицы. Известны комплексные соединения катионов – f,s,p – элементов.
Лигандами, как правило, являются ионы (анионы), или нейтральные молекулы, например: ионы F— фторо, Cl— хлоро, J- — иодо,CN- — циано,OH- — гидроксо,CNS- — роданидо; нейтральные молекулы H2O — аква, NH3 – аммин. Чтобы доказать амфотерность гидроксида алюминия, надо осуществить превращение: AlCl3Al (OH) 3Na[Al(OH) 6]
Гексагидроксоалюминат натрия – комплексное соединение.
Запишем уравнения реакций и составим комплексное соединение.
AlCl3+3NaOH=3NaCl+Al (OH)3
Al (OH)3+3NaOH=Na3 [Al(OH) 6]
Координационное число (КЧ) зависит от радиуса атома комплексообразователя и его заряда.
| КЧ (четное) | Заряд комплексообразователя |
| 2 | +1 |
| (6)4 | +2 |
| (4)6 | +3 |
| (6)8 | +4 |
Чем больше радиус комплексообразователя, тем большее число лиганд соединится с ним.
- Найдем комплексообразователь и определим его заряд – А1+3 .
- Определим координационное число комплексообразователя, т. е. число лиганд – 6.
- Находим лиганды. В данном случае это – ОН-.
4. Составляем формулу комплексного иона и подсчитываем его заряд: [Al+3(OH)- 6]-3.
+3 -6 за скобкой -3.
5. К комплексному иону дописываем внешнюю сферу — 3Na+.
Самостоятельная работа.
Составьте комплексные соединения, обозначьте составные части, заряды ионов.
2AgNO3 Ag+[Ag+(NO3)2]-
Pt+4Cl4*2KCl ( кч Pt=6) K2+[Pt+4(Cl-)6]-2
Названия комплексных соединений.
Формула комплексного соединения читается справа налево. Сначала называется анион (если он есть): Cl- — хлорид, ОН- — гидроксид, SO4 — сульфат и т.д. Число лигандов указывают греческими числительными: 1-моно, 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса. Ионы лигандов внутренней сферы в названии приобретают суффикс “о”(смотри выше). Комплексообразователь –корень латинский плюс окончание “ат” (высшая степень окисления (с.о.) или “ит” (низшая с.о.) или просто название металла. Если разная с.о. — она указывается римской цифрой. После обозначения состава внутренней сферы называют внешнесферные катионы (если такие имеются).
Задание. Дайте названия в каждом конкретном примере.
[Al(H2O) 6]Cl3 — хлорид гексааквааллюминия,
K2[Pt(Cl) 6] — гексахлороплатинат (IV) калия,
Na2[Zn(OH)4] -тетрагидроксоцинкат натрия,
[Cu(NH3)4]*2OH -гидроксид тетраамминмеди (II),
NH4Cl -хлорид аммония,
[Ag(NH3)2]Cl -хлорид диамминсеребра (I).
Свойства комплексных соединений.
Свойства комплексных соединений определяются их составом и строением. В воде они диссоциируют на внешнюю сферу и комплексный ион: K3[Fe(CN)6] ↔ 3К+ + [Fe(CN)6]-3
Важнейшим свойством комплексов в растворах является их устойчивость. Количественно она характеризуется константой нестойкости. Внутренняя сфера комплекса в незначительной степени подвергается электролитической диссоциации, распадаясь на комплексообразователь и лиганды, например:
[Fe(CN)6]-3 ↔ Fe+3 + 6 CN-
Отношение произведения концентраций комплексообразователя и лигандов к концентрации недиссоциированного комплекса называется константой нестойкости, т. е. константа нестойкости – это константа диссоциации комплексного иона:
[Fe3+]*[CN- ]6
Кнест. [Fe(CN)6]-3 = —————— = 1х10-44
[Fe(CN)6]-3
Чем меньше константа нестойкости, тем прочнее комплекс.
Комплексные соли вступают в реакции обмена и другие реакции, например:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] ↓ + 2K2SO4
Zn+2Na [Au (CN)2] = Na2[Zn(CN)4]+2Au
т.е. комплексные соли в растворах ведут себя так же, как и простые соли.
Пример окислительно – восстановительной реакции:
2K4[Fe(CN)6] + С12 = 2К3 [Fe(CN)6] + 2КС1
окисл. С12 +2е → 2С1- │2 1 процесс восстановления
│ 2
восст. Fe+2 – 1е → Fe+3 │1 2 процесс окисления
Объяснение амфотерности гидроксидов.
Согласно протолитической теории амфотерные соединения способны быть как донорами, так и акцепторами протона. Типичным примером амфотерных соединений может служить вода:
Н2О + Н2О ↔ Н3О+ + ОН-
Из гидроксидов наиболее ярко выражены амфотерные свойства у гидроксида галлия
Ga(OH)3 , для которого константы диссоциации в водном растворе по кислотному и основному типу почти равны.
Преобладание кислотных или основных свойств у гидроксидов различных элементов связано с положением элементов в периодической системе. Ослабление основных и усиление кислотных свойств гидроксидов R(OH)m наблюдается с увеличением поляризующего действия иона Rn+ , т. е.
с уменьшением его радиуса и возрастанием числа внешних электронов. Поэтому к сильным основаниям относятся гидроксиды щелочных и щелочноземельных металлов.
Во второй группе периодической системы бериллий и цинк, а в третьей группе алюминий, галлий и индий образуют амфотерные гидроксиды.
Исследование влияния концентрации ионов Н+ в растворе на свойства различных гидроксидов показало, что амфотерность обусловлена устойчивостью гидроксокомплекса данного металла. Гидроксид цинка растворяется в кислотах и щелочах, например:
Zn(OH)2 + 2HCl ↔ ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH + Na2[Zn(OH)4]
Или в ионной форме: Zn(OH)2 + 2H+ = Zn2+ + 2H2O
Zn(OH)2 + 2ОH- + [Zn(OH)4]2-
Цинк проявляет координационное число – 4, а лигандами в ионе являются ионы ОН-.В водном растворе свободные ионы не могут существовать , а находятся в виде гидратов.
Энергия гидратации велика и при этом образуются аквакомплексы постоянного состава. Число молекул воды равно КЧ. Аквакомплексы ведут себя как кислоты.
Например, в водном растворе какой либо соли цинка его аквакомплекс дисоциирует:
[Zn(Н2О)4]2+ ↔ [Zn(Н2О)3ОН]+ + Н+
В ряду аквакомплексов и аквагидроксокомплексов цинка
[Zn(Н2О)4]2+→ [Zn(Н2О)3ОН]+ → [Zn(Н2О)2 (ОН)2]↓ → [ZnН2О(ОН)3]-→ [Zn(OH)4]2-
каждый последующий член ряда по составу молекул отличается от предыдущего на один протон. При переходе каждого предыдущего члена в последующий первый ведет себя как кислота. Обратный переход связан с притяжением протона, а, следовательно, с проявлением соединением основных свойств. Равновесие взаимоперехода одних комплексов в другие
в указанном ряду вправо смещено в щелочной среде, а влево – в кислой.
Рассмотрим образование аналогичных комплексов у алюминия. При растворении алюминия в кислоте (в сильно кислой среде) получается катион в виде аквакомплекса:
2А1 + 6Н+ + 6Н2О = 2[А1 (Н2О)6]3+ + 3Н2↑
2А1 + 6НС1 + 6Н2О = 2[А1 (Н2О)6]С13 + 3Н2↑
Хлорид гексаакваалюминия
При постепенном прибавлении раствора щелочи происходит замена молекул воды в комплексе на гидроксильные группы (переход от аквакомплексов к гидроксокомплексам):
[А1 (Н2О)6]3+ + ОН- = [А1ОН(Н2О)5]2+ + Н2О
[А1ОН(Н2О)5]2+ + ОН- = [А1(ОН)2(Н2О)4]+ + Н2О
[А1(ОН)2(Н2О)4]+ + ОН- = [ А1(ОН)3(Н2О)3]↓ + Н2О
Нейтральный гидроксид не растворяется в воде и выпадает в осадок.
При дальнейшем прибавлении раствора щелочи снова образуются ионы, но уже не катионы а анионы, и осадок растворяется: [ А1(ОН)3(Н2О)3] + ОН- = [ А1(ОН)4(Н2О)2]- + Н2О
[ А1(ОН)4(Н2О)2]- + ОН- = [ А1(ОН)5(Н2О)]2- + Н2О
[ А1(ОН)5(Н2О)]2- + ОН- = [ А1(ОН)6]3- + Н2О
Таким образом, амфотерность трехвалентного алюминия проявляется в возможности его существования в водном растворе в составе как катионов, так и анионов. Состав этих ионов зависит от кислотности среды. В школьном курсе химии принято для аниона использовать формулу А1(ОН)4- , где координационное число алюминия не 6, а- 4.
Получение комплексных солей.
Комплексные соли получаются в результате реакций обмена, соединения, окислительно-восстановительных реакций, при электролизе, например:
HgI2 + 2KI = K2 [HgI4]
избыток
CuSO4 + 4NH4OH = [Cu (NH3) 4] SO4 + 4H2O
Применение КС.
а) Гальванические покрытия — защита одного металла другим. Медью покрывают железо с помощью КС, тогда медное покрытие крепко соединяется с железом.
б) Электролитическое получение металлов
Алюминий в расплаве криолита: Nа3[AlF6]. Из расплавов соединений комплексных солей получают Nb, Tl, Th, Mg.
в) Защита металлов от коррозии. Ингибиторы — комплексные органические вещества или комплексные соли.
г) Аналитическая химия.
КС — реактивы, индикаторы, которые помогают распознать вещества или ионы
соединений, заряды ионов: железо +2 можно распознать с помощью реакции 3Fe+2SO4+2K3[Fe+3(CN)6]-3=3K2 SO4+Fe3+2[Fe+3(CN)6]2-3
синий осадок (турнбулева синь)
II опыт: 4Fe+3Cl3+3K4[Fe+2(CN)6]-4=12KCl +Fe4+3[Fe+2(CN)6]3-4
темно-синий осадок (берлинская лазурь)
д) Получение металлов (золота).
Золотой песок растворяется в растворе цианида натрия (NaCN), в присутствии кислорода и воды. Образуется комплексное соединение.
4Au + O2 + 2H2O + 8Na CN = 4Na[Au+(CN) 2] -+ 4Na OH (C.O. Au-+1, кч-2)
Из полученного КС золото вытесняют цинком.
Zn+2Na [Au (CN)2]=Na2[Zn(CN)4]+2Au
е) Комплексные соединения — важнейшие органические соединения – гемоглобин и хлорофилл (схема строения данных соединений в книге «Металлы в живых организмах» автор Николаев Л.А. или Соросовский образовательный журнал №3 1997год), ферменты, витамины и т.д. Синтез лекарственных препаратов, витаминов, биодобавок и многих других веществ, связан с комплексными соединениями.
Литература:
- Гузей Л.С., Суровцева Р.П. учебник “Химия 10 класс”
- Л.А. Николаев “Металлы в живых организмах”, М.:Просвещение,1983
- Вузовский учебник Глинка Н.Л. “Общая химия”
- Хомченко Г.П. “Неорганическая химия”
- Ф.Б. Гликина, Н.Г. Ключников “Химия комплексных соединений М.: Просвещение 1982”
- Соросовский образовательный журнал №3 1997 г стр.58
- Ю.Н. Кукушкин “Соединения высшего порядка”, Ленинград “Химия” 1991.
Лунькина В.А., учитель МОУ СОШ №1, р.п. Колышлей, Пензенской области.
ч. 1
Структура, классификация, номенклатура комплексных соединений
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы.
Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
- Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки.
Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl– соответственно.
- Центральный атом или ион внутренней сферы называют комплексообразователем.
Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы.
Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+.
- Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др.
В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
- Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
- Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
- По электрическому заряду: катионные, анионные и нейтральные комплексы.
- Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
- Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4]
- Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.
- По количеству комплексообразователей
- Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
- Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
- Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
- Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
- Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], .
- Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4]
- Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
- По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- Кислоты — H[AuBr4], H2[PtCl6]
- Основания — [Cu(NH3)4](OH)2,[Ag(NH3)2]OH
- Соли — Cs3[Al(OH)6], [Ni(H2O)4]Cl2
- Неэлектролиты — [Pt(NH3)2Cl2]
- По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
- Монодентатные лиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN−, F−, Cl−, OH−, SCN−, и др.
- Бидентатные лиганды. К такому типу лигандов относятся ионы H2N—CH2—COO−, СО32−, SO42−, S2O32−, молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
- Полидентатные лиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантные лиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
- В названиях комплексных соединений, как и ионных солей, первым указывают анион, а затем – катион.
- В названии комплекса сначала указывают лиганды, а после – комплексообразователь. Лиганды перечисляют в алфавитном порядке.
- Нейтральные лиганды называются также, как молекулы, к анионным лигандам прибавляют окончание –о. В таблице ниже даны названия наиболее распространенных лигандов
| Лиганд | Название лиганда | Лиганд | Название лиганда |
| en | этилендиамин | O2- | Оксо |
| H2O | Аква | H— | Гидридо |
| NH3 | Аммин | H+ | Гидро |
| CO | Карбонил | OH— | Гидроксо |
| NO | Нитрозил | SO42- | Сульфато |
| NO— | Нитрозо | CO32- | Карбонато |
| NO2— | Нитро | CN— | Циано |
| N3— | Азидо | NCS— | Тиоционато |
| Cl— | Хлоро | C2O42- | Оксалато |
| Br— | Бромо |
- Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
- Названия комплексных анионов оканчиваются суффиксом – ат
- После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем следующие соединения:
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
Начнем с лигандов: в комплексном анионе содержится 4 лиганда CN—, которые называются тетрациано.
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия