Правила
составления формул основных солей по
названию.
Пример
1.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)FeOHCl
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе — одна ОН группаНазвание
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( — 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)+3
-1 -1FeOHCl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( — 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть — металл с ОН группой;
вторая часть — кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+3
-1(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2+3
-1 -1FeOHCl
+2
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2У
группы FeOH индекс1
не пишем+3
-1 -1FeOHCl2
+2
+ (-2) = 0Вторая
часть: кислотный остаток ( Cl )Для
равенства зарядов у кислотногоостатка
Cl пишем индекс: 2Заряд
второй части равен:-1
•
2 = — 2
¾
12 ¾
Пример
2.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)Fe(OH)2Cl
Приставка
ДИГИДРОКСО означает, что соль
основная,и
в её составе — две ОН группы“ДИ”
означает ДВЕ ( две ОН группы )Название
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
группа Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( — 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)+3
-1 -1Fe(OH)2Cl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( — 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть — металл с ОН группой;
вторая часть — кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группы+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
+ ( -1 ) = 0Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
1 = — 1Заряды
частей равны, поэтому, индексы ставить
не надо, т.к. формула составлена.
¾
13 ¾
Пример
3.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)СuOHCO3
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе — одна ОН группаНазвание
КАРБОНАТ означает, что это соль
угольнойкислоты,
поэтому, в составе кислотного остатка
группа CО3
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( — 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)+2
-1 -2СuOHCO3
Валентность
меди равна II ( указано в названии ),поэтому,
заряд атома меди равен ( + 2 )Валентность
кислотного остатка CО3
равна
II , т.к.в
Н2CО3
два атома водорода, поэтому, заряд
CО3равен
( — 2 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть — металл с ОН группой;
вторая часть — кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+2
-1(
СuOH )Заряд
первой части равен:+2
+ (-1) = +1+2
-1 -2CuOHCO3
+1
-2Вторая
часть: кислотный остаток(
CO3
)Заряд
второй части равен: -2
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
CuOH )Заряд
первой части равен:+2
+ (-1) = +1У
группы CuOH запишите индекс 2+2
-1 -2(СuOH)2CO3
+1
+ (-2) = -1Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
2 = — 2У
кислотного остатка CO3индекс
1 не пишем
¾
14 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
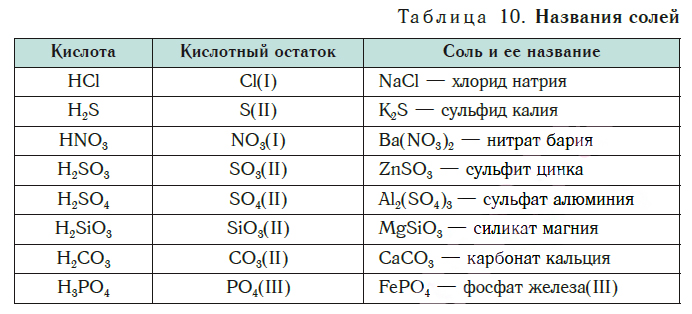
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте H3PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
| 01 |
Соли — самый разнообразный и многочисленный класс неорганических соединений. Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства. |
||||||||
Средние соли |
|||||||||
| 02 | Наиболее простые среди прочих видов солей — средние:
средние соли — это соединения, состоящие из атомов металлов и кислотных остатков Свое название эти соли получили именно потому, что представляют собой нечто среднее между основанием и кислотой: |
||||||||
| 03 |
Согласно правилам систематической номенклатуры название средней соли состоит из названия кислотного остатка, названия металла и валентности металла, если она не постоянна:
|
| 04 | Чтобы определить неизвестную валентность металла по формуле соли, необходимо:
|
||||||
| 05 | Можно воспользоваться альтернативным способом определения валентности металла:
|
||||||
| 06 | Чтобы написать формулу средней соли по ее названию, например:
необходимо, как и в любых подобных ситуациях:
|
||||||
| 07 |
К средним солям относится и хорошо знакомая нам поваренная соль — это хлорид натрия NaCl. Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). |
Кислые соли |
|||||
| 10 | Кислые соли называются так потому, что при их образовании не все атомы водорода в кислоте были замещены атомами металлов:
кислые соли — это соединения, состоящие из атомов металлов, кислотных остатков и не замещенных металлами атомов водорода Например, серная кислота может образовывать как средние, так и кислые соли:
В то же время бромистоводородная кислота HBr, не может образовывать кислых солей вообще, поскольку имеет лишь один атом водорода: либо он есть, либо его нет. А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4. |
||||
| 11 |
Каждый атом водорода уменьшает валентность кислотного остатка на единицу. Так, если для образования средней соли одному атому двухвалентного кальция требовался один сульфат, то в случае кислой соли их потребуется уже два:
|
||||
| 12 |
Название кислой соли состоит из названия кислотного остатка, к которому добавляется префикс гидро- или дигидро-, в зависимости от того, сколько атомов водорода — один или два, — с ним связано, а также названия металла и его валентности, если она не постоянна:
|
||||
| 13 | Валентность металла в кислой соли, например Cr(HSO3)3, определяется по известному алгоритму: | ||||
| 14 | Теперь попробуем вывести формулу кислой соли по ее названию, например:
Для этого:
|
||||
Основные соли |
|||||
| 15 | Осно́вные соли называются так потому, что при их образовании не все гидроксилы в соответствующем основании были замещены кислотными остатками:
основные соли — это соединения, состоящие из атомов металлов, незамещенных гидроксилов и кислотных остатков. Так, кальций может образовывать одну основную соль:
а трехвалентное железо — две: Гидроксиды же одновалентных металлов, очевидно, вообще не могут образовывать основных солей. |
||||
| 16 |
Каждый гидроксил уменьшает валентность металла на единицу: в средней соли на один карбонат приходится один атом кальция, а в основной соли — уже два:
|
||||
| 17 |
Название основной соли состоит из названия кислотного остатка, названия металла, к которому добавляется префикс гидроксо-, дигидроксо- или тригидроксо-, в зависимости от того, сколько гидроксилов — один, два или три, — связано с одним атомом металла, а также валентности металла, если она не постоянна:
|
||||
| 18 | Валентность металла в основной соли, например Sn(OH)3NO3, определяется таким же способом, как и в других типах солей: | ||||
| 19 | Чтобы вывести формулу основной соли по ее названию, например
силикат гидроксомеди (II), сделаем следующее:
|
||||
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» — краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
—
HCl соляная
кислота Cl хлорид
—
HF фтороводородная
кислота F фторид
—
HBr бромоводородная
кислота Br бромид
—
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
—
HNO3
азотная кислота NO3 нитрат
—
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
—
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3

























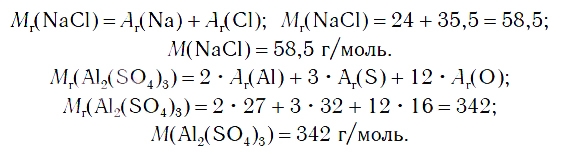


2.jpg)
3.jpg)



2.jpg)

2.jpg)

2CO3.jpg)
2Br.jpg)