Тема: Соли. Составление формул по степени окисления.
Цель урока:
-
дать понятие о классе неорганических соединений – солях;
-
сформировать умение составлять формулы солей и правильно давать им названия;
-
привести в систему знания учащихся о классификации солей.
Задачи урока:
Обучающие:
1.Дать определение солей.
2. Рассмотреть состав и название солей.
3. Продолжить обучение школьников определять степени окисления в сложных соединениях.
4. Научить, составлять формулы солей.
5. Познакомить с физическими свойствами солей.
6. Познакомить учащихся с классификацией солей.
Развивающие: развивать составление степени окисления элементов, мышление, память, внимание, логическое мышление, умение работать в парах, умение работать с малым набором реактивов.
Воспитывающие: воспитание толерантности, умение работать в парах и в группе.
Методы: частично — поисковый, объяснительно- иллюстративный.
Тип урока: комбинированный.
Метапредметные связи: биология, география.
Формы организации познавательной деятельности обучающихся: индивидуальная, парная и групповая.
Реактивы: Образцы солей: железный купорос, мел, хлорид натрия, медный купорос, сульфат магния.
Оборудование: Таблица Д.И.Менделеева, таблица растворимости кислот, оснований и солей в воде, ПК, экран, штатив с пробирками.
Учебник: Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2008г.
Планируемые результаты обучения. Учащиеся должны уметь:
-
составлять формулы солей;
-
давать им названия;
-
отличать соли от других классов неорганических соединений.
Ход урока:
I.Организационный момент.
-Проверка подготовленности учащихся к уроку.
— Приветствие, фиксация отсутствующих.
— Организация внимания.( Сигнал тишины)
II.Актуализация изученных знаний:
1.Фронтальный опрос:
-
Какие классы веществ вы знаете?
-
Что такое оксиды?
-
Что такое основания?
-
Что такое кислоты?
2.Обучающая структура .
1 этап. «Мозговой штурм»
-Учитель задает тему для обсуждения и время для размышления.
-учащиеся записывают максимальное количество слов или фраз по теме индивидуально и в тишине. (задается слово КИСЛОТЫ)
(Предполагаемые записи учащихся: соляная, серная, угольная и т.п., формулы кислот, одноосновная, двухосновная, простые ионы, сложные ионы, индикаторы, лакмус, красный цвет, растворимые, нерастворимые и т.д.)
2 этап. Создание связей и формулирование вопроса.
3 этап. Формулирование выводов и обмен ответами.
III. Изучение новых знаний.
Учитель предлагает отгадать загадку: «Без этого вещества невозможно жизнь растений, животных, человека. В год человек потребляет от 3 до 5 кг этого вещества. Это символ гостеприимства и радушия хозяев». Что же это за вещество? (Ответы учащихся: соль). Слайд №3
Учитель: Ребята, сегодня мы с вами посещаем Страну веществ, название класса которых означает «рождённые солнцем». Почему? Потому что многие вещества этого класса любят «прятаться» в воде. Но как только горячие солнечные лучи выпарят воду, эти вещества предстают перед нами во всей своей красе. Посмотрите, какими разными они бывают! (Слайды с изображением нового класса соединений №4)
Учитель просит из предложенных формул выбрать те формулы, которые они ещё не изучали. (Слайд № ) И сравнить, чем они сходны между собой, а чем отличаются? (предполагаемый ответ: сходство — во всех формулах на первом месте присутствует металл, а отличаются кислотными остатками).
Учащимся предлагается сформулировать определения самим, а затем поверяют по изображению на экране:
|
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков. |
Интересный материал (Сообщение заранее готовит один из учащихся):
Это самый многочисленный класс из неорганических соединений. А одно вещество из этого класса все мы используем в пищу.
Когда-то в Голландии существовала мучительная казнь: осужденные получали только хлеб и воду без добавления этой соли. Через некоторое время эти люди умирали, а их трупы начинали мгновенно разлагаться…
А жители некоторых островных государств, чтобы утолить потребность в соли, ели сырую рыбу, обмакивая ее в морскую воду. Она называется поваренная соль. Её формула NaCI. Состоит из ионов Na+ и CI—.
(Самостоятельное изучение учебника стр.110 снизу 2-ой абзац). Добывание соли в природе.
IV.Вывод: Соли имеют большое практическое значение.
-Так как соли очень важны, мы должны знать их свойства. Перед тем как приступить к рассмотрению этого вопроса проведем физ.минутку.
Вносим в почву мы фосфаты.
Не забудем и нитраты.
Ну, а осенью, друзья,
Испеку пирог вам я.
-Рассмотрим физические свойства солей.
Выполнение лабораторной работы. Учащиеся, работают в парах, знакомятся с образцами солей и заполняют таблицу:
|
Название вещества |
Агрегатное состояние |
Цвет |
Запах |
Формула |
Раство- римость в воде |
|
Карбонат кальция |
CaCO3 |
||||
|
Кристаллогидрат сульфата меди (II) – медный купорос |
CuSO4*5H2O |
||||
|
Хлорид натрия |
NaCI |
||||
|
Кристаллогидрат сульфата железа (II) – железный купорос |
FeSO4*7H2O |
||||
|
Сульфат магния |
MgSO4 |
Структура ТАЙМД РАУНД РОБИН (Timed Round Robin)
Работа в группе, по часовой стрелке.
IV.Вывод: Соли представляют твёрдые вещества, кристаллические, хорошо растворимые в воде, с разнообразным цветом.
Номенклатуру солей изучаем по учебнику таблица 5 стр.109.
Обращаем внимание на таблицу растворимости веществ. Изучаем растворимость солей.
IV.Вывод: По растворимости в воде соли делят на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Если нет таблицы, есть правила, которые очень легко запомнить. (учебник стр.109-110)
V. Закрепление.
Задание 1: По таблице растворимости дать названия всех солей для иона натрия.
III.Объяснение учителя:
При составлении формулы соли необходимо:
-
расставить заряды ионов металлов и заряды ионов кислотных остатков;
-
найти наименьшее общее кратное числовых значений зарядов.
-
Разделить наименьшее общее кратное на величины зарядов.
-
Записать индексы..
V. Закрепление.
Задание 2: С помощью таблицы растворимости составить формулу сульфата алюминия.
III.Объяснение учителя:
Определение степеней окисления каждого элемента соли аналогично кислотам:
Na+12CХ O3-2 +1∙2 + Х + (-2)∙3 = 0 Х = + 4
Na+12C+4 O3-2.
V. Закрепление.
Задание 3: Определите степени окисления каждого элемента для солей: Na2CO3, K3PO4 и дайте названия солям.
VI.Домашнее задание.
-Изучить параграф.21, упр.1 стр. 113.
-Знать определение и правила, изученные на уроке.
VII. Итог урока .
РЕЛЛИ РОБИН (Rally Robin) — обучающая структура, в которой два участника поочередно обмениваются короткими ответами в виде списка.
Музыка. Встают, двигаются, находят пару.
Обсуждают, что нового узнали на уроке в паре.
Учитель предлагает одному учащемуся проговорить вслух.
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте H3PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
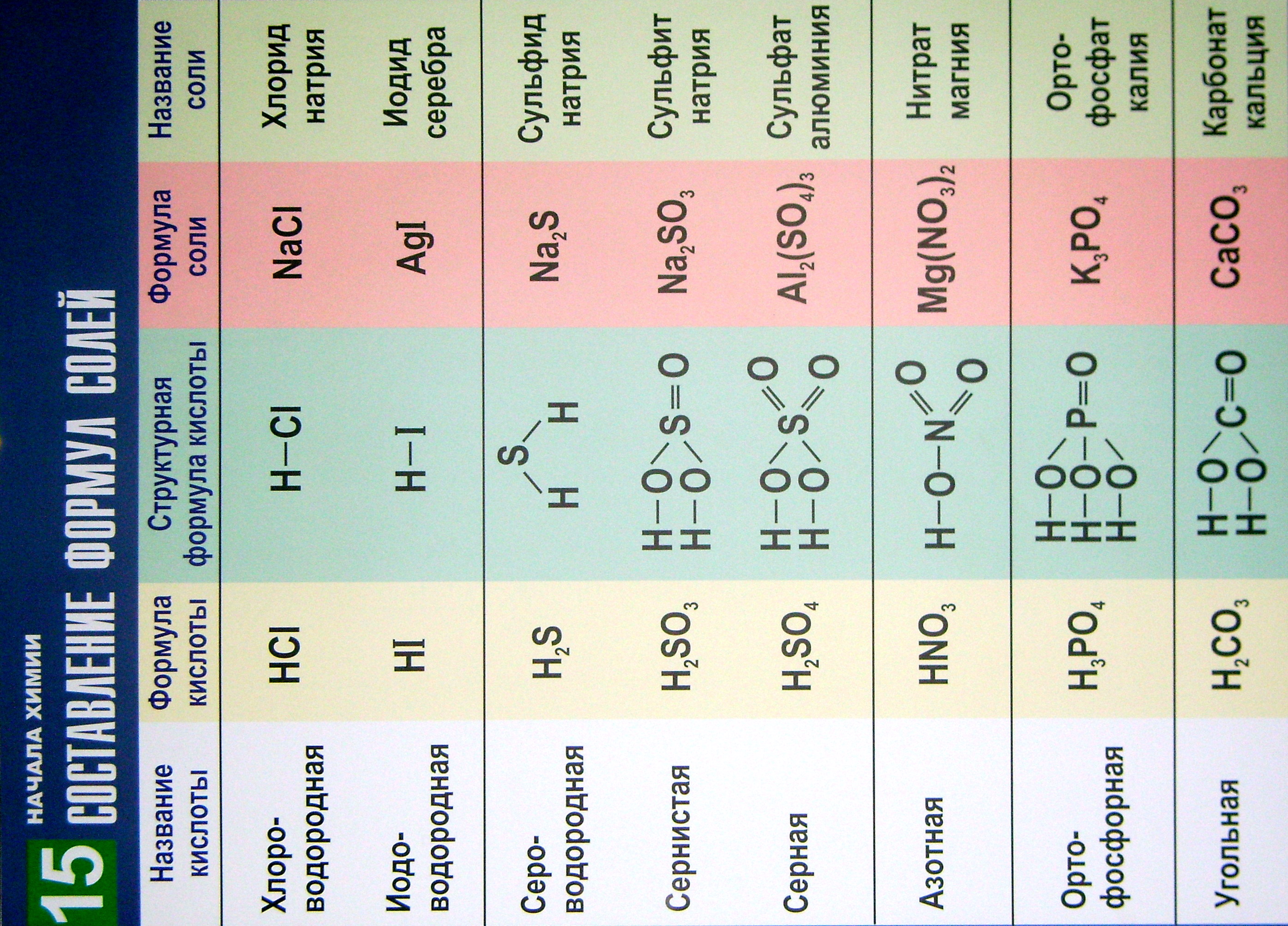
В таблице 15 приведены
названия часто встречающихся кислот,
их молекулярные и структурные формулы,
а также формульные единицы и названия
соответствующих солей.
Таблица помогает
составлять химические формулы солей
бескислородных и кислородсодержащих
кислот. Для образования химических
формул солей надо атомы водорода в
кислотах заменить на атомы металлов с
учётом их валентности.
Приведённые
названия кислот и солей соответствуют
принятой международной номенклатуре.
Название
бескислородных кислот образуются по
правилам для бинарных соединений.
Названия солей
начинаются с названия кислотного остатка
в именительном падеже. Это название
образуется из корня латинского названия
химического элемента, образующего
кислоту, и окончания «ат» или «ит»
в случае солей кислородсодержащих
кислот, для солей бескислородных кислот
– «ид».
Затем в солях бескислородных кислот
называется металл в родительном падеже.
Причём если атом металла может иметь
разную валентность, то её отмечают
римской цифрой (в скобках) после названия
химического элемента (без пробела).
Например, хлорид железа(II) и хлорид
олова(IV).
Включение в таблицу
названий молекулярных и структурных
формул часто встречающихся кислот
позволяет легко запомнить приведённые
в ней сведения.
Названия кислот
типа HnXOm
составляют с учётом валентности (степени
окисления) центрального атома:
-
атом X
имеет высшую (или единственную)
валентность (степень окисления): H2SО4
–
серная; HNО3
–
азотная; Н2СО3
– угольная; -
атом X
имеет промежуточные степени окисления:
H2SO3
–
сернистая; HNО2
–
азотистая; НСlО – хлорноватистая.
Таблица 15
Составление химических формул солей
16. Генетическая связь классов неорганических веществ
Таблица 16 показывает
в виде схемы взаимосвязь неорганических
веществ разных классов. Изучение свойств
веществ показывает, что можно при помощи
химических реакций переходить от простых
веществ к сложным и от одних сложных
веществ к другим. Связь между веществами
разных классов, основанная на их
взаимопревращениях и отражающая единство
их происхождения, называется
генетической.
Вещества по составу
подразделяются на простые и сложные.
Среди простых веществ различают
металлы и неметаллы. Эти две группы
веществ могут образовывать многочисленные
сложные вещества. К основным классам
неорганических соединений принадлежат
оксиды, гидроксиды и соли. Связь между
этими классами веществ обозначена при
помощи стрелок.
По таблице можно
проследить переходы металлов и неметаллов
в оксиды и гидроксиды:
|
металл |
+ |
О2 |
→ |
оксид, |
оксид металла |
+ |
Н2О |
→ |
гидроксид1 |
|
|
неметалл |
+ |
О2 |
→ |
оксид, |
оксид неметалла |
+ |
Н2О |
→ |
кислород |
Эти две цепочки
превращений аналогичны и роднят металлы
и неметаллы.
Однако надо
подчеркнуть, что простое вещество металл
является родоначальником сложных
веществ, обладающих оснóвными
свойствами (оснóвных оксидов и оснований).
Простое вещество неметалл выступает в
качестве родоначальника сложных
веществ, проявляющих кислотные свойства
(кислотных оксидов и кислот).
Различие свойств
кислотных и оснóвных оксидов, а также
свойств кислот и оснований приводит к
их взаимодействию друг с другом с
образованием солей. Таким образом, соли
генетически связаны с исходными
веществами – металлами и неметаллами
– посредством
их оксидов и гидроксидов.
Так как соли
представляют собой продукты реакций
кислот и оснований, то по составу
различают средние (нормальные), кислые
и оснóвные соли. Кислые соли содержат
в своём составе атомы водорода, оснóвные
– гидроксогруппы. Названия кислых солей
складываются из названий солей с
прибавлением слова «гидро», а
основных –
«гидроксо».
Существуют также
двойные соли (соли двух металлов), к ним
относят, например, алюмокалиевые квасцы
KA1(SО4)2
· 12Н2О,
смешанные соли NаСl · NаF, СаВrСl, комплексные
соли Nа2[Zn(ОН)4],
К3[Fе(СN)6],
К4[Fе(СN)6],
включая кристаллогидраты СuSО4
· 5Н2О
(медный купорос), Nа2SО4
· 10Н2О
(глауберова соль)
Необходимо научиться
составлять химические формулы гидроксидов
(кислородсодержащих кислот и оснований)
для атома элемента Э с валентностью
«n». Гидроксиды получают по реакции
присоединения воды к соответствующим
оксидам. При этом не имеет значение,
происходит ли эта реакция в реальных
условиях. Например, химическую формулу
угольной кислоты получают сложением
всех атомов по уравнению реакции
СО2
+ Н2О
= Н2СО3.
Химические формулы
метафосфорной,
пирофосфорной
и ортофосфорной
кислот составляют из формулы оксида
фосфора(V)1
и соответственно одной, двух и трёх
молекул воды:
Р2О5
+ Н2О
= 2НРО3;
Р2О5
+ 2Н2О
= Н4Р2О7;
Р2О5
+ 3Н2О
= 2Н3РО4.
Приведённая схема
взаимосвязи между классами неорганических
веществ не охватывает всего многообразия
химических соединений. В этой схеме в
качестве бинарных веществ выступают
оксиды,
Таблица 16
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Степень
окисления. Составление формул по степени окисления.
Курова
Ольга Геннадьевна,
учитель
химии МБОУ СОШ № 6 г. Торжка
Цели урока.
Дидактические:
- опираясь на знания учащихся,
повторить понятия “химическая формула”; - способствовать формированию у
учащихся понятия “степень окисления” и умению определять степень
окисления элементов по формулам веществ; - акцентировать внимание
школьников на возможности интеграции курсов химии, математики.
Развивающие:
- продолжить формирование умений
формулировать определения; - разъяснять смысл изученных
понятий и объяснять последовательность действий при определении степени
окисления по формуле вещества; - способствовать обогащению
словарного запаса, развитию эмоций, творческих способностей; - развивать умение выделять
главное, существенное, сравнивать, обобщать, развивать дикцию, речь.
Воспитательные:
- воспитывать чувство
товарищества, умение работать коллективно; - повысить уровень эстетического
воспитания учащихся; - ориентировать учащихся на
здоровый образ жизни.
Планируемые
результаты обучения:
- Учащиеся должны уметь
формулировать определение “степень окисления”, знать атомы с постоянной
степенью окисления, определять по ней степень окисления атомов других
элементов в бинарных соединениях, - Уметь разъяснять смысл понятия
“степень окисления” и последовательность действий при ее определении атомов
элементов по формулам веществ.
Понятия, впервые
вводимые на уроке: степень окисления, значения степени окисления..
Организационные
формы: беседа,
индивидуальные задания, самостоятельная работа.
Средства обучения:
алгоритм
определения степени окисления
Демонстрационное
оборудование: шаростержневые модели молекул хлороводорода, воды,
аммиака, метана.
Оборудование для
учащихся:
на каждом столе “Алгоритм определения степени окисления”.
Опережающее
задание: индивидуальное
задание – подготовить сообщение на тему “Эволюция понятия “степень окисления”.
Ход урока
I. Ориентировочно-мотивационный
этап.
1. Фронтальная беседа с учащимися
по пройденной теме “Химическая формула”.
Задание: Чтение
формул, отработка информации по ним. (Демонстрация учителем формул,
отпечатанных на отдельных листах).
2. Индивидуальная работа по карточкам
трёх учащихся по теме “Расчеты по формуле”. Учащиеся проводят расчеты
относительной молекулярной массы, массовых соотношений, массовой доли. (Выполняют
решение на доске). Анализируют и оценивают учащиеся класса.
Карточка № 1.
Рассчитайте относительную молекулярную массу, массовые соотношения, массовые доли
веществ: NaCl, K2O. Необходимые данные – в ПС
Карточка № 2. Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CuO, SO2.
Карточка № 3. Рассчитайте
относительную молекулярную массу, массовые соотношения, массовые доли веществ:
CH4, NO.
3. Самостоятельная работа учащихся
в тетрадях.
Задача
информационно-вычислительного характера (условие записано в раздаточном
материале).
Эффективность зубных паст в профилактике
кариеса можно сравнить по содержанию в них активного фтора, способного
взаимодействовать с зубной эмалью. Зубная паста “Флюорит” (производство Россия)
содержит, как указано на упаковке, SnF2, а зубная паста “DENT”
(производство Болгария) содержит NaF. Вычислите, какая из этих двух паст более
сильнодействующее средство для профилактики кариеса.
Проверка: решения
у пяти первых учащихся, обсуждение и решение у доски — один
учащийся.
II.
Операционно-исполнительный этап.
1. Объяснение учителя. Постановка
проблемы.
Понятие степени окисления.
– До сих пор мы пользовались
готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести
на основании данных о составе веществ. Но чаще всего при составлении химических
формул учитываются закономерности, которым подчиняются элементы, соединяясь
между собой.
Задание: сравните
качественный и количественный состав в молекулах: HCl , H2O, NH3,
CH4.
Беседа с
учащимися:
– Что общего в составе молекул?
Предполагаемый
ответ: Наличие
атомов водорода.
– Чем они отличаются друг от друга?
Предполагаемый
ответ:
- HCl – один атом хлора
удерживает один атом водорода, - H2O – один атом
кислорода удерживает два атома водорода, - NH3 – один атом
азота удерживает три атома водорода, - CH4 – один атом углерода
удерживает четыре атома водорода.
Демонстрация шаростержневых
моделей.
Проблема: Почему
различные атомы удерживают различное количество атомов водорода?
(Выслушиваем
варианты ответов учащихся).
Вывод: У атомов
разная способность удерживать определённое количество других атомов в
соединениях. Это можно определить по степени окисления элементов в молекуле.
Степень окисления в неорганической химии
Степень окисления (с.о.) – условный заряд атома
(или группы атомов) в соединении, вычисленный из предположения, что оно состоит
только из ионов.
Ионы – это положительно (катионы) или
отрицательно (анионы) заряженные частицы, образованные в результате отдачи или
присоединения электронов нейтральными атомами или группами атомов.
Запись в тетради:
Степень окисления может быть
положительная у металлов и неметаллов, когда атом отдает все валентные
электроны, обозначается (+ n), где n – номер группы.
Записи на доске и
в тетрадях:
|
+1 -1 |
+1 |
+1 |
I |
Степень окисления водорода
постоянная с неметаллами и равна +1, степень окисления кислорода (-2).
Правила определения степеней окисления
1. В простом веществе степень окисления атомов равна 0.
2. Сумма степеней окисления в нейтральном соединении равна 0, в
многоатомном ионе равна заряду иона.
3. В бинарном соединении степень окисления более
электроотрицательного атома обозначают со знаком «–», а менее
электроотрицательного – со знаком «+».
4. Cтепени окисления атомов некоторых элементов в соединениях:
а) фтора (F) –1;
б) металлов Iа группы (Li, Na, K, Rb, Cs) +1, металлов IIа группы
(Be, Mg, Ca, Sr, Ba) +2, алюминия (Al) +3;
в) водорода (Н) в соединениях с металлами –1, в остальных
соединениях +1;
г) кислорода (О) во фториде OF2 +2, в пероксиде O2F2
+1, в остальных пероксидах (содержат группу –О–О–) –1, в остальных соединениях
–2.
5. Суммарная степень окисления атомов элементов гидроксильной
группы OH –1, группы NH4 +1.
6. Суммарная степень окисления атомов элементов кислотного остатка
(продукта «отрыва» одного или нескольких ионов H+ от кислоты)
отрицательна и равна числу «оторванных» ионов Н+.
Программа деятельности № 1.«Определение степени окисления атома по
формуле вещества»
|
Программа деятельности |
Пример выполнения |
|
1) Запиши известные значения с.о. атомов |
+1 |
|
2) Вычисли суммарные с.о. атомов каждого элемента, для этого: а) |
а) У K: (+1)•2 = +2, |
|
3) Определи суммарную с.о. для атомов того элемента, у которого |
Суммарная с.о. (2Сr) = +12 |
|
4) Рассчитай искомую с.о., для этого раздели величину, |
с.о. (Сr) = (+12)/2 = +6, +1 |
Программа деятельности № 2.«Составление эмпирической формулы
вещества по степеням окисления атомов или зарядам ионов»
|
Программа деятельности |
Примеры выполнения |
|
|
1) Запиши знаки химических элементов, образующих соединение*, |
+3 –2 |
Na+(PO4)3– |
|
2) Для с.о. или зарядов ионов найди наименьшее общее кратное |
НОK (2•3) = 6 |
НОK (1•3) = 3 |
|
3) Рассчитай число атомов или ионов в соединении, для этого |
6 : 3 = 2, |
3 : 1 = 3 |
*Если бинарное соединение состоит из атомов металла и неметалла,
то на первое место в формуле ставят символ металла; если бинарное соединение
состоит из атомов двух неметаллов, то на первом месте пишут символ элемента,
который стоит левее в ряду:
Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl,
O, F.
III.
Оценочно-рефлексивный этап.
Первичная проверка усвоения знаний.
В течение трёх минут необходимо
выполнить одно из трёх заданий по выбору. Выбирайте только то задание, с
которым вы справитесь. Задание в раздаточном материале.
- Репродуктивный
уровень (“3”). Определите степень окисления атомов химических
элементов по формулам соединений: NH3, Au2O3,
SiH4, CuO. - Прикладной
уровень (“4”). Из приведённого ряда выпишите только те формулы,
в которых атомы металлов имеют степень окисления (+2): MnO, Fe2O3
, CrO3, CuO, K2O, СаH2. - Творческий
уровень (“5”). Найдите закономерность в
последовательности формул: N2O, NO, N2O3
и проставьте степень окисления над каждым элементом.
Проверка
выборочная. Консультант из числа учащихся по готовому
шаблону проверяет тетради учащихся.
Работа над
ошибками.
Ответы на обратной стороне доски.
Проверь себя
Упражнение 1. Запиши символы:
а) неметаллов с постоянной с.о. ………………………………….………………… ;
б) металлов с постоянной с.о. ……………………………………………………….. .
Упражнение 2. Стрелками укажи c.о.
атомов кислорода и водорода в веществах:
Упражнение 3. Составь формулы
кислотных остатков и определи суммарную с.о. атомов элементов.
|
Kислота |
Kислотные остатки |
с.о. |
|
H2SO4 |
HSO4 |
–1 |
|
SO4 |
–2 |
|
|
H3PO4 |
H2PO4 |
…………… |
|
HPO4 |
……………. |
|
|
PO4 |
…………… |
|
|
HNO3 |
…………… |
…………… |
|
H2SO3 |
…………… |
…………… |
|
…………… |
…………… |
|
|
H2CO3 |
…………… |
…………… |
|
…………… |
…………… |
Упражнение 4. Определи степени
окисления атомов элементов, входящих в состав веществ:
а) AlCl3, H2Se, CaH2, SiF4,
AlN, XeO4, LiH, SF6, NH3, NF3, N2O5,
N2H4, O2F2, P4O10,
I2O5, Ca2Si;
б) HСlO, KHF2, K2CO3, KСlO3,
HСlO4, NH4OH, NaClO2, H3PO4,
K2Cr2O7, NH2OH, MgOHCl, Cl2.
Упражнение 5. Проставь степени
окисления атомов металлов и суммарные с. о. атомов элементов кислотных остатков
следующих солей (формулы кислот см. в приложении, табл. 2):
a) MnSO4, LiNO2, PbSiO3, Fe(NO3)3;
б) Fe2(SO4)3, Hg(NO3)2,
Zn3(PO4)2, Cd(HCO3)2;
в) Fe3(PO4)2, SnHPO4,
Pb(HSO4)2, Cu(NO3)2;
г) Ag2SO3, Cu(NO2)2,
Fe(H2PO4)2, ZnSO3;
д) Fe(OH)2Cl, AlOH(NO3)2, Сu2(OH)2CO3,
Ca3(PO4)2.
Упражнение 6. В клетках таблицы
вместо точек запиши формулы бинарных соединений АхВy,
состоящих из атомов элементов в указанных с. о.
|
Элемент А |
+1 Na |
+2 |
+3 |
+5 |
+3 |
+4 |
|
Элемент В |
||||||
|
–2 |
…………. |
…………. |
…………. |
…………. |
…………. |
…………. |
|
–1 |
…………. |
…………. |
…………. |
…………. |
…………. |
…………. |
|
–2 |
…………. |
…………. |
…………. |
…………. |
…………. |
…………. |
|
–1 |
…………. |
…………. |
…………. |
…………. |
…………. |
…………. |
Упражнение7. Проанализируй формулы
веществ: H2SO4, SO2, Na2S, SO3,
H2S, K2SO3. Раздели их:
а) на две группы:
1) ………………………………………. ; 2) ………………………………………… ;
б) на три группы:
1) ………………………………………. ; 2) …………………..……………………. ;
3) ……………………….……………… .
Укажи критерии классификации в каждом случае:
а) ……………………………………….…………………………………………………… ;
б) ……………………………………………………………………………………………. .
4. Упражнение: определить
степень окисления элементов в веществах (тренажёр: ученики цепочкой
выходят к доске). Задание в раздаточном материале.
SiH4, CrO3, H2S,
CO2, CO, SO3, SO2, Fe2O3,
FeO, HCl, HBr, Cl2O5, Cl2O7, РН3,
K2O, Al2O3, P2O5, NO2,
N2O5, Cr2O3, SiO2, B2O3,
SiH4, Mn2O7, MnO, CuO, N2O3.
IV. Подведение
итогов урока.
Беседа с учащимися:
- Какую проблему мы поставили в
начале урока? - К какому выводу мы пришли?
- Дать определение “степени
окисления”. - Чему равна степень окисления водорода?
Кислорода? - Как определить степень
окисления атома в соединении?
Оценка работы учащихся в целом и
отдельных учащихся.
Домашнее задание:
О.С. Габриелян Химия 8 класс § 17, в 1-3
– Благодарю за урок. До свидания.
Основы деления солей на отдельные группы были заложены в трудах французского химика и аптекаря Г. Руэля ((1703)–(1770)). Именно он в (1754) г. предложил разделить известные к тому времени соли на кислые, основные и средние (нейтральные). В настоящее время выделяют и другие группы этого чрезвычайно важного класса соединений.
Средними называют соли, в состав которых входят металлический химический элемент и кислотный остаток.
В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония
NH4I
.
Примеры средних солей:
— хлорид натрия;
Al2IIISO4II3
— сульфат алюминия;
NHI4NO3I
— нитрат аммония.
Кислыми называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят атомы водорода.
Кислые соли можно считать продуктом неполной нейтрализации многоосновной кислоты.
Обрати внимание!
Составляя формулы кислых солей, следует иметь в виду, что валентность остатка от кислоты численно равна количеству атомов водорода, входивших в состав молекулы кислоты и замещённых металлом.
При составлении названия такого соединения к названию соли добавляется приставка «гидро», если в остатке от кислоты имеется один атом водорода, и «дигидро», если в остатке от кислоты содержатся два атома водорода.
— гидрокарбонат кальция;
Na2IHPO4⏞II
— гидрофосфат натрия;
NaIH2PO4⏞I
— дигидрофосфат натрия.
Простейшим примером кислых солей может служить пищевая сода, т. е. гидрокарбонат натрия (NaHCO_3).
Основными называют соли, в состав которых, кроме металлического химического элемента и кислотного остатка, входят гидроксогруппы.
Основные соли можно рассматривать как продукт неполной нейтрализации многокислотного основания.
Обрати внимание!
Составляя формулы таких веществ, следует иметь в виду, что валентность остатка от основания численно равна количеству гидроксогрупп, «ушедших» из состава основания.
При составлении названия основной соли к названию соли добавляется приставка «гидроксо», если в остатке от основания имеется одна гидроксогруппа, и «дигидроксо», если в остатке от основания содержатся две гидроксогруппы.
— гидроксохлорид магния;
FeOH⏞IINO32I
— гидроксонитрат железа((III));
FeOH2⏞INO3I
— дигидроксонитрат железа((III)).
Известным примером основных солей может служить налёт зелёного цвета гидроксокарбоната меди((II)) ((CuOH)_2CO_3), образующийся с течением времени на медных предметах и предметах, изготовленных из сплавов меди, если они контактируют с влажным воздухом. Такой же состав имеет и минерал малахит.
Комплексные соединения — разнообразный класс веществ. Заслуга в создании теории, объясняющей их состав и строение, принадлежит лауреату Нобелевской премии по химии (1913) г. швейцарскому учёному А. Вернеру ((1866)–(1919)). Правда, термин «комплексные соединения» в (1889) г. был введён другим выдающимся химиком, лауреатом Нобелевской премии (1909) г. В. Оствальдом ((1853)–(1932)).
В составе катиона или аниона комплексных солей имеется элемент-комплексообразователь, связанный с так называемыми лигандами. Число лигандов, которое присоединяет комплексообразователь, называется координационным числом. Например, координационное число двухвалентной меди, а также бериллия, цинка, равно (4). Координационное число алюминия, железа, трёхвалентного хрома равно (6).
В названии комплексного соединения число лигандов, соединённое с комплексообразователем, отображается греческими числительными: (2) — «ди», (3) — «три», (4) — «тетра», (5) — «пента», (6) — «гекса». В качестве лигандов могут выступать как электрически нейтральные молекулы, так и ионы.
Название комплексного аниона начинается с указания состава внутренней сферы.
Если в качестве лигандов выступают анионы, к их названию добавляется окончание «–о»:
(–Cl) — хлоро-, (–OH) — гидроксо-, (–CN) — циано-.
Если лигандами являются электрически нейтральные молекулы воды, используется название «аква», а если аммиака — название «аммин».
Затем называют комплексообразователь, используя его латинское название и окончание «–ат», после чего без пробела римскими цифрами в скобках указывают степень окисления (если комплексообразователь может иметь несколько степеней окисления).
После обозначения состава внутренней сферы указывают название катиона внешней сферы — той, что в химической формуле вещества находится вне квадратных скобок.
Пример:
— тетрагидроксоцинкат калия,
K3AlOH6
— гексагидроксоалюминат калия,
K4FeCN6
— гексацианоферрат((II)) калия.
В школьных учебниках формулы комплексных солей более сложного состава, как правило, упрощаются. Например, формулу тетрагидроксодиакваалюмината калия
KAlH2O2OH4
принято записывать как формулу тетрагидроксоалюмината.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления.
Пример:
— хлорид диамминсеребра,
CuH2O4SO4
— сульфат тетрааквамеди((II)).
Гидратами называют продукты присоединения воды к частичкам вещества (термин образован от греческого hydor — «вода»).
Многие соли выпадают в осадок из растворов в виде кристаллогидратов — кристаллов, содержащих молекулы воды. В кристаллогидратах молекулы воды прочно связаны с катионами или анионами, образующими кристаллическую решётку. Многие соли такого вида по сути являются комплексными соединениями. Хотя многие из кристаллогидратов известны с незапамятных времён, начало систематическому изучению их состава положил голландский химик Б. Розебом ((1857)–(1907)).
В химических формулах кристаллогидратов принято указывать соотношение количества вещества соли и количество вещества воды.
Обрати внимание!
Точка, которая делит химическую формулу кристаллогидрата на две части, в отличие от математических выражений не обозначает действие умножения и читается как предлог «с».
Например, химическая формула
Na2SO4⋅10H2O
читается так:
«натрий-два-эс-о-четыре-с-десятью-аш-два-о».
В названии при помощи греческого числительного (а для числа (9) — латинского) указывается количество вещества воды в моле кристаллогидрата, затем слитно следует слово «гидрат», а за ним (раздельно) — систематическое, т. е. международное, название соли.
Пример:
— дигидрат сульфата кальция;
CuSO4⋅5H2O
— пентагидрат сульфата меди((II)).
Для названия целого ряда кристаллогидратов, кроме систематического, используют и исторические (тривиальные) названия. Например, гемигидрат сульфата кальция
CaSO4⋅0.5H2O
называют жжёным гипсом, пентагидрат сульфата меди((II))
CuSO4⋅5H2O
называют медным купоросом, а декагидрат карбоната натрия
Na2CO3⋅10H2O
— кристаллической содой.