
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.

Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!

Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Формула фосфата натрия
Определение и формула фосфата натрия
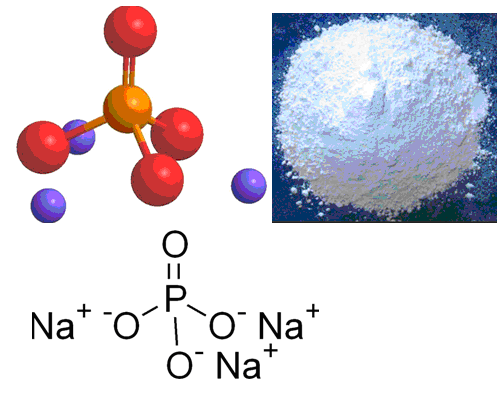
Формула –
Молярная масса равна г/моль.
Физические свойства – белое твердое вещество, плавящееся без разложения, термически устойчивый.
Обладает хорошей растворимостью в воде, при этом происходит гидролиз по аниону. Реакция среды — сильнощелочная.
Образует кристаллогидрат состава .
Химические свойства фосфата натрия
- Вступает в реакции обмена с кислотами и солями:
- Фосфат натрия переводит в раствор такие металлы как алюминий и цинк, например:
Получение
Основные методы получения фосфата натрия основаны на реакциях обмена:
Применение
Ортофосфат натрия является вредной добавкой и сама средняя соль применяется редко.
В большей степени находят применение ее кислые соли, особенно в пищевой промышленности.
применяется для обесцвечивания стекла.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Определение и формула
Фосфат натрия Na3PO4– средняя соль ортофосфорной кислоты H3PO4 и гидроксида натрия NaOH. Пищевая добавка с индексом Е542, принадлежит к группе эмульгаторов, регуляторов pH и веществ против слеживания.
Синонимы
Ортофосфат натрия, тринатрийфосфат, натрий фосфорнокислый
Формула
Na3PO4
Свойства фосфата натрия
Физические свойства
| Свойство | Описание |
|---|---|
| Внешний вид | Кристаллическое вещество белого цвета |
| Молярная масса | 163,941 г/моль |
| Плотность | 2,536 г/см3 |
| Температура плавления | 1340°С |
| Cтандартная мольная энтальпия образования при 298К ΔGDelta G °298, кДж/моль | -1922,8 |
| Cтандартная мольная энергия Гиббса образования при 298 К ΔDelta кДж/моль | -1819 |
| Стандартная мольная энтропия при 298 К S°298, Дж/(моль•К) | 224,7 |
| Растворимость в воде, 100 г | при 0°С — 5,4 при 25°С — 14,5 при 100°С — 94,6 |
Химические свойства
В водных растворах гидролизуется по аниону:
Na3P04 + H2O = Na2HP04 + Na0H.
Раствор имеет щелочную реакцию.
При взаимодействии с кислотами образует кислые соли:
Na3P04 + HСl = Na2HP04 + NaCl,
Na3P04 + H2SO4 = NaH2P04 + Na2SO4.
Вступает в реакции обмена с образованием нерастворимых фосфатов:
2Na3P04 + 3CaCl2 = 6NaCl + 2Ca3(P04)2↓,
Na3P04 + AlCl3 = 3NaCl + AlP04↓,
Na3P04 + 3AgNO3 = 6NaCl + Ag3P04↓.
Последняя реакция является качественной реакцией на растворимые фосфаты щелочных металлов и аммония. При добавлении к их раствором раствора нитрата серебра AgNO3 выпадает осадок фосфата серебра Ag3P04 желтого цвета. А натрий можно определить окрашиванию пламени в желтый цвет.
Получение химического соединения
Лабораторные способы получения
Фосфат натрия получают взаимодействием фосфорной кислоты с гидроксидом или карбонатом натрия:
H3PO4 + 3NaOH = Na3PO4 + 3H2O;
2H3PO4 + 3Na2CO3 =2Na3PO4 + 3H2O + 3CO2↑.
Получение фосфата натрия в промышленности
В промышленности фосфат натрия получают в два этапа.
Сначала взаимодействием кальцинированной соды Na2CO3 с фосфорной кислотой H3PO4 получают гидрофосфат натрия Na2HP04:
Н3Р04 + Na2C03 = Na2HP04 + С02↑+ Н20,
а затем взаимодействием едкого натра NaOH с полученным гидрофосфатом натрия Na2HP04 получают фосфат натрия Na3PO4:
Na2HP04 + Na0H = Na3P04 + H20.
После охлаждения нейтрализованных растворов до 30°С фосфат натрия кристаллизуются в виде Na3PO4·12H2O. Он плавится при 70°С. Чтобы получить безводный фосфат натрия, кристаллогидрат прокаливают 2 часа при температуре 120°С, а затем 30 мин при температуре 800°С.
Применение
Фосфат натрия в быту используют как чистящее средство, так как он прекрасно отмывает жир. Благодаря этому свойству он также входит в состав моющих средств. Кроме того, фосфат натрия смягчает воду, переводя соли жесткости в нерастворимые фосфаты:
3Ca(HCO3)2 + 2Na3P04 = 6NaHCO3 + Ca3(P04)2↓,
3Mg(HCO3)2 + 2Na3P04 = 6NaHCO3 + Mg3(P04)2↓.
Применяется он также и в стекольной промышленности для получения оптических стекол.
В строительстве фосфат натрия используют для упрочнения бетона. Его добавка увеличивает также влагостойкость бетона, так как он становится менее пористым.
В медицине фосфат натрия изредка применяют как слабительное и средство от изжоги.
В пищевой промышленности он известен как пищевая добавка Е339(iii). Фосфат натрия используют в качестве эмульгатора, стабилизатора, влагоудерживающего агента. Добавляют его в майонезы и кетчупы, плавленные сыры и хлебобулочные изделия, правда чаще применяют гидрофосфат (пищевая добавка Е339(i)) и дигидрофосфат натрия (пищевая добавка Е339(iii)). Фосфатом натрия обрабатывают куриные окорочка, мясо и рыбу, чтобы удержать воду и сохранить вес.
Относится к малоопасным веществам (4 класс опасности), но при передозировке в пищевых продуктов приводит к расстройствам пищеварения, а у детей нередко вызывает возбуждение и гиперактивность.
Пример решения задачи
Сколько фосфата натрия получится при нейтрализации фосфорной кислотой 240 г едкого натра?
Решение.
240 г – х г
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
3 моля – 1 моль
3 * (23+16+1) = 120 г
3 * 23+31+4 * 16 = 164 г
Составляем пропорцию:
120 г NaOH – 164 г Na3PO4,
240 г NaOH – х г Na3PO4.
Отсюда:
х= (240 * 164)/120 = 328 г.
Ответ: 328 г.
Тест по теме «Фосфат натрия»
Фосфаты натрия — группа неорганических соединений, солей фосфорных кислот 
— соли (ортофосфат Na3PO4, пирофосфат Na4P2O7, дигидрофосфат NaH2PO4, гидрофосфат Na2HPO4 и др.);
— их кристаллогидраты (NaH2PO4∙H2O, Na2HPO4∙12H2O, Na3PO4∙12H2O, …);
— конденсированные фосфаты (содержат группу (РО3)-;
— циклические полифосфаты (NaPO3)n.
Свойства
Фосфаты натрия представляют собой белый или стекловидный кристаллический порошок, хорошо растворяющийся в воде, гигроскопичный на воздухе. Раствор соли в воде имеет ярко выраженную сильнощелочную реакцию. Соли хорошо выдерживают нагревание до высоких температур: начиная с +250 °С кристаллическое вещество плавится, но не разлагается.
Получение
В индустриальных масштабах фосфаты натрия получают методом химической реакции ортофосфорной кислоты с кальцинированной содой или гидроксидом натрия. Потом вещества выкристаллизуются и высушиваются до солей или их кристаллогидратов.
Применение

— Как чистящие средства для металлов в металлургии.
— В пищепроме в качестве добавки Е339 используются как разрыхлитель для различной выпечки; эмульгатор при изготовлении колбасных изделий, паштетов, паст, сгущенного молока; солей плавления в производстве плавленых сыров. Кроме того эта разрешенная в России и Евросоюзе добавка применяется в качестве регулятора рН, антиоксиданта, стабилизатора и усилителя окраски пищевых продуктов (бульонные концентраты, сухое молоко и сливки, соки и газировки, полуфабрикаты быстрого приготовления).
— Для смягчения воды используют безводные фосфаты, образующие комплексные соединения с элементами, отвечающими за жесткость воды: с кальцием, магнием, барием, металлами.
— Как антислеживающая добавка.
— В фотоделе в качестве проявителя.
— Фосфаты натрия применяются в горнодобыче для обогащения руд; в составе ПАВ при изготовлении цемента, в буровых растворах в нефтедобыче.
— При производстве красок, фосфатных стекол.
— На производстве стекол с помощью ортофосфата натрия обесцвечивают стекольную массу.
— В различных электролитических процессах, например, в электрофорезе.
— В медицине и фармакологии входят в состав лекарств, оказывающих слабительное, антацидное действие; для поддержания кислотно-щелочного и минерального баланса крови; как вспомогательные вещества.
— Используются в моющих средствах для смягчения воды и лучшей отстирываемости. Наиболее часто для этих целей применяется тринатрий фосфат, 
— Кристаллогидрат тринатрия фосфата применяется в цветной и черной металлургии, в целлулозно-бумажной индустрии, в газо- и нефтедобывающей промышленности, в производстве смазочных масел и охлаждающих жидкостей, в энергетике.
В химическом магазине Prime Chemicals Group вы можете купить как непосредственно один из фосфатов натрия — тринатрий фосфат, так и сырье для производства фосфатов натрия: ортофосфорную кислоту и кальцинированную соду. Реактивы продаются в розницу и оптом, по выгодным ценам и с доставкой.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
OBRAZOVALKA.COM
OBRAZOVALKA.COM — образовательный портал
Наш сайт это площадка для образовательных консультаций, вопросов и ответов для школьников и студентов .
На вопросы могут отвечать также любые пользователи, в том числе и педагоги.
Консультацию по вопросам и домашним заданиям может получить любой школьник или студент.
