Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
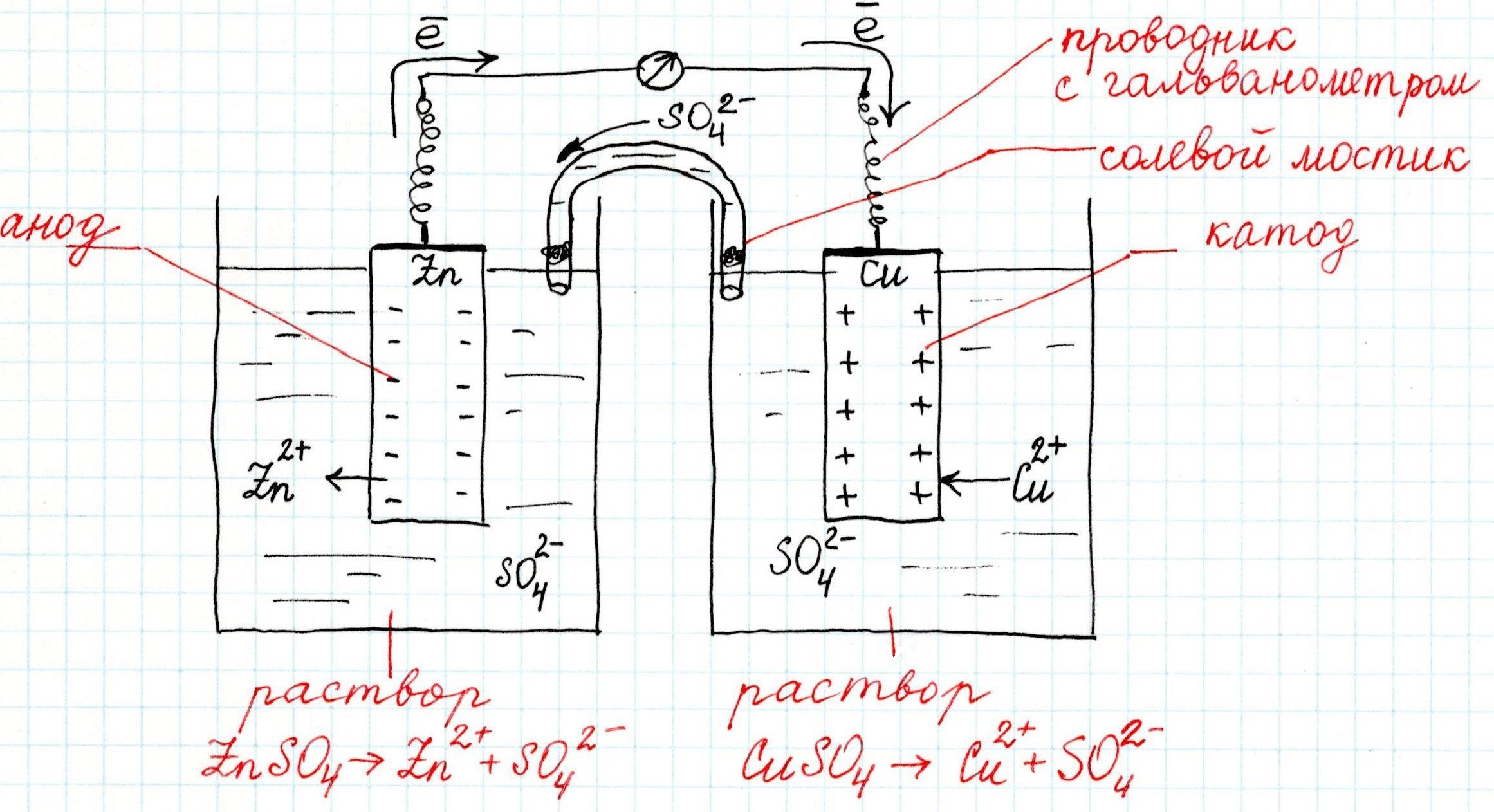
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
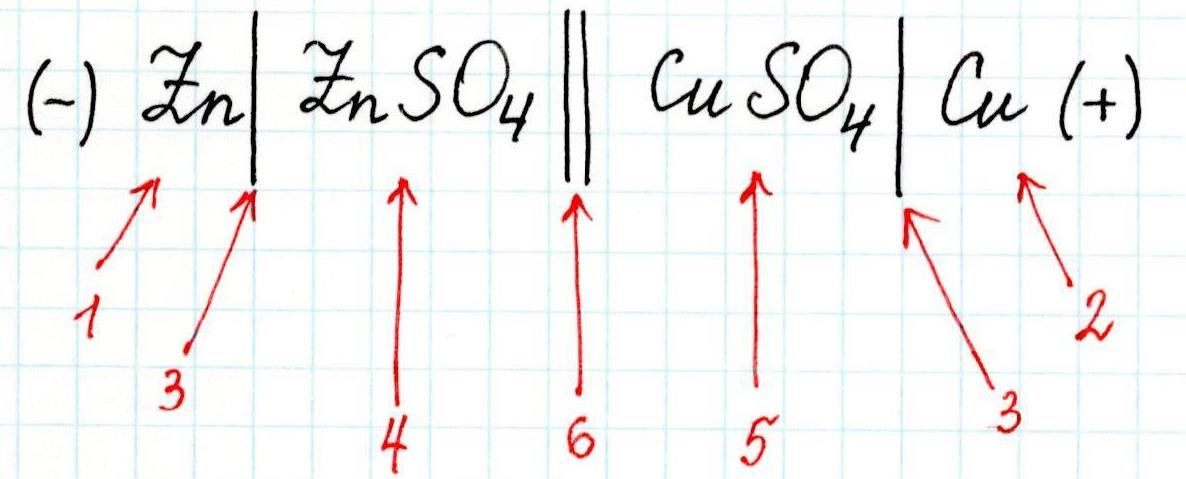
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Алгоритм составления схемы гальванического элемента.
-
Записать схемы
электродов. -
Используя
уравнение Нернста рассчитать величины
электродных потенциалов. -
Определить,
зная, что φк
φа,
электрод-анод и электрод-катод. -
Составить
схему гальванического элемента,
используя принятую форму записи. -
Записываем
уравнения катодной, анодной и суммарной
реакций, идущих в элементе. -
Рассчитать ЭДС
гальванического элемента.
Пример
1. Составить
схему гальванического элемента, анодом
которого является магний, погруженный
в раствор соли с концентрацией 0,01М.
Решение.
1.
Записываем схему электрода: Mg|Mg2+
-
По
уравнению. Нернста рассчитываем величину
электродного потенциала:
-
Так
как в условии задачи не указан материал,
из которого изготовлен катод, то
используя соотношение φк
φа,
выбираем металл с более положительным
потенциалом. Например, цинковый электрод.
Значение потенциала выбранного электрода
определяем по таблице «Стандартные
электродные потенциалы металлов при
250С».
Следовательно,
.
-
Записываем схему
гальванического элемента:
А(-)
Mg|Mg2+||Zn2+|Zn (+)K
-
Записываем
электродные реакции:
А(-)
Mg
2e—
Mg2+
K(+)
Zn2+
+ 2e—
Zn0
Суммарная
реакция: Mg0
+ Zn2+
Mg2+
+ Zn0
-
Рассчитываем ЭДС
гальванического элемента:
Пример
2. Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с рН =3 и железного
электрода, погруженного в раствор соли
с концентрацией 0.1М. Рассчитайте ЭДС
элемента.
Решение.
1.
Записываем схемы электродов:
Водородный
– 2Н+|
Н2
(Pt);
Железный
–
Fe|Fe2+
-
По
уравнению Нернста рассчитываем величину
электродного потенциала железного
электрода:
Используя
уравнение Нернста (4) рассчитываем
величину электродного потенциала
водородного электрода:
-
Используя
соотношение φк
φа
определяем электрод-анод.
Так
как величина φ-потенциала
железного электрода меньше
следовательно этот электрод является
анодом.
-
Записываем схему
гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+)
K
-
Рассчитываем ЭДС
гальванического элемента.
Задания для
самоконтроля
-
Составьте
схему гальванического элемента,
состоящего из никелевого электрода-катода,
погруженного в раствор соли с концентрацией
0.02М. Напишите уравнения электродных
реакций и вычислите ЭДС гальванического
элемента. -
Составьте
схему гальванического элемента,
состоящего из медного электрода,
погруженного в раствор соли меди с
концентрацией 0.01М и железного электрода,
погруженного в раствор соли железа с
концентрацией 0.1М. Напишите уравнения
электродных реакций. Вычислите ЭДС
гальванического элемента. -
Составьте
схему гальванического элемента,
состоящего из стандартного водородного
электрода и ртутного электрода.
Рассчитайте его ЭДС при [Hg2+]=0,1
М. Напишите уравнения электродных
реакций. -
Составьте
схему и рассчитайте ЭДС концентрированного
гальванического элемента, составленного
из двух железных электродов, погруженных
в раствор соли железа с концентрациями
1 М и 0,01 М. Напишите уравнения электродных
реакций. -
В гальваническом
элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему
и уравнения электродных реакций.
Вычислите ЭДС этого элемента при
стандартных условиях. Какой металл
вместо никеля можно взять, чтобы увеличить
ЭДС?
-
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=5,
и марганцевого электрода, погруженного
в раствор соли марганца с концентрацией
0,2 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС. -
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=10,
и серебряного электрода, погруженного
в раствор соли серебра с концентрацией
0,01 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Вычисление ЭДС, составление схемы гальванического элемента
Задача 195.
Составьте схему гальванического элемента, состоящего из двух металлических пластин, опущенных в растворы их солей. Напишите уравнения электродных процессов. Вычислите ЭДС гальванического элемента. Cu (Cсоли = 1,5 моль/л) и Ni (Cсоли = 1,8 моль/л).
Решение:
Стандартный электродный потенциал меди – Е(Cu2+/Cu0) = +0,34 B; стандартный электродный потенциал никеля – E(Ni2+/Ni0) = -0,25 B. Медь, потенциал которой (+0,34 В) более электроположительный, чем у никеля (-0,25 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu2+ + 2e = Cu0
Никель, имеющий меньший потенциал, является анодом, на котором протекает окислительный процесс:
Ni0 — 2e = Ni2+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC, где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; C – концентрация ионов металла в растворе.
Тогда
Е(Cu) = +0,34 + (0,059/2)lg1,5 = +0,345 B;
Е(Ni) = -0,25 + (0,059/2)lg1,8 = -0,2575 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,345 — (-0,2575) = +0,6025 приблизительно +),60 B.
Схема гальванического элемента будет иметь вид:
(+) Ni|Ni2+(1,8 M)||Cu2+(1,5 M)|Cu (-).
Задача 196.
Вычислить ЭДС гальванического элемета: Mn|MnSO4||AgNO3|Ag, если концентрация MnSО4 равна 10 М, а AgNО3 — 2 М.
Решение:
Серебро, потенциал которого (+0,799 В) более электроположительный, чем у марганца (-1,180 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1e = Ag0
Марганец имеет меньший потенциал (-1,180 В) является анодом, на котором протекает окислительный процесс:
Mn0 — 2e = Mn2+
Электродные процессы на электродах:
К(-): 2|Ag+ + 1e = Ag0
А(+): 1|Mn0 — 2e = Mn2+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
2Ag+ + Mn0 = 2Ag0 + Mn2+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC, где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; C – концентрация ионов металла в растворе.
Тогда
Е(Ag) = +0,799 + (0,059/1)lg10 = +0,858 B.
Е(Mn) = -1,180 + (0,059/2)lg2 = -1,171 B;
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,858 — (-1,171) = +0,313 B.
Ответ: +0,313 B.
Задача 196.
Составьте схему медного концентрационного гальванического элемента с активностями иона Cu2+, равными 1 моль/л у одного электрода и 10–3 – у другого. Рассчитайте ЭДС этого элемента при 298 К.
Решение:
а1 = 1 моль/л;
а2 = 1 • 10-3 моль/л.
Таким образом, a1 > a2; [Cu2+]1 > [Cu2+]2; 1 моль/л > 1 • 10-3 моль/л.
Полюсы элемента:
отрицательный — это электрод с меньшей концентрацией электролита;
положительный — электрод с большей концентрацией электролита.
Схема электродных процессов:
Катод (-): 1|Cu2+ + 2e = Cu2+ (a2)
Анод (+): 1|Cu0 — 2е = Cu0 (a1)
Определим потенциалы электродов:
Е1(K) = +0,34 + (0,059/2) • lg[1 · 10-3] = +0,2515 B;
Е2(A) = +0,34 + (0,059/2) • lg[1] = +0,34 В.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = -0,52 — (-1,26) = +0,74 B.
Схема гальванического элемента:
К(-)Cu|Cu2+(10-3 M)||Cu2+(1 M)|Cu(+)A
Задача 197.
Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента, возникающего при коррозии ферромарганца в растворе, с концентрацией 2•10-3. Вычислите ЭДС коррозионного элемента.
Решение:
Железо, потенциал которого (-0,44 В) более электроположительный, чем у марганца (-1,18 В) — катод, т.е. электрод, на котором протекает восстановительный процесс:
Fe2+ + 2e = Fe0
Марганец имеет меньший потенциал (-1,18 В) является анодом, на котором протекает окислительный процесс:
Mn0 — 2e = Mn2+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Fe2+ + Mn0 = Fe0 + Mn2+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC, где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; C – концентрация ионов металла в растворе.
Тогда
Е(Fe) = -0,44 + (0,059/2)lg0,002 = -0,52 B;
Е(Mg) = -1,18 + (0,059/2)lg0,002 = -1,26 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = -0,52 — (-1,26) = +0,74 B.
В гальваническом элементе, в котором электродами являются два металла Fe и Mn, опущенные в растворы их солей, электроны будут перемещаться от электрода с более положительным значением стандартного потенциала к электроду с более отрицательным значением стандартного потенциала. Так как электродный потенциал железа (-0,44 B) более электроположителен чем у марганца (-1,18 B), то электроны будут перемещаться от железного электрода к марганцевому, т.е. железо будет катодом, марганец — анодом.
Тогда схема данного гальванического элемента будет иметь вид:
(-)Fe|Fe2+(0,002 M)||Mn2+(0,002 M)|Mn(+)
Можно схематично решить данную задачу так:
1. Схема электродных процессов:
Катод: Fe2+ + 2e = Fe0
Анод: Mn0 — 2e = Mn2+
2. Cуммарное уравнение процесса:
Fe2+ + Mn0 = Fe0 + Mn2+
3. ЭДС коррозионного элемента:
Е(Fe) = -0,44 + (0,059/2)lg0,002 = -0,52 B;
Е(Mg) = -1,18 + (0,059/2)lg0,002 = -1,26 B.
ЭДС = -0,52 — (-1,26) = +0,74 B.
4. Схема коррозионного элемента:
(-)Fe|Fe2+(0,002 M)||Mn2+(0,002 M)|Mn(+)
Задача 198.
1. Схема гальванического элемента : Al|Al2(SO4)3||AgNO3|Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298 К, если [Al3+] =0,0001 моль/л, [Аg+] =0,1моль/л.
2. Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
1). Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1e = Ag0
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al0 — 3e = Al3+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al0 + 3Ag+ = 3Ag0 + Al3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Тогда
Е (Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е (Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 — (-1,74) = +2,48 B.
2). Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
(-)Al3+|Al||Mg|Mg2+(+)
Или
(-)AlCl3|Al||Mg|MgCl2(+)
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) — катод, т. е. электрод, на котором протекает восстановительный процесс:
Al3+ + 3e = Al0
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg0 — 2e = Mg2+
Cуммарное уравнение процесса:
3Mg0 + 2Al3+ = 3Mg2+ + 2Al0
Как составить схему гальванического элемента
В основе работы гальванического элемента, или элемента Даниэля, лежат химические реакции для выработки электрической энергии. Несколько гальванических элементов соединенных между собой составляют батарею. Расчет такой электрохимической ячейки не составляет трудностей.

Вам понадобится
- Справочная литература
- База по окислительно-восстановительным потенциалам
- Стандартные электродные потенциалы при 25o С
- Ручка
- Листок бумаги
Инструкция
Подобрать химические элементы, которые будут использованы для работы с помощью базы по окислительно-восстановительным потенциалам. Очень часто в таких целях используют сульфат цинка и медный купорос, потому что их очень легко приобрести в любом садоводческом магазине.
Записать формулу гальванического элемента в стандартном виде. Например:
Zn | ZnSO4 || CuSO4 | Cu
Здесь вертикальная линия обозначает границу раздела фаз, а двойная вертикальная линия – солевой мостик.
Записать электродные полуреакции, пользуясь таблицей электродных потенциалов. Обычно их записывают в виде реакций восстановления. Для нашего примера это выглядит следующим образом:
Правый электрод: +2Cu + 2e = Cu
Левый электрод: +2Zn + 2e = Zn
Записать общую реакцию на гальваническом элементе. Она представляет собой разность между реакциями на правом и левом электродах:
+2Cu + Zn = Cu + Zn2+
Рассчитать потенциалы левого и правого электродов по формуле Нернста.
Рассчитать электродвижущую силу (ЭДС) для гальванического элемента. Она, в общем случае, равна разности потенциалов левого и правого электродов. Если ЭДС положительна, то реакция на электродах протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. Для большинства гальванических элементов ЭДС находится в пределах 1.1 Вольта.
Обратите внимание
Старайтесь выбирать те химические элементы, которые не являются токсичными или особо вредными, так как их будет сложно найти в продаже, и они могут нанести непоправимый вред вашему здоровью.
Полезный совет
Перед тем как выбирать вещества для гальванического элемента, посоветуйтесь со специалистом или найдите в справочной литературе, какая пара даст наибольшую положительную разность потенциалов.
Проверьте свои расчеты несколько раз или дайте их на проверку опытному человеку.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Определение полярности электродов и ЭДС гальванического элемента
Гальванопара
|
Электрод 1 (подложка) Концентрация С1: моль/л до 2 моль/л Температура T1: К от 273 до 373 K |
Электрод 2 (покрытие) Концентрация С2: моль/л до 2 моль/л Температура T2: К от 273 до 373 K |
Замечание
Катодное восстановление (выделение) магния и алюминия из водных растворов невозможно. По этой причине составление гальванической пары, в которой один из этих металлов восстанавливался бы на катоде — невозможно.
Замечание
Анодное растворение палладия и золота в растворах их простых неорганических солей невозможно из-за пассивации. По этой причине составление гальванической пары, в которой один из этих металлов служил бы анодом — невозможно.
Гальванический элемент представляет собой систему из двух электродов, погруженных в раствор своих солей.
При выборе одинаковых металлов для обоих электродов гальванический элемент рассматривается как концентрационный.
Не меняя стандартных условий возможно оценить механизм защиты, рассматривая сочетание металлов как гальванопару «подложка-покрытие».
Программа вычисляет значения равновесных потенциалов для каждого из электродов на основании введенных данных по металлам,
концентрациям, температурам по уравнению Нернста E = E0 + [RT/(z*F)]*ln[C], определяет катодом тот электрод,
потенциал которого — больше и анодом тот — потенциал которого меньше, после чего производит расчет ЭДС как разность
потенциалов электродов ΔE = Eкатода — Eанода.