Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
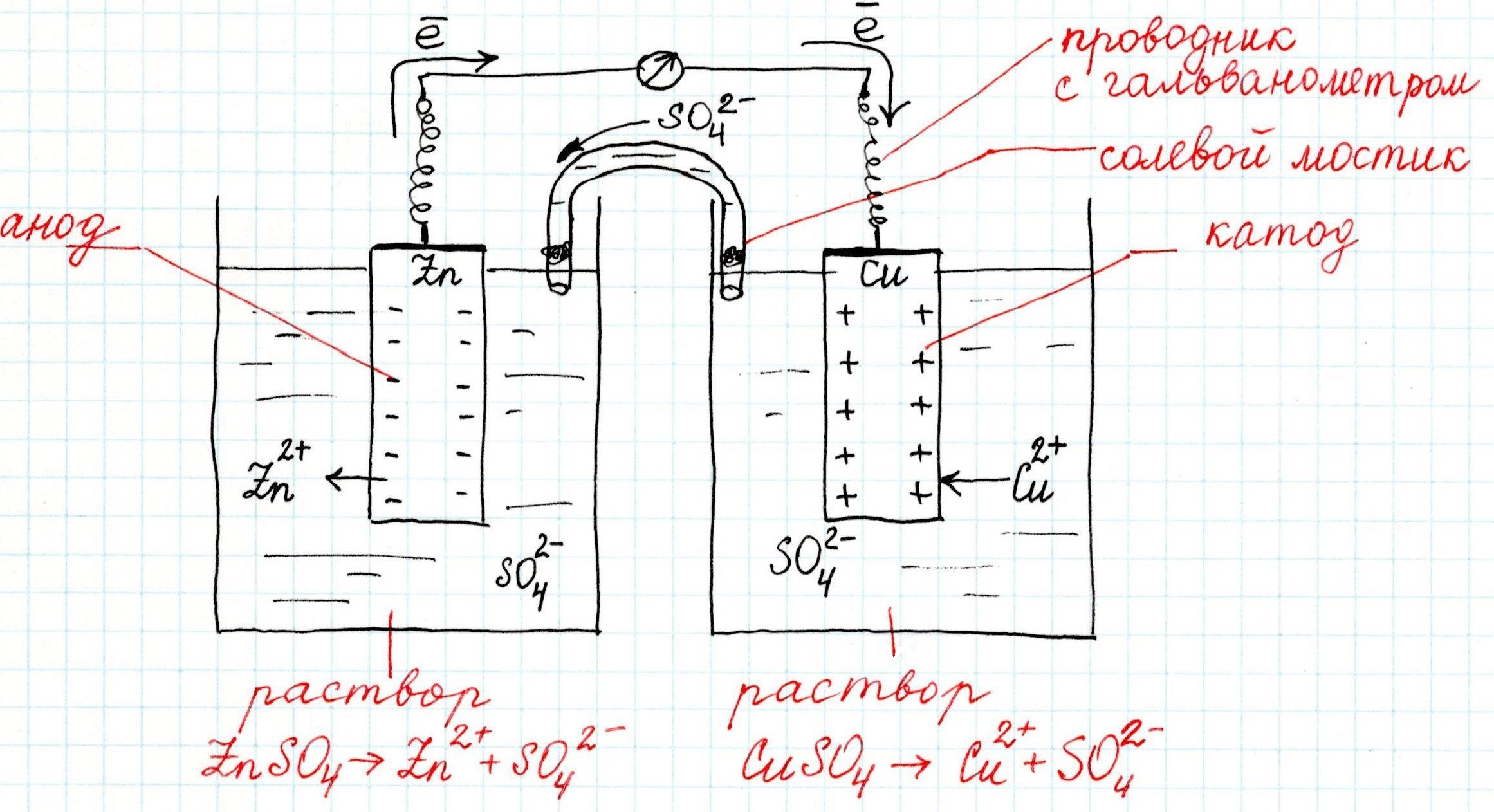
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
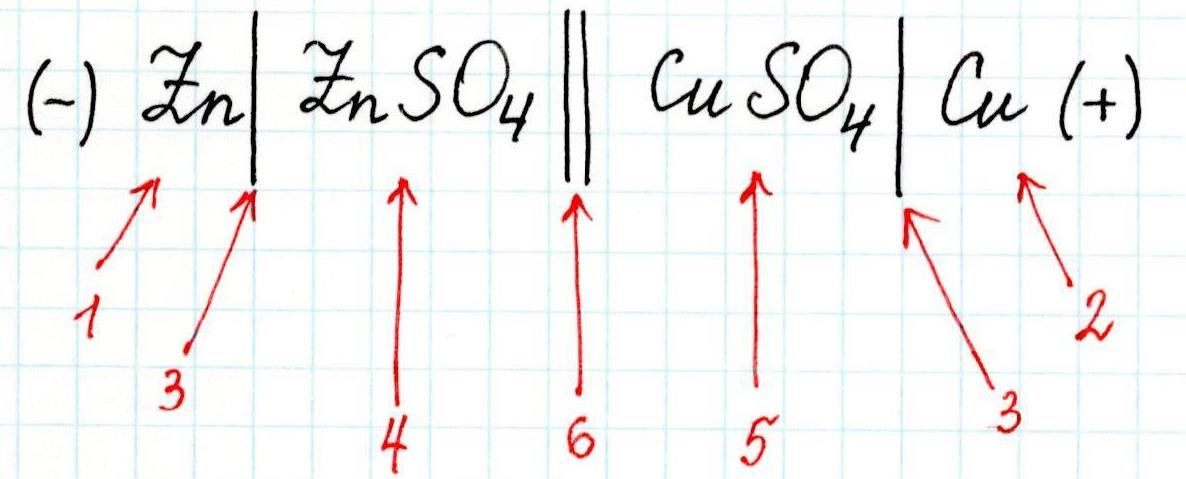
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Алгоритм составления схемы гальванического элемента.
-
Записать схемы
электродов. -
Используя
уравнение Нернста рассчитать величины
электродных потенциалов. -
Определить,
зная, что φк
φа,
электрод-анод и электрод-катод. -
Составить
схему гальванического элемента,
используя принятую форму записи. -
Записываем
уравнения катодной, анодной и суммарной
реакций, идущих в элементе. -
Рассчитать ЭДС
гальванического элемента.
Пример
1. Составить
схему гальванического элемента, анодом
которого является магний, погруженный
в раствор соли с концентрацией 0,01М.
Решение.
1.
Записываем схему электрода: Mg|Mg2+
-
По
уравнению. Нернста рассчитываем величину
электродного потенциала:
-
Так
как в условии задачи не указан материал,
из которого изготовлен катод, то
используя соотношение φк
φа,
выбираем металл с более положительным
потенциалом. Например, цинковый электрод.
Значение потенциала выбранного электрода
определяем по таблице «Стандартные
электродные потенциалы металлов при
250С».
Следовательно,
.
-
Записываем схему
гальванического элемента:
А(-)
Mg|Mg2+||Zn2+|Zn (+)K
-
Записываем
электродные реакции:
А(-)
Mg
2e—
Mg2+
K(+)
Zn2+
+ 2e—
Zn0
Суммарная
реакция: Mg0
+ Zn2+
Mg2+
+ Zn0
-
Рассчитываем ЭДС
гальванического элемента:
Пример
2. Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с рН =3 и железного
электрода, погруженного в раствор соли
с концентрацией 0.1М. Рассчитайте ЭДС
элемента.
Решение.
1.
Записываем схемы электродов:
Водородный
– 2Н+|
Н2
(Pt);
Железный
–
Fe|Fe2+
-
По
уравнению Нернста рассчитываем величину
электродного потенциала железного
электрода:
Используя
уравнение Нернста (4) рассчитываем
величину электродного потенциала
водородного электрода:
-
Используя
соотношение φк
φа
определяем электрод-анод.
Так
как величина φ-потенциала
железного электрода меньше
следовательно этот электрод является
анодом.
-
Записываем схему
гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+)
K
-
Рассчитываем ЭДС
гальванического элемента.
Задания для
самоконтроля
-
Составьте
схему гальванического элемента,
состоящего из никелевого электрода-катода,
погруженного в раствор соли с концентрацией
0.02М. Напишите уравнения электродных
реакций и вычислите ЭДС гальванического
элемента. -
Составьте
схему гальванического элемента,
состоящего из медного электрода,
погруженного в раствор соли меди с
концентрацией 0.01М и железного электрода,
погруженного в раствор соли железа с
концентрацией 0.1М. Напишите уравнения
электродных реакций. Вычислите ЭДС
гальванического элемента. -
Составьте
схему гальванического элемента,
состоящего из стандартного водородного
электрода и ртутного электрода.
Рассчитайте его ЭДС при [Hg2+]=0,1
М. Напишите уравнения электродных
реакций. -
Составьте
схему и рассчитайте ЭДС концентрированного
гальванического элемента, составленного
из двух железных электродов, погруженных
в раствор соли железа с концентрациями
1 М и 0,01 М. Напишите уравнения электродных
реакций. -
В гальваническом
элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему
и уравнения электродных реакций.
Вычислите ЭДС этого элемента при
стандартных условиях. Какой металл
вместо никеля можно взять, чтобы увеличить
ЭДС?
-
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=5,
и марганцевого электрода, погруженного
в раствор соли марганца с концентрацией
0,2 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС. -
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=10,
и серебряного электрода, погруженного
в раствор соли серебра с концентрацией
0,01 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Гальванический элемент
Схема гальванического элемента Даниэля-Якоби Обозначение гальванического элемента на принципиальных электрических схемах
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах.
История изучения гальванических процессов[ | ]
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета (г.
Болонья, Италия) — Луиджи Гальвани в 1786 году: Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закреплённых на медных крючках, при прикосновении стального скальпеля.
Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алессандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А.
Вольта проделал серию опытов и пришёл к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение — А. Вольта заменил лапку лягушки изобретённым им электрометром и повторил все действия.В 1800 году А.
Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления.Русский учёный Петров в 1802 году использовал гальванический элемент для построения электрической дуги.
Виды электродов[ | ]
В состав гальванического элемента входят электроды.Электроды бывают:
Обратимые электроды[ | ]
- Электроды 1-го рода — электроды, состоящие из металла, погружённого в раствор его соли;
- Электроды 2-го рода — электрод, состоящий из металла, покрытого труднорастворимой солью этого же металла, погружённый в раствор соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод, каломельный электрод, металл-оксидные электроды);
- Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов: в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом — есть общий анион с первым осадком;
- Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (, водородный электрод);
- Амальгамные электроды — электроды, состоящие из раствора металла в ртути;
- Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
Характеристики гальванических элементов[ | ]
Гальванические элементы характеризуются электродвижущей силой (ЭДС), ёмкостью; энергией, которую он может отдать во внешнюю цепь; сохраняемостью.
- Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями протекающих электрохимических процессов в виде уравнения Нернста.
- Электрическая ёмкость элемента — это количество электричества, которое источник тока отдаёт при разряде. Ёмкость зависит от массы реагентов, запасённых в источнике, и степени их превращения; снижается с понижением температуры или увеличением разрядного тока.
- Энергия гальванического элемента численно равна произведению его ёмкости на напряжение. С увеличением количества вещества реагентов в элементе и до определённого предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
- Сохраняемость — это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
Классификация гальванических элементов[ | ]
Использованные источники питания различных типов и размеров
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки).
Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом.
Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Литий-ионный аккумулятор сотового телефона
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щёлочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются.
Восстановителем является водород (H2), метанол (CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый.В кислородно-водородном топливном элементе со щёлочным электролитом, происходит превращение химической энергии в электрическую.
Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов.
Применение[ | ]
- Батарейки используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления.
- Аккумуляторы используются для запуска двигателей машин; возможно так же и применение в качестве временных источников электроэнергии в местах, удалённых от населенных пунктов.
- Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
Литература[ | ]
- Ахметов Н. С. Общая и неорганическая химия
- Аксенович Л. А. Физика в средней школе: Теория. Задания.
- Еремин В. В., Каргов С. И., Успенская И. А., Кузменко Н. Е., Лунин В. В. Основы физической химии. Теория и задачи: учебное пособие для вузов
Ссылки[ | ]
Виды гальванических элементов: устройство и работа солевых, щелочных и литиевых батарей и аккумуляторов
Разные виды гальванических элементов преобразовывают свою химическую энергию в электрический ток. Своё название они получили в честь итальянского учёного Гальвани, который проводил первые подобные эксперименты и исследования. Электричество вырабатывается благодаря химическому взаимодействию двух металлов (обычно цинка и меди) в электролите.
- Принцип действия
- Разновидности элементов
- Сфера применения
Учёные помещали в ёмкости с кислотой медную и цинковую пластинку. Их соединяли проводником, на первой образовывались пузырьки газа, вторая начинала растворяться. Это доказывало то, что по проводнику протекает электрический ток.
После Гальвани опытами занялся Вольт. Он создал элемент цилиндрической формы, похожий на вертикальный столбец. В его составе были цинковые, медные и суконные кольца, предварительно пропитанные кислотой.
Первый элемент имел высоту в 50 см, и выработанное им напряжение чувствовалось человеком.
Принцип работы заключается в том, что два вида металла в электролитической среде вступают во взаимодействие, в результате которого по внешней цепи начинает проходить ток.
Современные гальванические элементы и аккумуляторы называют батарейками. Их напряжение зависит от используемого металла. Устройство помещено в цилиндр из мягкой жести.
В качестве электродов выступают сетки с окислительным и восстановительным напылением.
Преобразование химической энергии в электричество исключает возможность восстановления свойств батареек. Ведь при работе элемента реагенты расходуются, из-за чего уменьшается ток.
Восстановителем обычно служит отрицательный вывод из лития или цинка. Во время функционирования он теряет электроны.
Положительную часть изготавливают из металлических солей или оксида магния, она выполняет работу окислителя.
В обычных условиях электролит не пропускает ток, он распадается на ионы только во время замыкания цепи. Именно это обуславливает появление проводимости. В качестве электролита используют раствор кислоты, натриевые или калиевые соли.
Разновидности элементов
Батарейки используют для питания приборов, устройств, техники, игрушек. Все гальванические элементы по схеме делят на несколько видов:
- солевые;
- щелочные;
- литиевые.
Наиболее популярные — солевые батарейки, изготовленные из цинка и марганца. Элемент сочетает в себе надёжность, качество и приемлемую цену. Но в последнее время производители снижают или полностью прекращают их изготовление, так как со стороны фирм, выпускающих бытовую технику, к ним постепенно повышают требования. Основные преимущества гальванических батарей этого типа:
- универсальные параметры, позволяющие использовать их в разных областях;
- лёгкая эксплуатация;
- невысокая стоимость;
- простые условия производства;
- доступное и недорогое сырье.
Среди недостатков выделяют небольшой срок службы (не более двух лет), уменьшение свойств из-за низких температур, уменьшение ёмкости при повышении тока и снижение напряжения во время работы.
Когда солевые батарейки разряжаются, они могут потечь, так как положительный объем электрода выталкивает электролит. Проводимость повышают графит и сажа, активная смесь состоит из диоксида марганца.
Срок эксплуатации напрямую зависит от объёма электролита.
В прошлом столетии появились первые щелочные элементы. Роль окислителя в них играет марганец, а восстановителя — цинковый порошок. Корпус батарейки амальгамируют во избежание появления коррозии. Но использование ртути запретили, поэтому их покрывали смесями из цинкового порошка с ингибиторами ржавчины.
Активное вещество в устройстве гальванического элемента — это цинк, индий, свинец и алюминий. В активную массу входят сажа, марганец и графит.
Электролит изготавливают из калия и натрия. Сухой порошок значительно повышает функционирование батарейки. При таких же габаритах, как у солевых видов, щелочные имеют большую ёмкость.
Они продолжают хорошо работать даже при сильном морозе.
Литиевые элементы используют для питания современной техники. Их выпускают в виде батареек и аккумуляторов разных размеров. В составе первых находится твёрдый электролит, в других устройствах — жидкий.
Такой вариант подходит для приборов, требующих стабильного напряжения и средних зарядов тока.
Литиевые аккумуляторы можно заряжать несколько раз, батарейки используют только однажды, их не вскрывают.
Сфера применения
К производству гальванических элементов выдвигают ряд требований. Корпус батареек должен быть надёжным и герметичным. Электролит не должен вытекать, а также нельзя допускать попадания внутрь устройства посторонних веществ.
В некоторых случаях при вытекании жидкости она загорается. Повреждённый элемент нельзя использовать. Габариты у всех батареек практически одинаковы, отличаются только размеры аккумуляторов.
Элементы могут иметь разную форму: цилиндрическую, призматическую или дисковую.
У всех типов устройств есть общие достоинства: они компактны и имеют незначительный вес, приспособлены к разным диапазонам рабочей температуры, обладают большой ёмкостью и стабильно работают в разных условиях. Есть также и некоторые недостатки, но они касаются определённых типов элементов. Солевые служат недолго, литиевые устроенные так, что могут воспламеняться при разгерметизации.
Сферы применения батареек многочисленны:
- цифровая техника;
- детские игрушки;
- медицинские приборы;
- оборонная и авиационная промышленность;
- космическое производство.
Гальванические элементы легко использовать, они доступны по стоимости. Но с некоторыми видами нужно обращаться аккуратно и не использовать их в случае повреждения. Перед приобретением батареек нужно внимательно изучить инструкцию прибора, который они будут питать.
Гальванический элемент: схема, принцип работы, применение
Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора.
Кроме того, схема двух гальванических элементов предполагает наличие катода и анода.
Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля.
Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод).
Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим.
Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода.
Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде.
В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения.
В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Гальванические элементы. Виды и устройство. Работа и особенности
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую.
Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток.
Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов.
Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости.
Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три вида:
- Щелочные.
- Солевые.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены.
Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси.
Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония.
Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция.
Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите.
Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3.
Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк.
Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование.
Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом.
Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов.
Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение.
Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической.
Габариты практически не отличаются от других видов батареек.
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Похожие темы:
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
- Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
Источник электрической энергии
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
История открытия химического электричества
Мало известен факт, что в 1752 году гальваническое электричество упоминалось Иоганном Георгом. Издание Исследование происхождения приятных и неприятных ощущений, выпущенное Берлинской академией наук, даже придавало явлению вполне правильное толкование.
Опыт: серебряную и свинцовую пластины соединяли с одного конца, а противоположные с разных сторон прикладывались к языку. На рецепторах наблюдается вкус железного купороса. Читатели уже догадались, описанный способ проверки батареек часто использовали в СССР.
Химическое электричество
Объяснение явления: видимо, имеются некие частицы металла, раздражающие рецепторы языка. Частицы испускаются одной пластиной при соприкосновении. Причём один металл при этом растворяется.
Собственно, налицо принцип действия гальванического элемента, где цинковая пластина постепенно исчезает, отдавая энергию химических связей электрическому току. Объяснение сделано за полвека до официального доклада Королевскому обществу Лондона Алессандро Вольта об открытии первого источника питания.
Но, как происходит часто с открытиями, к примеру, электромагнитным взаимодействием, опыт остался незамечен широкой научной общественностью и не исследован должным образом.
Добавим, это оказалось связано с недавней отменой преследования за колдовство: немногие решались после печального опыта «ведьм» на изучение непонятных явлений. Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье.
Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр.
363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Примечательно, что необычное явление подмечено ассистентом, в точности, как с отклонением стрелки компаса проводом с электрическим током: открытие сделали лишь косвенно связанные с научными исследованиями люди. Наблюдение касалось подергиваний нижних конечностей лягушки.
В ходе опыта ассистент задел внутренний бедренный нерв препарируемого животного, ножки дёрнулись. Рядом, на столе стоял электростатический генератор, на приборе проскочила искра. Луиджи Гальвани немедленно загорелся идеей повторить опыт. Что удалось.
И опять на машине проскочила искра.
Опыты Луиджи Гальвани
Образовалась параллель связи с электричеством, и Гальвани возжелал узнать, станет ли на лягушку действовать подобным образом гроза. Оказалось, что природные катаклизмы не оказывают заметного воздействия.
Лягушки, прикреплённые медными крючками за спинной мозг к железной ограде, дёргались вне зависимости от погодных условий. Опыты не удавалось реализовать со 100-процентной повторяемостью, атмосфера воздействия не оказывала.
В итоге Гальвани нашёл сонм пар, составленных из разных металлов, которые при соприкосновении между собой и нервом вызывали подёргивание лапок у лягушки. Сегодня явление объясняют различной степенью электроотрицательности материалов.
К примеру, известно, что нельзя алюминиевые пластины клепать медью, металлы составляют гальваническую пару с ярко выраженными свойствами.
Гальвани справедливо заметил, что образуется замкнутая электрическая цепь, предположил, что лягушка содержит животное электричество, разряжаемое подобно лейденской банке. Алессандро Вольта не принял объяснения.
Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления.
Цитата Вольты из письма, адресованного редактору научного журнала:
Проводники первого рода (твёрдые тела) и второго рода (жидкости) при соприкосновении в некоторой комбинации рождают импульс электричества, сегодня нельзя объяснить причины возникновения явления. Ток течёт по замкнутому контуру и исчезает, если целостность цепи нарушена.
Вольтов столб
Лепту в череду открытий внёс Джованни Фаброни, сообщивший, что при размещении двух пластинок гальванической пары в воду, одна начинает разрушаться. Следовательно, явление имеет отношение к химическим процессам.
А Вольта тем временем изобрёл первый источник питания, долгое время служивший для исследования электричества. Учёный постоянно искал способы усиления действия гальванических пар, но не находил.
В ходе опытов создана конструкция вольтова столба:
- Попарно брались цинковые и медные кружки в плотном соприкосновении друг с другом.
- Полученные пары разделялись мокрыми кружками картона и ставились друг над другом.
Легко догадаться, получилось последовательное соединение источников тока, которые суммируясь, усиливали эффект (разность потенциалов). Новый прибор вызывал при прикосновении ощутимый для руки человека удар. Подобно опытам Мушенбрука с лейденской банкой.
Однако для повторения эффекта требовалось время. Стало очевидно, что источник энергии имеет химическое происхождение и постепенно возобновляется. Но привыкнуть к понятию нового электричества оказалось непросто.
Вольтов столб вёл себя подобно заряженной лейденской банке, но…
Эксперимент Вольта
Вольта организует дополнительный эксперимент. Снабжает каждый из кружков изолирующей ручкой, приводит в соприкосновение на некоторое время, потом размыкает и проводит исследование электроскопом.
К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается.
Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.
Вольта объяснил, что без мокрых кружков, прокладываемых между металлами, конструкция ведёт себя как две пластинки: медная и цинковая. Усиления не происходит. Вольта нашёл первый ряд электроотрицательности: цинк, свинец, олово, железо, медь, серебро.
И если исключить промежуточные металлы между крайними, «движущая сила» не изменяется. Вольта установил, что электричество существует, пока соприкасаются пластины: сила не видна, но легко чувствуется, следовательно, она истинна.
Учёный 20 марта 1800 года пишет президенту Королевского общества Лондона сэру Джозефу Бэнксу, к которому обращался впервые и Майкл Фарадей.
Английские исследователи быстро обнаружили: если на верхнюю пластину (медь) капнуть воды, в указанной точке в районе контакта выделяется газ. Они проделали опыт с обоих сторон: провода подходящей цепи заключили в колбы с водой. Газ исследовали.
Оказалось, что газ горючий, выделяется лишь с единственной стороны. С противоположной заметно окислилась проволока. Установлено, что первое является водородом, а второе явление происходит вследствие избытка кислорода.
Установлено (2 мая 1800 года), что наблюдаемый процесс — разложение воды под действием электрического тока.
Уильям Крукшенк немедленно показал, что аналогичное допустимо проделать с растворами солей металлов, а Волластон окончательно доказал идентичность вольтова столба статическому электричеству. Как выразился учёный: действие слабее, но обладает большей продолжительностью.
Мартин Ван Марум и Христиан Генрих Пфафф зарядили от элемента лейденскую банку. А профессор Хампфри Дэви установил, что чистая вода не может служить в этом случае электролитом.
Напротив, чем сильнее жидкость способна окислять цинк, тем лучше действует вольтов столб, что вполне согласовывалось с наблюдениями Фаброни.
Кислота намного улучшает работоспособность, ускоряя процесс выработки электричества. В конце концов Дэви создал стройную теорию вольтова столба.
Он пояснил, что металлы изначально обладают неким зарядом, при замыкании контактов вызывающим действие элемента.
Если электролит способен окислять поверхность донора электронов, слой истощённых атомов постепенно удаляется, открывая новые слои, способные давать электричество.
В 1803 году Риттер собрал столб из чередующихся кружков серебра и мокрого сукна, прообраз первого аккумулятора. Риттер зарядил его от вольтова столба и наблюдал процесс разрядки. Правильное толкование явлению дал Алессандро Вольта.
И лишь в 1825 году Огюст де ла Рив доказал, что перенос электричества в растворе осуществляется ионами вещества, наблюдая образование оксида цинка в камере с чистой водой, отделённой от соседней мембраной.
Заявление помогло Берцелиусу создать физическую модель, в которой атому электролита представлялись составленными из двух противоположно заряженных полюсов (ионов), способных диссоциировать. В результате получилась стройная картина переноса электричества на расстояние.
Как составить схему гальванического элемента
В основе работы гальванического элемента, или элемента Даниэля, лежат химические реакции для выработки электрической энергии. Несколько гальванических элементов соединенных между собой составляют батарею. Расчет такой электрохимической ячейки не составляет трудностей.

Вам понадобится
- Справочная литература
- База по окислительно-восстановительным потенциалам
- Стандартные электродные потенциалы при 25o С
- Ручка
- Листок бумаги
Инструкция
Подобрать химические элементы, которые будут использованы для работы с помощью базы по окислительно-восстановительным потенциалам. Очень часто в таких целях используют сульфат цинка и медный купорос, потому что их очень легко приобрести в любом садоводческом магазине.
Записать формулу гальванического элемента в стандартном виде. Например:
Zn | ZnSO4 || CuSO4 | Cu
Здесь вертикальная линия обозначает границу раздела фаз, а двойная вертикальная линия – солевой мостик.
Записать электродные полуреакции, пользуясь таблицей электродных потенциалов. Обычно их записывают в виде реакций восстановления. Для нашего примера это выглядит следующим образом:
Правый электрод: +2Cu + 2e = Cu
Левый электрод: +2Zn + 2e = Zn
Записать общую реакцию на гальваническом элементе. Она представляет собой разность между реакциями на правом и левом электродах:
+2Cu + Zn = Cu + Zn2+
Рассчитать потенциалы левого и правого электродов по формуле Нернста.
Рассчитать электродвижущую силу (ЭДС) для гальванического элемента. Она, в общем случае, равна разности потенциалов левого и правого электродов. Если ЭДС положительна, то реакция на электродах протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. Для большинства гальванических элементов ЭДС находится в пределах 1.1 Вольта.
Обратите внимание
Старайтесь выбирать те химические элементы, которые не являются токсичными или особо вредными, так как их будет сложно найти в продаже, и они могут нанести непоправимый вред вашему здоровью.
Полезный совет
Перед тем как выбирать вещества для гальванического элемента, посоветуйтесь со специалистом или найдите в справочной литературе, какая пара даст наибольшую положительную разность потенциалов.
Проверьте свои расчеты несколько раз или дайте их на проверку опытному человеку.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.