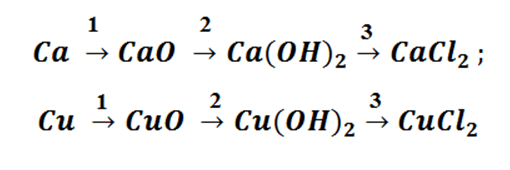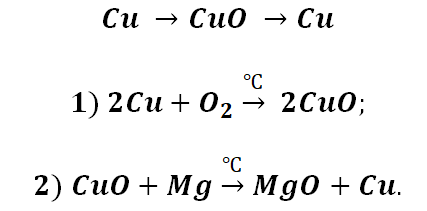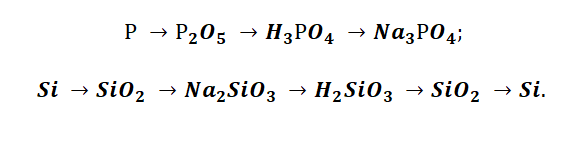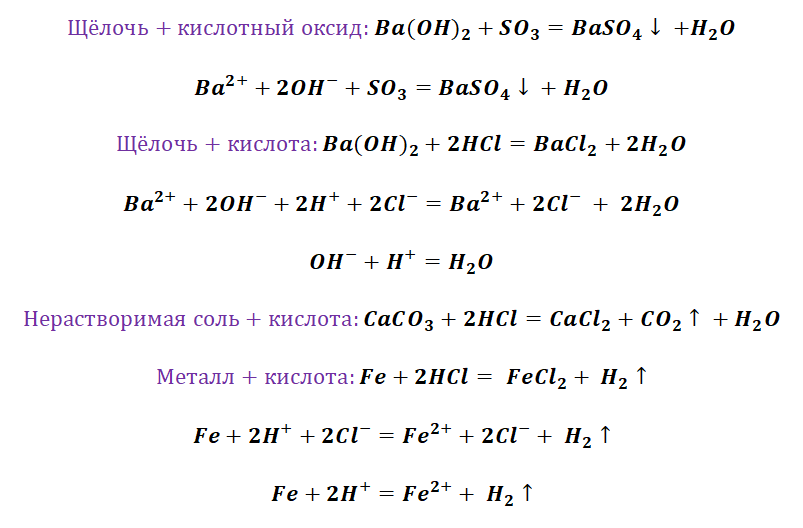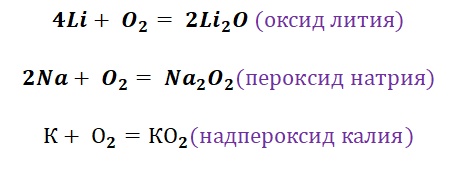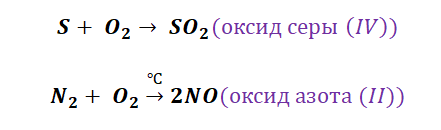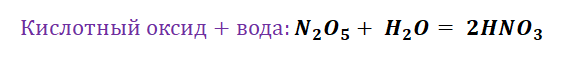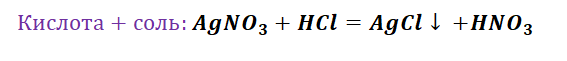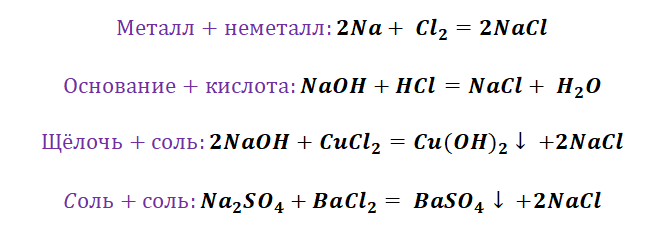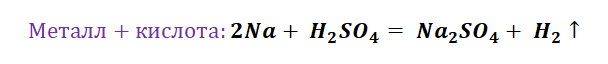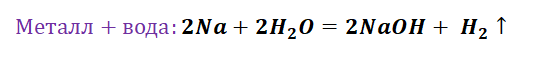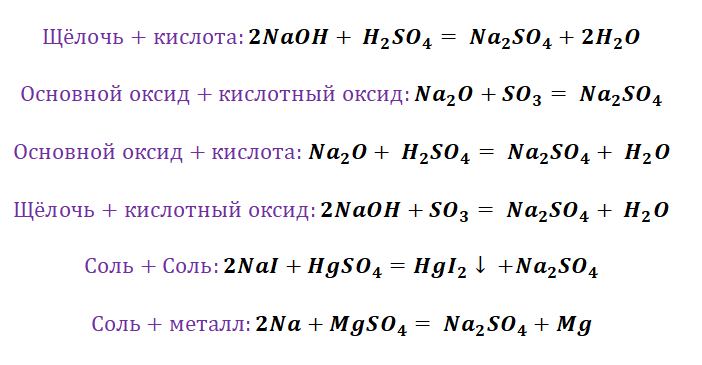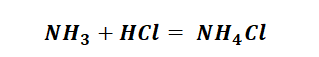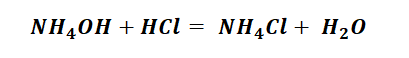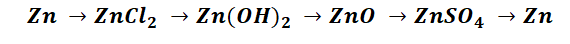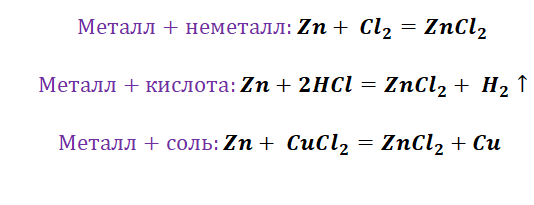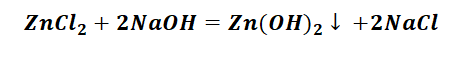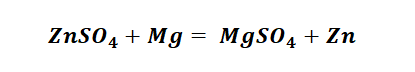Генетическая связь между основными классами неорганических соединений
I. Учебный видео-фильм: “Генетическая связь между отдельными классами неорганических соединений”
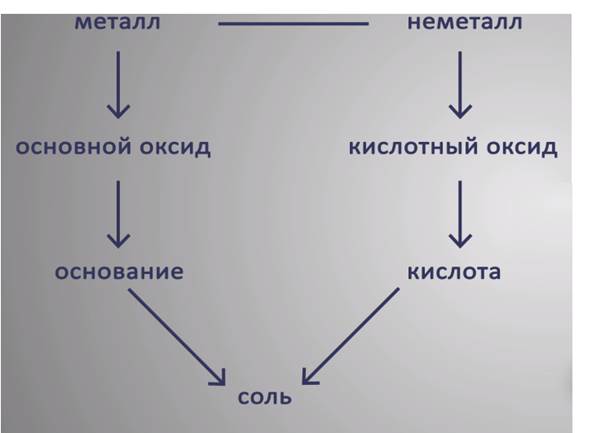
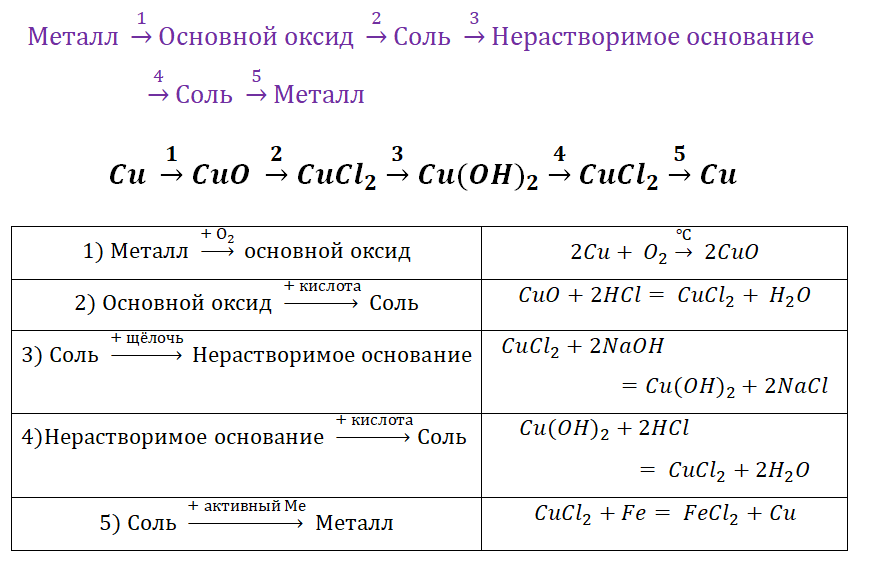
II. Генетический ряд металлов
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях.
Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
2. Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→
→основный оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
III. Генетический ряд неметаллов
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота →кислотный оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si
IV. Закрепление
Осуществите превращения по схеме, укажите типы реакций, назовите вещества
1.Al→Al2O3→AlCl3→Al(OH)3→Al2O3
2. P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
3. Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
4.Cu →CuO→CuCl2→Cu(OH)2→CuO→Cu
5.N2O5→HNO3→Fe(NO3)2→Fe(OH)2→FeS→FeSO4
V. Тренажёры
Тренажёр №1. «Классы неорганических соединений»
Тренажёр №2. «Генетическая связь между классами неорганических веществ»
Задание:
Прочитайте отрывок из романа Л. Буссенара «Похитители бриллиантов» и выполните задания:
«Пожар пылал несколько часов подряд. Пещера превратилась в настоящую печь по обжигу извести. Неслыханной силы пламя обожгло весь известковый пласт, который представляет собой углекислую соль кальция. Под действием огня известняк разложился, угольная кислота выделилась, и получилось именно, то, что называется негашеной известью. Оставалось только, чтобы на нее попало известное количество воды.
Так и случилось. Ливень, который последовал за грозой, залил всю эту огромную массу негашеной извести, она разбухла, стала с непреодолимой силой распирать сжимавший её уголь и выталкивать его по направлению к пропасти… Скалы, деревья, клад, мумии – все исчезло в мгновение ока вместе с презренными негодяями».
Задания:
- Составить и осуществить цепочку превращений.
- Решить задачу.
- Определить массу негашеной извести, образующейся при разложении известняка массой 300г., в котором массовая доля некарбонатной примеси составляет 20%.
Лабиринт
Пять человек отправляются в путешествие в царство Солей. Если формула вещества соответствует приведенному под ней названию, то вы переходите к следующему пункту по стрелке «да», если не соответствует – по стрелке «нет». Можно войти в любой «вход». Но правильный «выход» только один – «пункт Г».
ЦОРы
Учебный видео-фильм: “Генетическая связь между отдельными классами неорганических соединений”
Из веществ одного класса можно получить вещества другого класса. Такую связь, отражающую происхождение веществ, называют генетической (от греч. «генезис» — происхождение). Рассмотрим сущность генетических связей между классами неорганических веществ.
В ходе химических реакций химический элемент не исчезает, атомы переходят из одного вещества в другое. Атомы химического элемента как бы передаются от простого вещества к более сложному, и наоборот. Таким образом, возникают так называемые генетические ряды, начинающиеся простым веществом – металлом или неметаллом – и заканчивающиеся солью.
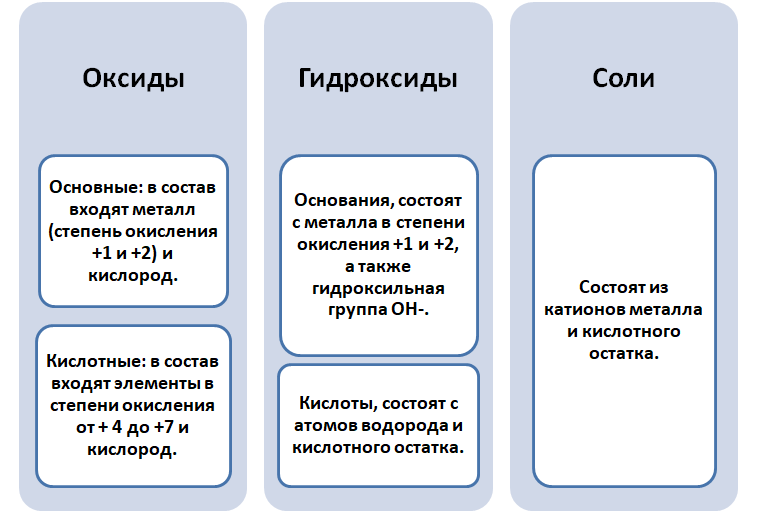
Напомню вам, что в состав солей входят металлы и кислотные остатки. Итак, генетический ряд металла может выглядеть таким образом:
Из металла в результате реакции соединения с кислородом можно получить основный оксид, основный оксид при взаимодействии с водой дает основание (только, если это основание – щелочь), из основания в результате реакции обмена с кислотой, солью или кислотным оксидом можно получить соль.
Обратите внимание, такой генетический ряд подходит только для металлов, гидроксиды которых являются щелочами.
Запишем уравнения реакций, соответствующих превращениям лития в его генетическом ряду:
Li → Li2O → LiOH→ Li2SO4
Как вы знаете, металлы при взаимодействии с кислородом, как правило, образуют оксиды. При окислении кислородом воздуха литий образует оксид лития:
4Li + O2 = 2Li2O
Оксид лития, взаимодействуя с водой, образует гидроксид лития – растворимое в воде основание (щелочь):
Li2O + H2O = 2LiOH
Сульфат лития можно получить из лития несколькими способами, например, в результате реакции нейтрализации с серной кислотой:
2LiOH + H2SO4 = Li2SO4 + 2H2O
2. Генетический ряд неметалла
Составим теперь генетический ряд неметалла:
Неметалл образует кислотный оксид. Из кислотного оксида при реакции с водой образуется кислота. Из кислоты в результате взаимодействия с металлом, основанием, солью или основным оксидом можно получить соль.
В качестве примера рассмотрим последовательные превращения серы:
S → SO2 → H2SO3 → K2SO3
Для получения оксида серы(IV) нужно провести реакцию горения серы в кислороде:
S + O2 = SO2
При растворении оксида серы(IV) в воде образуется сернистая кислота:
SO2 + H2O = H2SO3
Сульфит калия из сернистой кислоты можно получить, например, в результате реакции с основным оксидом — оксидом калия:
K2O + H2SO3 = K2SO3 + H2O
Другой способ получения сульфита калия из сернистой кислоты – реакция нейтрализации с гидроксидом калия:
2KOH + H2SO3 = K2SO3 + 2H2O
3. Реакции между представителями двух генетических рядов
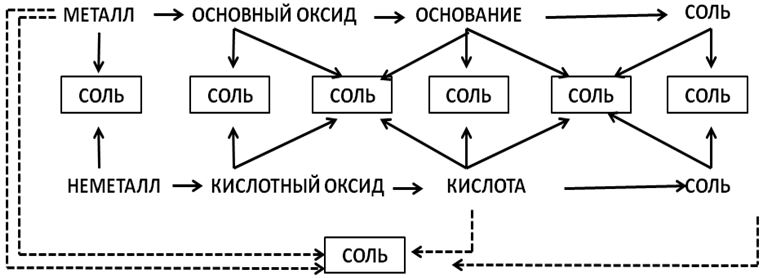
Генетическая связь между классами неорганических веществ приведена на Рис. 1.
Рис. 1. Генетическая связь между классами неорганических веществ
В приведенной схеме пары стрелок, направленных навстречу друг другу, показывают, какие реагенты нужно взять, чтобы получить соль.
Например, соль образуется при взаимодействии металла и неметалла, основного оксида и кислоты, металла и кислоты и т.д.
Запомним, что характерными являются реакции между представителями разных генетических рядов. Вещества из одного генетического ряда, как правило, не вступают во взаимодействия.
Содержание:
- § 1 Химические свойства солей
- § 2 Генетическая связь неорганических соединений
- § 3 Краткие итоги урока
§ 1 Химические свойства солей
Изучая химические свойства классов неорганических соединений, мы познакомились с одним из общих свойств солей – взаимодействием их растворов с растворами щелочей. Например, раствор хлорида железа (III) может вступать в реакцию с раствором гидроксида натрия, при этом образуется бурый осадок гидроксида железа (III) и растворимая соль хлорид натрия.
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl.
Если в состав соли входит металл, образующий нерастворимое основание, то эти реакции можно рассматривать и как способ получения нерастворимых оснований.
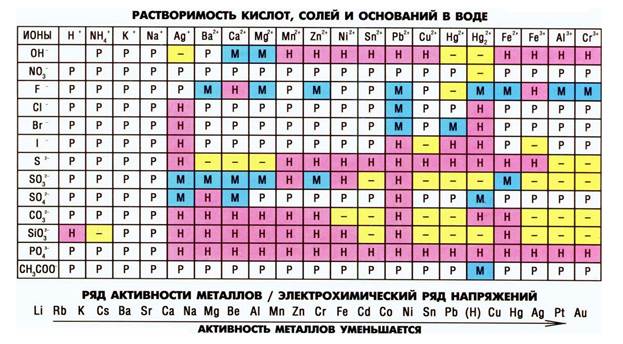
Уже из данного свойства ясно, что способность конкретной соли (например, хлорида серебра, нитрата свинца или любой другой) вступать в те или иные химические реакции зависит от ее растворимости в воде.
Взаимодействие солей со щелочами не единственное их свойство. Они также вступают в реакции замещения с металлами, более активными, чем тот, который образует соль (стоящими в ряду активности металлов левее). Опустим, например, железный гвоздь в голубой раствор сульфата меди (II). Мы увидим, что на гвозде появился темно-красный налет – это выделилась медь, а раствор постепенно побледнел и приобрел желтоватую окраску, свойственную солям железа (II).
Fe + CuSO4 → FeSO4 + Cu.
Многие соли способны вступать в обменные реакции с кислотами и другими солями. Важным условием обменных реакций является образование летучего соединения или осадка среди продуктов, иначе обменная реакция считается обратимой, не протекающей до конца. Образование осадка мы можем предсказать, используя таблицу растворимости солей, оснований и кислот; образование летучего соединения – только зная свойства конкретных соединений. Например, мы знаем, что угольная кислота – очень нестойкое соединение и сразу разлагается на воду и углекислый газ. Н2СО3 → Н2О + СО2↑, поэтому о ее образовании мы будем судить по появлению пузырьков в реакционной смеси. Если к раствору соли угольной кислоты, карбоната натрия, добавить соляную кислоту, то можно будет наблюдать появление пузырьков углекислого газа, который выделяется при разложении образующейся угольной кислоты. Кроме того, в данной реакции образуется и растворимая соль хлорид натрия. Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑.
При взаимодействии солей с другими солями газообразных веществ не образуется, зато может образоваться осадок нерастворимого продукта. Например, при взаимодействии растворов хлорида натрия и нитрата серебра образуется белый хлопьевидный осадок хлорида серебра и раствор нитрата натрия.
NaCl + AgNO3 → AgCl↓ + NaNO3.
§ 2 Генетическая связь неорганических соединений
Первую в химии классификацию элементов и их соединений дал великий шведский ученый Йенс Якоб Берцелиус.
Хотя его представления о свойствах элементов в дальнейшем были существенно изменены, они сыграли большую роль в последующем развитии классификации веществ.
Приведем в единую систему накопленные нами знания о классификации неорганических веществ.
Связь между классами неорганических соединений, основанная на получении веществ одного класса из веществ другого класса, называется генетической.
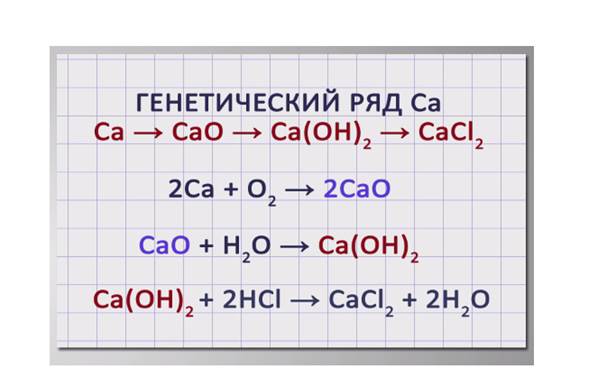
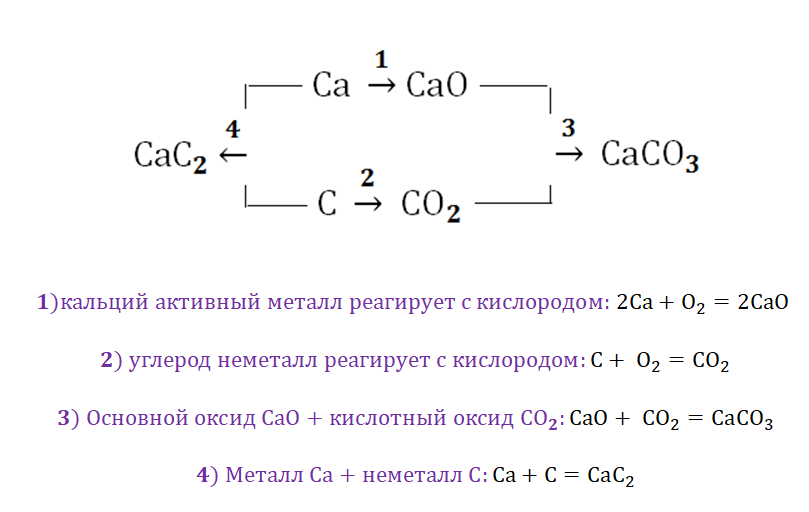
Приведем пример цепочки превращений, иллюстрирующей генетический ряд металла кальция.
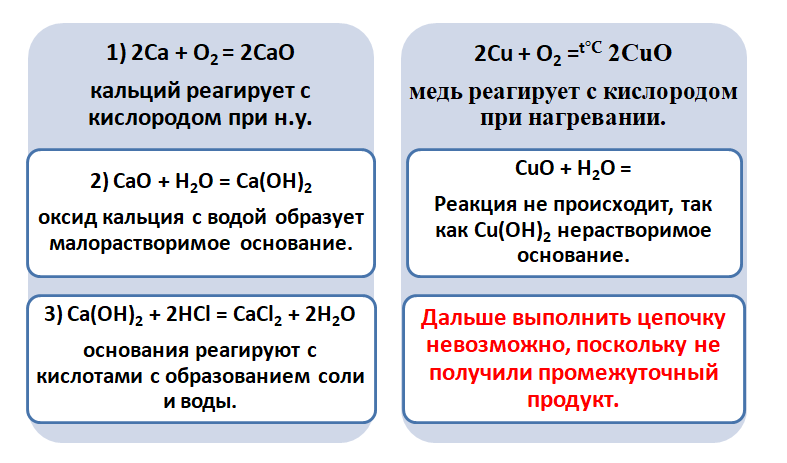
Са → СаО → Са(ОН)2 → СаСl2. Из кальция получим оксид кальция, соединив его с кислородом: 2Са + О2 → 2СаО. Из оксида кальция путем взаимодействия его с водой получим гидроксид кальция: СаО + Н2О → Са(ОН)2. Из гидроксида кальция при его взаимодействии с соляной кислотой можем получить хлорид кальция. Са(ОН)2 + 2HCl → СаСl2 + 2H2O.
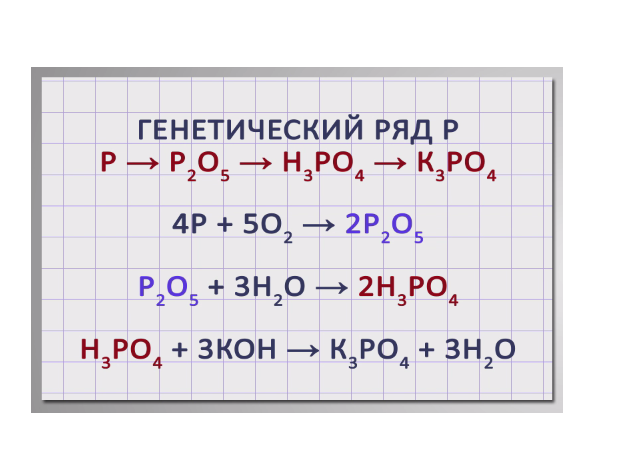
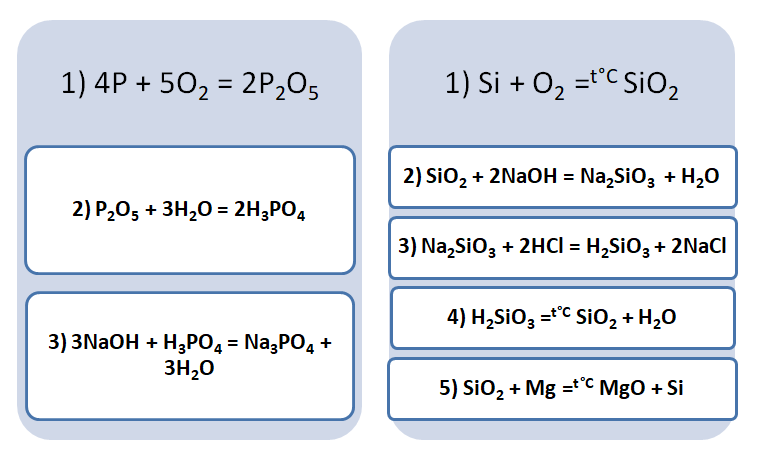
Аналогично составим генетический ряд неметалла фосфора.
Р → Р2О5 → Н3РО4 → К3РО4. В результате сжигания фосфора в кислороде получим оксид фосфора (V): 4Р + 5О2 → 2Р2О5. Растворением оксида фосфора (V) в воде получим фосфорную кислоту: Р2О5 + 3Н2О → 2Н3РО4. В результате взаимодействия фосфорной кислоты с гидроксидом калия получим фосфат калия:
Н3РО4 + 3КОН → К3РО4 + 3Н2О.
Генетический ряд металла включает сам металл, его основный оксид, гидроксид (основание) и соли.
Генетический ряд неметалла состоит из самого неметалла, его кислотного оксида, кислоты и ее солей. Как правило, между собой взаимодействуют вещества, относящиеся к противоположным генетическим рядам. Например, два основных оксида друг с другом не взаимодействуют, зато вступают в реакции с кислотными оксидами.
§ 3 Краткие итоги урока
Таким образом, для основных оксидов характерно взаимодействие с кислотными оксидами и кислотами, для кислотных оксидов – с основными оксидами и щелочами. Кислоты вступают в химическое взаимодействие с металлами, их оксидами и гидроксидами – растворимыми и нерастворимыми. Растворимые основания вступают в химическое взаимодействие с кислотными оксидами, кислотами и растворимыми солями. Нерастворимые основания взаимодействуют только с кислотами. Соли вступают в реакции с металлами, растворимыми основаниями, кислотами и солями.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
10. 02. 2018 Химические свойства солей. Генетическая связь неорганических соединений.
1. РАСТВОРИМАЯ СОЛЬ + ЩЕЛОЧЬ = НОВАЯ СОЛЬ + НЕРАСТВОРИМОЕ ОСНОВАНИЕ↓ (р. обмена) Fe. Cl 3 + 3 Na. OH → Fe(OH)3↓ + 3 Na. Cl
2. СОЛЬ + КИСЛОТА = НОВАЯ СОЛЬ + НОВАЯ КИСОТА (↓, ↑) ( р. обмена) Ag. NO 3 + HCl →НNO 3 + Ag. Cl↓ Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2↑ + Н 2 О Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду: H 2 CO 3 → H 2 O + CO 2↑ H 2 SO 3 → H 2 O + SO 2↑ Неустойчивое основание: NH 4 OH → NH 3↑ + H 2 O
3. СОЛЬ 1 (р-р) + СОЛЬ 2 (р-р) = СОЛЬ 3 + СОЛЬ 4↓ ( р. обмена) Ag. NO 3 + Na. Cl →Na. NO 3 + Ag. Cl↓ Na 2 CO 3 + Ca. Cl 4 → 2 Na. Cl + Ca. CO 3 ↓
4. СОЛЬ + МЕТАЛЛ (более активный, чем металл, образующий соль) = НОВАЯ СОЛЬ+ НОВЫЙ МЕТАЛЛ ( р. замещения) ПРАВИЛО: Более активный металл (стоящий левее в ряду напряжений) вытесняет менее активный металл (стоящий правее) из раствора его соли. 2 Ag. NO 3 + Сu →Cu(NO 3)2 + 2 Ag Fe + Cu. SO 4 → Cu + Fe. SO 4
Генетические связи — это связи между разными классами, основанные на их взаимопревращениях. 1. Генетический ряд, в котором в качестве основания выступает щёлочь. Металл → основный оксид → щёлочь → соль Ca → Ca. O → Ca(OH)2 → Ca. Cl 2
2. Генетический ряд, где в качестве основания выступает нерастворимое основание: Металл → основный оксид→ соль→ нерастворимое основание → → основный оксид → металл Cu → Cu. O → Cu. Cl 2→ Cu(OH)2→ Cu. O → Cu
3. Генетический ряд неметаллов, которому соответствует растворимая кислота. Неметалл → кислотный оксид → растворимая кислота → соль P → P 2 O 5→ H 3 PO 4 → Na 3 PO 4
4. Генетический ряд неметаллов, которым соответствует нерастворимая кислота: Неметалл → кислотный оксид → соль → кислота → кислотный оксид → неметалл Si→Si. O 2→Na 2 Si. O 3→H 2 Si. O 3→Si. O 2→Si
Осуществите превращения по схеме, укажите типы реакций, назовите вещества: 1. Al→Al 2 O 3→Al. Cl 3→Al(OH)3→Al 2 O 3 2. P→P 2 O 5→H 3 PO 4→Na 3 PO 4→Ca 3(PO 4)2 3. Zn→Zn. Cl 2→Zn(OH)2→Zn. O→Zn(NO 3)2 4. Cu →Cu. O→Cu. Cl 2→Cu(OH)2→Cu. O→Cu 5. N 2 O 5→HNO 3→Fe(NO 3)2→Fe(OH)2→Fe. О→Fe. SO 4
Домашнее задание: § 38 упр. 1
План урока:
Почему связь между классами веществ считается генетической
Родственные связи между металлами и неметаллами
Взаимопревращения между классами веществ
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
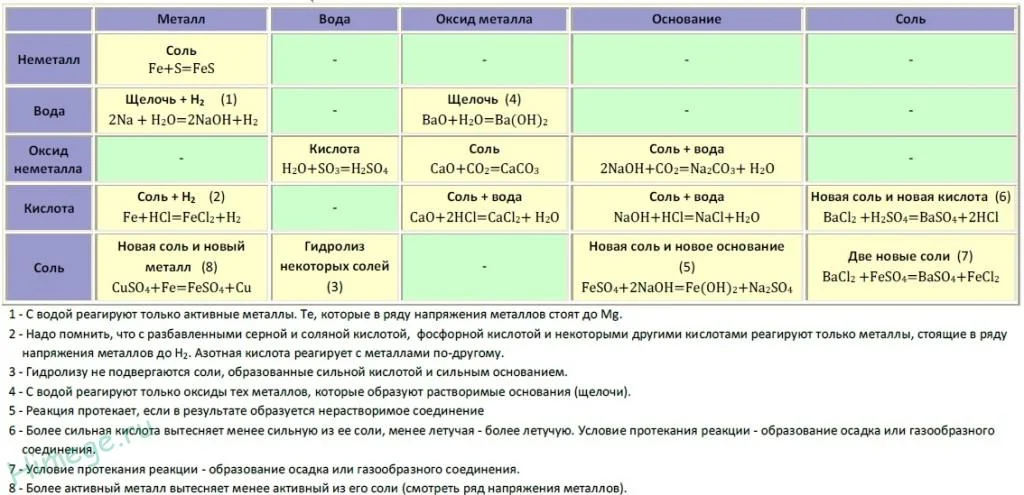
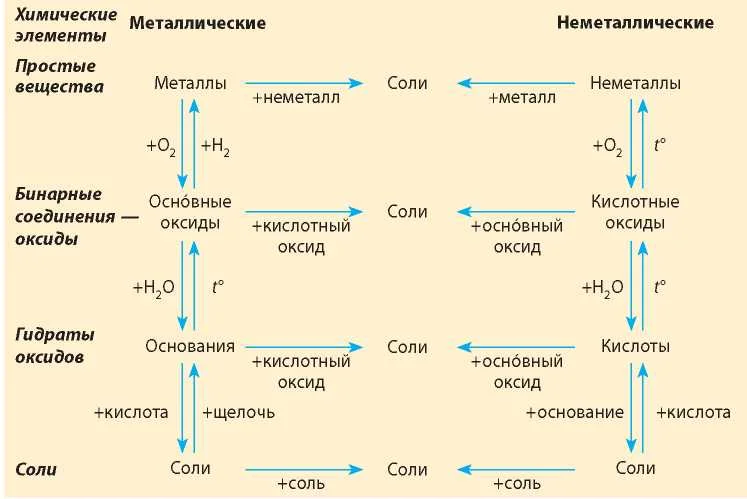
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Источник
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
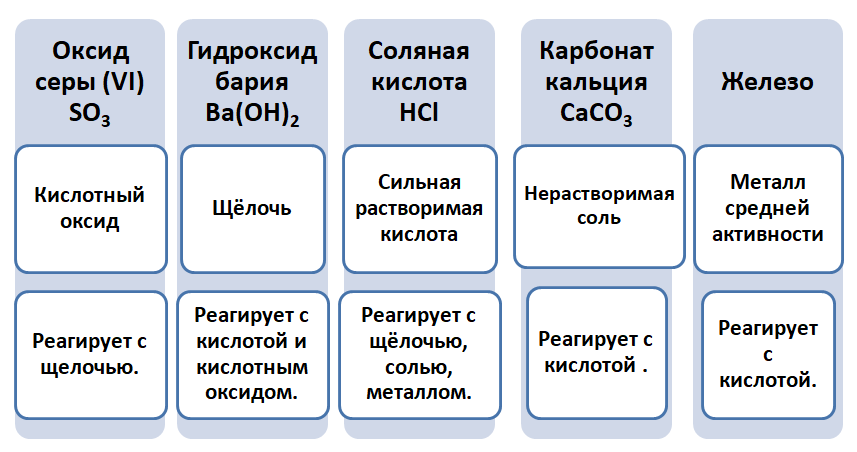
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Источник
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.