Оксиды неметаллов делят на несолеобразующие и солеобразующие. К несолеобразующим
относят оксид кремния два, оксид азота один, оксид азота два, оксид углерода два.
Все остальные оксиды являются солеобразующими. Например, оксид фосфора пять,
оксид хлора семь, оксид серы шесть, оксид серы четыре. Эти солеобразующие оксиды
являются кислотными.
Среди них есть газообразные, как оксид углерода четыре,
оксид серы четыре, оксид азота четыре и другие, а также жидкие, как оксид серы шесть,
оксид азота три и другие; твёрдые, как оксид фосфора пять, оксид кремния четыре
и другие.
Все кислотные оксиды – это ангидриды кислот. Например,
оксид углерода четыре – ангидрид угольной кислоты, оксид фосфора пять – ангидрид
фосфорной кислоты.
Все кислотные оксиды, кроме оксида кремния четыре, растворяются
в воде с образованием гидроксидов, которые по характеру являются кислотами.
При растворении оксида фосфора пять в воде образуется фосфорная кислота.
В оксидах неметаллов элемент-неметалл имеет положительные степени
окисления, причём этих степеней окисления может быть несколько и тогда неметалл
может образовывать несколько оксидов.
Например, сера в степени окисления плюс четыре образует оксид
серы четыре, в степени окисления плюс шесть – оксид серы шесть, азот также имеет
несколько степеней окисления.
Так, азот в степени окисления плюс один образует оксид
азота один, азот в степени окисления плюс два образует оксид азота два, азот в степени
окисления плюс три – оксид азота три, в степени окисления плюс четыре – оксид азота
четыре, в степени окисления плюс пять – оксид азота пять.
Чем выше степень окисления элемента-неметалла в оксиде, тем сильнее
кислотный характер оксида.
Так кислотные свойства оксида серы шесть выражены сильнее, чем оксида серы четыре.
Тоже самое наблюдается в ряду оксидов азота: начиная с оксида азота
один до оксида азота пять идёт усиление кислотных свойств оксидов, так как увеличивается
степень окисления элемента-неметалла.
Оксиды неметаллов – это соединения с полярной ковалентной связью. Кристаллические
решётки у этих оксидов могут быть молекулярные, как у оксида углерода четыре, оксида
серы шесть, и атомные, как у оксида кремния четыре.
По периоду слева направо усиливается кислотный характер оксида. Так
у оксида серы шесть кислотные свойства выражены сильнее, чем у оксида кремния четыре,
так как по периоду также увеличивается высшая степень окисления элементов-неметаллов
в соединениях.
В группах главных подгруппах сверху вниз кислотный характер оксидов
ослабевает, поэтому в пятой A группе кислотные свойства оксида азота пять
будут выражены сильнее, чем у оксида мышьяка пять. Так как в группе сверху вниз
увеличивается радиус иона неметалла, но степень окисления не изменяется.
Таким образом, все солеобразующие оксиды, образованные неметаллами,
обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления
неметалла и его радиуса атома.
Оксидам неметаллов соответствуют гидроксиды – кислородсодержащие кислоты. Изменение
силы кислоты зависит от степени окисления неметалла, радиуса атома.
Например, оксидам азота три и пять соответствуют кислоты – азотистая
и азотная. Азотная кислота является более сильной, чем азотистая и-за того, что
в азотной кислоте степень окисления азота плюс пять, а в азотистой плюс три.
Кислотные свойства оксидов хлора также усиливаются с увеличение степени
окисления атома хлора, поэтому и сила кислоты, которой соответствует данный оксид,
также будет увеличиваться. Поэтому в ряду от хлорноватистой до хлорной кислоты идёт
увеличение силы кислоты.
Таким образом, в периодах слева направо идёт увеличение заряда ядра атома неметалла,
поэтому наблюдается усиление кислотных свойств гидроксидов, образованных оксидами
неметаллов.
Например, хлорная кислота является более сильной, чем кремниевая, потому
что степень окисления хлора в хлорной кислоте плюс семь, а кремния в кремниевой
кислоте плюс четыре, а радиус иона неметалла уменьшается от кремниевой до хлорной
кислоты.
В группах сверху вниз кислотный характер гидроксидов, образованных
оксидами неметаллов, ослабевает. Например, серная кислота является более сильной, чем тэллуровая,
так как радиус иона неметалла в этом ряду возрастает, а степень окисления неметалла
не изменяется, и остаётся плюс шесть.
Все оксиды и гидроксиды, образованные элементами в максимальной степени
окисления всегда окислители.
Так, в реакции оксида серы шесть с сероводородом сера в степени окисления плюс шесть
понижает свою степень окисления до плюс четырёх, поэтому оксид серы шесть выступает
в роли окислителя, в реакции серной кислоты с медью, серная кислота также является
окислителем, потому что сера понижает свою степень окисления с плюс шести до плюс
четырёх.
Если же в оксиде или гидроксиде элемент-неметалл проявляет промежуточную
степень окисления, то эти соединения могут быть и окислителями, и восстановителями.
Так, в реакции оксида серы четыре с кислородом образуется оксид серы
шесть. Оксид серы четыре в данной реакции является восстановителем, так как сера
повышает свою степень окисления с плюс четырёх до плюс шести. В реакции оксида серы
четыре с сероводородом, образуется сера и вода. В этой реакции оксид серы четыре
является окислителем, так как сера понижает свою степень окисления с плюс четырёх
до нуля.
Водородные соединения
неметаллов
представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные,
быстроиспаряемые.
Электроотрицательность
неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях
неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот —
минус три, фосфор — минус три и так далее.
Водородные соединения
неметаллов проявляют основные, кислотные или амфотэрные свойства. Водородные соединения
неметаллов являются, как правило, сильными восстановителями.
Так, углероду соответствует
водородное соединение цэ-аш-четыре – метан, кремнию – силан, азоту – аммиак, фосфору
– фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород,
тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород,
йоду – йодоводород.
Водородные соединения
неметаллов
можно получить непосредственно взаимодействием неметалла с водородом. Сероводород
можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором,
воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
В водородных соединениях
присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую
решётку.
Как известно, электроотрицательность
усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях
возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому
и полярность связи будет уменьшаться.
Если рассмотреть третий
период, то от силена до хлороводорода будет наблюдаться усиление полярности связи
из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз
будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что
идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде.
Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное
взаимодействие с образованием водородных связей.
Если рассмотреть водородные соединения неметаллов третьего периода,
то здесь можно проследить следующую закономерность: при растворении в воде силана
не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает
в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую
среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до
хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность
связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
В группах сверху вниз кислотные свойства водородных соединений неметаллов
усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения
длины связи.
Например, водородные соединения седьмой A группы: хлороводород,
бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют.
Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у
фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные
водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением
заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные
свойства.
Например, водный раствор хлороводорода – проявляет кислотные свойства,
поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия
образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные
свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой
образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные
свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например,
в реакции сероводорода с хлором сероводород является восстановителем, потому что
сера повышает свою степень окисления с минус двух до нуля.
Таким
образом, все солеобразующие оксиды, образованные неметаллами,
обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления
неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов,
образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный
характер гидроксидов ослабевает. В периодах слева направо кислотные свойства
летучих водородных соединений элементов в водных растворах усиливаются. В группах
сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения
неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами.
Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами,
реагируют с кислотами.
Могут ли неметаллы образовывать гидроксиды?
Найдите правильный ответ на вопрос ✅ «Могут ли неметаллы образовывать гидроксиды? …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Могут ли неметаллы образовывать гидроксиды?
Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 Ca(OH)2
9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20
3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
либо
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например, гидроксид меди (II) взаимодействует с сильной соляной кислотой:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
NaOH + H3PO4 → NaH2PO4 + H2O
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
А в растворе образуется комплексная соль:
NaOH + Al(OH)3 = Na[Al(OH)4]
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
либо:
щёлочь + кислотный оксид(избыток) = кислая соль
Например, при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
2NaOH + CO2 = Na2CO3 + H2O
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Например, гидроксид натрия взаимодействует с сульфатом меди в растворе:
Cu2+SO42- + 2Na+OH— = Cu2+(OH)2—↓ + Na2+SO42-
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
NH4+NO3— + K+OH— = K+NO3— + NH3↑ + H2O
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
ZnSO4 + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
ZnSO4 + 4KOH = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например, гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
KHSO3 + KOH = K2SO3 + H2O
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Оксиды неметаллов
бывают солеобразующими и несолеоб-разующими.
К несолеобразующим относят оксиды
некоторых неметаллов в низких степенях
окисления (+1 и +2). Например:
,
N+2O,
C+2O
и др. Они не взаимодействуют с водой и
не образуют соли с основными и амфотерными
гидроксидами.
Солеобразующие
оксиды образуют неметаллы, находящиеся,
как правило, в высоких степенях окисления
(+3 и выше). Например:
,
,
,
S+4O2,
S+6O3
и др. Все солеобразующие
оксиды неметаллов являются кислотными.
1) Большинство
кислотных оксидов неметаллов
взаимодействуют с водой с образованием
кислот:
SO3
+ H2О
= H2SО4
P2O5
+ H2О
= 2H3PО4
В
этой связи кислотные оксиды иногда
называют ангидридами
(SO3
серный ангидрид, P2O5
фосфорный ангидрид).
2) Кислотные
оксиды неметаллов
реагируют с гидроксидами металлов,
образуя соль и воду:
SО2
+ 2NaOH = Na2SO3
+ H2O
P2O5
+ 6KOH = 2K3PO4
+ 3H2O
3) Кислотные
оксиды неметаллов
реагируют с основными и амфотерными
оксидами с образованием солей:
CO2
+ Na2O
= Na2СO3
Al2O3
+ 3SO3
= Al2(SO4)3
2.2. Гидроксиды
Гидроксидами
называют сложные вещества состава
HxЭyOz.
I. Гидроксиды металлов.
Как и
оксиды, гидроксиды металлов делятся на
оснóвные,
амфотерные
и кислотные.
2.2.1. Получение гидроксидов металлов
Растворимые
гидроксиды металлов (щелочи) получают
взаимодействием металлов или их оксидов
с водой:
2Na
+ 2H2O
= 2NaOH
+ H2↑
CaO
+
H2O
= Ca(OH)2
Малорастворимые
гидроксиды металлов получают, действуя
щелочами на водные растворы соответствующих
солей:
FeSO4
+ 2NaOH = Fe(OH)2↓
+ Na2SO4
AlCl3
+ 3KOH = Al(OH)3↓
+ 3KCl
1. Оснóвные гидроксиды.
Основные
гидроксиды образуют металлы в степенях
окисления +1 и +2. Например: Na+1OH,
Ca+2(OH)2,
Fe+2(OH)2
и др. Основные гидроксиды металлов
называют основаниями.
Растворимые в воде гидроксиды металлов
называют щелочами.
Щелочи
полностью диссоциируют в воде с
образованием гидроксид-ионов OH:
NaOH
Na+
+ OH
Ba(OH)2
Ba2+
+ 2OH
Названия
основных гидроксидов металлов включают
слово гидроксид и название металла.
Если металл проявляет различные степени
окисления, то она указывается в скобках
римскими цифрами:
NaOH
гидроксид натрия;
Fe(OH)2
гидроксид железа (II).
Наиболее
важными свойствами оснований являются
следующие:
1) Малорастворимые
основания при нагревании разлагаются
с образованием оксидов металлов:
Cu(OH)2
= CuO + H2O
2Fe(OH)3
= Fe2O3
+ 3H2O
2) Все
основания взаимодействуют с кислотами,
образуя соль и воду:
КОН
+ НСl
= КСl
+ Н2О
Cu(OH)2
+ H2SO4
= CuSO4
+ 2H2O
Взаимодействие
кислот с основаниями называется реакцией
нейтрализации.
3) Основания
реагируют с кислотными оксидами, образуя
соль и воду:
Са(ОH)2
+ СО2
= СаСО3
+ H2O
2. Кислотные гидроксиды.
Кислотные
гидроксиды образуют металлы в высоких
степенях окисления +5 и выше. Например:
H2Cr+6O4,
HMn+7O4.
Кислотные гидроксиды называют кислотами.
Они диссоциируют в воде с образованием
ионов H+:
H2CrO4
2H+
+ CrO42
HMnO4
H+
+ MnO4
и могут
образовывать соли с металлами:
Na2CrO4
хромат натрия; KMnO4
перманганат калия.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


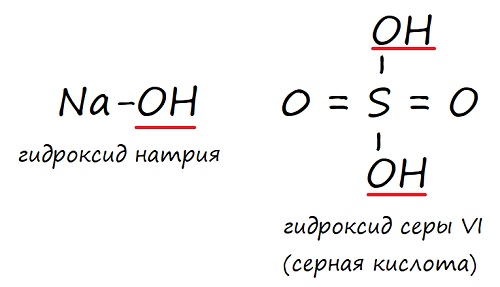
 Ca(OH)2
Ca(OH)2








