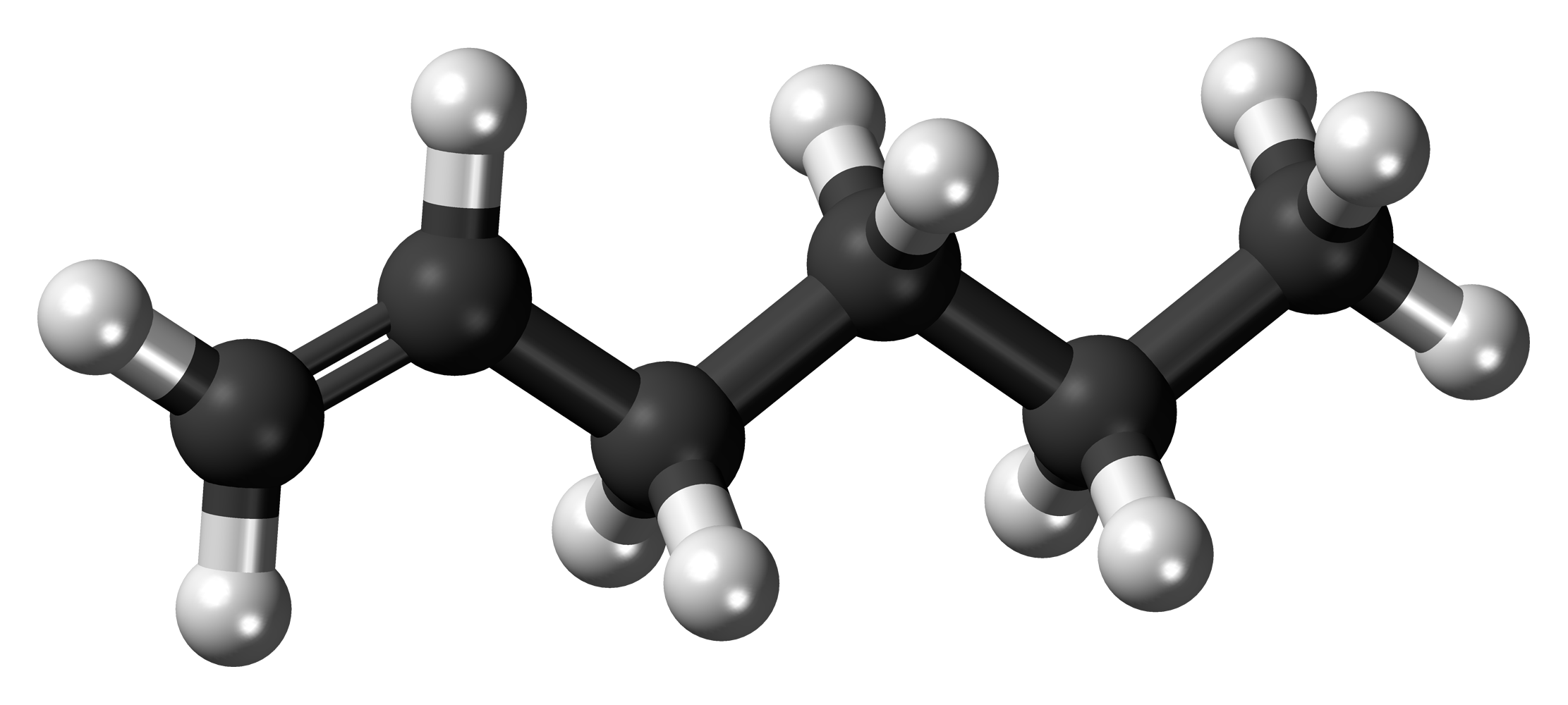
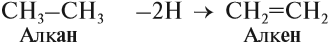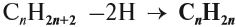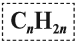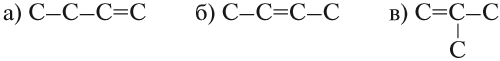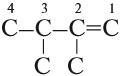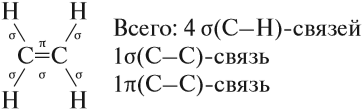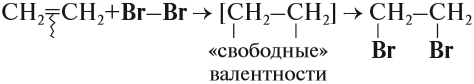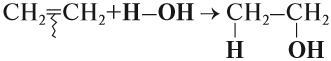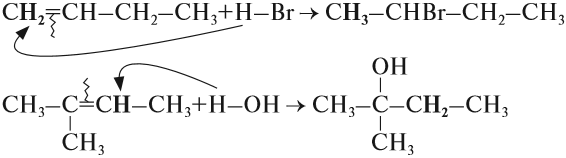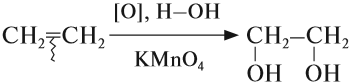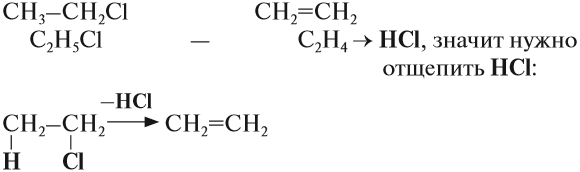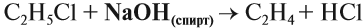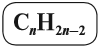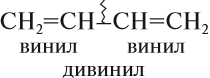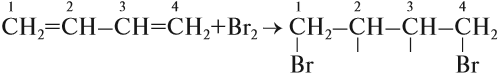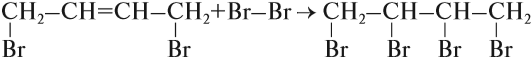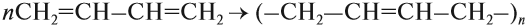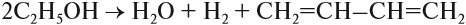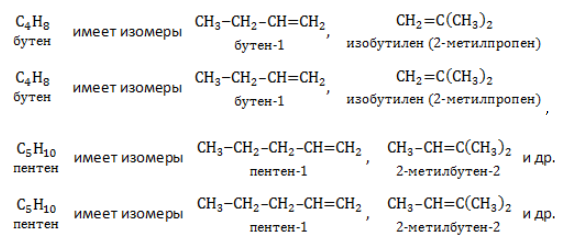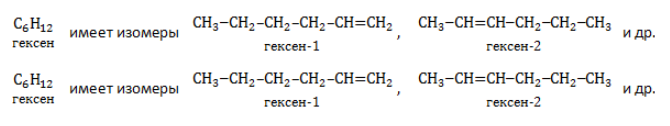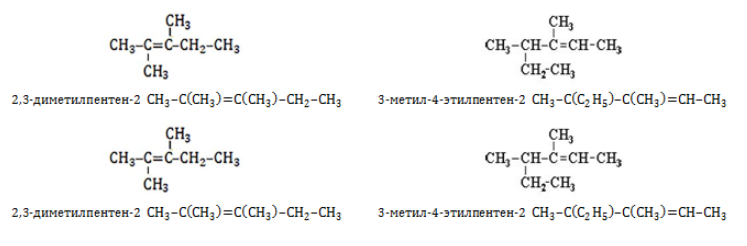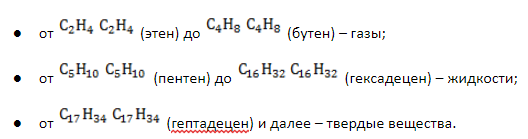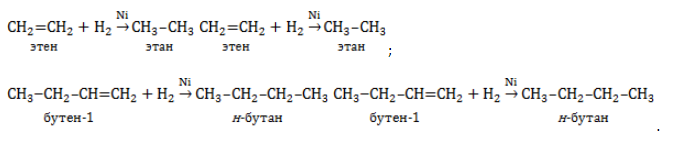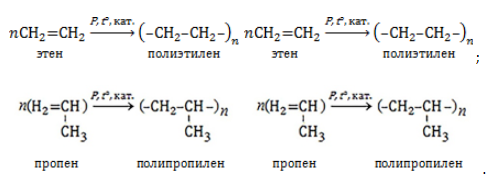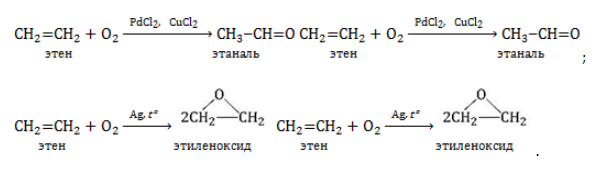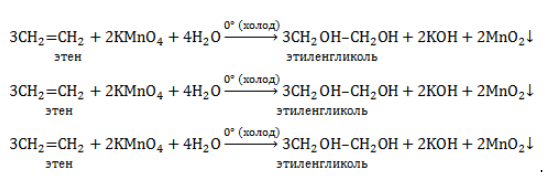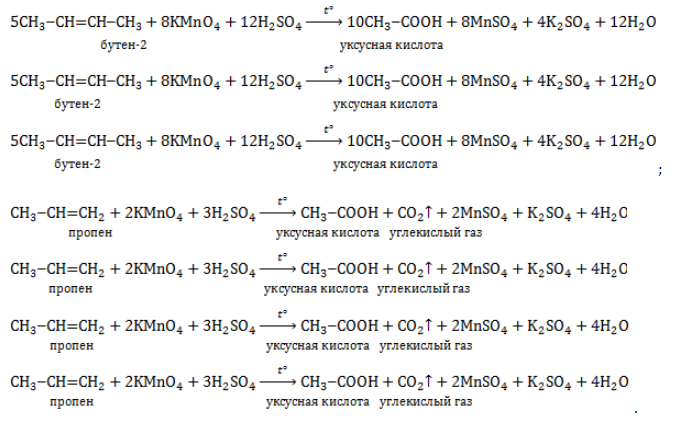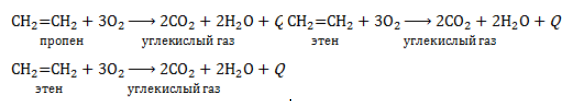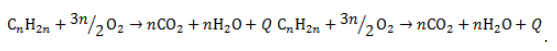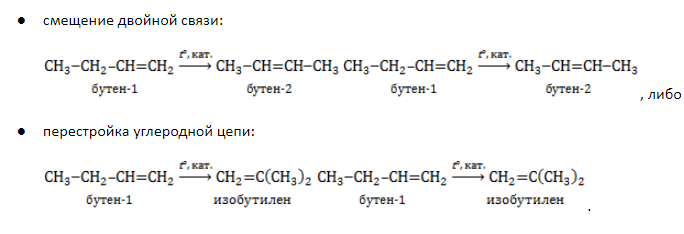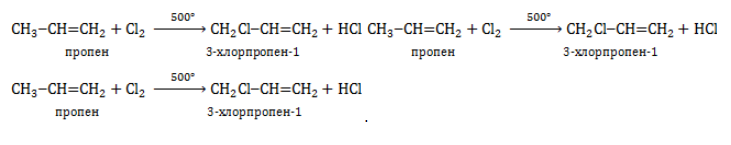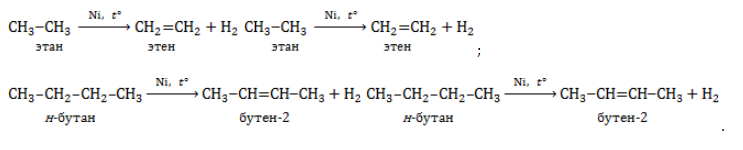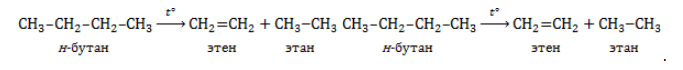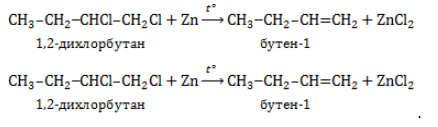Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкенов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
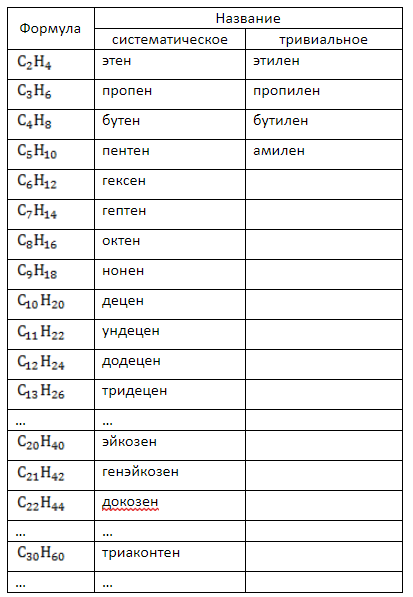
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
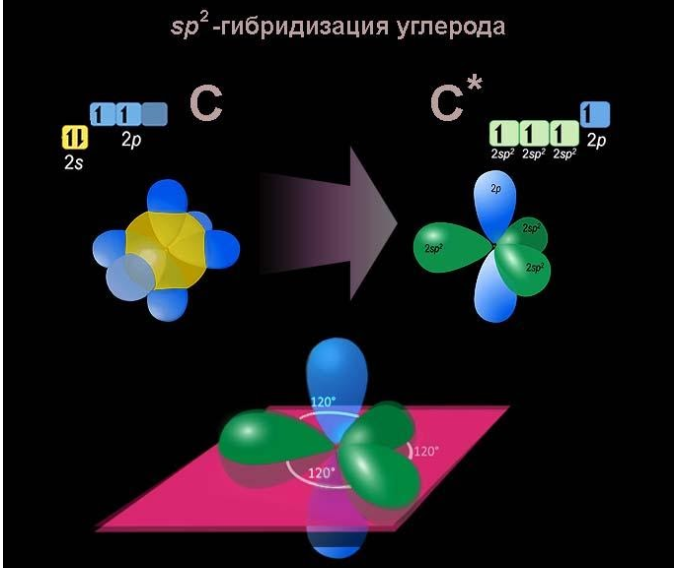
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
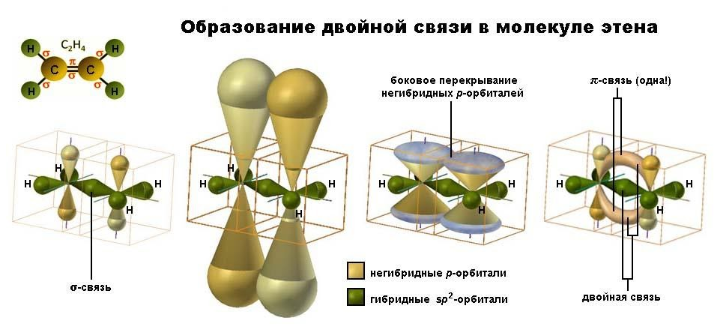
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
Изомерия алкенов
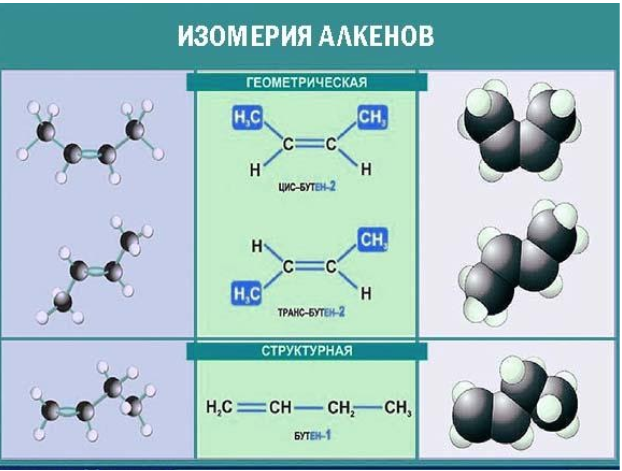
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
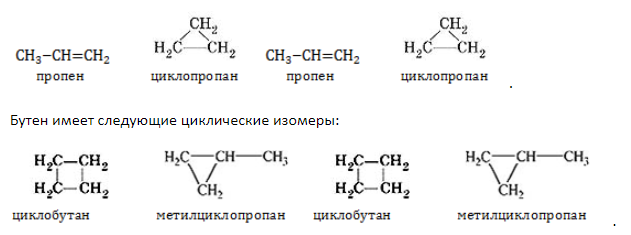
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
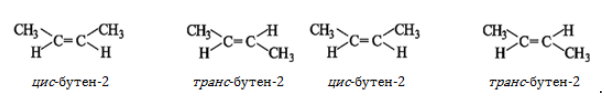
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

|
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
Номенклатура алкенов
В названиях алкенов для обозначения двойной связи используется суффикс -ЕН.
Например, алкен имеет название 2-метилпропен.
При этом правила составления названий (номенклатура) для алкенов в целом такие же, как и для алканов, но дополняются некоторыми пунктами:
1. Углеродная цепь, в составе которой есть двойная связь, считается главной.
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода при двойной связи получили наименьший номер. Нумерацию следует начинать с более близкого к двойной связи конца цепи.
3. В конце молекулы вместо суффикса АН добавляют суффикс ЕН и указывают наименьший номер атома углерода при двойной связи в углеродной цепи.
4. Для простейших алкенов применяются также исторически сложившиеся (тривиальные) названия:
Радикалы, содержащие двойную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH2=CH- | винил |
| CH2=CH-CH2— | аллил |
Химические свойства алкенов
Алкены – непредельные углеводороды, в молекулах которых есть одна двойная связь. Строение и свойства двойной связи определяют характерные химические свойства алкенов.
Двойная связь состоит из σ-связи и π-связи. Рассмотрим характеристики одинарной связи С-С и двойной связи С=С:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С-С | 348 | 0,154 |
| С=С | 620 | 0,133 |
Можно примерно оценить энергию π-связи в составе двойной связи С=С:
Еπ = Е(С=С) — Е(С-С) = 620 — 348 = 272 кДж/моль
Таким образом, π-связь — менее прочная, чем σ-связь. Поэтому алкены вступают в реакции присоединения, сопровождающиеся разрывом π-связи. Присоединение к алкенам может протекать по ионному и радикальному механизмам.
Для алкенов также характерны реакции окисления и изомеризации. Окисление алкенов протекает преимущественно по двойной связи, хотя возможно и жесткое окисление (горение).
1. Реакции присоединения
Для алкенов характерны реакции присоединения по двойной связи С=С, при которых протекает разрыв пи-связи в молекуле алкена.
1.1. Гидрирование
Алкены реагируют с водородом при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt, Pd и др.).
Например, при гидрировании бутена-2 образуется бутан.
Реакция протекает обратимо. Для смещения равновесия в сторону образования бутана используют повышенное давление.
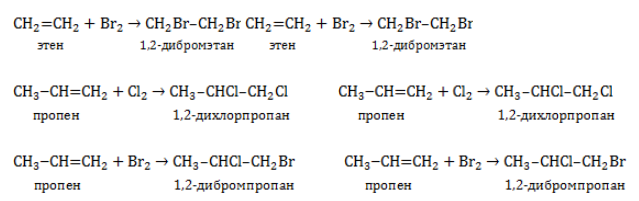
1.2. Галогенирование алкенов
Присоединение галогенов к алкенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
При взаимодействии с алкенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь.
Например, при бромировании пропилена образуется 1,2-дибромпропан, а при хлорировании — 1,2-дихлорпропан.
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкенов
Алкены присоединяют галогеноводороды. Реакция идет по механизму электрофильного присоединения с образованием галогенопроизводного алкана.
Например, при взаимодействии этилена с бромоводородом образуется бромэтан.
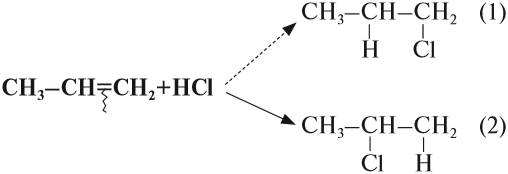
При присоединении полярных молекул к несимметричным алкенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Например, при присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы СН2=, поэтому преимущественно образуется 2-хлорпропан.
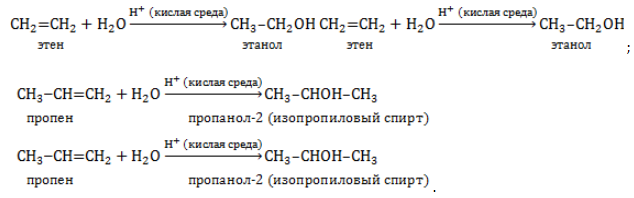
1.4. Гидратация
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
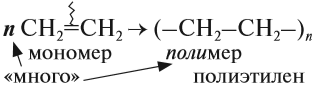
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
Например, при полимеризации этилена образуется полиэтилен, а при полимеризации пропилена — полипропилен.
2. Окисление алкенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
2.1. Каталитическое окисление
Каталитическое окисление протекает под действием катализатора.
Взаимодействие этилена с кислородом в присутствии солей палладия протекает с образованием этаналя (уксусного альдегида)
Взаимодействие этилена с кислородом в присутствии серебра протекает с образованием эпоксида
2.2. Мягкое окисление
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2)
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойной связи С=С и связей С-Н у атомов углерода при двойной связи. При этом вместо разрывающихся связей образуются связи с кислородом.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Поэтому можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутена-2 перманганатом калия в среде серной кислоты окислению подвергаются два фрагмента –CH=, поэтому образуется уксусная кислота:
При окислении метилпропена перманганатом калия в присутствии серной кислоты окислению подвергаются фрагменты >C= и CH2=, поэтому образуются углекислый газ и кетон:
При жестком окислении алкенов в нейтральной среде образующаяся щелочь реагирует с продуктами реакции окисления алкена, поэтому образуются соли (кроме реакций, где получается кетон — кетон со щелочью не реагирует).
Например, при окислении бутена-2 перманганатом калия в воде при нагревании окислению подвергаются два фрагмента –CH=, поэтому образуется соль уксусной кислоты – ацетат калия:
Например, при окислении метилпропена перманганатом калия в воде при нагревании окислению подвергаются фрагменты >C= и CH2=, поэтому образуются карбонат калия и кетон:
Взаимодействие алкенов с хроматами или дихроматами протекает с образованием аналогичных продуктов окисления.
2.3. Горение алкенов
Алкены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкенов выглядит так:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
3. Замещение в боковой цепи
Алкены с углеродной цепью, содержащей более двух атомов углерода, могут вступать в реакции замещения в боковой цепи, как алканы.
При взаимодействии алкенов с хлором или бромом при нагревании до 500оС или на свету происходит не присоединение, а радикальное замещение атомов водорода в боковой цепи. При этом хлорируется атом углерода, ближайший к двойной связи.
Например, при хлорировании пропилена на свету образуется 3-хлорпропен-1
4. Изомеризация алкенов
При нагревании в присутствии катализаторов (Al2O3) алкены вступают в реакцию изомеризации. При этом происходит либо перемещение двойной связи, либо изменение углеродного скелета. При изомеризации из менее устойчивых алкенов образуются более устойчивые. Как правило, двойная связь перемещается в центр молекулы.
Например, при изомеризации бутена-1 может образоваться бутен-2 или 2-метилпропен
CH2=CH-CH2-CH3 → CH3-CH=CH-CH3
Получение алкенов
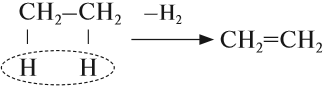
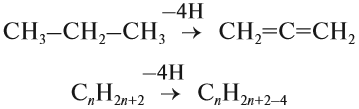
1. Дегидрирование алканов
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, образуются двойные и тройные связи.
Например, при дегидрировании этана может образоваться этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
2. Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Дегидрогалогенирование галогеналканов
Галогеналканы взаимодействуют с щелочами в спиртовом растворе. При этом происходит дегидрогалогенирование – отщепление (элиминирование) атомов водорода и галогена от галогеналкана.
Например, при взаимодействии хлорэтана с спиртовым раствором гидроксида натрия образуется этилен.
При отщеплении галогена и водорода от некоторых галогеналканов могут образоваться различные органические продукты. В таком случае выполняется правило Зайцева.
Правило Зайцева: отщепление атома водорода при дегидрогалогенировании и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Например, при взаимодействии 2-хлорбутана со спиртовым раствором гидроксида натрия преимущественно образуется бутен-2. Бутен-1 образуется в небольшом количестве (примерно 20%). В реакции мы указываем основной продукт.
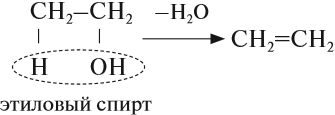
4. Дегидратация спиртов
При нагревании спиртов (выше 140оС) в присутствии водоотнимающих веществ (концентрированная серная кислота, фосфорная кислота) или катализаторов (оксид алюминия) протекает дегидратация. Дегидратация — это отщепление молекул воды.
При дегидратации спиртов образуются алкены.
Например, при дегидратации этанола при высокой температуре образуется этилен.
Дегидратация более сложных молекул также протекает по правилу Зайцева.
Например, при дегидратации бутанола-2 преимущественно образуется бутен-2.
5. Дегалогенирование дигалогеналканов
Дигалогеналканы, в молекулах которых два атома галогена расположены у соседних атомов углерода, реагируют с активными металлами с образованием алкенов.
Как правило, для отщепления используют двухвалентные активные металлы — цинк или магний.
Например, 1,2-дихлорпропан реагирует с цинком с образованием пропилена
6. Гидрирование алкинов
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1.
7. Гидрирование алкадиенов
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2).
При полном гидрировании дивинила образуется бутан:
Алкены — это непредельные углеводороды, в молекулах которых между атомами углерода имеется 1 двойная связь.
Их общая формула: CnH2n.
Простейший представитель — это этилен / этен, его формула C2H4.
Гомологический ряд — это ряд соединений одного структурного типа, которые отличаются друг от друга на отличающихся друг от друга на гомологическую разность.
Гомологической разностью будет звено —СН2—.
**
Гомологический ряд алкенов будет таким:
1) этилен/этен — C2H4
2) пропен — C3H6
3) бутен — C4H8
4) пентен — C5H10
5) гексен — C6H12
6) гептен — C7H14
7) октен — C8H16

9) децен — C10H20
10) ундецен — C12H22
Чтобы построить гомологический ряд можно использовать 2 способа:
-
воспользоваться общей формулой алкенов.
-
к младшему члену ряда (например, этен) прибавить гомологическую разность — получится старший член ряда (в случае с этеном это будет пропен).
По номенклатуре ИЮПАК названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен».
Содержание
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства алкенов
- Физические свойства
- Химические свойства
- Получение и применение алкенов
- Понятие об алкадиенах (диены)
- Выводы
Гомологический ряд, номенклатура, изомерия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
Общая формула:
Таким образом, алкены образует гомологический ряд, общая формула которого
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:
Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи. Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы). Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:
Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:
Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.
Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная. Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь. Таким образом, в молекуле этена (этилена) имеется:
Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:
Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Упражнение 19.3. В двух пробирках находятся бесцветные жидкости: н-пентан и пентен-1. Как при помощи химической реакции определить, где какая жидкость находится?
Решение. В обе пробирки добавляем жёлтую бромную воду и сильно встряхиваем: в пробирке, где был пентен-1, смесь обесцветится, а в другой пробирке цвет бромной воды не изменится.
Задание 19.3. Составьте уравнения реакций этих процессов.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
Задание 19.4. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
Задание 19.5. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Задание 19.6. Составьте уравнение реакции горения этилена.
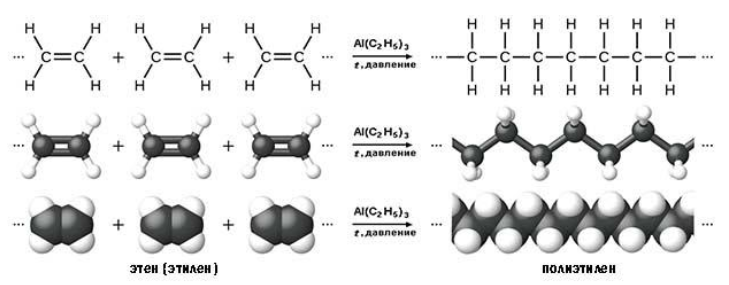
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал (см. урок 26).
Получение и применение алкенов
Главный промышленный источник алкенов — природный газ, нефть и продукты их переработки (например, продукты крекинга).
Основным способом получения алкенов является реакция отщепления. В этом случае от двух соседних атомов углерода отщепляется по одному атому или группе:
В лаборатории алкены можно получить реакцией дегидратации (отщепления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:
Упражнение 19.4. Какую молекулу нужно отщепить от хлорэтана, чтобы получить алкен?
Решение. Сравним состав хлорэтана и этилена:
Эта реакция происходит под действием спиртового раствора щёлочи. Уравнение этого процесса записывается так:
Вопрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана для получения этилена?
Алкены легко вступают в химические реакции, поэтому они применяются для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задание 19.7. Составьте уравнения реакций получения перечисленных веществ.
Плёнки полиэтилена находят большое применение не только для хранения пищевых продуктов: ими устилают дно каналов, чтобы уменьшить потери влаги; полиэтиленовую пленку используют для устройства парников; ею оборачивают трубы, чтобы уменьшить потери от коррозии и т. д.
Понятие об алкадиенах (диены)
Алкадиены — это углеводороды, в молекулах которых есть две двойные связи.
Алкадиены относят к группе непредельных ненасыщенных углеводородов.
Для того чтобы вывести общую формулу гомологического ряда алкадиенов, сравним состав алканов и алкадиенов:
Таким образом, алкадиены образуют гомологический ряд, общая формула которого
Первый член гомологического ряда алкадиенов С3Н4 называется пропадиен. Таким образом, названия составляют, используя те же принципы номенклатуры IUPAC, с использованием суффикса диен.
Вопрос. На что указывает этот суффикс?
Некоторые диены (так кратко обозначают представителей этого гомологического ряда) имеют тривиальные названия. Например, бутадиен-1,3 известен под названием дивинил, поскольку каждая его половинка является непредельным радикалом, который называется «винил»:
Его гомолог — 2-метилбутадиен-1,3 называется изопрен.
Задание 19.8. Составьте графическую формулу этого соединения.
Начиная с n = 4, возникает изомерия, которая связана не только со строением углеродной цепи, но и положением кратных связей. По этому признаку различают:
- диены с кумулированными связями С–С–С=С=С;
- диены с сопряжёнными связями С–С=С–С=С;
- диены с изолированными связями С=С–С–С=С.
Наибольшее значение и применение имеют диены с сопряжёнными связями. Рассмотрим их свойства.
Для алкадиенов, как и для алкенов, характерны реакции присоединения, которые идут в две стадии. Но диены с сопряжёнными связями вначале присоединяют бром (или другое вещество) в положение 1,4:
Образовавшиеся «свободные валентности» замыкаются, образуя двойную связь.
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученное вещество содержит двойную связь, возможна вторая стадия этого процесса:
Установлено, что на первой стадии присоединения образуется 2 изомера: 80 % указанного вещества (1,4-дибромбутен-2) и 20 % 3,4-дибромбутена-1*.
* Здесь нумерация цепи идёт по двойной связи, так как галогены не являются функциональной группой.
Задание 19.9. Составьте формулы обоих соединений.
Большое практическое значение имеет процесс полимеризации сопряжённых диенов. Вначале, как в случае бромирования, возникает двойная связь в положении 2,3:
Поскольку в полученном полимере имеется двойная связь, такие полимеры имеют два изомера: цис- и транс- (см. урок 19.1). Цис-изомеры таких полимеров являются эластичными и называются каучуки.
Каучуки — это эластичные полимеры, из которых получают резину. Резина образуется из каучука в результате вулканизации. Дело в том, что чистый каучук имеет крайне низкие эксплуатационные качества. Он становится твёрдым и хрупким на морозе, липким на жаре, быстро окисляется, крайне непрочен.
Бутадиен получают синтезом Лебедева**, который заключается в том, что этиловый спирт в присутствии определённых катализаторов подвергают одновременно дегидрированию и дегидратации:
** Лебедев Сергей Васильевич (25.07.1874–02.05.1934) — советский химик. Впервые получил (1910) образец синтетического бутадиенового каучука, разработал (1930) методы получения резины и резинотехнических изделий из синтетического каучука. По способу Лебедева впервые получен (1932) промышленный синтетический каучук.
Для алкадиенов, так же как и для алкенов, характерна реакция окисления. Например, они обесцвечивают раствор перманганата калия. При этом образуются многоатомные спирты.
Производные изопрена широко распространены в природе. К ним относятся многие душистые вещества (мяты, лимона), витамины (каротин, витамин А), а также холестерин.
Выводы
Алкены и алкадиены — это непредельные углеводороды, содержащие двойные связи. Для таких веществ характерны реакции
- присоединения;
- окисления;
- полимеризации.
Все они происходят за счёт разрыва π-связи, которая входит в состав двойной связи.
Алкадиены с сопряжёнными связями образуют полимеры с особыми свойствами — каучуки.
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
Гомологический ряд алканов в таблице
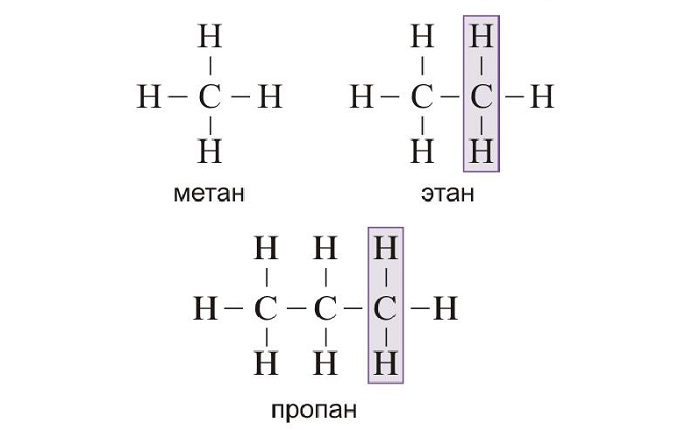
Алканы — ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
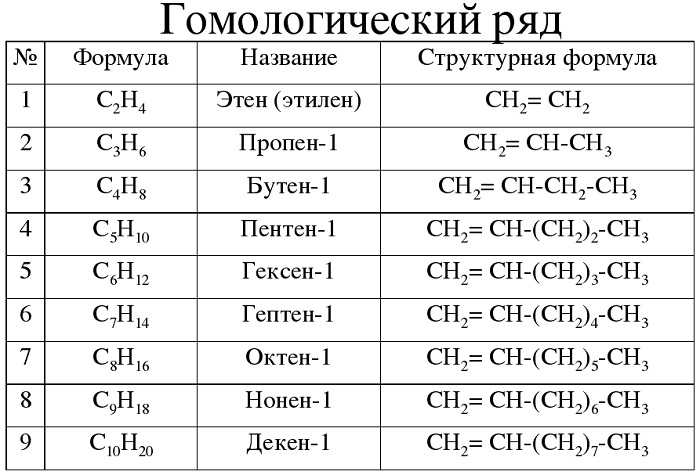
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
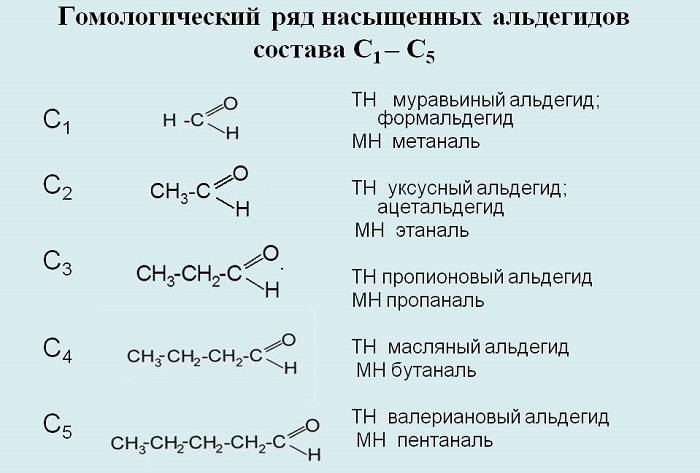
Гомологический ряд альдегидов
Альдегиды — органические вещества, имеющие в своём составе группу -CHO.
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Содержание
- 1 Строение алкенов
- 1.1 Электронная конфигурация
- 1.2 Двойная связь
- 2 Изомерия и номенклатура углеводородов ряда алкенов
- 2.1 Структурная изомерия
- 2.2 Пространственная изомерия
- 2.3 Номенклатура алкенов
- 3 Физические свойства алкенов
- 4 Химические свойства алкенов
- 4.1 Реакции присоединения
- 4.2 Окисление алкенов
- 4.3 Изомеризация
- 4.4 Радикальное замещение
- 5 Получение алкенов
- 5.1 Дегидрирование алканов
- 5.2 Крекинг алканов
- 5.3 Дегидратация спиртов
- 5.4 Дегалогенирование и дегидрогалогенирование галогеналканов
- 6 Применение алкенов
Непредельные (ненасыщенные) углеводородные органические соединения отличает от предельных наличие в молекулах кратных химических связей между атомами углерода. Ациклические ненасыщенные углеводороды образуют гомологические ряды, в числе которых алкены – гомологи этена (этилена), характеризуются простым строением молекулы. Они обладают комплексом свойств, что выражается в определенном наборе характерных химических процессов.
Строение алкенов
Общая формула гомологического ряда углеводородов, относящихся к алкенам, имеет вид . В углеродной цепочке молекулы помимо одинарных связей, присутствует одна двойная. Данная особенность служит отличительным признаком, позволяющим определить, какие вещества следует называть алкенами, и причиной того, что молекула алкена содержит на два водородных атома меньше, чем соответствующий алкан.
Электронная конфигурация
В основном состоянии электронные оболочки атома углерода имеют конфигурацию , а в возбужденном –
, так как возможен переход одного 2s-электрона на свободный подуровень 2p. В этом случае все четыре электрона внешнего уровня становятся валентными.
Для алкенов характерна гибридизации типа sp2. Три гибридные орбитали, оси которых лежат в одной плоскости разделяются углами 120°, поскольку отрицательно заряженные электроны испытывают взаимное электростатическое отталкивание. Этой плоскости перпендикулярна негибридная p-орбиталь.
Двойная связь
Во взаимодействии двух sp2-гибридизованных атомов углерода принимают участие гибридные и негибридные орбитали:
- По одной гибридной орбитали каждого атома, перекрываясь по линии оси, образуют σ-связь. Остальные гибридные орбитали вступают в σ-связь с атомами водорода.
- Негибридные орбитали путем бокового перекрывания образуют π-связь. Она располагается перпендикулярно плоскости гибридных орбиталей, вне оси, по которой расположены центры атомов и поэтому слабее σ-связи и легче поддается разрыву.
Строение этена – первого члена в гомологическом ряду алкенов – отражается структурной формулой
, следующий за ним пропен
имеет строение
и т. д. Двойной чертой в структурных формулах обозначается кратная связь, образованная совместно σ- и π-связями:
. Остальные углеродные звенья в молекулах алкенов характеризуются sp3-гибридизацией и образуют простые одинарные связи
.
Изомерия и номенклатура углеводородов ряда алкенов
Все алкены, кроме самого простого в ряду – этилена, – обладают свойством изомерии, то есть при одинаковом атомном составе их молекулы могут быть построены по-разному, что обусловливает различие в свойствах. У алкенов существует несколько видов изомерии, так как наличие двойной связи позволяет реализовать значительное количество вариантов строения. Так, уже у бутена насчитывается шесть изомеров. Число изомерных форм возрастает по мере увеличения количества углеродных атомов в цепи.
Структурная изомерия
Алкенам свойственны следующие разновидности изомерии:
- Изомерия углеродного скелета связана с ветвлением молекулы и начинается с бутена:
- Изомерия положения кратной (двойной) связи в молекуле также появляется у бутена:
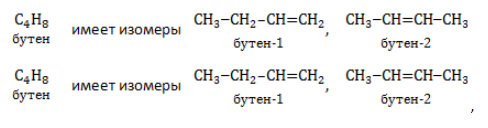
- Межклассовая изомерия у алкенов возникает с предельными циклическими углеводородами – циклоалканами. Она начинается с пропена, который изомерен циклопропану:
Бутен имеет следующие циклические изомеры:
Далее по гомологическому ряду наблюдается увеличение структурного разнообразия молекул и рост количества изомеров.
Пространственная изомерия
Для алкенов наличие π-связи приводит к невозможности вращения без разрыва двойной связи. В случаях, когда соединенные через нее атомы углерода присоединяют разные заместители, возникают геометрические изомеры, различающиеся порядком заместителей по отношению к π-связи.
В цис-изомерах (от лат. cis «по эту сторону») аналогичные радикалы размещены по одну сторону от плоскости связей σ – π, в транс-изомерах (от лат. trans «через») – по разные стороны:
Номенклатура алкенов
Согласно правилам, наименования оканчиваются суффиксом «-ен» и, начиная с четвертого члена ряда, основываются на греческих числительных и показывают, сколько атомов углерода насчитывается в цепи. Некоторые алкены имеют тривиальные наименования, которые представлены в таблице гомологического ряда алкенов:
Наименования составляются по следующим правилам:
- Найти в молекуле самую протяженную цепь, включающую связь σ – π;
- Нумерацию вести с ближайшего к двойной связи конца;
- Указать место двойной связи после наименования;
- Положение радикалов указывается в начале названия по порядку нумерации атомов углерода аналогично номенклатуре алканов.
Примеры:
Если связь C=C в середине молекулы, нумерацию ведут с ближайшего к радикалам конца:
Физические свойства алкенов
Температуры плавления и кипения углеводородов ряда алкенов возрастают соответственно удлинению молекулы и росту молекулярной массы.
Агрегатные состояния алкенов в стандартных условиях:
Алкены не образуют водных растворов из-за низкой полярности ковалентных связей, но хорошо растворяются в органических неполярных растворителях.
Химические свойства алкенов
Электронное и пространственное строение молекул алкенов определяет их способность к химическим взаимодействиям. Непрочная π-связь, обладающая меньшей энергией, разрывается легче, чем σ-связь, и более доступна для атаки реагента, поэтому алкены проявляют высокую химическую активность.
Реакции присоединения
Данные процессы локализуются на двойной связи. Разрушение π-связи сопровождается возникновением двух σ-связей, через которые осуществляется присоединение.
Гидрирование
Водород захватывается алкенами в присутствии никелевого либо иного металлического катализатора (платина, палладий). Продуктом гидрирования является алкан:
Гидратация
В присутствии сильных неорганических кислот (серной, фосфорной) алкены присоединяют воду. В реакции образуются спирты:
Гидратация протекает по правилу Марковникова, то есть гидроксид-ион присоединяется к менее гидрированному углеродному атому, а катион
– к более гидрированному. Поэтому алкены, кроме этилена, гидратируются с образованием вторичных спиртов.
Галогенирование
Реагируя с бромной водой, с растворами хлора или брома в тетрахлорметане, алкен присоединяет оба атома галогена с превращением в дигалогеналкан:
Реакция с участием бромной воды благодаря ее обесцвечиванию используется как качественная на присутствие двойной связи.
Гидрогалогенирование
Присоединение галогенводородов приводит к образованию галогеналканов:
Полимеризация
Алкены способны при разрыве π-связей соединять отдельные молекулы – мономеры посредством σ-связей с образованием высокомолекулярного соединения – полимера:
Повторяющийся фрагмент полимера называется элементарным звеном, а коэффициент n – степенью полимеризации.
Окисление алкенов
Характер протекания реакций окисления зависит от условий. Углеродная цепь сохраняется либо разрушается по двойной связи.
Каталитическое окисление
Присутствие солей металлов или серебра оказывает различное действие на ход реакции окисления:
Мягкое окисление
Процесс, называемый также реакцией Вагнера, протекает в водном растворе перманганата калия . π-связь рвется, и к атомам углерода присоединяются гидроксил-ионы. Продуктом является двухатомный спирт:
Жесткое окисление
При нагревании с кислотным раствором молекула алкана разрывается по двойной связи:
По продуктам жесткого окисления можно судить о расположении двойной связи алкена.
Полное окисление (горение)
Алкены сгорают в кислороде до углекислого газа и воды с выделением энергии, подобно другим углеводородам:
В общем виде горение алкенов выражается уравнением
Изомеризация
При условии высокой температуры и катализа алкены переходят в другую изомерную форму. Результатом реакции становится
Радикальное замещение
За исключением этена, все алкены при нагревании способны замещать водород на галоген аналогично алканам:
Получение алкенов
Нахождение алкенов в природе – редкое явление, поскольку эти соединения химически активны. Распространение имеет низший алкен – этилен, который синтезируется в плодах растений и представляет собой гормон роста. Трикозен вырабатывается организмом некоторых насекомых в качестве феромона в изомерной форме цис-трикозена-9 (также имеет наименование мускалур).
Алкены получают искусственно из алканов и их производных, используя в качестве сырья нефть и природный газ.
Дегидрирование алканов
В присутствии катализатора нагревание этана, пропана или бутана приводит к отщеплению водорода от углеродных атомов и образованию двойной связи:
Крекинг алканов
Крекингом называют разложение длинной молекулы алкана на низкомолекулярные углеводороды каталитическим или термическим путем:
Крекинг и дегидрирование – главные способы производства алкенов в промышленности.
Дегидратация спиртов
Нагревание в присутствии неорганических сильных кислот вызывает отщепление воды от молекулы спирта:
Дегалогенирование и дегидрогалогенирование галогеналканов
В спиртовом растворе щелочи от галогенпроизводного алкана отщепляются водород и галоген, и на месте простых связей появляется двойная:
Цинк или магний отнимают атомы галогена от дигалогеналкана при условии, если в нем галогенизированы стоящие рядом атомы углерода:
Применение алкенов
Благодаря высокой реакционной способности алкены широко применяются в химической промышленности, где служат ценным сырьем:
- Этилен является самым массовым продуктом из всех органических веществ. Из этилена получают этанол, дихлорэтаны, уксусную кислоту и другие соединения. Продуктами полимеризации этена и его производных являются полиэтилен, поливинилхлорид, полистирол и другие пластики, синтетические масла и каучуки.
- Пропен используется главным образом для производства полипропилена, глицерина, изопропилового спирта.
- Бутены представляют собой сырье для получения каучуков и масел.
- Высшие алкены применяются в синтезе поверхностно-активных веществ и производстве высших спиртов.
Несмотря на малое содержание в естественной среде, алкены используются и поэтому широко распространены.
Это интересно:
Галогеналканы
Гомологический ряд алкадиенов
Гомологический ряд алканов