2.5. Валентность
элементов. Графические формулы веществ
Рассмотрим
химические формулы соединений некоторых элементов с водородом:
Как
видно из этих примеров, атомы элементов хлора,
кислорода, азота, углерода присоединяют не любое, а только определенное
число атомов водорода (1,2,3,4 атома
соответственно).
Между
атомами в химических соединениях существуют химические связи. Напишем формулы, в которых каждая химическая
связь обозначается черточкой:
Такие
формулы называются графическими.
Графические
формулы веществ
– это формулы, которые показывают порядок соединения атомов в молекулах и число
связей, которые образует каждый атом.
Число химических
связей, которые образует один атом данного элемента в данной молекуле,
называется валентностью элемента.
Валентность
обозначается римскими цифрами: I, II, III, IV,
V, VI, VII, VIII.
Во
всех рассматриваемых молекулах каждый атом водорода образует одну связь;
следовательно, валентность водорода равна единице.
Некоторые
элементы имеют постоянную валентность.
Элементы с
постоянной валентностью – это элементы, которые во всех соединениях проявляют одинаковую валентность.
Большинство
элементов имеют переменную валентность.
Элементы с
переменной валентностью – это элементы, которые в разных соединениях могут
иметь различные значения валентности.
Наиболее характерные значения валентности некоторых
элементов
Для
определения валентности таких элементов в каком-либо данном соединении можно
использовать правило валентности.
Используя
правило валентности, можно составлять
формулы бинарных соединений, т.е. определять индексы в этих формулах.
Алгоритм составления
формулы соединения оксида фосфора
|
Последовательность действий |
Составление формулы оксида фосфора |
|
1. Написать символы элементов |
Р О |
|
2. Определить валентности |
V II |
|
3. Найти наименьшее общее кратное |
5•2 = 10 |
|
4. Найти соотношения между атомами |
10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
|
5. Записать индексы при символах |
Р2 О5 |
|
6. Формула соединения (оксида) |
Р2О5 |
Обратите
внимание, что в большинстве бинарных соединений атомы одного элемента непосредственно
друг с другом не соединяются.
Напишем
графические формулы некоторых соединений:
УПРАЖНЕНИЯ
1.
Составьте формулы
солей:
|
Металл |
Валентность |
Серная кислота H2SO4 |
Соляная кислота HCl |
|
Кислотный остаток |
SO4(II) |
Cl (I) |
|
|
Ba |
II |
||
|
Na |
I |
Решение:
|
Металл |
Валентность |
Серная кислота H2SO4 |
Соляная кислота HCl |
|
Кислотный остаток |
SO4(II) |
Cl (I) |
|
|
Ba |
II |
BaSO4 |
BaCl2 |
|
Na |
I |
Na2SO4 |
NaCl |
_______________________________________________________________
2.
Найти
валентности всех элементов в соединении NH3.
Решение: Валентность
водорода нам известна — она постоянна и равна I. Умножаем валентность Н на
число атомов водорода в молекуле аммиака: 1 • 3 = 3. Следовательно, для азота
произведение 1 (число атомов N) на X (валентность азота) также должно быть
равно 3. Очевидно, что Х = 3. Ответ: N(III), H(I).
_______________________________________________________________
3.
Найти
валентности всех элементов в молекуле Cl2O5.
Решение: У кислорода валентность постоянна (II), в молекуле
данного оксида пять атомов кислорода и два атома хлора. Пусть валентность хлора
= Х. Составляем уравнение: 5 • 2 = 2 • Х. Очевидно, что Х = 5. Ответ: Cl(V),
O(II).
_______________________________________________________________
4.
Составьте
формулу соединения серы с фтором, если известно, что валентность серы равна
шести.
Решение: Пусть формула соединения — SxFy.
Валентность серы дана (VI), валентность фтора постоянна (I). Вновь составляем
уравнение: 6 • x = 1 • y. Несложно понять, что наименьшие возможные значения
переменных — это 1 и 6. Ответ: SF6.
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какими цифрами обычно обозначается валентность.
2.
Что такое элементы с постоянной валентностью.
3.
Какие элементы имеют постоянную валентность.
4.
Что такое элементы с переменной валентностью. Укажите
наиболее характерные значения валентности для хлора, серы, углерода, фосфора, железа.
5.
Как называются формулы, которые показывают порядок
соединения атомов в молекулах и валентность каждого элемента.
6.
Определите валентность элементов в следующих
соединениях:
7.
Составьте графические формулы веществ:
8.
Определите индексы m и n в следующих формулах:
9.
Составьте молекулярные и графические формулы
соединений хрома с кислородом, в которых хром проявляет валентность II, III,
VI.
10.
Составьте формулы соединений, которые состоят
из:
а) марганца (II) и кислорода; б) марганца (IV) и кислорода; в) марганца (VI) и кислорода; г) бария и кислорода.
Напишите графические формулы этих веществ.
|
1. Максимальная валентность атома фосфора: |
|
|
а) +5 |
б) V |
|
в) +4 |
г) IV |
|
2. Отметьте |
|
|
а) все ответы верны |
б) СО2 |
|
в) СН4 |
г) Н2СО3 |
|
3. Валентность, равную номеру группы, могут |
|
|
а) углерод |
б) азот |
|
в) кислород |
г) цинк |
|
4. Чему равна валентность фосфора в соединении Р2О5: |
|
|
а) V |
б) II |
|
в) III |
г) VI |
|
5. Чему равна валентность фосфора в соединении РН3: |
|
|
а) III |
б) VI |
|
в) I |
г) V |
|
6. Выберите элементы с постоянной валентностью, равной I: |
|
|
а) Na, P |
б) Na, K |
|
в) K, O |
г) H, Zn |
|
7. Выберите элементы с постоянной валентностью, равной II: |
|
|
а) Na, P |
б) H, Zn |
|
в)Ca, Mg |
г) Ca, K |
|
8. Выберите элементы с постоянной валентностью, равной III: |
|
|
а) Al, B |
б) Ca, K |
|
в) K, O |
г) Al, H |
|
9. Элементы с переменной валентностью – это: |
|
|
а) элементы, которые во всех |
б) элементы, которые в разных |
|
в) элементы, которые в одинаковых |
г) нет верного ответа |
|
10. Элементы с |
|
|
а) элементы, которые в одинаковых |
б) нет верного ответа |
|
в) элементы, которые во всех |
г) элементы, которые в разных |
Ответы:
|
1 |
б |
|
2 |
а |
|
3 |
а |
|
4 |
а |
|
5 |
а |
|
6 |
б |
|
7 |
в |
|
8 |
а |
|
9 |
б |
|
10 |
в |
При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
Как написать электронно-графическую формулу
Чтобы научиться составлять электронно-графические формулы, важно понять теорию строения атомного ядра. Ядро атома составляют протоны и нейтроны. Вокруг ядра атома на электронных орбиталях находятся электроны.
Вам понадобится
- — ручка;
- — бумага для записей;
- — периодическая система элементов (таблица Менделеева).
Инструкция
Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой энергии:1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На одной орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
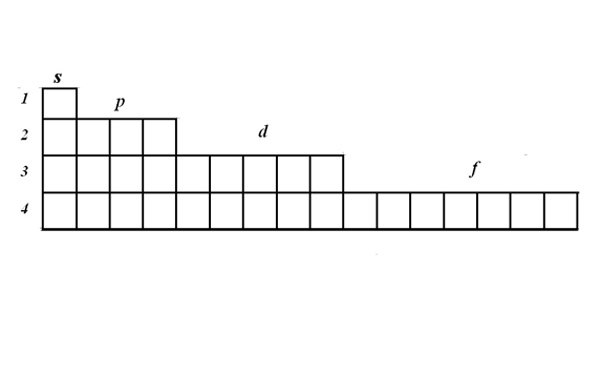
Рассмотрите принцип составления электронно-графической формулы на примере марганца. Найдите марганец в таблице Менделеева. Его порядковый номер 25, значит в атоме 25 электронов, это элемент четвертого периода.
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.
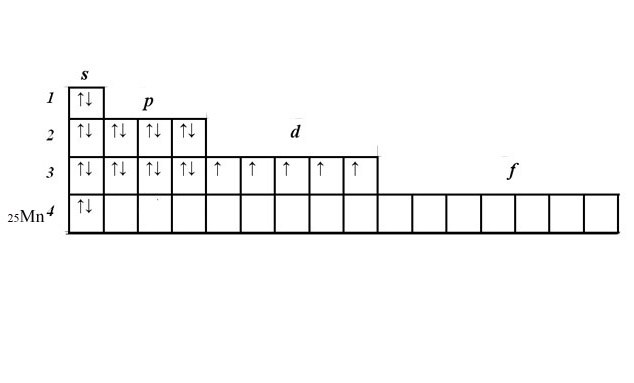
У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
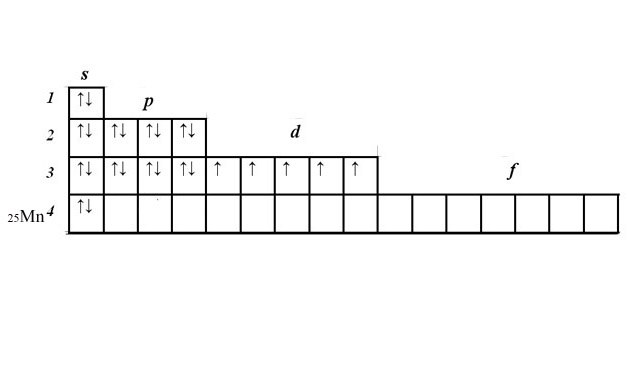
Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность.
Обратите внимание
Помните, что химия – наука исключений. У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена, ниобия и др. Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником.
Источники:
- как составить электронную формулу химического элемента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Валентные возможности атомов химических элементов
Понятие валентность происходит от латинского слова «valentia» и было известно еще в середине XIX века. Первое «пространное» упоминание валентности было
еще в работах Дж. Дальтона, который утверждал, что все вещества состоят из атомов, соединенных между собой в определенных пропорциях. Затем, Франкланд ввел
само понятие валентности, которое нашло дальнейшее развитие в трудах Кекуле, который говорил о взаимосвязи валентности и химической связи, А.М. Бутлерова,
который в своей теории строения органических соединений связывал валентность с реакционной способностью того или иного химического соединения и Д.И.
Менделеева (в Периодической системе химических элементов высшая валентность элемента определяется номером группы).
Основное состояние атома (состояние с минимальной энергией) характеризуется электронной конфигурацией атома, которая соответствует положению элемента в
Периодической системе. Возбужденное состояние – это новое энергетическое состояние атома, с новым распределением электронов в пределах валентного уровня.
Графические электронные формулы
Электронные конфигурации электронов в атоме можно изобразить не только в виде электронных формул, но и с помощью электронно-графических формул
(энергетических, квантовых ячеек). Каждая ячейка обозначает орбиталь, стрелка – электрон, направление стрелки (вверх или вниз) показывает спин электрона,
свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. Если в ячейке 2 электрона, такие электроны называются спаренными,
если электрон 1 – неспаренный. Например:
6C 1s22s22p2
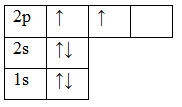
Орбитали заполняют следующим образом: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку
на 2p подуровне три орбитали с одинаковой энергией, то каждый из двух электронов занял по одной орбитали. Одна орбиталь осталась свободной.
Определение валентности элемента по электронно-графическим формулам
Валентность элемента можно определить по электронно-графическим формулам электронных конфигураций электронов в атоме. Рассмотрим два атома – азота и
фосфора.
7N 1s22s22p3
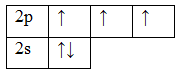
Т.к. валентность элемента определяется числом неспаренных электронов, следовательно, валентность азота равна III. Поскольку у атома азота нет свободных
орбиталей, для этого элемента невозможно возбужденное состояние. Однако III, не максимальная валентность азота, максимальная валентность азота V и
определяется номером группы. Поэтому, следует запомнить, что с помощью электронно-графических формул не всегда можно определить высшую валентность, а также
все валентности, характерные для этого элемента.
15P 1s22s22p63s23p3
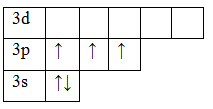
В основном состоянии атом фосфора имеет 3 неспаренных электрона, следовательно, валентность фосфора равна III. Однако, в атоме фосфора имеются свободные
d-орбитали, поэтому электроны, находящиеся на 2s – подуровне способны распариваться и занимать вакантные орбитали d-подуровня, т.е. переходить в
возбужденное состояние.
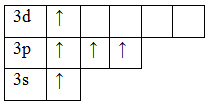
Теперь атом фосфора имеет 5 неспаренных электронов, следовательно для фосфора характерна и валентность, равная V.
Элементы, имеющие несколько значений валентности
Элементы IVA – VIIA групп могут иметь несколько значений валентности, причем, как правило, валентность изменяется ступенчато на 2 единицы. Такое явление
обусловлено тем, что в образовании химической связи электроны участвуют попарно.
В отличие от элементов главных подгрупп, элементы В-подгрупп, в большинстве соединений не проявляют высшую валентность, равную номеру группы, например,
медь и золото. В целом, переходные элементы проявляют большое разнообразие химических свойств, которое объясняется большим набором валентностей.
Рассмотрим электронно-графические формулы элементов и установим, в связи с чем элементы имеют разные валентности (рис.1).
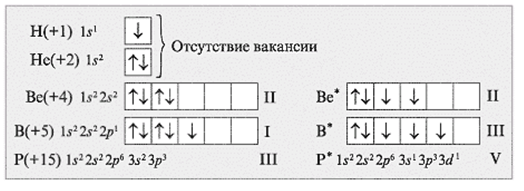
Задания:
определите валентные возможности атомов As и Cl в основном и возбужденном состояниях.
Ответы:
33As 1s22s22p63s23p63d104s24p3
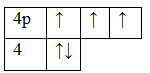
Основное состояние. Валентность равна III.
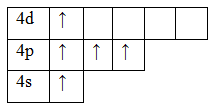
Возбужденное состояние. Валентность равна V.
17Cl 1s22s22p63s23p5
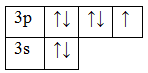
Основное состояние. Валентность равна I.
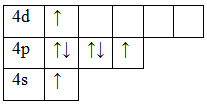
Возбужденное состояние 1. Валентность равна III.
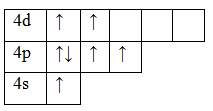
Возбужденное состояние 2. Валентность равна IV.
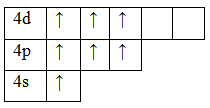
Возбужденное состояние 3. Валентность равна VII.























