H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
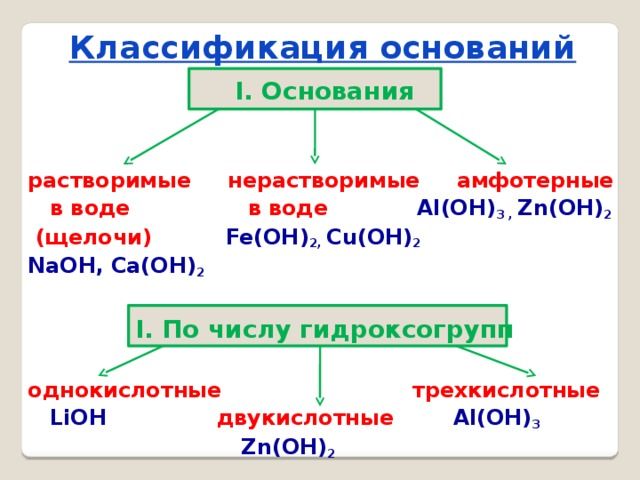
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
-
Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
-
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
-
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
-
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.
Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
-
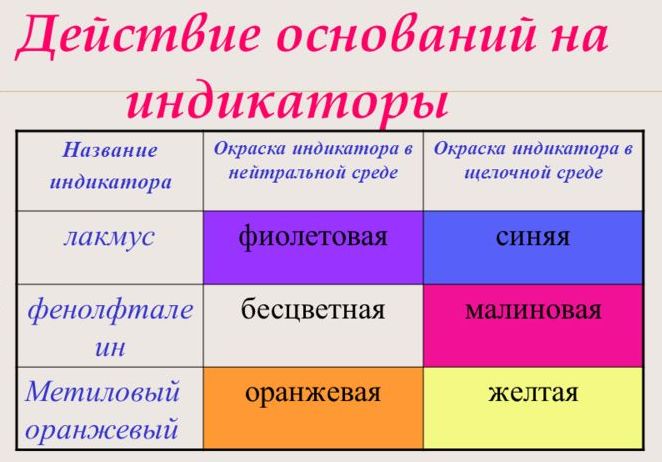
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
-
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
-
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
-
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
-
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
-
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
-
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 Ca(OH)2
9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |
В гидроксиды представляют собой комбинации катионов металлов и гидроксильных анионов (OH–). Они есть неорганические соединения тройные, так как они содержат в своей структуре водород, кислород и металлический элемент. Их получают, когда оксид металла и вода. Например: гидроксид натрия, гидроксид бария, гидроксид алюминия.
При растворении в воде гидроксиды диссоциируют и высвобождают гидроксильная группа, помимо катиона металла. Гидроксиды имеют сильный основной характер, это связано с тем, что гидроксильная группа может захватывать протоны, поэтому их еще называют базы.
Характеристики гидроксидов
В соответствии с Номенклатура акцийЧтобы назвать гидроксид, достаточно к выражению «гидроксид» добавить название металла, из которого он состоит. Однако некоторые металлы, которые могут вступать в комбинацию с гидроксильными группами, могут принимать более одного состояния окисление, например, +2 или +3.
В этом случае номенклатура усложняется и необходимо указать между скобка, после названия металла степень окисления С чем сочетается металл в римских цифрах?
Другой вариант — использовать суффикс в названии металла, который дает отчет о его степени окисления в молекула (Это известно как функциональная номенклатура). «Медвежий» окончание соответствует самому низкому состоянию окисления или валентности (из двух, которые имеет металл), окончание «ico» соответствует самому высокому.
Чтобы написать формулу гидроксида, необходимо помнить, что число гидроксила будет указано в нижнем индексе, и оно будет совпадать с степенью окисления, принятой для металла.
Из-за его основной персонажгидроксиды заставляют лакмусовую бумагу менять цвет с красного на синий, а в присутствии фенолфталеина раствор меняет цвет с бесцветного на розовый. Реакция взаимодействия гидроксидов и кислоты производить соль и воду; обычно эти реакции высвобождают энергию.
Использование гидроксидов
Гидроксиды имеют разные использует в повседневной жизни. Например, сода или едкий калий (гидроксид натрия и калия соответственно) используются для прочистки труб.
В гидроксид магния известен как антацид, многие желудочные пищеварения включают его в свои рецептуры. В более высоких концентрациях обладает слабительным действием.
В гидроксид алюминия он также используется в качестве антацида в так называемых «фруктовых солях». Гидроксид кальция широко используется в строительстве, в этой области он известен как «гашеная известь».
Примеры гидроксидов
Двадцать пять гидроксидов перечислены ниже в качестве примера:
- Гидроксид натрия, NaOH. Его используют в текстильной промышленности, также из него делают мелки и бумагу. Он также используется в различных чистящих средствах, например в красках.
- Гидроксид бария, Ba (OH)2. Его используют при изготовлении керамики и различных видов ядов.
- Гидроксид алюминия, Al (OH)3. Он используется для снятия различных расстройств желудка.
- Гидроксид цинка, Zn (OH)2. Используется как адсорбент; Также были созданы наночастицы этого гидроксида.
- Гидроксид железа, Fe (OH)3. Его используют при производстве красок и лекарств.
- Гидроксид железа, Fe (OH)2. Широко используется в металлургической промышленности.
- Гидроксид меди, Cu (OH)2. Он используется как лабораторный реактив, а также как фунгицид.
- Гидроксид меди, CuOH. Подобен гидроксиду меди (Cu (OH)2).
- Гидроксид кальция, Ca (OH)2. Это так называемая мертвая известь или гашеная известь, столь важная в строительстве. Он также используется в сельское хозяйство и в химической, фармацевтической и еда.
- Гидроксид лития, LiOH. Он используется для удаления углекислого газа в системах очистки.
- Гидроксид хрома (III), Cr (OH)3. Его используют при производстве красок, особенно для достижения зеленого цвета.
- Гидроксид свинца (IV), Pb (OH)4. В основном используется в оболочках для кабелей.
- Гидроксид золота (III), Au (OH)3. Он используется во многих областях медицины и керамики.
- Гидроксид серебра, AgOH. Он используется для создания определенных продуктов, которые работают для обнаружения хлоридов в других растворах.
- Гидроксид ртути, Hg (OH)2. Его используют все реже из-за его токсичности.
- Гидроксид бериллия, Be (OH)2. Он используется как сырье в получении металлического бериллия.
- Гидроксид свинца (II), Pb (OH)2. Его часто используют для покрытий.
- Гидроксид платины (IV), Pt (OH)4. Он используется для производства очень тонкой проволоки.
- Гидроксид кобальта (II), Co (OH)2. Он используется при приготовлении солей кобальта.
- Гидроксид марганца (III), Mn (OH)3. Он образует разные типы зеленых кристаллов.
- Гидроксид стронция, Sr (OH)2. Поглощает углекислый газ из воздуха.
- Гидроксид магния, Mg (OH)2. Он используется как антацидное или слабительное средство.
- Гидроксид олова (II), Sn (OH)2. Он используется в красителях в тканевой промышленности.
- Гидроксид аммония, NH4ой. Он используется в основном в пищевой промышленности.
- Гидроксид кадмия, Cd (OH)2. Встречается в промышленных аккумуляторных батареях.
Основания

4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH)3 → Fe2O3 + 3H2O |
|
С кислотными оксидами (реагируют щёлочи) |
Соль |
NaOH + CO2 → NaHCO3 |
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H2O → Na2SiO3 +H2↑ |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Никита Ковалёв
9/10
-
Еркежан Рысова
10/10
-
Александр Котков
10/10
-
Мишлен Громов
10/10
-
Вика Мартынова
10/10
-
Ольга Хромцова
10/10
-
Лилия Швец
10/10
-
Наталья Чернова
10/10
-
Максим Макеев
10/10
-
Сергей Ефремов
8/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 2547.
А какая ваша оценка?
Гидроксиды
Гидроксиды
− это соединения формулы Э–О–Н, где Э
– элемент, образующий гидроксид. В
зависимости от прочности связей Э – О
или О – Н гидроксиды подразделяют на
основные, кислотные и амфотерные.
Основные
гидроксиды
(проявляют свойства оснований) —
гидроксиды, в которых менее прочная
связь Э – О. Поэтому при распаде молекулы
(диссоциации) основного гидроксида
образуется гидроксид — ион (ОН—).
KOH
= K+
+ OH—
KOH,
Ca(OH)2,
Fe(OH)2.
Кислотные
гидроксиды
(проявляют свойства кислот) – гидроксиды,
в которых менее прочная связь О – Н.
Поэтому при распаде молекулы (диссоциации)
кислотного гидроксида образуются ион
водорода (Н+).
HNO3
=
H+
+ NO3—
HNO3,
H2SO4,
H2SiO3.
Амфотерные
гидроксиды
(в зависимости от условий проявляют как
основные, так и кислотные свойства).
Прочность связей Э – О и О – Н, близкие
величины. Поэтому при распаде (диссоциации)
молекулы могут образовываться как ионы
водорода (H+),
так и гидроксид – ионы (OH—).
Zn(OH)2
или
H2ZnO2
, Al(OH)3
или
H3AlO3
Основания
Основаниями
называют
сложные вещества, молекулы которых
состоят из атомов металлического
элемента (за исключением NH4+)
и гидроксидных групп (OH).
NaOH,
Ca(OH)2,
Al(OH)3,
Fe(OH)3,
NH4OH
Название
образуется из слова «ГИДРОКСИД»
и русского названия металлического
элемента, образующего соединение. Если
металлический элемент имеет переменную
степень окисления, указывается степень
окисления.
NaOH
– гидроксид натрия,
Fe(OH)2
– гидроксид железа (II),
Fe(OH)3
– гидроксид железа (III).
Растворимые
в воде основания называют щелочами.
Характер
основания связан с положением элемента
в Периодической системе элементов
Д.И.Менделеева. Сила основания,
образованного элементами, расположенными
в группе Периодической системе элементов
Д.И.Менделеева сверху вниз возрастает:
Например: Mg(OH)2
→ Ca(OH)2
→ Ba(OH)2
Кислоты
Кислотами
называют сложные вещества, молекулы
которых состоят из атомов элемента
водорода и кислотного остатка.
HCl,
H2S,
H2SO4,
H2SO3,
H2S2O7
Элемент,
входящий в состав кислотного остатка
называется кислотообразующим элементом.
По
химическому составу кислоты классифицируют:
бескислородные
– кислотный
остаток не содержит атомы кислорода,
кислородсодержащие
– кислотный
остаток содержит атомы кислорода.
Название
кислот образуется от «РУССКОГО» названия
кислотообразующего
элемента.
Для кислот H2S,
H2SO4,
H2SO3,
H2S2O7
кислотообразующим элементом является
элемент сера.
Затем
в названии бескислородных
кислот добавляют суффикс «О» и окончание
«ВОДОРОДНАЯ КИСЛОТА»:
H2S
–сер – о – водородная кислота.
HCl
– хлор – о – водородная кислота,
В
названии кислородсодержащих
кислот добавляют окончание, которое
зависит от степени окисления
кислотообразующего элемента:
а) если элемент находится в
высшей степени окисления, то добавляется
окончание « -НАЯ» или « -ОВАЯ»:
H2SO4
– сер – ная кислота (степень окисления
+6),
H2WO4
– вольфрам – овая кислота (степень
окисления +6).
б)
если элемент находится в
более
низкой степени окисления (обычно высшая
степень
окисления
минус два),
то добавляется окончание «-ИСТАЯ»:
H2SO3
– серн– истая кислота (степень окисления
+4),
HNO2
– азот – истая кислота (степень
окисления+3).
в)
для элементов, имеющих различные степени
окисления (в кислотах больше двух,
например, хлор +7,+5,+3,+1,-1), по мере понижения
степени окисления окончания изменяются
в последовательности:
« -НАЯ» HClO4
— хлорная
кислота,
«-ОВАТАЯ» HClO3
– хлорноватая кислота,
«-ИСТАЯ» HClO2
– хлористая кислота,
«-ОВАТИСТАЯ» HClO
– хлорноватистая кислота.
Если
кислотообразующий элемент находится
в одной и той же степени окисления, но
образует несколько кислот за счет
разного количества атомов элементов
водорода и кислорода, то к названию
кислоты, содержащей меньшее число атомов
кислорода, добавляется приставка
«МЕТА-», а к названию кислоты с большим
числом атомов кислорода добавляется
приставка «ОРТО-»:
HBO2
– мета-борная кислота,
H3BO3
– орто-борная кислота.
Если
молекула кислоты содержит несколько
атомов кислотообразующего элемента,
то перед названием кислоты добавляется
«РУССКОЕ ЧИСЛИТЕЛЬНОЕ»:
H2S2O7
– двусерная кислота,
H2B4O7
– четырехборная кислота.
Характер
кислоты связан с положением элемента
в Периодической системе элементов
Д.И.Менделеева. Сила кислоты, образованной
элементами, расположенными в группе
Периодической системе элементов
Д.И.Менделеева снизу вверх возрастает:
Например HJ
→ HBr
→ HCl
или HJO4
→ HBrO4
→ HClO4
Соли
Солями
называют
сложные вещества, молекулы которых
состоят из атомов металлического
элемента (за исключением NH4+)
и кислотного остатка. Это продукты
замещения атомов водорода в кислоте на
атом металлического элемента или
гидроксидных групп в основаниях на
кислотный остаток:
H3PO4
+2NaOH = Na2HPO4
+ 2H2O,
Na2HPO4
+ NaOH = Na3PO4
+ H2O,
или
Fe(OH)3
+ 2HCl = Fe(OH)Cl2
+2H2O,
Fe(OH)Cl2
+ HCl = FeCl3
+ H2O.
Поэтому
соли подразделяются на средние
(нормальные), кислые и основные.
Средние
соли –
продукты полного замещения атомов
водорода в кислоте на атомы металлического
элемента или гидроксидных групп в
основаниях на кислотный остаток:
Na3PO4,
FeCl3,
K2CO3,
Na2S,
MgBr2.
Кислые
соли –
продукты неполного замещения атомов
водорода в кислоте на атомы металлического
элемента:
Na2HPO4,
KHSO4,
Ca(HCO3)2.
Основные
соли –
продукты неполного замещения гидроксидных
групп в основаниях на кислотный остаток:
Mg(OH)Cl,
Fe(OH)2NO3,
(CaOH)2SO4.
По
химическому составу соли подразделяются
на:
бескислородные
соли –
кислотный остаток не содержит атомы
кислорода;
кислородсодержащие
соли –
кислотный остаток содержит атомы
кислорода.
Название
солей образуется от
«ЛАТИНСКОГО» названия
кислотообразующего элемента.
Латинские названия некоторых элементов,
отличающиеся от русского названия,
приведены в таблице.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


![K_{b}={frac {[{mathsf {NH_{4}^{+}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {NH_{3}}}]}}=1{,}79cdot 10^{{-5}};](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a84df26045c54cf2f49c317887b42b68713f776)





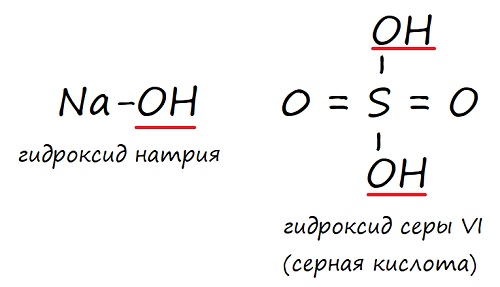
 Ca(OH)2
Ca(OH)2