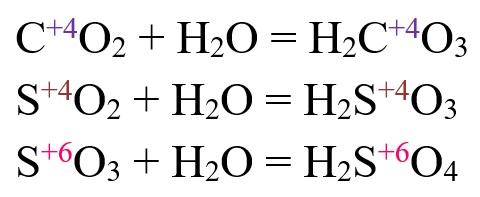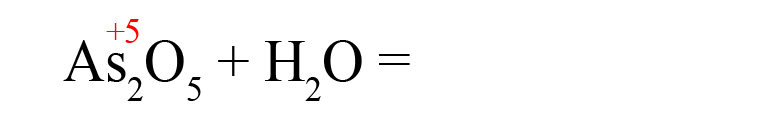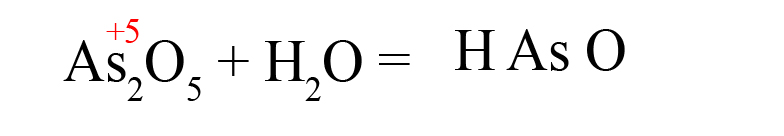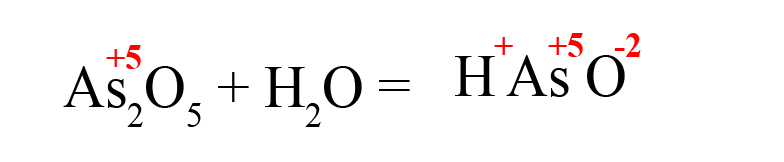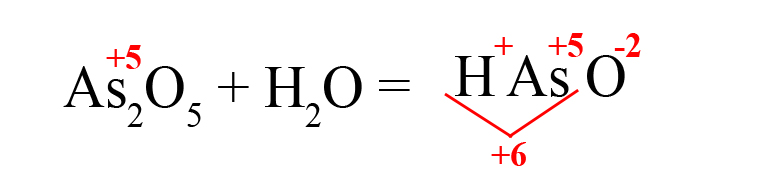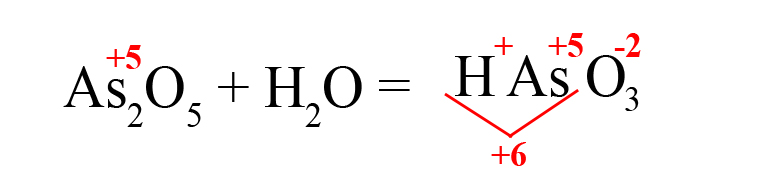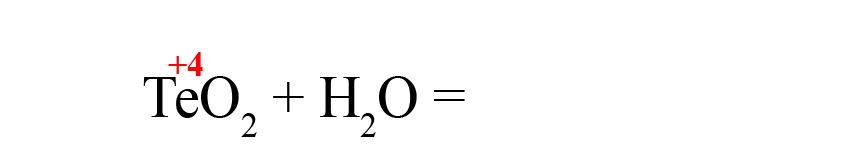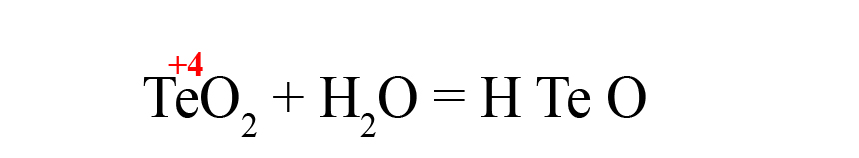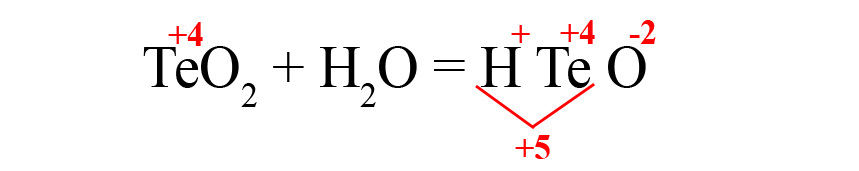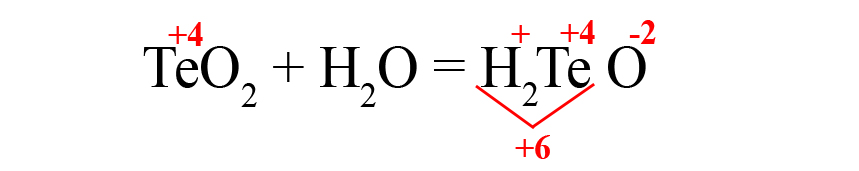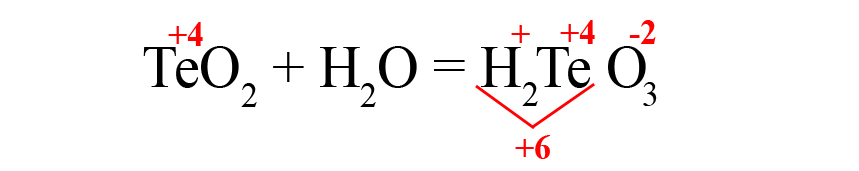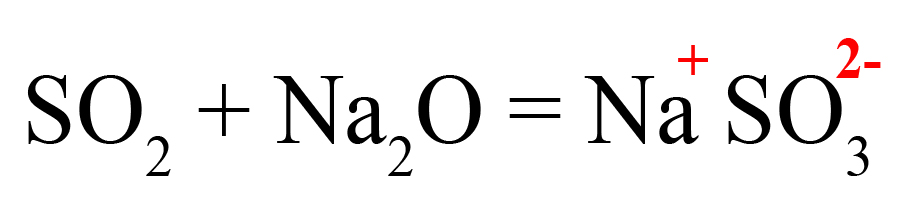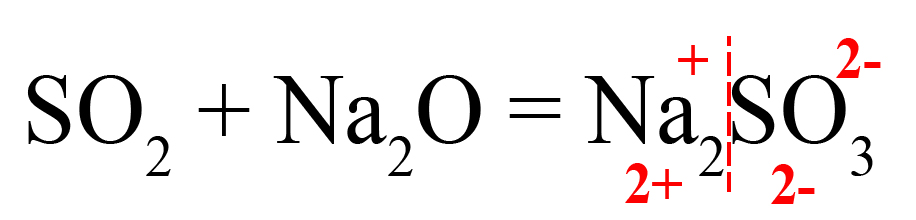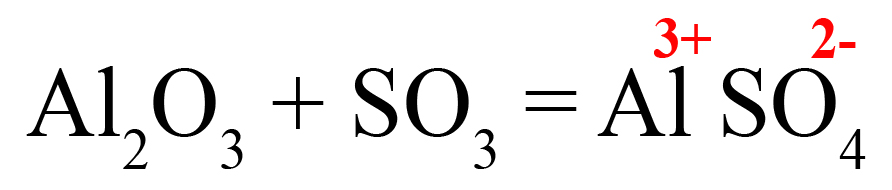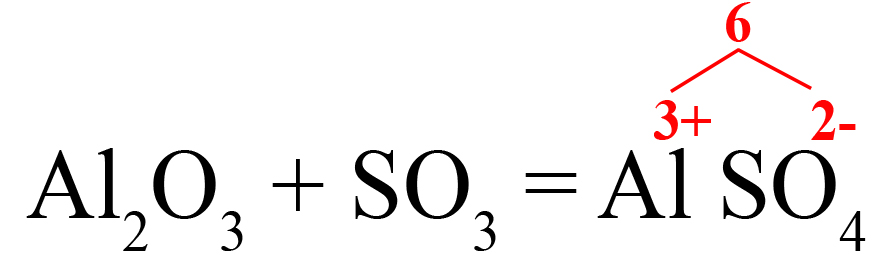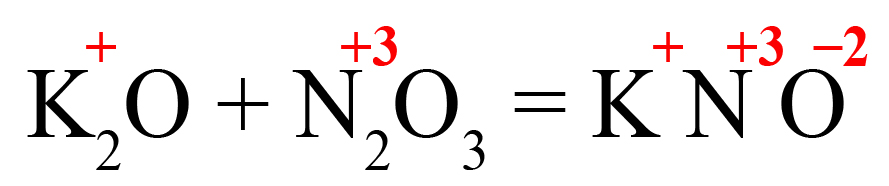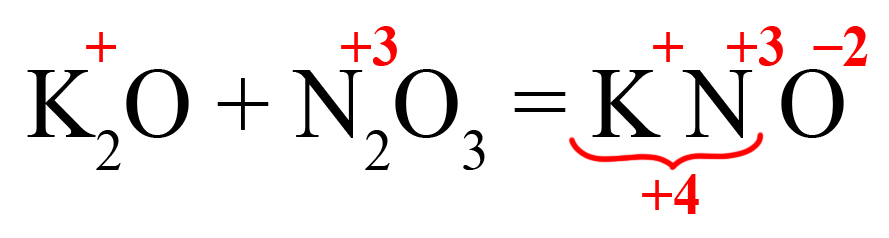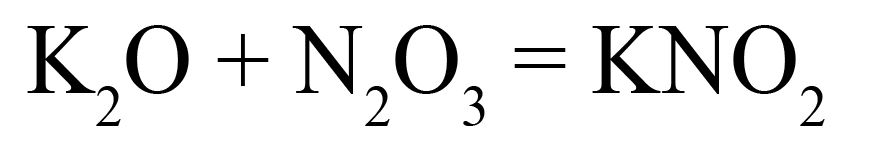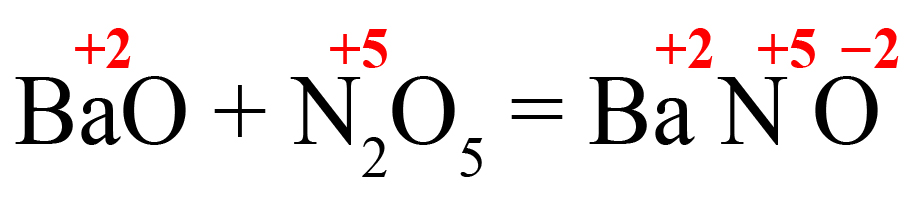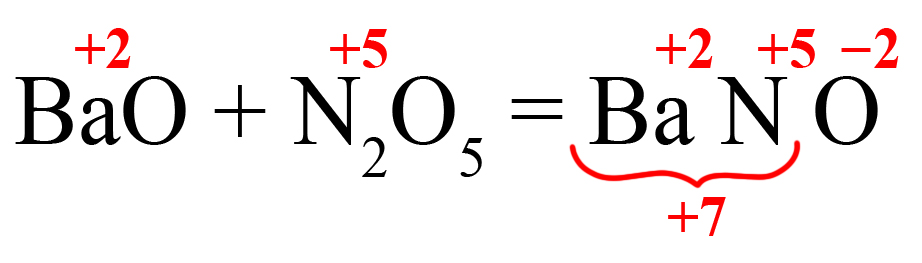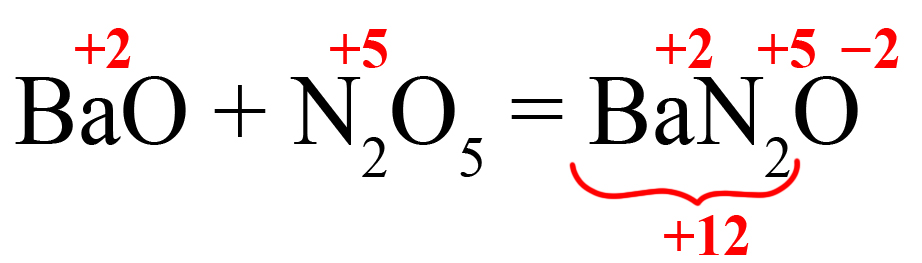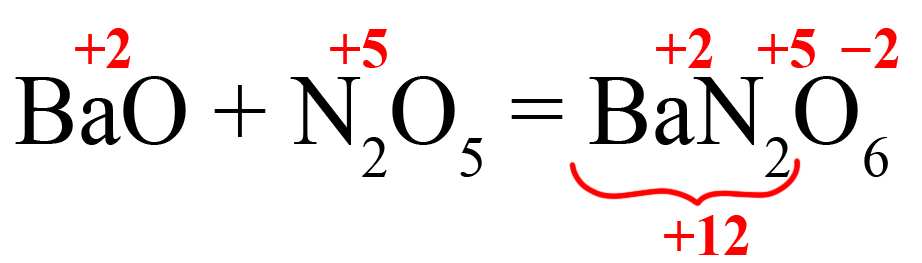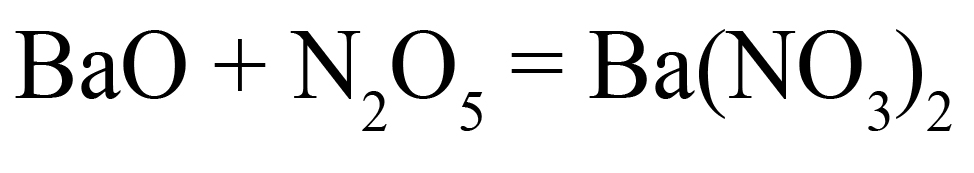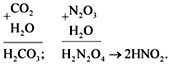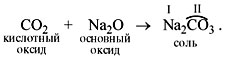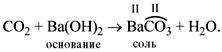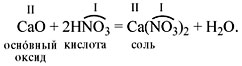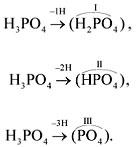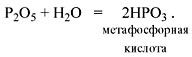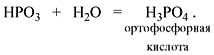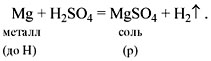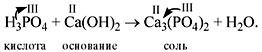Свойства кислотных оксидов
Материал по химии
К кислотным оксидам относят оксиды неметаллов (кроме CO, SiO, NO и N2O), а также оксиды металлов в степени окисления «+5», «+6», «+7».
Кислотные оксиды реагируют с водой, основными и амфотерными оксидами, основаниями, с солями.
- При взаимодействии с водой все кислотные оксиды (за редким исключением, например, SiO2) образуют кислоты.
- При взаимодействии с основными оксидами образуется средняя соль.
- При взаимодействии с основаниями образуется средняя соль и вода, либо кислая соль и вода не выделяется.
- При взаимодействии с растворами солей образуются кислые соли. Оксид, соответствующий более сильной кислоте, может вытеснить из соли оксид, соответствующий менее сильной кислоте.
- Кислотные оксиды не реагируют с кислотами, исключение: P2O5 с кислородсодержащими кислотами (кислотными гидроксидами).
- Кислотный оксид + вода = кислота
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
Как определить, какая кислота образуется из кислотного оксида?
Способ первый. Выучить оксиды, соответствующие кислотам:
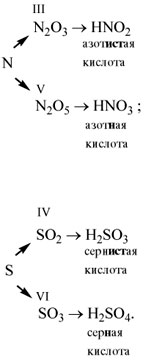
- Оксиду SO2 соответствует кислота H2SO3 (сернистая)
SO2 + H2O = H2SO3
- Оксиду SO3 соответствует кислота H2SO4 (серная)
SO3 + H2O = H2SO4
- Оксиду CO2 соответствует кислота H2CO3 (угольная)
CO2 + H2O = H2CO3
- Оксиду P2O5 соответствуют кислоты H3PO4, H4P2O7, HPO3 (ортофосфорная, пирофосфорная и метафосфорная соответственно)
Кислота зависит от соотношения воды и оксида фосфора:
P2O5 + H2O = 2HPO3 (метафосфорная)
P2O5 + 2H2O = H4P2O7 (пирофосфорная)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная)
- Оксиду N2O3 соответствует кислота HNO2 (азотистая)
N2O3 + H2O = 2HNO2
- Оксиду N2O5 соответствует кислота HNO3 (азотная)
N2O5 + H2O = 2HNO3
- Оксиду NO2 также соответствует кислота HNO3, однако, при определенных условиях из этого оксида можно получить смесь азотной и азотистой кислот:
NO2 + H2O + O2 = HNO3
NO2 + H2O = HNO2 + HNO3
- Оксиду SiO2 соответствует кислота H2SiO3 (кремниевая), но напрямую из этого оксида кислоту получить нельзя, так как диоксид кремния нерастворим в воде.
- Оксиду CrO3 соответствуют кислоты H2CrO4 и H2Cr2O7 (хромовая и дихромовая):
CrO3 + H2O = H2CrO4
2CrO3 + H2O = H2Cr2O7
- Оксиду Mn2O7 соответствует кислота HMnO4 (марганцовая)
Mn2O7 + H2O = HMnO4
- Оксидам Cl2O, Br2O, I2O соответствуют кислоты HClO, HBrO, HIO (хлорноватистая, бромноватистая, йодноватистая)
Cl2O + H2O = 2HClO
Br2O + H2O = 2HBrO
I2O + H2O = 2HIO
- Оксидам Cl2O3, Br2O3, I2O3 соответствуют кислоты HClO2, HBrO2, HIO2 (хлористая, бромистая, йодистая)
Cl2O3 + H2O = 2HClO2
Br2O3 + H2O = 2HBrO2
I2O3 + H2O = 2HIO2
- Оксидам Cl2O5, Br2O5, I2O5 соответствуют кислота HClO3, HBrO3, HIO3 (хлорноватая, бромноватая, йодноватая)
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
- Оксидам Cl2O7, Br2O7, I2O7 соответствуют HClO4, HBrO4, HIO4 (хлорная, бромная, йодная).
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Способ второй. Считать степени окисления (или валентность). В оксиде и образующейся из неё кислоте у основного элемента должна быть одинаковая степень окисления. Таким образом оксиду SO3 соответствует только H2SO4, потому что степень окисления в обоих веществах «+6» (или валентность VI), а из всего разнообразия хлорсодержащих кислот, оксиду Cl2O3 будет соответствовать HClO2, так как и в оксиде, и в кислоте степень окисления хлора равна «+3» (или валентность III).
Свойства кислотных оксидов
Какие оксиды соответствуют кислотам?
Способ третий. Составим кислоту самостоятельно, пользуясь алгоритмом (это особенно удобно, когда дан оксид, соответствующую кислоту которого мы не знаем):
- Пишем исходные вещества, определим степень окисления оксидообразующего элемента:
- В продуктах запишем «скелет» молекулы (последовательность всегда будет следующей водород → элемент → кислород):
- Расставим степени окисления в продукте (они равны исходным степеням окисления в оксидах):
- Складываем положительные заряды:
- Ставим после кислорода такой индекс, чтобы умножение его на -2 дало значение равное количеству положительных зарядов, посчитанных ранее (в нашем примере индекс «3»):
В результате реакции оксида мышьяка образовалась мышьяковая кислота.
Рассмотрим еще один пример – получения теллуристой кислоты.
- Пишем исходные оксиды, определяем степень окисления теллура:
- Формируем основу кислоты в порядке: водород → теллур → кислород.
- Переносим степени окисления из левой части уравнения (у водорода и кислорода в кислотах и оксидах типичные для них степени окисления, поэтому они не указаны в первой части уравнения), считаем сумму положительных зарядов:
- В данном случае общий положительный заряд равен нечётному числу, чтобы молекула стала электронейтральной, после кислорода пришлось бы ставить индекс 2,5, что недопустимо. Поэтому сначала помножаем элемент, дающий нечётную степень окисления (у нас это водород) на 2, поставив индекс после него:
Это влияет на общий положительный заряд, который теперь становится чётным.
- Осталось умножить кислород на «3», чтобы общий отрицательный заряд стал равен шести:
- Кислотный оксид + основный оксид = средняя соль.
Например: CaO + N2O5 = Ca(NO3)2
Как определить, какая соль образуется из кислотного оксида?
Способ первый. Соль состоит из катиона металла и кислотного остатка. Кислотный остаток соответствует оксиду с такой же степенью окисления, как в нём. Как определить степень окисления элемента в ионе? Прежде всего, необходимо помнить, что ион отличается от молекулы наличием заряда (молекулы элетронейтральны). Этот заряд складывается из положительных и отрицательных зарядов частиц, образующих ион:
Степень окисления кислорода в большинстве веществ равна ‒2, ион содержит три кислорода, они суммарно вносят в заряд этого иона ‒6, азот вносит х. Из этого получим уравнение: x ‒ 6 = ‒ 1 (где «‒1» — общий заряд иона), откуда х = 5.
Таким образом, нитрат-ион соответствует оксиду азота V, потому что в них одинаковая степень окисления азота.
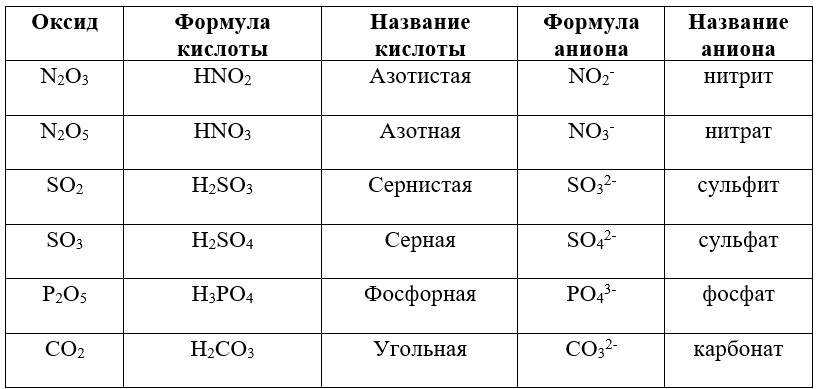
В таблице приведены готовые группы соответствующих веществ и ионов:
Таблица «Взаимосвязь оксидов, кислот и их остатков»
Не забывайте об индексах! После того как Вы подобрали нужный анион, нужно убедиться, что количество положительных и отрицательных зарядов в молекуле равны.
Рассмотрим, несколько примеров расстановки индексов в солях.
Пример 1. Взаимодействие оксида серы IV и оксида натрия:
- Подберем нужные ионы продуктах. Оксид серы IV соответствует сульфит-иону:
- Проверяем количество положительных и отрицательных ионов. В полученном веществе на один положительный заряд приходится два отрицательных. Количество положительных и отрицательных зарядов должно быть одинаковым, поэтому добавляем индекс «2» после натрия:
Индекс «2» говорит о том, что в сульфите натрия содержится два катиона натрия, каждый из которых несет заряд «+», таким образом, два натрия имеют общий заряд «2+».
Пример 2. Взаимодействие оксида серы VI с оксидом алюминия (с кислотными оксидами ведет себя как основный).
- Подбираем ионы в продуктах. Оксиду серы VI соответствует сульфат-ион:
- В случаях, когда придется ставить коэффициенты после обоих ионов, находим наименьшее общее кратное:
- Делим наименьшее общее кратное на 3 (заряд алюминия), получаем индекс «2» после алюминия. Делением общего кратного на 2 (заряд сульфат-иона), получаем индекс «3» после SO42-. Сульфат-ион заключаем в скобки, так как индекс после скобок действует на весь ион, без скобок он будет действовать только на тот элемент, после которого стоит.
Способ второй.
Этот способ уже рассматривался выше, он основан на степенях окисления элементов в исходных оксидах.
Пример 1. Образование нитрита калия.
- В продукте образуется соль, на первом месте должен стоять металл, на втором – элемент из кислотного оксида, на третьем – кислород. Определим степени окисления элементов в исходных оксидах, перенесем эти степени в правую часть уравнения:
- Посчитаем общее количество положительных зарядов:
- Поделим это количество на степень окисления кислорода, получим индекс «2»:
Пример 2. Образование нитрата бария.
- В правой части реакции образуем соль. На первое место ставим металл, на второе – элемент из кислотного оксида, на третье – кислород. Определяем степень окисления элементов в исходных веществах, переносим вправо:
- Определяем количество положительных зарядов:
Получаем нечетное значение. Если оставить всё так, то индекс после кислорода должен стать равным 3,5. Чтобы избежать этого поставим удваивающий индекс после того элемента, который даёт нечетный заряд (азот):
Теперь общее количество положительных зарядов равно двенадцати.
- Делим 12 на степень окисления кислорода, получаем индекс «6»:
- Выносим индекс «2» за скобку, получаем формулу нитрата бария:
- Кислотный оксид + основание = соль + вода
Кислотный оксид + основание = кислая соль.
При образовании средней и кислой соли можно руководствоваться теми же способами, которые использовались в реакциях кислотных оксидов с основными.
От чего зависит, будет ли образованная соль кислой или средней? Рассмотрим два примера образования разных солей из одинаковых реагентов:
KOH + SO2 = KHSO3 (кислая соль, гидросульфит калия)
2KOH + SO2 = K2SO3 + H2O(средняя соль, сульфит калия)
Разница заключается лишь в количестве взятых реагентов. При образовании средней соли гидроксида калия в два раза больше оксида серы (об этом говорят коэффициенты перед веществами: «2» KOH и «1» перед SO2. Перед оксидом серы IV коэффициента нет, в таком случае подразумевается единица). При образовании кислой соли KOH взяли в два раза меньше относительно реакции, в которой образовалась средняя соль. В таких случаях говорят о том, что гидроксид калия был взят в недостатке или оксид серы – в избытке.
Рассмотрим другие пары реакций со схожим результатом:
Ca(OH)2 + CO2 = CaCO3 + H2O (образуется мутный раствор из-за образования нерастворимого карбоната кальция).
Ca(OH)2 + 2CO2 = Ca(HCO3)2 (образуется прозрачный раствор, так как гидрокарбонат растворим).
При образовании кислой соли был взят избыток углекислого газа (или недостаток гидроксида кальция).
Оксиды, соответствующие трехосновным кислотам (см.Классификация кислот)
, могут образовывать не одну кислую соль, а несколько:
6NaOH + P2O5 = 2Na3PO4 + 3H2O (образуется фосфат натрия, средняя соль).
4NaOH + P2O5 = 2Na2HPO4 + H2O (образуется гидрофосфат натрия, кислая соль).
2NaOH + P2O5 + H2O = 2NaH2PO4 (образуется дигидрофосфат натрия, кислая соль)
Из этих трех реакций можно сделать вывод: чем меньше взято щелочи, тем кислее будет соль.
Если оксид соответствует одноосновной кислоте, то при его реакции с основаниями будут образовываться только средние соли:
2KOH + Cl2O = 2KClO + H2O (Cl2O соответствует кислоте HClO)
NaOH + Mn2O7 = NaMnO4 + H2O (Mn2O7 соответствует кислоте HMnO4)
- Соль + кислотный оксид = кислая соль.
Оксид должен соответствовать двухосновной или многоосновной кислоте, оксид должен совпадать с кислотным остатком, уже имеющимся в соли, реакция идет в растворах или при наличии воды в окружающей среде.
Примеры:
CaCO3 + CO2 + H2O = Ca(HCO3)2 (мутный раствор становится прозрачным).
Na2SO3 + SO2 + H2O = 2NaHSO3
Одни кислотные оксиды могут вытеснять другие кислотные оксиды из солей:
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
Nакая реакция происходит, когда засыхает силикатный клей. В тюбике с клеем содержится раствор силиката натрия, при выдыхании человек выделяет углекислый газ, который взаимодействует с силикатом натрия с образованием кремниевой кислоты, которая при высыхании полимеризуется, склеивая бумагу.
Na2CO3 + SiO2 = Na2SiO3 + CO2 (такая реакция происходит при нагревании).
Оксиды, соответствующие более сильным кислотам, вытесняют из соединений оксиды, соответствующие менее сильным кислотам:
Na2CO3 + SO3 = Na2SO4 + CO2
Оксид серы VI (SO3) соответствует сильной серной кислоте, а углекислый газ (CO2) – слабой угольной кислоте, поэтому оксид серы вытесняет оксид углерода.
- Оксид фосфора отнимает у кислородсодержащих кислот воду, при этом образуется фосфорная кислота и оксид, соответствующий исходной кислоте (основной элемент оксида имеет такую же степень окисления, как в исходной кислоте):
2HNO3 + P2O5 = 2HPO3 + N2O5
HClO4 + P2O5 = HPO3 + Cl2O7
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13/2007
Глава 2. Важнейшие классы
неорганических соединений
2.1. Оксиды
Оксиды – сложные вещества, которые состоят из
атомов двух химических элементов, один из
которых кислород.
Определим, какое из следующих соединений оксид:
PH3, H3PO4, P2O5.
К оксидам относят соединение P2O5.
Два других вещества – не оксиды: в состав РН3
не входит атом кислорода, а в состав H3PO4 входят
атомы трех химических элементов – H, Р, O.
Названия оксидов складываются из двух слов:
первое слово – «оксид», второе слово – название
химического элемента, образующего данный оксид,
в родительном падеже. Например: СаО – оксид
кальция.
Если оксид образован химическим элементом с
переменной валентностью, то после названия
элемента нужно указать его валентность.
Например: Fe2О3 – оксид железа(III), FеО –
оксид железа(II).
Задание 2.1. Среди следующих соединений
найдите оксиды и назовите их:
N2O3, NH3, MnO2, H2O,
HCl, NaOH, Na2O, P2O5, H2SO4.
Задание 2.2. Составьте формулы следующих
оксидов:
оксид хрома(III), оксид углерода(IV), оксид магния,
оксид серы(VI), оксид азота(V), оксид калия, оксид
марганца(VI).
Многие оксиды могут реагировать с кислотами
или основаниями. В таких реакциях получаются
соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов,
которые к таким реакциям не способны. Такие
оксиды называют несолеобразующими.
Задание 2.3. Назовите несолеобразующие оксиды:
H2O, CO, N2O, NO, F2O.
Некоторые оксиды имеют особые (тривиальные)
названия: Н2О – вода, СО – угарный газ, СО2
– углекислый газ и др.
Солеобразующие оксиды подразделяют на три
группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только
изучая его химические свойства. Например,
кислотные оксиды реагируют с основаниями и не
реагируют с кислотами. Основные оксиды реагируют
с кислотами и не реагируют с основаниями.
Амфотерные оксиды могут реагировать и с
кислотами, и с основаниями.
По формуле оксида можно определить, какими
свойствами он обладает. Правда, иногда эта оценка
будет приблизительной.
• Неметаллы образуют только кислотные и
безразличные оксиды.
• Металлы в зависимости от валентности могут
образовывать разные оксиды – основные, амфотерные
и кислотные.
Предсказать свойства оксида металла может
помочь эта схема:
Основные оксиды металлов от кислотных оксидов
металлов отличить легко: малая валентность
металла – основный оксид, большая – кислотный.
Как быть с амфотерными оксидами? «Любимая»
валентность металлов в этих оксидах III, но есть и
исключения. Поэтому желательно запомнить
формулы наиболее часто встречающихся амфотерных
оксидов: ZnO, Al2O3, SnO, PbO, Cr2O3.
Задание 2.4. Назовите амфотерные оксиды:
ZnO, SnO, PbO, Al2O3, Cr2O3.
Задание 2.5. Классифицируйте приведенные
ниже оксиды:
V2O5, SO2, ZnO, Fe2O3,
SO3, CO2, Li2O, FeO, Al2O3, H2O,
BaO.
Задание рекомендуется выполнить по следующей
схеме.
1) Определить, какой это оксид – солеобразующий
или несолеобразующий.
2) Определить, какой элемент входит в состав
солеобразующего оксида – металл или неметалл.
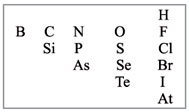
Для этого надо выписать из таблицы
Д.И.Менделеева символы элементов-неметаллов. Они
расположены в главных подгруппах на линии бор –
астат и выше этой линии (рис. 1).
|
|
Рис. 1. Элементы-неметаллы
|
3) Если в состав оксида входит атом
неметалла, то оксид кислотный.
4) Если в состав оксида входит атом металла, то
следует определить его валентность и по ней
выяснить характер оксида – основный, амфотерный
или кислотный.
Например: Cr2O3 – амфотерный, т.к. хром
– металл с валентностью III;
N2O3 – кислотный оксид, т.к. азот –
неметалл;
CrO3 – кислотный оксид, т.к. хром – металл с
высокой валентностью VI.
Зная характер оксида, можно описать его
свойства.
Свойства кислотных оксидов
• Кислотные оксиды реагируют c водой, образуя
кислоты. Например:
CO2 + H2O = H2CO3.
Чтобы составить формулу кислоты, нужно сложить
все атомы исходных веществ, записывая на первом
месте атом водорода, на втором – элемент,
образующий оксид, и на последнем – кислород. Если
индексы получились четными, то их можно
сократить:
N2O3 + H2O = H2N2O4
(2HNO2).
Эти же реакции можно записать в виде
арифметического примера:
Задание 2.6. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с водой.
• Кислотные оксиды реагируют с осно?вными
оксидами, образуя соли соответствующей кислоты,
т.е. соль той кислоты, которая образуется при
взаимодействии этого оксида с водой. Например:
Чтобы составить такое уравнение, нужно
действовать по следующей схеме.
1) Составить формулу кислоты (прибавив к
молекуле оксида молекулу воды):
CO2 + H2O = H2CO3.
2) Определить валентность кислотного остатка
(это часть молекулы кислоты без атомов водорода).
В данном случае кислотный остаток имеет
состав СО3, его валентность равна числу
атомов водорода в кислоте, т.е. II.
3) Cоставить формулу соли, записав вместо атомов
водорода атом металла из основного оксида с его
валентностью (в данном случае натрий).
4) Составить формулу соли по валентности
металла и кислотного остатка: Na2CO3.
Задание 2.7. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с оксидом
кальция.
• Кислотные оксиды реагируют с основаниями,
образуя соль соответствующей кислоты и воду.
Например:
Принципы составления уравнений реакций с
основаниями те же, что и для реакций с
осно?вными оксидами (см. выше).
Задание 2.8. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с гидроксидом
натрия NаОН.
З а п о м н и т е! Кислотные оксиды ни с кислотами,
ни c кислотными оксидами не реагируют.
Свойства основных оксидов
• Основные оксиды реагируют с водой,
образуя основания. Реакция протекает, если
получающееся основание растворимо в воде.
Общая формула оснований – М(ОН)х, где х
– число ОН-групп, равное валентности металла М.
Например:
СаО + Н2О = Са(ОН)2,
Fe2O3 + Н2О нет реакции.
Последняя реакция не идет, т.к. основание Fe(ОН)3
нерастворимо в воде. Растворимость веществ в
воде можно определить по таблице растворимости
(рис. 2).
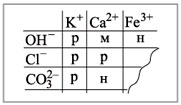 |
Рис. 2.
|
Условные обозначения: р – растворимо в воде, м
– малорастворимо в воде,
н – нерастворимо в воде.
При определении возможности протекания данной
реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он
образован активным металлом. Эти металлы стоят в
ряду напряжений до магния: Li, K, Ba, Ca, Na, Mg…
Задание 2.9. Составьте уравнения реакций основных
оксидов из задания 2.5 с водой.
• Основные оксиды реагируют с
кислотами, образуя соль и воду:
Обратите внимание: при составлении формулы
соли нужно вместо атомов водорода в формуле
кислоты написать символ металла, а затем
расставить индексы согласно валентности.
Задание 2.10. Составьте уравнения реакций
осно?вных оксидов из задания 2.5 с Н2SО4.
• Основные оксиды реагируют с
кислотными оксидами, образуя соли.
• Некоторые основные оксиды
реагируют при нагревании с водородом, при этом
образуются металл и вода:
CuO + H2 = Cu + H2O.
З а п о м н и т е! Основные оксиды с
основаниями и основными оксидами не
реагируют!
В ы в о д. В реакцию легче всего вступают
вещества с противоположными свойствами и не
вступают в реакцию вещества со сходными
свойствами.
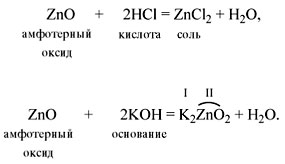
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi – двойной)
проявляют двойственные свойства: они могут
реагировать и с кислотами, и с основаниями
(точнее, со щелочами). При этом образуются соль и
вода. Например:
Задание 2.11. Составьте уравнения реакций
амфотерных оксидов из задания 2.5 с КОН и НNО3.
Задание 2.12. С какими из веществ – Н2О,
NаОН, НСl – могут реагировать следующие оксиды:
Cr2O3, CrO, SO3, V2O5?
Составьте уравнения возможных реакций.
Способы получения оксидов
Оксиды могут быть получены при разложении
некоторых кислот, оснований, солей:
H2SO3 = SO2 + H2O,
Cu(OH)2 = CuO + H2O,
Са(НСО3)2 = Н2О + СО2
+ СаСО3.
Оксиды обычно получают сжиганием в кислороде
простых и сложных веществ:
2Mg + O2 = 2MgO,
C + O2 = CO2,
2H2 + O2 = 2H2O,
CH4 + 2O2 = CO2 + 2H2O.
Обратите внимание: при сгорании сложного
вещества образуются оксиды элементов, которые
входят в его состав. Исключение составляют
только азот и галогены, которые выделяются в виде
простых веществ.
В ы в о д ы по главе 2.1
Молекулы оксидов состоят из атомов двух
элементов. Один из этих элементов – кислород.
Оксиды, образующие соли, бывают кислотными,
амфотерными и основными.
Оксиды реагируют с веществами, которые
проявляют противоположные свойства.
Основные оксиды реагируют с
кислотными оксидами или кислотами, кислотные
оксиды – с основными оксидами или
основаниями, амфотерные оксиды – и с кислотами, и
с основаниями (щелочами).
2.2. Кислоты
Кислоты – это сложные вещества, в состав
молекул которых входят активные атомы водорода и
кислотные остатки. Активный атом водорода в
химических реакциях способен замещаться на атом
металла, в результате чего всегда получается
соль.
В формулах неорганических кислот атом водорода
записывается на первом месте*.
Например:
В состав молекулы любой кислоты кроме атомов
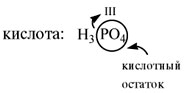
водорода входит кислотный остаток. Кислотный
остаток – это часть молекулы кислоты без атомов
водорода (которые могут быть замещены на атом
металла). Валентность кислотного остатка равна
числу таких атомов водорода:
При определении валентности кислотного
остатка учитываются те атомы водорода, которые
участвовали в реакции или могут участвовать в
ней. Так, фосфорной кислоте Н3РО4 в
зависимости от условий могут соответствовать
кислотные остатки разного состава:
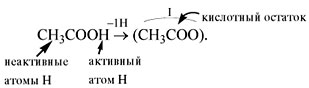
У органических кислот не все атомы водорода в
молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность
кислотных остатков для кислот, учитывая, что все
атомы водорода кислот активные:
HNO3, H2S, NaHCO3, H2SO3,
KOH, HMnO4.
По числу атомов водорода в молекулах кислоты
делят на одноосновные и многоосновные.
Например:
HCl – одноосновная кислота, т. к. в ее молекуле
один атом водорода;
Н2СО3 – двухосновная кислота, т. к. в
ее молекуле два атома водорода.
По составу кислоты делят на бескислородные
(НСl, Н2S) и кислородсодержащие (НСlO, Н2SO4).
Бескислородные кислоты представляют собой
растворы некоторых газов в воде, при этом и
растворенному газу, и полученному раствору
приписывают одинаковые свойства, хотя это не так.
Например, из простых веществ водорода и хлора
получается газ хлороводород:
H2 + Cl2 = 2HCl.
Этот газ не проявляет кислотных свойств, если
он сухой: его можно перевозить в металлических
емкостях, и никакой реакции не происходит.
Но при растворении хлороводорода в воде
получается раствор, который проявляет свойства
сильной кислоты. Такую кислоту перевозить в
металлических емкостях нельзя.
Названия бескислородных кислот составляют по
схеме:
элемент + водород + «ная» кислота.
Например: H2S – сероводородная кислота
(раствор газа сероводорода в воде).
Некоторые бескислородные кислоты имеют особые
(тривиальные) названия: НСl – соляная кислота
(раствор газа хлороводорода в воде), НF –
плавиковая кислота (раствор газа фтороводорода в
воде).
Задание 2.14. Дайте химические названия
соляной и плавиковой кислотам.
Кислородсодержащие кислоты могут быть
получены при действии воды на кислотные оксиды
(см. выше). Исходные кислотные оксиды называют
«ангидриды кислот»:
Метафосфорная кислота неустойчива и,
присоединяя воду, превращается в более
устойчивую ортофосфорную кислоту:
Или в суммарном виде:
Р2О5 + 3Н2О = 2Н3РО4
.
Таким образом, Р2O5 – ангидрид
фосфорной кислоты, а также некоторых других,
менее устойчивых кислот.
Обратите внимание: название
кислородсодержащей кислоты содержит в виде
корня название элемента, входящего в состав
ангидрида: фосфор Р
фосфорный ангидрид Р2О5 фосфорная кислота Н3РО4.
Если элементу соответствует несколько кислот,
то для кислоты с большей валентностью
элемента, входящего в состав ангидрида, в
названии употребляют суффиксы «н» или «в».
Для кислот с меньшей валентностью элемента в
название кислоты добавляют суффикс «ист».
Валентность элемента проще всего определять по
формуле ангидрида:
В названии сернистой кислоты основной суффикс
«ист», а суффикс «н» введен дополнительно для
благозвучия.
Сведения о названиях некоторых кислот обобщены
в табл. 3.
Таблица 3
Названия кислот
| Ангидрид | Кислота | Название |
| Нет | НС1 | Соляная, хлороводородная |
| CO2 | Н2СО3 | Угольная |
| SiO2 | …………… | Кремниевая |
| N2O3 | …………… | Азотистая |
| N2O5 | …………… | Азотная |
| SO2 | …………… | …………………….. |
| SO3 | …………… | …………………….. |
| P2O5 | …………… | …………………….. |
| CrO3 | …………… | Хромовая |
| Нет | H2S | Сероводородная |
Задание 2.15. Вместо пропусков в табл.
3 напишите формулы и названия соответствующих
кислот.
Задание 2.16. Напишите на память (никуда не
заглядывая) формулы кислот: кремниевой,
сернистой, серной, сероводородной, азотистой,
азотной, соляной, фосфорной, угольной. Укажите
ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их
способность образовывать соли. Соль образуется в
любой реакции, в которой участвует кислота, при
этом замещаются активные атомы водорода (один
или несколько).
• Кислоты реагируют с металлами. При этом атомы
водорода кислоты замещаются на атомы металла с
образованием растворимой соли и водорода.
Например:
Не все металлы способны вытеснять водород из
растворов кислот. Этот процесс возможен только
для тех металлов, которые стоят в ряду напряжений
(ряд активности) до водорода (рис. 3, см. с. 20):
 |
Рис. 3. Ряд напряжений металлов |
Задание 2.17. Составьте уравнения
возможных реакций:
серная кислота + алюминий,
соляная кислота + серебро,
бромоводородная кислота + цинк.
При составлении уравнений пользуйтесь рядом
напряжений. Не забывайте, составляя формулы
солей, учитывать валентности металла и
кислотного остатка.
Некоторые кислоты могут растворять металлы,
которые стоят в ряду напряжения после водорода,
но водород при этом не выделяется:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
• Кислоты реагируют с основаниями, образуя
соль и воду**. Это реакция
обмена, и поэтому валентность составных частей в
результате реакции не меняется:
Расставим коэффициенты:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2
+ 6Н2О.
Задание 2.18. Составьте уравнения реакций:
серной кислоты и Fe(ОН)3,
соляной кислоты и Ва(ОН)2,
сернистой кислоты и NаОН.
Не забудьте порядок действий: составить
формулу соли по валентности металла и кислотного
остатка; расставить коэффициенты.
• Кислоты могут реагировать с солями. При этом
сильная кислота вытесняет более слабую из ее
соли.
К сильным кислотам относятся серная, азотная,
соляная и др.
К слабым кислотам относятся угольная,
кремниевая, сероводородная, азотистая.
В реакции обмена кислоты с солью образуются
новая соль и новая кислота. Например:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
Более подробно о подобных реакциях см. главу 6.
Задание 2.19. Составьте, не обращаясь к
учебнику и пособиям, формулы: а) сильных кислот;
б) слабых кислот.
Задание 2.20. Составьте уравнения реакций:
соляная кислота + FeS,
азотная кислота + Na2SiO3,
серная кислота + K2CO3.
• Как обнаружить кислоту в растворе? Например,
в одном стакане налита вода, а в другом – раствор
кислоты. Как определить, где кислота? Хотя все
кислоты кислые на вкус, пробовать их нельзя, это
опасно. Выручают особые вещества – индикаторы.
Это соединения, которые изменяют цвет в
присутствии кислот.
Синий лакмус в кислоте становится красным;
оранжевый метилоранж тоже становится красным в
присутствии кислот.
В ы в о д ы по главе 2.2
Кислоты классифицируют:
по числу атомов водорода – на одноосновные,
двухосновные и т.д.;по наличию атома кислорода в составе
молекулы – на бескислородные и
кислородсодержащие;по силе – на сильные и слабые;
по устойчивости – на устойчивые и
неустойчивые.
Кислоты реагируют:
с активными металлами (стоящими в ряду
активности до Н),с основаниями,
с основными и амфотерными оксидами,
с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой
(«красной») области.
* В химических формулах
органических кислот атом водорода стоит в конце,
например CH3COOH – уксусная кислота.
** Реакция между кислотой и
основанием называется реакцией нейтрализации.
Продолжение следует
Составьте химические формулы кислот, соответствующих оксидам, формулы которых:
N
2
O
3
,
C
O
2
,
P
2
O
5
,
S
i
O
2
,
S
O
2
. Дайте названия всех веществ.
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §21. Вопросы и задания. Номер №3
Решение
| Оксид | Кислота |
|---|---|
|
N 2 + O 3 − оксид азота (III) |
H + N + O 2 − |
|
C + O 2 − оксид углерода (IV) |
H 2 + C + O 3 − |
|
P 2 + O 5 − оксид фосфора (V) |
H 3 + P + O 4 − |
|
S + O 2 − оксид кремния (IV) |
H 2 + S + O 3 − |
|
S + O 2 − оксид серы (IV) |
H 2 + S + O 3 − |
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания,
берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта
готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием
сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом
администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта
и представлены на сайте исключительно для ознакомления. Авторские права на материалы
принадлежат их законным авторам. Частичное или полное копирование материалов сайта без
письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой
зрения авторов.