План урока:
Валентность
Причины постоянной и переменной валентности
Правила определения степени окисления
Валентность
Представьте на минуточку, что атомы не могли бы соединяться между собой, какой вид имела бы планета, а вопрос: «Существовала ли вообще Солнечная система?» Именно благодаря тому, что атомы соединяются между собой, существуют вещества, а также и мы.
Вернёмся к деталям, мы их будем сравнивать с атомами, а их внешний вид, с количеством связей, которые они могут образовать.
Представим, что в нашем распоряжении есть вот такие детали.
Валентность элементов обусловлена количеством неспаренных электронов на внешнем уровне.
Рассмотрим металлы, расположенные в I группе. Их объединили в одно семейство щелочных металлов, поскольку реагируя с водою, они все образуют щёлочи, состава МеОН. Формула внешнего уровня имеет вид ns1. Если провести параллель с элементами конструктора, то они будут выглядеть следующим образом.
Они могут отличаться цветом, формой, однако их объединяет количество связей, которые они способны образовать. Иначе говоря, что щелочные металлы одновалентны.
Это правило срабатывает и для элементов II группы, только они будут иметь вид двойных деталей.
Вспоминаем, что элементы этой группы имеют формулу ns2, приходим к тому, что валентность атомов численно равна II.
Как возможно Вы заметили, или вспомнили с темы строение атома, что высшая валентность определяется номером группы, но не всегда ей равна. Исключением с данного правила являются атомы элементов таких как азот, фтор и кислород.
Почему фтор, находясь в VII группе, имеет валентность постоянную равную единице. В то время, для других его родственников, она будет равнять I, III, V или даже VII.
Источник
Поиграем с Вами в старую добрую игру «Найди … отличий». Несмотря на то, что они находятся в одной группе, имеют общую формулу внешнего слоя ns2np5, валентность их будет отличаться. Атомы хлора выигрывают за счёт свободного 3d уровня, на который при определённых условиях могут мигрировать электроны с наружного слоя, образуя при этом 3 возбуждённых состояния. Атом фтора в этом плане бедный, в распоряжении его электронов нет d-орбитали, его электронам некуда мигрировать.Поэтому имея только 1 неспаренный электрон, может образовать только единственную связь.
Причины постоянной и переменной валентности
Для большинства элементов характерно иметь переменную валентность. Но для некоторых она будет постоянной. Некоторые элементы Вам уже известны, пополнит этот список кислород и цинк, которые всегда двухвалентны, алюминий имеет число связей III.
Расположение элементов в периодической таблице подсказывает, о количестве связей, которые могут они образовать.
Источник
Определение валентности элементов по формулам
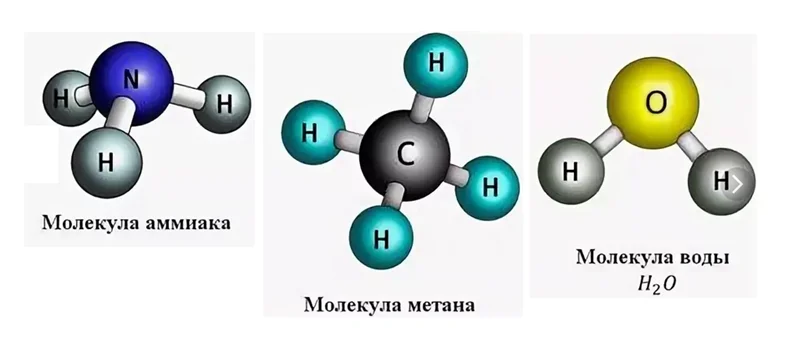
На рисунке изображены молекулы известных Вам веществ: это аммиак NH3, запах этого газа очень резкий и его трудно забыть, если хоть раз ощущали запах нашатырного спирта, с помощью его приводят людей в чувство после обморока.
Источник
С молекулой метана СН4 Вы встречаетесь на кухне, когда открываете газовый кран, чтобы приготовить пищу. На самом деле, метан не имеет запаха, но поскольку он относится к взрывоопасным веществам, то к нему прибавляют специальные соединения, имеющие запах, чтобы в случае утечки, его можно было обнаружить.
Молекула Н2О окружает нас повсюду. Во всех этих соединениях имеются атомы водорода, только в разных количествах. Давайте попробуем определить валентность по формуле вещества. Вспомним, что водород одновалентен. Если в аммиаке водорода насчитываем 3 атома, значит азот, условно, можем изобразить в виде такой детали.
Как видно с рисунка, он имеет валентность III. Поэтому принципу определим валентность углерода, приходим к выводу, что он четырёхвалентен.
Но не всегда мы видим структурные формулы, которые отображают связи между атомами, и не всегда имеем дело с одновалентными элементами. Возьмём, к примеру, вещество состава Р2О5. На два атома фосфора приходится 5 атомов кислорода. Постоянную валентность имеет кислород, которая равняется II. Чтобы определить, какую валентность будет иметь фосфор, необходимо выполнить следующие математические действия.
Встречаются такие соединения, где необходимо определить валентность остатков, входящих в состав кислот. Например, вещество состава Mg3(PO4)2.
Выполним согласно алгоритму. Магний всегда двухвалентен.
Искомая валентность кислотного остатка равна III. Следует заметить, что в веществе всегда находиться элемент, который проявляет постоянную валентность.
При написании уравнений реакций возникает необходимость составления формул веществ. Рассмотрим реакцию обмена между оксидом алюминия и соляной кислотой.
В результате обмена образуется два вещества состава AlCl и НО. Чтобы определить количественный состав в веществах, воспользуемся следующим алгоритмом.
Составление химических формул по валентности
Уравнение приобретает вид
Обратите внимание, что количество атомов отличается в реагентах и продуктах, его необходимо уравнять.
Составим формулы веществ по валентности элементов.
Немаловажную роль наравне с валентностью играет такое понятие как степень окисления (СО).
Термин валентность применим для соединений, имеющих молекулярное строение. Но, как известно, ещё существуют вещества ионного строения, которые образуются за счёт электростатического притяжения между разноимёнными зарядами. Каким образом они образуются? Чтобы ответить на данный вопрос, вспомним об электроотрицательности.
При образовании вещества, одни атомы будут отдавать свои электроны, другие – принимать. Рассмотрим на примере соединений молекулярного строения Cl2, HCl и ионного NaCl.
Обратите внимание, что вещества молекулярного строения, имеют структурную формулу, соединение атомов между собой показывается в виде черты – между ними. Для веществ имеющих строение, отличающее от молекулярного, более применимо понятие степени окисления, которое имеет универсальное применение для всех типов веществ.
Каким образом получается молекула вещества HCl? У водорода имеется один-единственный электрон, который располагается на 1s уровне, у хлора целых 7, занимающих уровни 3s2 и 3р5. Как Вы считаете, какой атом будет отдавать, а какой принимать электроны? При всём своём желании, атом водорода никак не сможет принять электроны хлора, ему просто некуда. Как он сможет расположить в своей 1s ячейке целых 7 электронов хлора. Логично предположить, что принимать будет хлор. Ему как раз не хватает одного электрона, чтобы завершить свой уровень. Поэтому водород будет иметь заряд +, а хлор -. Степень окисления указывается в правом верхнем углу элемента, арабскими цифрами, знак + или – ставим перед цифрой H+Cl−.
А вот какую степень окисления имеет простое вещество. Атомы равноценные партнёры, поэтому она будет нулевая.
При образовании ионного соединения NaCl натрий, как элемент имеющий малое число электронов на внешнем слое, а именно 1, подобно водороду, отдаёт его хлору, образуя при этом катион Na+, хлор при этом становится отрицательным анионом Cl−.
Правила определения степени окисления
Подобно валентности, для определённых элементов свойственна постоянная степень окисления. Это металлы, которые отличаются малым количеством электронов внешнего слоя. Отличительной характеристикой их будет невозможность иметь отрицательный заряд, поскольку они ВСЕГДА отдают электроны.
В противовес металлам существует один-единственный элемент, который абсолютно ни с кем не хочет делиться своими электронами.Ни при каких условиях он не отдаст их, это фтор, который всегда отрицателен F−.
Такой элемент, как кислород, обычно имеет отрицательный заряд, это -2. И только с фтором, он будет положительным +2.
Аналогичная ситуация с водородом, характерная СО (степень окисления) +1, однако исключения составляют соединения с металлами, где его степень окисления будет отрицательная и равняется -1.
Все эти значения вытекают с периодической системы, которая помогает определить степени окисления элементов.
Источник
С таблицы видно, что для большинства элементов эта величина не постоянная.
Чтобы вычислить степень окисления элементов в соединениях, будем руководствоваться следующими правилами.
Как бы то ни было, природа не ограничивается бинарными соединениями. Существует множество веществ состоящих из 2 и более элемента. Впрочем вычисление совсем не отличается, первоначально определяем элементы, имеющие постоянную степень окисления, а дальше проделав нехитрые математические действия находим СО для остальных. Главное правило, чтобы вещество было нейтральным, количество плюсов должно равняться количеству минусов.
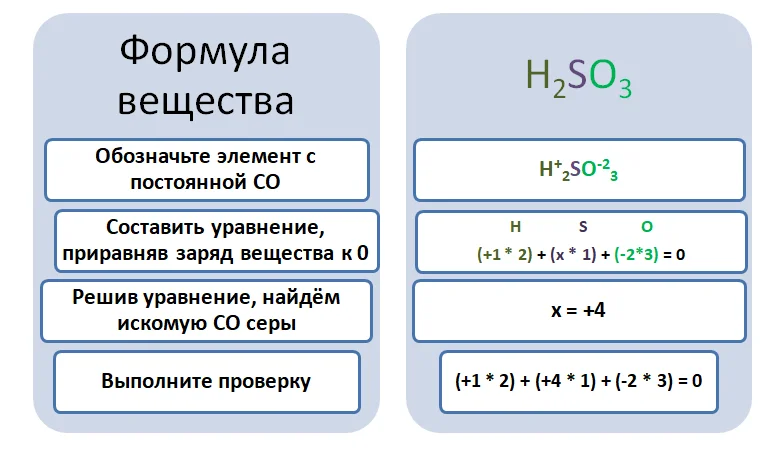
К примеру, в веществе H2SO3 самым электроотрицательным является кислород, он заберёт электроны как в водороде, так и в серы, вследствие этого имеет отрицательную СО, а Hи Sстанут положительными. В этом соединение имеются 2 элемента, имеющих известную СО – это Н и О.
Обратите внимание, на нахождение СО в кислотном остатке. В данном случае, мы приравниваем не к 0, а к заряду аниона.
Здесь у серы х внизу
Как правило, валентность и степень окисления совпадают по абсолютной величине. Но исключения составляют простые вещества, например, в простом веществе азот, формула которого N2, степень окисления равняется 0, в тоже время, валентность атомов азота равна III. N0 ≡ N0.
Либо в катионе аммония NH4+. Азот имеет СО -3, а валентность IV.
Степень окисления — это условный заряд атома химического элемента в веществе.
Правила:
1. Степень окисления элемента в простом веществе равна (0):
,
O20
,
N20
,
F20
,
Cl20
,
Fe0
,
Ca0
.
2. В сложных веществах:
- степень окисления водорода в соединениях с неметаллами равна (+1), а в соединениях с металлами — (–1):
- степень окисления кислорода равна (–2) (исключения: O+2F−12, H+12O−12):
- степень окисления фтора всегда равна (–1):
- степень окисления металла — положительная и совпадает с его валентностью. Может быть постоянной и переменной:
,
K+1
,
Ca+2
,
Mg+2
,
Al+3
;
- степень окисления неметалла может быть как положительная, так и отрицательная. Численные значения тоже совпадают с валентностью:
,
N+4
,
N+3
,
N+2
,
N+1
,
N−3
;
3. Сумма степеней окисления элементов в веществе равна (0).
Пример:
.
Составление формул по известным степеням окисления элементов
Пример:
составим формулу соединения кальция и азота. Степень окисления кальция равна (+2), а азота — (–3).
Запишем символы химических элементов рядом. Первым обычно записывают символ элемента, у которого степень окисления положительная. Укажем значения степеней окисления над символами:
Найдём для них наименьшее общее кратное и разделим на соответствующие значения степеней окисления. Получим индексы в формуле:
Урок «Составление
формул бинарных соединений»
8 класс
Эпиграф:
«Химические формулы говорят целую история вещества».
Д.И.Менделеев
Тема урока. Составление
химических формул бинарных соединений по степени окисления химических элементов
и валентности.
Место данного урока в теме: второй
урок в данной теме.
Задачи урока:
- Образовательные:
- закрепить у
учащихся понятие степени окисления, бинарные соединения, химическая
формула; - научить правильно составлять
химические формулы бинарных соединений по степени окисления химических
элементов и валентности. - Развивающие:
- научить
приемам сравнения и обобщения изучаемых понятий ; - отработать
умения и навыки в определении степени окисления по химическим формулам; - продолжить
развитие навыков самостоятельной работы (через работу с учебником);
- умения
работать в парах (при проверке домашнего задания) ; - способствовать
развитию логического мышления (через вопросы заставляющие
логически мыслить) - Воспитательные:
- формировать
чувство толерантности (терпимости и уважения к чужому мнению),
взаимопомощи - осуществлять
эстетическое воспитание (через оформление доски и тетрадей, при
применении презентации) - развивать
уважение к мыслителям прошлого (при помощи высказываний великих
людей).
Практическая
направленность: умение составлять формулы веществ при решении
практических задач.
Технические средства
обучения:
- ПК, проектор, экран
- Периодическая система Д.И.
Менделеева - Презентация (авторская
разработка) - О.С.Габриелян, « Учебник.
Химия 8 класс».
Раздаточный
материал:
1. Тест
- Алгоритм для составления
формул бинарного соединения. - Номенклатура бинарных
соединений.
Тип урока: комбинированный
Методы и
технологии:
- Словесно-наглядно-практический
метод - «Урок – упражнение»
- Использование информационных
технологий - Практический метод
- Коммуникативный метод
- Игровой метод
Этапы урока:
- Организационный момент.
(Приветствие, готовность, мотивация) - Проверка домашнего задания.
- Практическая значимость.(Видео
фрагмент) - Постановка темы урока и ее
целей. Активизация мыслительных действий (через высказывания великий
людей). - Обобщение. Выведение алгоритма
составления формулы бинарного соединения. (Раздаточный материал) - Закрепление.
- Итоговое обобщение.
- Оценки за урок.
- Домашнее задание.
- Рефлексия.
ХОД УРОКА:
1. Организационный
момент.
(Учебник, тетрадь, дневник,
дидактический материал). Приветствие, готовность, мотивация.
Здравствуйте, ребята. Сегодня у нас на уроке присутствуют мои коллеги,
поприветствуйте их.
Притча Сократа:
«Три человека тащат тяжёлые камни в город. Пот катится со всех
трёх.
Одного спросили:
– Что ты делаешь?
– Тащу эту проклятую ношу.
Второго спросили:
– Что ты делаешь?
– Зарабатываю на хлеб себе и семье, – бодро ответил он.
Третий на тот же вопрос улыбнулся:
– Строю замечательный храм, который простоит века на радость
людям и утешение им!»
Вывод: Труд имеет значимость для каждого из нас. С
помощью трудовой, сознательной деятельности каждый человек создаёт для себя и
для людей блага.
Я хочу вас спросить: «А зачем вы пришли ко мне на урок?»
Учитель говорит о том,
что дети приходят на занятия по химии, чтобы сделать открытия, чтобы узнать
что то новое.
Учитель рассказывает о
том, что когда то и он, будучи учеником, открыл для себя химические формулы. Сейчас
он знает их много, но ему не надо их заучивать.Для того, чтобы написать формулу
вещества, достаточно знать всего лишь одно химическое понятие «Степень
окисления», с которым вы познакомились на прошлом уроке.
2. Проверка
домашнего задания.
Тест. (приложение 1)
1.Степень окисления — это величина
а) постоянная
б) переменная
в)
постоянная и переменная
2. Высшая степень окисления фосфора
равна:
а) номеру
группы, т.е. 5,
б) нулю,
в) трем.
3. Степень окисления хлора равна
-1 в:
а) Cl2O3,
б) PCl5,
в) Cl2.
4.В каком соединении степень
окисления определена не верно:
а) Mg+2 O-2
б) P2+2 O5-3
в) H+1 CL-1
5.Степени окисления марганца в
соединениях MnO, MnO2, Mn2O7
соответственно равны:
а)+1,+2,+7
б)+2,+4,+7
в)+1,+2,+2
3. Практическая
значимость.
— Посмотрите
на формулы веществ представленных на слайде. Что у них общего? (состоят из
двух элементов, т.е. являются бинарными).
Из представленных формул есть
важнейшие из них.
Н2О-самое удивительное,
распространенное и самое необходимое вещество на нашей планете .Без воды
никуда.
СО2-углекислый газ,
основа процесса фотосинтеза, т.е. нашего дыхания, используется для
приготовления газированных напитков, сухой лед для хранения мороженного.
Al2O3— оксид
алюминия входит в состав минералов и горных пород, является основой драгоценных
камней (рубин, сапфир)
CaO — оксид кальция, применяется в
строительстве для получения вяжущих материалов.
Более подробно с ними познакомимся
на следующем уроке.
4. Учитель объявляет тему урока – запись темы в
тетрадь.
Сегодня на
уроке мы научимся составлять химические формулы бинарных соединений по
степени окисления химических элементов и валентности.
Составить
формулу вещества, значит определить индексы, показывающие число атомов в
молекуле.
А сейчас вы получите алгоритм как
составлять формулу бинарного соединения, который вклейте в тетрадь. Раздать
раздаточный материал «Алгоритм составления формулы бинарного соединения»
Алгоритм
составления формулы бинарного соединения.(приложение 2)
- На первом месте пишется
элемент с меньшей электроотрицательностью (См. в таблицу Д.И.
Менделеева). - Элемент написанный на первом
месте имеет положительный заряд, а на втором отрицательный. Указать для
каждого элемента степень окисления. - Найти наименьшее общее кратное
для значений степеней окисления. (Число которое делится на исходные числа
без остатка). - Разделить наименьшее общее
кратное на значение степени окисления и полученные индексы приписать внизу
справа после символа соответствующего элемента. - Проверка. Суммарное значение
степеней окисления равно 0.
Пример:
1. AL S
2. AL+3S-2
3. НОК: 3 *2=6
4. AL 6:3=2
S 6:2=3
5. AL2S3
Закрепление.
Задание: попробуем
составить формулы содержащие Ca и Сl, AL и O.
— А как назвать эти бинарные
вещества?
Правило составления
названия бинарных веществ. (приложение3)
1.Названия состоят из двух слов.
2.Первое слово обозначает
электроотрицательную часть соединения – неметалл, его латинское название с
суффиксом –ид стоит всегда в именительном падеже.
3.Второе слово обозначает
электроположительную часть – металл или менее электроотрицательный элемент, его
название в родительном падеже.
1. AL2S3 — сульфид
алюминия
2. CaCl2— хлорид
кальция
3. AL2O3
–
оксид алюминия
Запомнить!
ЭxHy — гидриды
ЭxOy — оксиды
ЭxSy
-сульфиды
ЭxCly -хлориды
ЭxBry -бромиды
ЭxFy — фториды
ЭxPy— фосфиды
ЭxNy -нитриды
ЭxIy –йодиды
ЭxCy -карбиды
ЭxSiy -силициды
— Составьте
формулы веществ состоящих из Fe+3 и Cl, Fe+2 и Cl.
А как же назвать
эти вещества?
FeCl3 — хлорид
железа (III)
FeCl2 — хлорид
железа (II)
5.Понятие
о валентности.
Валентность
— это свойства атомов одного химического элемента присоединять определённое
число атомов другого.
Это понятие было введено в химию в 1853 г. английским химиком-органиком
Франклендом для обоснования количественных отнощений атомов элементов в
химических соединениях. Развитие учения о валентности в большой степени связано
с открытием Д.И. Менделеевым Периодического закона. Им была установлена связь
между валентностью элемента и его положением в периодической системе, введено понятие
о переменной валентности. Учение о строении атомов и молекул способствовало
разработке электронной теории валентности.
Для расчётов, для составления формул веществ неоходимо знать количественные
соотношения атомов различных элементов, в которых они соединяются. Валентность
показывает, со сколькими атомами одновалентного элемента соединяется атом
данного элемента.
Одновалентными считают все элементы, атомы которых в двухэлементных соединениях
всегда связаны с одним атомом другого элемента. Примером одновалентного
элемента является водород. Поэтому считается, что валентность элемента
указывает на то, со сколькими атомами водорода соединён один атом
рассматриваемого элемента. Например: в HCl хлор-одновалентен, в H2O
кислород-двухвалентен,в NH3 азот-трёхвалентен.
Водородные соединения известны не для всех элементов, но почти все элементы
образуют соединения с кислородом О. Кислород считается всегда двухвалентным.
Таблица
постоянных валентностей.
|
Валентности |
Элементы |
|
I |
H, Na, Li, K, Rb, Cs |
|
II |
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd |
|
III |
B, Al, Ga, In |
Используя
валентности можно составить формулу соединения.
Химическая формула-это условная запись состава вещества
посредством химических знаков и индексов.
Например: H2O-формула воды, где Н и О-химические знаки элементов,
2-индекс, который показывает число атомов данного элемента, входящих в состав
молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его
валентность, которая ставится в скобки. Например, Р2О5—
оксид фосфора (V).
Правила
определения валентности
элементов в соединениях
Валентность
водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О
к одному атому кислорода присоединено два атома водорода.
Кислород
в своих соединениях всегда проявляет валентность II. Поэтому углерод в
соединении СО2 (углекислый газ) имеет валентность IV.
Учитель.
Как определить валентность элемента, исходя из таблицы
Д.И.Менделеева?
У
металлов, находящихся в группах а, валентность равна номеру группы.
У
неметаллов в основном проявляются две валентности: высшая и низшая (схема).
Высшая
валентность равна номеру группы.
Низшая
валентность равна разности между числом 8 (количество групп в таблице) и
номером группы, в которой находится данный элемент.
Учитель.
Например: сера имеет высшую валентность VI и низшую (8 – 6),
равную II; фосфор проявляет валентности V и III.
Валентность
может быть постоянной (у элементов главных подгрупп таблицы Д.И.Менделеева) или
переменной (у элементов побочных подгрупп в таблице), но с этим явлением вы
познакомитесь чуть позже, а если интересуетесь, то почитайте учебник 9-го
класса.
Валентность
элементов необходимо знать, чтобы составлять химические формулы соединений. Для
этого удобно воспользоваться следующей таблицей.
Таблица
Алгоритм
составления формулы соединения В и О
|
Последовательность действий |
Составление формулы оксида бора |
|
1. Написать символы |
В О |
|
2. Определить |
V II |
|
3. Найти наименьшее |
3•2 = 6 |
|
4. Найти соотношения |
6 : 3 = 2, 6 : 2 = 3; В : О = 2 : 5 |
|
5. Записать индексы |
В2 О3 |
|
6. Формула соединения |
В2О3 |
Учитель.
Запомните еще два правила для составления химических формул соединений
неметаллов между собой.
1)
Низшую валентность проявляет тот элемент, который находится в таблице
Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный
левее и ниже. (Демонстрация таблицы Д.И.Менделеева.)
Например,
в соединении с кислородом сера проявляет высшую валентность VI, а кислород –
низшую II. Таким образом, формула оксида серы будет SO3.
В
соединении кремния с углеродом первый проявляет высшую валентность IV, а второй
– низшую IV. Значит, формула – SiC. Это карбид кремния,
основа огнеупорных и абразивных материалов.
Итоговое обобщение
1. Используя
знания, полученные на этом уроке, составьте формулы следующих веществ: фосфида
кальция, оксида свинца (IV)
2. Найдите
соответствие между формулой вещества и его названием
|
Формула |
Название |
||
|
1 |
Na2S |
А |
Оксид |
|
2 |
Cu2O |
Б |
Хлорид |
|
3 |
CuCl2 |
В |
Сульфид |
Итог урока,
выставление оценок
Домашнее
задание:
На «3» — §17,упр.2
На «4» — §17,упр.2
и 5
На «5» — §17,упр.2,3
и 5
Валентность
Валентность (лат. valere — иметь значение) — мера «соединительной способности» химического элемента, равная числу индивидуальных
химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю
вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном
состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для
полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди,
железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие
элементы — с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III — у азота, II — кислорода. Подведем итог полученным знаниям,
написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N — III
- O — II
- H, Na, K, Li — I
- S — VI
- C — III (в угарном газе CO, так как одна связь образована по донорно-акцепторному механизму), IV (в углекислом газе CO2 и карбонате натрия Na2CO3)
- Fe — II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной
реакции). В простых веществах СО всегда равна нулю, в сложных — ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны,
образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд «+», а другим «-«. Это связано с электроотрицательностью —
способностью атома притягивать к себе электроны. Знак «+» означает недостаток электронов, а «-» — их избыток. Повторюсь, СО — условное
понятие.

Сумма всех степеней окисления в молекуле равна нулю — это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент
принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и «уходит в минус». Кто отдает свои электроны и испытывает их недостаток —
получает знак «+».

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2,
KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 
степеней окисления должно заменить даже самую развитую интуицию 

Особо хочу выделить тему ионов. Ион — атом, или группа атомов, которые за счет потери или приобретения одного или нескольких
электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к «0», как в молекуле. Ионы даны в таблице растворимости, они имеют
разные заряды — к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.