Copyright ©
Providosiki.ru
Смотрите видео онлайн на Providosiki.ru. Смотрите сериалы бесплатно, музыкальные клипы, новости мира и кино, обзоры мобильных устройств
[email protected] — Почта для жалоб и предложений
Содержание:
- § 1 Валентность химических элементов
- § 2 Определение валентности по формулам соединений
- § 3 Составление химических формул по валентности
- § 4 Определение названия вещества по химической формуле
§ 1 Валентность химических элементов
В свое время, состав всех веществ был установлен на основании данных эксперимента. Однако можно составлять химические формулы, не прибегая к предварительному выполнению сложных опытов, требующих длительной, кропотливой работы.
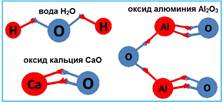
Если сравнить между собой формулы таких веществ, как вода H2O, оксид кальция СаО, оксид алюминия Al2O3, оксид углерода СО2, оксид фосфора Р2О5, оксид серы SО3 и оксид хлора Cl2О7, то можно заметить, что кислород во всех этих соединениях присоединяет к себе неодинаковое число атомов других химических элементов.
Для определения состава бинарных или двухэлементных, то есть состоящих из атомов двух химических элементов соединений, и составления их формул, достаточно знать валентность химических элементов.
Валентность (от латинского слова Valentia – «сила») – свойство атома химического элемента присоединять или замещать определённое число атомов другого химического элемента
Поскольку атомы в молекуле соединены между собой химическими связями, валентность определяется числом простых (одинарных) химических связей, которые данный атом образует с другими атомами.
§ 2 Определение валентности по формулам соединений
Как это можно представить себе, если не прибегать к теории строения атома? Каждый атом имеет определенное число потенциальных химических связей – валентных возможностей.
Например, водород – одну, кислород и кальций – по две, алюминий – три, углерод – четыре, фосфор – пять, сера – шесть, хлор – семь. Соединяться друг с другом эти атомы могут, только используя эти самые валентные возможности.
Поэтому атомы химических элементов и образуют соединения, подчиняясь закону постоянства состава.
Закон постоянства состава утверждает, что вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Способность элементов проявлять то или иное значение валентности определяется строением их атомов. Поскольку строение атомов обычно изучается позднее, научимся определять валентность, исходя из положения элементов в периодической системе.
Для этого следует учитывать, что каждая группа (вертикальный столбец) элементов состоит из двух подгрупп: главной А и побочной В.
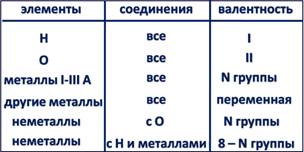
Элементы-металлы, располагающиеся в главных подгруппах I и II групп, проявляют постоянную валентность, равную номеру группы. Это же относится и к алюминию (III группа). А вот металлические элементы IV группы (главная подгруппа) олово и свинец служат исключением и проявляют переменную валентность, численно равную 2 и 4. Длямногих металлов побочных подгрупп также характерно наличие переменной валентности, однако высшее значение валентности обычно равно номеру группы!
Большая часть неметаллов, располагающихся в главных подгруппах групп с четвёртой по седьмую, проявляет переменную валентность. В ряду возможных значений валентностей неметаллов следует выделять высшую и низшую. Высшая валентность равна номеру группы, низшая – разности, полученной вычитанием числа, равного номеру группы, из числа 8. Например: высшая валентность элемента фосфора, стоящего в V группе, равна 5,
низшая: 8-5=3. Следовательно, валентность фосфора переменная – 3 и 5. Следует помнить, что высшая валентность неметаллов проявляется только в соединениях с кислородом, а низшая – в соединениях с металлами и водородом. Валентность водорода всегда во всех соединениях равна 1, валентность кислорода всегда 2.
§ 3 Составление химических формул по валентности
Для составления формул сложных веществ, состоящих из атомов двух неметаллов, следует учитывать, что высшую валентность проявит тот элемент, который стоит в периодической системе левее или ниже, а низшую – соответственно тот, который стоит правее или выше.
Составляем формулы и названия веществ по валентности, используя следующий алгоритм:
1. записываем знаки элементов (по наличию) в порядке: металл, водород, неметалл, кислород;
2. расставляем значения валентностей элементов по периодической системе химических элементов;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность, если она не постоянная.
Составим формулу и название для вещества, состоящего из атомов фосфора и кислорода:
1. записываем знаки Р и О;
2. валентность фосфора высшая, равна 5, валентность кислорода, как и во всех соединениях равна 2;
3. наименьшее общее кратное 10
10/5=2, пишем индекс у знака Р
10/2=5, пишем индекс у знака О
получилось Р2О5;
4. назовем вещество: корень латинского названия кислорода «оксигениум» окс, к нему прибавляем суффикс ид, получаем оксид. Русское название первого элемента – фосфор, валентность его переменная, равная 5. Получилось название «оксид фосфора 5».
§ 4 Определение названия вещества по химической формуле
Таким образом, при составлении названия вещества, имеющего определенную химическую формулу, необходимо указывать валентность, а чтобы ее указать, необходимо определить. По периодической системе это получается не всегда. Определить валентность и составить название веществаможно, используя алгоритм:
1. указать валентность известного элемента;
2. умножить указанную валентность на соответствующий индекс;
3. полученный результат делим на индекс элемента с неизвестной валентностью;
4. называем вещество. К латинскому корню второго элемента прибавляем суффикс ид, указываем русское название первого элемента и его валентность.
Определим валентность и составим название вещества, имеющего формулу CrO3:
1. валентность кислорода постоянна и равна 2;
2. 2×3=6;
3. 6/1=6. Валентность хрома равна 6;
4. название вещества – оксид хрома 6.
Теперь научимся составлять формулу по названию вещества
1. записываем знаки химических элементов в нужном порядке;
2. указываем валентности, обращая внимание на название. Если валентность первого элемента переменная, она будет указана. Валентность второго элемента – низшая;
3. находим наименьшее общее кратное значений валентностей (наименьшее число, которое делится на оба значения валентностей), делим его на валентность каждого элемента, получаем и записываем индекс.
Определим формулу оксида серы:
1. записываем знаки S и О.
2. валентность серы равна 4, валентность кислорода, как и во всех соединениях – два.
3. наименьшее общее кратное 4
4/2=2, пишем индекс у знака О
4/4=1, пишем индекс у знака S;
4. получилось SО2.
Список использованной литературы:
- Н.Е. Кузнецова. Химия. 8 класс. Учебник для общеобразовательных учреждений. – М. Вентана-Граф, 2012.
Использованные изображения:
Составление химических формул по валентности видеоурок
Составление химических формул по валентности
Валентность. Часть 2. Составляем формулы по валентности.
23. Составление формулы вещества по валентности
Каждое вещество имеет свое название. Но по названию нельзя определить, из каких частиц состоит это вещество. Запись вещества с помощью формул помогает это определить.
Больше уроков на сайте https://mriya-urok.com/
Химическая формула простого вещества записывается в виде знака — символа элемента. Например, медь — простое вещество — обозначается Сu; сера — S и т.д. У некоторых простых веществ молекула состоит из двух атомов. Например, из двухатомных молекул состоят некоторые неметаллы в газообразном состоянии: водород Н2 (читается «аш-два»), кислород О2 («о-два»), хлор Сl2 («хлор-два»). Из этих формул видно, что число, записанное справа внизу у символа элемента, означает число атомов в молекуле. Его называют индексом.
Сложные вещества состоят из атомов разных элементов. Например, вода Н2О («аш-два-о»), углекислый газ СО2 («це-о-два»), поваренная соль NaCl («натрий-хлор»).
Химические формулы показывает, атомы каких элементов и в каких количествах соединены между собой.
Числа, которые показывают, сколько атомов содержится в молекуле, называется индексами
Коэффициент — это число перед формулой, которое означает число молекул данного вещества.
Относительная атомная масса (Аr) элемента есть отношение массы атома данного элемента к 1/12 массы атома углерода; это безразмерная величина.
Например: Аr(Н2) = 1 · 2 = 2
Аr(S) = 32
Аr(Сl2 ) = 35,5 · 2 = 71
Относительная молекулярная масса (Мr) вещества представляет собой сумму относительных атомных масс элементов, образующих данное вещество.
Алгоритм составления Химические формулы по валентности элемента Пример 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. В О 2. Над знаками химических элементов поставь их валентность. III II В О Отвечают на вопросы. Записывают в тетрадь правило определения валентности. Определяют валентность элементов по формуле вещества. Самооценка. Отвечают на вопросы. Записывают тему урока. Определяют цель урока. Слушают объяснение учителя. 3. Определи Н.О.К. (наименьшее общее кратное — это число, которое делится на исходные числа без остатка) чисел, выражающих валентность этих элементов. Запиши Н.О.К. над формулой. 6 III II В О 4. Раздели Н.О.К. на валентность каждого элемента. Запиши полученный индекс. 6 III II В О 6: III= 2 6:II=3 6 III II В2 О3 5. Сделайте проверку, то есть подсчитайте число единиц валентностей каждого элемента
Составляем электронные формулы элементов без всяких расчетов(алгоритмы советской школы).
Здравствуйте, уважаемые читатели!
Обучение школьников составлению электронных формул химических элементов в большинстве случае производится в соответствии со следующим алгоритмом: (https://www.calc.ru/Elektronnaya-Formula-Elementa.html).
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s2, на втором – максимум 8 (два s и шесть р: 2s22p6), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Как правило, использование этого алгоритма подразумевает распределение электронов по уровням и подуровням с помощью расчетов , т. е на основе постоянного сравнения количества уже учтенных в электронной формуле электронов с общим количеством электронов в атомов. Использование же таблицы Менделеева при этом минимально.
Это можно проследить на множестве обучающих видеоматериалов, в которых авторы обращаются к ТМ практически только за порядковым номером элемента:
или используют ее раскраску:
Проанализировав более 20 видеоматериалов на данную тему, я смогла найти только один, в котором в качестве основы составления формул использовались не расчеты и не искусственные подсказки в виде разной раскраски знаков элементов, а сама структура таблицы Менделеева (10-12 минуты видео):
Преподавание — творческий процесс, каждый преподаватель выбирает те приемы и алгоритмы, которые близки его психологическим характеристикам. Сказывается также и первоначальное знакомство с данным материалом на уроках химии, когда сам преподаватель был школьником.
Ни в коей мере не претендуя на навязывание алгоритмов, по которым работаю, хочу познакомить (или напомнить), как составлять полные и сокращенные электронные формулы с помощью таблицы Менделеева. С данным приемом я познакомилась на уроках моей мамы в далекие советские годы , а затем — на лекциях и семинарах по неорганике в МИТХТ. Об эффективности этого приема может свидетельствовать то, что электронные формулы элементов четырех периодов легко составляли даже те мои одноклассники, которые с трудом могли посчитать молярную массу.
На приведенном ниже видео я попыталась показать, как, используя 2 источника — алгоритм заполнения электронами орбиталей и таблицу Менделеева, можно легко составлять полные и сокращенные электронные формулы любого химического элемента. Заранее прошу прощения за технические и терминологические ляпы (например, «элемент» вместо «атом»), а также за «жаргонные» словечки (вроде «прощелкать по клеткам»). Дело в том, что это видео -мой первый опыт в создании видеоматериалов.
Источник статьи: http://zen.yandex.ru/media/id/5d2de3c4bc228f00aec36bc0/sostavliaem-elektronnye-formuly-elementov-bez-vsiakih-raschetovalgoritmy-sovetskoi-shkoly-5d70b5f57cccba00adae76df
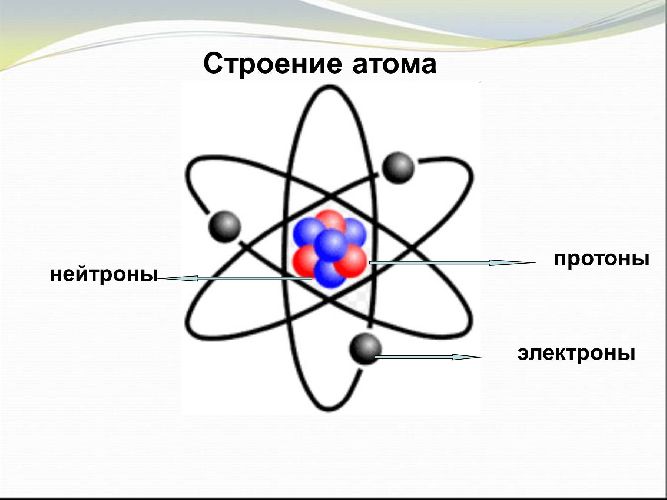
Как написать электронные формулы атомов?
Атом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Электроны располагаются в атоме, образуя энергетические уровни и подуровни.
Электронная формула атома – это распределение электронов в атоме по энергетическим уровням и подуровням в соответствии с принципом наименьшей энергии (Клечковского), принципом Паули, правилом Гунда.
Электронные формулы атомов
Состояние электрона в атоме описывается с помощью квантово-механической модели – электронного облака, плотность соответствующих участков которого пропорциональна вероятности нахождения электрона. Обычно под электронным облаком понимают область околоядерного пространства, которая охватывает примерно 90% электронного облака. Эта область пространства называется также орбиталью.
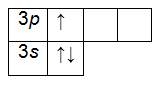
Атомные орбитали образуют энергетический подуровень. Орбиталям и подуровням присвоены буквенные обозначения. Каждый подуровень имеет определенное число атомных орбиталей. Если атомную орбиталь изобразить в виде магнитно-квантовой ячейки, то атомные орбитали, находящиеся на подуровнях, можно представить следующим образом:
| энергетический подуровень | s | p | d | f |
| атомные орбитали |  |
. |
На каждой атомной орбитали могут находиться одновременно не более двух электронов, различающихся спином (принцип Паули). Это различие обозначается стрелками ¯.
Зная, что на s-подуровне одна s-орбиталь, на р-подуровне три р-орбитали, на d-подуровне пять d-орбиталей, на f-подуровне семь f-орбиталей, можно найти максимальное количество электронов на каждом подуровне и уровне.
Так, на s-подуровне, начиная с первого энергетического уровня, 2 электрона; на р-подуровне, начиная со второго энергетического уровня, 6 электронов; на d-подуровне, начиная с третьего энергетического уровня, 10 электронов; на f-подуровне, начиная с четвертого энергетического уровня, 14 электронов. Электроны на s-, p-, d-, f-подуровнях называются соответственно s-, р-, d-, f-электронами.
Согласно принципу наименьшей энергии, последовательное заполнение энергетических подуровней электронами происходит таким образом, что каждый электрон в атоме занимает подуровень с наиболее низкой энергией, отвечающей его прочной связи с ядром. Изменение энергии подуровней может быть представлено в виде ряда Клечковского или шкалы энергии:
Электронная формула химических элементов
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
1s Читайте также: Как найти периметр и площадь прямоугольника?
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным (это наиболее наглядно отражается при составлении электронно-графических формул).
Источник статьи: http://rgiufa.ru/matematika-fizika-himiya/kak-napisat-elektronnye-formuly-atomov.html
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
Энергетическая диаграмма аргона.
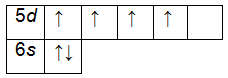
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Источник статьи: http://www.calc.ru/Elektronnaya-Formula-Elementa.html
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
Электронная формула алюминия выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/elektronnaya-i-elektronno-graficheskaya-formula/
Электронные формулы химических элементов
Строение атома
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Рис. 1. Общее строение атома.
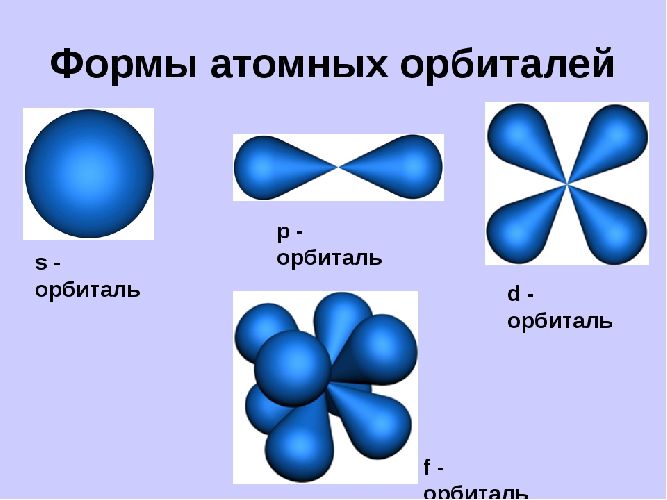
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
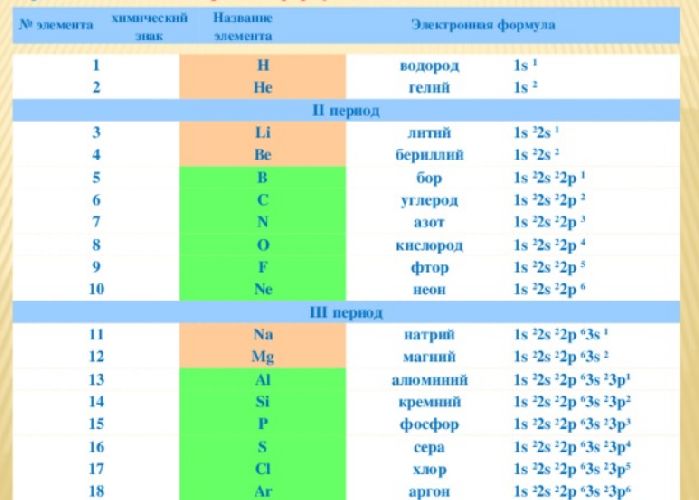
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
Рис. 3. Таблица электронных формул.
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s 2 , неона – 1s 2 2s 2 2p 6 . Следовательно, полная формула магния – 1s 2 2s 2 2p 6 3s 2 .
Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Источник статьи: http://obrazovaka.ru/himiya/elektronnye-formuly-himicheskih-elementov-konfiguracii-atomov.html