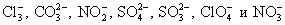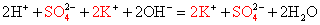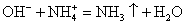Статьи
Основное общее образование
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
06 июня 2019
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Купить
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

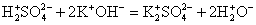
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.

АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
-
Записываем молекулярное уравнение химического процесса.
H2SO4 + KOH = K2SO4 + H2O
-
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
H2SO4 + 2KOH = K2SO4 + 2H2O
-
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
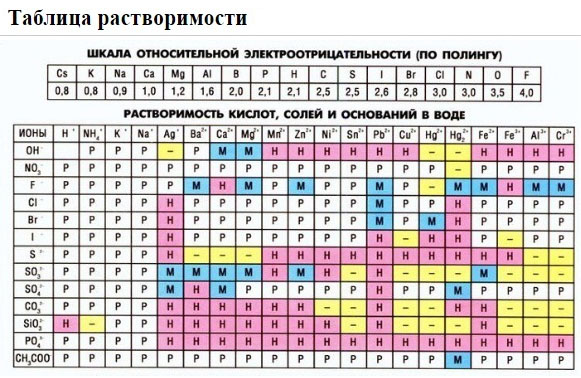
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
-
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
-
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
-
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
2H + 2OH = 2H2O
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
-
Записываем молекулярное уравнение, проверяем коэффициенты.
KOH + NH4Cl = KCl + NH4OH
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
KOH (p) + NH4Cl (p) = KCl (p) + NH3↑+ H2O
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
-
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
-
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
-
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Что происходит?
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
-
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
-
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
-
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
#ADVERTISING_INSERT#
Ионные химические реакции
02-Фев-2014 | комментария 3 | Лолита Окольнова
Ионные реакции — реакции между ионами в растворе
Давайте разберем основные ионные химические реакции неорганической и некоторые реакции органической химии.
Очень часто в различных заданиях по химии просят написать не только химические уравнения в молекулярной форме, но и в ионной (полные и сокращенные). Как уже было замечено, ионные химические реакции идут в растворах. Зачастую, вещества распадаются на ионы именно в воде.
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2NaOH + H2SO4 = Na2SO4 + 2H2O — молекулярное уравнение реакции
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O
OH— + H+ = H2O — сокращенное ионное уравнение реакции
По результатам этого сокращения одинаковых ионов видно, какие ионы образовали то, что нерастворимо или малорастворимо — газообразные продукты или реагенты, осадки или малодиссоциирующие вещества.
Не раскладывают на ионы в ионных химических реакциях вещества:
1. нерастворимые в воде соединения (или малорастворимые) (см. ТАБЛИЦЫ);
Ca(NO3)2 + 2NaOH = Ca(OH)2↓ + 2NaNO3
Сa2+ + 2NO3— + 2Na+ +2OH— = Ca(OH)2 + 2Na+ +2NO3— — полное ионное уравнение реакции
Сa2+ + 2OH— = Ca(OH)2 — сокращенное ионное уравнение реакции
2. газообразные вещества, например, O2, Cl2, NO и т.д.:
Na2S + 2HCl = 2NaCl + H2S
2Na+ + S-2 + 2H+ +2Cl— = 2Na+ + 2Cl— + H2S — полное ионное уравнение реакции
S-2 + 2H+ = H2S — сокращенное ионное уравнение реакции
3. малодиссоциирующие вещества (H2O, NH4OH);
реакция нейтрализации
OH— + H+ = H2O — сокращенное ионное уравнение реакции
4. оксиды (все: и образованные металлами, и неметаллами);
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
2Ag+ + 2NO3— + 2Na+ + 2OH— = Ag2O + 2NO3— + 2Na+ + H2O — полное ионное уравнение реакции
2Ag+ + 2OH— = Ag2O + H2O — сокращенное ионное уравнение реакции
5. органические вещества (органические кислоты относят к малодиссоциирующим веществам)
CH3COOH + NaOH = CH3COONa + H2O
CH3COOH + Na+ + OH— = CH3COO— + Na+ + H2O — полное ионное уравнение реакции
CH3COOH + OH— = CH3COO— + H2O — сокращенное ионное уравнение реакции
Зачастую ионные химические реакции — это реакции обмена.
Если все участвующие в реакции вещества находятся в виде ионов, то связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Отличительной особенностью химических реакций ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
- в ЕГЭ это вопрос А23 — Реакции ионного обмена
- в ГИА (ОГЭ) это А8 — Реакции ионного обмена
Обсуждение: «Ионные химические реакции»
(Правила комментирования)
Загрузить PDF
Загрузить PDF
Ионные уравнения являются неотъемлемой частью химии. В них представлены лишь те компоненты, которые изменяются в ходе химической реакции. Чаще всего ионные уравнения используют для описания окислительно-восстановительных реакций, реакций обмена и нейтрализации.[1]
Чтобы записать ионное уравнение, необходимо выполнить три основных шага: сбалансировать молекулярное уравнение химической реакции, перевести его в полное ионное уравнение (то есть записать компоненты в том виде, в каком они существуют в растворе) и, наконец, записать краткое ионное уравнение.
-
1
Поймите разницу между молекулярными и ионными соединениями. Для записи ионного уравнения первым делом следует определить участвующие в реакции ионные соединения. Ионными называют те вещества, которые в водных растворах диссоциируют (распадаются) на заряженные ионы.[2]
Молекулярные соединения не распадаются на ионы. Они состоят из двух неметаллических элементов, и иногда их называют ковалентными соединениями.[3]
- Ионные соединения могут возникать между металлом и неметаллом, металлом и многоатомными ионами, либо между несколькими многоатомными ионами.
- Если вы сомневаетесь, к какой группе принадлежит то или иное соединение, посмотрите на свойства составляющих его элементов в таблице Менделеева.[4]
-
2
Определите растворимость соединения. Не все ионные соединения растворяются в водных растворах, то есть не все из них диссоциируют на отдельные ионы. Прежде чем приступить к записи уравнения, следует найти растворимость каждого соединения. Ниже приведены краткие правила растворимости. Более подробные сведения и исключения из правил можно найти в таблице растворимости.[5]
- Следуйте правилам в том порядке, в котором они приведены ниже:
- все соли Na+, K+ и NH4+ растворяются;
- все соли NO3—, C2H3O2—, ClO3— и ClO4— растворимы;
- все соли Ag+, Pb2+ и Hg22+ нерастворимы;
- все соли Cl—, Br— и I— растворяются;
- соли CO32-, O2-, S2-, OH—, PO43-, CrO42-, Cr2O72- и SO32- нерастворимы (за некоторыми исключениями);
- соли SO42- растворимы (за некоторыми исключениями).
-
3
Определите катион и анион соединения. Катионами называют положительно заряженные ионы (обычно это металлы). Анионы имеют отрицательный заряд, как правило это ионы неметаллов. Некоторые неметаллы могут образовывать не только анионы, но и катионы, в то время как атомы металлов всегда выступают в роли катионов.[6]
- Например, в соединении NaCl (поваренная соль) Na является положительно заряженным катионом, поскольку это металл, а Cl представляет собой отрицательно заряженный анион, так как это неметалл.
-
4
Определите участвующие в реакции многоатомные (сложные) ионы. Такие ионы представляют собой заряженные молекулы, между атомами которых существует такая сильная связь, что они не диссоциируют при химических реакциях.[7]
Необходимо выявить многоатомные ионы, поскольку они обладают своим зарядом и не распадаются на отдельные атомы. Многоатомные ионы могут иметь как положительный, так и отрицательный заряд.- При изучении общего курса химии вам, скорее всего, понадобится запомнить некоторые из наиболее распространенных многоатомных ионов.
- К наиболее распространенным многоатомным ионам относятся CO32-, NO3—, NO2—, SO42-, SO32-, ClO4— и ClO3—.[8]
- Существует множество других многоатомных ионов, которые можно найти в учебнике химии или интернете.[9]
Реклама
-
1
Сбалансируйте полное молекулярное уравнение. Прежде чем приступить к записи ионного уравнения, следует сбалансировать исходное молекулярное уравнение. Для этого необходимо расставить соответствующие коэффициенты перед соединениями, так чтобы число атомов каждого элемента в левой части равнялось их количеству в правой части уравнения.
- Запишите число атомов каждого элемента по обе стороны уравнения.
- Добавьте перед элементами (кроме кислорода и водорода) коэффициенты, так чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаковым.
- Сбалансируйте атомы водорода.
- Сбалансируйте атомы кислорода.
- Пересчитайте количество атомов каждого элемента по обе стороны уравнения и убедитесь, что оно одинаково.
- Например, после балансировки уравнения Cr + NiCl2 —> CrCl3 + Ni получаем 2Cr + 3NiCl2 —> 2CrCl3 + 3Ni.
-
2
Определите, в каком состоянии находится каждое вещество, которое участвует в реакции. Часто об этом можно судить по условию задачи. Есть определенные правила, которые помогают определить, в каком состоянии находится элемент или соединение.[10]
- Если в условии задачи не указано состояние того или иного элемента, используйте для его определения таблицу Менделеева.
- Если в условии сказано, что соединение находится в растворе, отметьте это (р-р).
- Если в уравнение входит вода, определите по таблице растворимости, диссоциирует ли данное ионное соединение.[11]
В случае высокой растворимости соединение диссоциирует в воде (р-р). Если соединение имеет низкую растворимость, оно останется в твердом виде (тв). - Если в реакции не участвует вода, ионное соединение останется в твердом виде (тв).
- Если в задаче фигурирует кислота или основание, они будут растворены в воде (р-р).
- В качестве примера рассмотрим реакцию 2Cr + 3NiCl2 —> 2CrCl3 + 3Ni. В чистом виде элементы Cr и Ni находятся в твердой фазе. NiCl2 и CrCl3 представляют собой растворимые ионные соединения, то есть они находятся в растворе. Таким образом, данное уравнение можно переписать в следующем виде: 2Cr(тв) + 3NiCl2(р-р) —> 2CrCl3(р-р) + 3Ni(тв).
-
3
Определите, какие соединения диссоциируют (разделяются на катионы и анионы) в растворе. При диссоциации соединение распадается на положительный (катион) и отрицательный (анион) компоненты. Эти компоненты затем войдут в ионное уравнение химической реакции.
- Не диссоциируют твердые тела, жидкости, газы, молекулярные соединения, ионные соединения с низкой растворимостью, многоатомные ионы и слабые кислоты.
- Полностью диссоциируют ионные соединения с высокой растворимостью (используйте таблицу растворимости) и сильные кислоты (HCl(р-р), HBr(р-р), HI(р-р), H2SO4(р-р), HClO4(р-р) и HNO3(р-р)).[12]
- Учтите, что хотя многоатомные ионы не диссоциируют, они могут входить в состав ионного соединения и отделиться от него в растворе.
-
4
Посчитайте заряд каждого диссоциировавшего иона. При этом помните, что металлы образуют положительно заряженные катионы, а атомы неметаллов превращаются в отрицательные анионы. Определите заряды элементов по таблице Менделеева. Необходимо также сбалансировать все заряды в нейтральных соединениях.
- В приведенном выше примере NiCl2 диссоциирует на Ni2+ и Cl—, а CrCl3 распадается на Cr3+ и Cl—.
- Ион никеля имеет заряд 2+, поскольку он соединен с двумя ионами хлора, каждый из которых имеет единичный отрицательный заряд. При этом один ион Ni должен сбалансировать два отрицательно заряженных иона Cl. Ион Cr имеет заряд 3+, так как он должен нейтрализовать три отрицательно заряженных иона Cl.
- Помните о том, что многоатомные ионы имеют свои собственные заряды.[13]
-
5
Перепишите уравнение так, чтобы все растворимые соединения были разделены на отдельные ионы. Все что диссоциирует или ионизируется (например, сильные кислоты) распадется на два отдельных иона. При этом вещество останется в растворенном состоянии (р-р). Проверьте, чтобы уравнение было сбалансировано.
- Твердые вещества, жидкости, газы, слабые кислоты и ионные соединения с низкой растворимостью не изменят своего состояния и не разделятся на ионы. Оставьте их в прежнем виде.
- Молекулярные соединения просто рассеются в растворе, и их состояние изменится на растворенное (р-р). Есть три молекулярных соединения, которые не перейдут в состояние (р-р), это CH4(г), C3H8(г) и C8H18(ж).
- Для рассматриваемой реакции полное ионное уравнение запишется в следующем виде: 2Cr(тв) + 3Ni2+(р-р) + 6Cl—(р-р) —> 2Cr3+(р-р) + 6Cl—(р-р) + 3Ni(тв). Если хлор не входит в состав соединения, он распадается на отдельные атомы, поэтому мы умножили количество ионов Cl на 6 с обеих сторон уравнения.
-
6
Сократите одинаковые ионы в левой и правой части уравнения. Можно вычеркнуть лишь те ионы, которые полностью идентичны с обеих сторон уравнения (имеют одинаковые заряды, нижние индексы и так далее). Перепишите уравнение без этих ионов.
- В нашем примере обе части уравнения содержат 6 ионов Cl—, которые можно вычеркнуть. Таким образом, получаем краткое ионное уравнение: 2Cr(тв) + 3Ni2+(р-р) —> 2Cr3+(р-р) + 3Ni(тв).
- Проверьте результат. Суммарные заряды левой и правой частей ионного уравнения должны быть равны.
Реклама
Советы
- Приучите себя всегда записывать агрегатное состояние всех компонентов во всех уравнениях химических реакций.
Реклама
Об этой статье
Эту страницу просматривали 72 262 раза.