Химические Уравнения онлайн!
Расширенный поиск
Или Попробуйте случайную реакцию
Реакции ионного обмена – это химические взаимодействия, в которых участвуют вещества, находящиеся в состоянии водных растворов. При этом степень окисления элементов, из которых они состоят, никогда не изменяется. Такие реакции проходят только с веществами, являющимися электролитами.
Это химические соединения, обладающие свойством проводить электрический ток.
В данных процессах реагирующие вещества обмениваются ионами друг с другом. Эти ионы образуют новые устойчивые связи.
Правило Бертолле
В соответствии с этим правилом можно определить, будет ли реакция ионного обмена протекать до конца. Такая реакция будет идти, если:
- образуется твердое вещество, являющееся практически нерастворимым (его легко обнаружить по выпавшему на дне пробирки осадку):
Ba(OH)2+H2SO4→BaSO4↓+2H2O;
- происходит образование летучего газообразного вещества (пузырьки газа всплывают из раствора на поверхность):
CaCO3+2HNO3→Ca(NO3)2+CO2↑+H2O;
- образуется хорошо растворяющееся в воде вещество, являющееся слабым малодиссоциирующим электролитом (также может образовываться вода, которая тоже относится к слабым электролитам):
3NaOH+H3PO4→Na3PO4+3H2O;
- происходит формирование комплексного иона (образуется комплексная соль):
2KOH+ZnO+H2O→K2[Zn(OH)4].
Для протекания реакции достаточно выполнения хотя бы одного из приведенных здесь условий. Если же не соблюдается ни одно условие, реакция в водном растворе так и не начнется.
Как составить ионное уравнение реакции
При составлении ионных уравнений необходимо учитывать, что:
- вещества, которые не растворяются в воде, не могут диссоциировать, т.е. в таком случае реакция ионного обмена начаться не может;
- вещества, относящиеся к малорастворимым, также присутствуют в растворах, находясь в них в виде ионов;
- если в процессе реакции образуется малорастворимое соединение, при записи уравнения в ионном виде оно условно считается нерастворимым;
- суммарные значения зарядов в левой и правой частях уравнения должны иметь одинаковую величину.
Составляя ионное уравнение, нужно всегда придерживаться следующей последовательности действий:
- Записать уравнение реакции в обычном, молекулярном виде. Чтобы правильно составить формулы образующихся соединений, необходимо к положительно заряженному иону одного реагирующего вещества (это начальный элемент его формулы) присоединить отрицательный ион другого вещества. Для оставшихся ионов следует проделать аналогичную операцию.
MgCl2+2AgNO3→2AgCl+Mg(NO3)2
- Используя таблицу растворимости, определить степень растворимости каждого соединения. Эти данные нужно получить для веществ из обеих частей уравнения.
MgCl2+2AgNO3→2AgCl+Mg(NO3)2
- Составить уравнение, которое отображает процесс диссоциации соединений, считающихся растворимыми. Это нужно сделать как для исходных компонентов, так и для конечных продуктов реакции.
MgCl2↔Mg2++2Cl—
AgNO3↔Ag++NO3—
AgCl – эта соль не диссоциирует, поскольку согласно данным, полученным из таблицы растворимости, она является нерастворимой:
Mg(NO3)2↔Mg2++2NO3—
- В соответствии с данными, полученными при выполнении предыдущего шага, составить полное ионное уравнение.
Mg2++2Cl—+2Ag++2NO3—→2AgCl↓+Mg2++2NO3—
- Записать ионное уравнение в сокращенном виде. Для этого достаточно просто убрать из левой и правой частей полного ионного уравнения совпадающие и одинаковые ионы.
Mg2++ 2Cl—+ 2Ag++2NO3— → 2AgCl↓+Mg2++2NO3—
Удалив все парные ионы, получим:
Ag++Cl—→AgCl↓
Ионное уравнение наглядно отображает сущность протекания реакции. В нем содержится информация, из которой можно узнать, что же на самом деле происходит в растворе. Что касается сокращенной записи ионного уравнения, то тут стоит отметить, что в виде одного и того же ионного уравнения может быть записано несколько реакций с разными веществами. Проиллюстрируем этот факт двумя примерами.
Примеры реакций ионного обмена
| Пример 1 | Пример 2 |
|---|---|
| HNO3+KOH→KNO3+H2O | 2HCl+Ba(OH)2→BaCl2+2H2O |
| H++NO3—+K++OH—→K++NO3—+H2O | 2H++2Cl—+Ba2++2OH—→Ba2++2Cl—+2H2O |
| H++OH—→H2O | H++OH—→H2O |
Данные примеры свидетельствуют, что химические процессы, наблюдающиеся в обеих случаях, схожи по своей сути.
Следует иметь в виду, что некоторые вещества при их растворении в воде начинают активно разлагаться. В частности, к ним относятся такие соли, как сульфид алюминия (Al2S3) и трехвалентный ацетат хрома (Cr(CH3COO)3). Это значит, что такие соединения в результате проведения реакций ионного обмена получить не удастся.
Тест по теме «Реакции ионного обмена»
Instructions
Enter an equation of an ionic chemical equation and press the Balance button.
The balanced equation will be calculated along with the solubility states, complete ionic equation, net ionic equation, spectator ions and precipitates.
- Use uppercase for the first character in the element and lowercase for the second character. Examples: Fe, Au, Co, Br, C, O, N, F.
- Replace immutable groups in compounds to avoid ambiguity. For example, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O will not be balanced, but XC2H5 + O2 = XOH + CO2 + H2O will.
- Compound states [like (s) (aq) or (g)] are not required.
- You can use parenthesis () or brackets [].
Перейти к содержанию
Калькулятор химических реакций
Автор Владислав Панарин На чтение 3 мин Просмотров 51.3к. Опубликовано 25.10.2022 Обновлено 12.12.2022
Вам также может понравиться
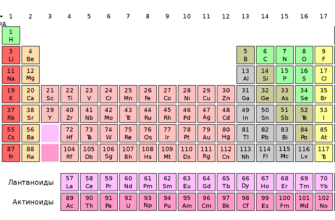
Интерактивная периодическая таблица (система) химических
01.9к.
Интерактивный калькулятор, позволяющий рассчитать молекулярную
03к.
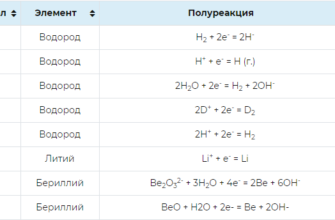
Стандартные окислительно-восстановительные потенциалы
075.5к.
Электрохимический ряд напряжений (активности) металлов —
017.9к.
Таблица растворимости — это наглядная таблица со списком
019.4к.
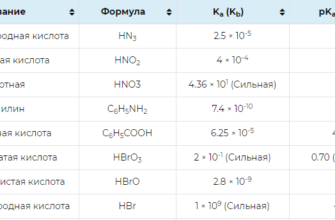
Константы диссоциации кислот и оснований в водных растворах.
0105к.
Длиннопериодная периодическая таблица (система) химических
011.8к.
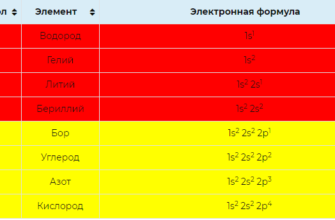
Электронные конфигурации атомов химических элементов.
075.6к.
Ионные химические реакции
02-Фев-2014 | комментария 3 | Лолита Окольнова
Ионные реакции — реакции между ионами в растворе
Давайте разберем основные ионные химические реакции неорганической и некоторые реакции органической химии.
Очень часто в различных заданиях по химии просят написать не только химические уравнения в молекулярной форме, но и в ионной (полные и сокращенные). Как уже было замечено, ионные химические реакции идут в растворах. Зачастую, вещества распадаются на ионы именно в воде.
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2NaOH + H2SO4 = Na2SO4 + 2H2O — молекулярное уравнение реакции
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O
OH— + H+ = H2O — сокращенное ионное уравнение реакции
По результатам этого сокращения одинаковых ионов видно, какие ионы образовали то, что нерастворимо или малорастворимо — газообразные продукты или реагенты, осадки или малодиссоциирующие вещества.
Не раскладывают на ионы в ионных химических реакциях вещества:
1. нерастворимые в воде соединения (или малорастворимые) (см. ТАБЛИЦЫ);
Ca(NO3)2 + 2NaOH = Ca(OH)2↓ + 2NaNO3
Сa2+ + 2NO3— + 2Na+ +2OH— = Ca(OH)2 + 2Na+ +2NO3— — полное ионное уравнение реакции
Сa2+ + 2OH— = Ca(OH)2 — сокращенное ионное уравнение реакции
2. газообразные вещества, например, O2, Cl2, NO и т.д.:
Na2S + 2HCl = 2NaCl + H2S
2Na+ + S-2 + 2H+ +2Cl— = 2Na+ + 2Cl— + H2S — полное ионное уравнение реакции
S-2 + 2H+ = H2S — сокращенное ионное уравнение реакции
3. малодиссоциирующие вещества (H2O, NH4OH);
реакция нейтрализации
OH— + H+ = H2O — сокращенное ионное уравнение реакции
4. оксиды (все: и образованные металлами, и неметаллами);
2AgNO3 + 2NaOH = Ag2O + 2NaNO3 + H2O
2Ag+ + 2NO3— + 2Na+ + 2OH— = Ag2O + 2NO3— + 2Na+ + H2O — полное ионное уравнение реакции
2Ag+ + 2OH— = Ag2O + H2O — сокращенное ионное уравнение реакции
5. органические вещества (органические кислоты относят к малодиссоциирующим веществам)
CH3COOH + NaOH = CH3COONa + H2O
CH3COOH + Na+ + OH— = CH3COO— + Na+ + H2O — полное ионное уравнение реакции
CH3COOH + OH— = CH3COO— + H2O — сокращенное ионное уравнение реакции
Зачастую ионные химические реакции — это реакции обмена.
Если все участвующие в реакции вещества находятся в виде ионов, то связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Отличительной особенностью химических реакций ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
- в ЕГЭ это вопрос А23 — Реакции ионного обмена
- в ГИА (ОГЭ) это А8 — Реакции ионного обмена
Обсуждение: «Ионные химические реакции»
(Правила комментирования)