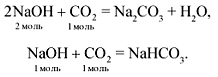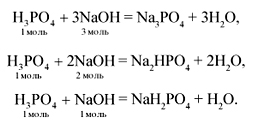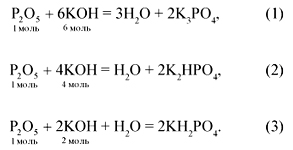Особенности взаимодействия кислых солей со щелочами.
Достаточно часто возникают затруднения при записи реакций кислых солей со щелочами. Ниже рассмотрим основные закономерности подобных взаимодействий. Под кислыми солями подразумеваем соли, в которых остались атомы водорода, способные к замещению на катионы металлов или аммония. Отсюда первый вывод: при добавлении щелочи водород в составе «кислого» аниона будет замещаться с образованием среднего аниона. По такой схеме будут идти простейшие примеры 1) и 2):
1) NaHCO3 + NaOH = Na2CO3 + H2O
Na+ + HCO3− + Na+ + OH− = 2Na+ + CO32- + H2O
HCO3− + OH− = CO32- + H2O
2) LiHS + LiOH = Li2S + H2O
Li+ + HS− + Li+ + OH− = 2Li+ + S2- + H2O
HS− + OH− = S2- + H2O
При рассмотрении солей фосфорной кислоты будут возникать дополнительные варианты за счет образования двух видов кислых солей: гидрофосфатов и дигидрофосфатов. Тут следует обращать внимание на избыток/недостаток соли, либо щелочи. Сравните примеры 3) и 4):
3) NaH2PO4(изб.) + NaOH = Na2HPO4 + H2O
Na+ + H2PO4− + Na+ + OH− = 2Na+ + HPO42- + H2O
H2PO4− + OH− = HPO42- + H2O
Щелочи в примере 3) мало, не хватает для полного замещения атомов водорода в кислой соли.
4) NaH2PO4 + 2NaOH(изб.) = Na3PO4 + 2H2O
Na+ + H2PO4− + 2Na+ + 2OH− = 3Na+ + PO43- + 2H2O
H2PO4− + 2OH− = PO43- + 2H2O
В примере 4) щелочи много, заместит все возможные атомы водорода в кислой соли.
Значительно больше сложностей возникает при взаимодействии кислой соли и щелочи с разными катионами. Здесь все так же сперва происходит превращение кислого аниона в средний, а далее возможен обмен катионами. Влиять на такой обмен будет природа катионов, растворимость соответствующих средних солей, а также избыток/недостаток соли, либо щелочи. Рассмотрим возможные комбинации для солей двухосновной кислоты, например, угольной:
5) 2KHCO3(изб.) + Ba(OH)2 = K2CO3 + BaCO3 + 2H2O
2K+ + 2HCO3− + Ba2+ + 2OH− = 2K+ + CO32- + BaCO3 + 2H2O
2HCO3− + Ba2+ + 2OH− = CO32- + BaCO3 + 2H2O
В описании задания случай 5) можно охарактеризовать фразой «в образовавшемся растворе практически отсутствовали гидроксид-ионы», что вполне понятно из ионного уравнения.
6) KHCO3 + Ba(OH)2(изб.) = KOH + BaCO3 + H2O
K+ + HCO3− + Ba2+ + 2OH− = K+ + OH− + BaCO3 + H2O
HCO3− + Ba2+ + OH− = BaCO3 + H2O
Для случая 6) можно записать «в образовавшемся растворе практически отсутствовали карбонат-ионы», что вполне понятно, поскольку они полностью перешли в состав осадка карбоната бария.
Различие в примерах 5) и 6) легко понять, если представить, что карбонат калия, образовавшийся на первой стадии, может далее вступить в обмен с избытком гидроксида бария.
Теперь давайте поменяем местами исходные катионы и убедимся, что тогда реакция может пойти единственным образом:
7) Ba(HCO3)2 + 2KOH = K2CO3 + BaCO3 + 2H2O
Ba2+ + 2HCO3− + 2K+ + 2OH− = 2K+ + CO32- + BaCO3 + 2H2O
2HCO3− + Ba2+ + 2OH− = CO32- + BaCO3 + 2H2O
Почему невозможен вариант с получением гидроксида бария по аналогии со случаем 6)? Потому что карбонат бария уже является осадком и в дальнейшее взаимодействие с гидроксидом калия не вступает:
BaCO3 + KOH – нет реакции
Схожие рассуждения можно применить и для реакций с участием трехосновной фосфорной кислоты. Там так же будет больше вариантов протекания, если исходим из соли щелочного металла и щелочи, содержащей щелочноземельный металл:

12Cs+ + 6HPO42- + 3Ca2+ + 6OH− = 12Cs+ + 4PO43- + Ca3(PO4)2 + 6H2O
6HPO42- + 3Ca2+ + 6OH− = 4PO43- + Ca3(PO4)2 + 6H2O
Вариант 
9) 2Cs2HPO4 + 3Ca(OH)2(изб.) = 4CsOH + Ca3(PO4)2 + 2H2O
4Cs+ + 2HPO42- + 3Ca2+ + 6OH− = 4Cs+ + 4OH− + Ca3(PO4)2 + 2H2O
2HPO42- + 3Ca2+ + 2OH− = Ca3(PO4)2 + 2H2O
Вариант 9) с образованием соли и щелочи, по формулировке «в образовавшемся растворе практически отсутствовали фосфат-ионы». Гидроксида кальция взяли много, все фосфат-ионы перешли в осадок.
Если взять изначально соль щелочноземельного металла и гидроксид щелочного, то вариант будет только один:
10) 3CaHPO4 + 3CsOH(изб.) = Cs3PO4 + Ca3(PO4)2 + 3H2O
3CaHPO4 + 3 Cs+ + 3OH− = 3Cs+ + PO43- + Ca3(PO4)2 + 3H2O
3CaHPO4 + 3OH− = PO43- + Ca3(PO4)2 + 3H2O
Причина отсутствия гидроксида кальция в продуктах по аналогии с пунктом 7) – нерастворимость промежуточно образовавшегося фосфата кальция и отсутствие обмена с ним:
Ca3(PO4)2 + CsOH – нет реакции
Реакции с дигидрофосфатами будут идти по аналогичным схемам и приводить к двум солям, либо соли и щелочи. Рассмотрим два примера из числа возможных:
11) 2KH2PO4 + 3Sr(OH)2(изб.) = Sr3(PO4)2 + 2KOH + 4H2O
2K+ + 2H2PO4− + 3Sr2+ + 6OH− = Sr3(PO4)2 + 2K+ + 2OH− + 4H2O
2H2PO4− + 3Sr2+ + 4OH− = Sr3(PO4)2 + 4H2O
Весь фосфат перешел в осадок.
12) 3Sr(H2PO4)2 + 12KOH(изб.) = Sr3(PO4)2 + 4K3PO4 + 12H2O
3Sr2+ + 6H2PO4− + 12K+ + 12OH− = Sr3(PO4)2 + 12K+ + 4PO43- + 12H2O
3Sr2+ + 6H2PO4− + 12OH− = Sr3(PO4)2 + 4PO43- + 12H2O
Часть фосфата перешла в осадок, новый гидроксид образоваться не может.
Реакции ионного обмена (РИО)
РИО – это необратимые реакции, протекающие в растворах электролитов. Реакции протекают без изменения степени окисления атомов,
входящих в состав соединений.
Сущность реакции в растворах электролитов выражается ионным уравнением.
•В водном растворе сильные электролиты присутствуют в виде ионов.
•Слабые электролиты, малорастворимые и летучие вещества записываются в молекулярной форме.
Растворимость электролита в воде нельзя использовать как критерий его силы. Многие нерастворимые в воде соли, являются сильными электролитами, но концентрация ионов в растворе оказывается очень низкой именно вследствие их низкой растворимости. Поэтому
малорастворимые вещества записываются в недиссоциированной форме.
Примеры
Na2SO4 = 2Na+ + SO42- сильный электролит ( растворимая соль)
Ba(OH)2 = Ba2+ + 2OH— — сильный электролит (основание с высокой растворимостью)
BaSO4↓- сильный электролит ( нерастворимая соль)
Zn(OH)2 ↓ — малорастворимое слабое основание NH4OH – растворимое слабое основание
H3PO4 , HCN, CH3COOH и др. – растворимые слабые кислоты
СO2↑, H2S ↑ и др. – летучие вещества.
Реакции в растворах электролитов протекают в направлении связывания ионов.
Существует несколько форм связывания ионов:
1. Образование осадка
2.Выделение газа
3.Образование слабого электролита.
· ·
1. Образование осадка:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl.
Ba2++2Cl— + 2Na++ SO42-→ BaSO4↓ + 2Na++2Cl— — полное ионное
уравнение
Ba2+ + SO42-→ BaSO4↓ — сокращенное ионное уравнение.
Сокращенное ионное уравнение показывает, что при взаимодействии любого растворимого соединения, содержащего ион Ba2+, с соединением, содержащим карбонат- анион SO42-, в результате получится нерастворимый осадок
BaSO4 ↓.
Ba(NO3)2 + H2SO4 = BaSO4↓ + HNO3
Ba2+ + 2NO3— + 2H+ + SO42- = BaSO4↓ + 2NO3— + 2H+ Ba2+ + SO42-→ BaSO4↓
Сокращенное ионное уравнение идентично для обеих реакций!
2. Выделение газа:
Na2CO3 +H2SO4 → Na2SO4 + H2O + CO2↑
2Na+ + CO32- +2H++ SO42- → 2Na+ + SO42- + H2O + CO2↑ полное ионное уравнение
2H+ + CO32- → H2O + CO2↑ сокращенное ионное уравнение.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
2Na+ + CO32- +2H++ 2Cl— = 2Na+ ++ 2Cl— + H2O + CO2↑
2H+ + CO32- → H2O + CO2↑ сокращенное ионное уравнение.
3. Образование слабого электролита:
Реакция нейтрализации
KOH + HBr → KBr + H2O
K+ + OH— + H+ + Br— → K+ + Br— + H2O полное ионное уравнение
OH— + H+ → H2O — сокращенное ионное уравнение
Реакция протекает между сильным основанием и сильной кислотой. 2NaOH + H2SO4 = Na2SO4 + 2H2O
2Na+ + 2OH— + 2H+ + SO42- = 2Na+ + SO42- + 2H2O OH— + H+ → H2O — сокращенное ионное уравнение
3. Образование слабого электролита: Другие растворимые слабые электролиты
• Слабые растворимые кислоты
NaNO2 + HCl = NaCl + HNO2
Na+ + NO2— + H+ + Cl— = HNO2 + Na+ + Cl—
H+ + NO2— = HNO2 •2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4
2CH3COO— + SO42-+ 2H+ + 2Na+ = 2CH3COOH + SO42- + 2Na+
CH3COO— + H+ = CH3COOH
• Слабые растворимые основания
NH4Cl + NaOH = NH4OH + NaCl
NH4+ + Cl— + Na+ + OH— = NH4OH + Cl— + Na+
NH4+ + OH— = NH4OH
Ионные реакции в растворах кислых солей
•NaHCO3 + HCl = NaCl + H2O + CO2↑ — молекулярное, Na+ +HCO3— +H+ +Cl— =Na+ +Cl— +H2O+CO2 ↑ — полное
ионное,
HCO3— + H+ = H2O+CO2 ↑ — сокращенное ионное
• NaHCO3 + NaOH = Na2CO3 + H2O
Na+ + HCO3— + Na+ + OH— = Na+ + CO32- + H2O
HCO3— + OH— = CO32- + H2O
Кислотный остаток в растворе кислой соли записывается в виде иона кислой соли, отщепления иона водорода не происходит, потому что кислая соль образована анионом слабой кислоты.
Ионные реакции в растворах основных солей
Основные соли, как правило, нерастворимы в воде
При ступенчатом взаимодействии средних солей многозарядных катионов с основаниями сначала образуется основная соль
CuCl2 + NaOH = CuOHCl ↓ + NaCl
Ионная реакция
Cu2+ + 2Cl— + Na+ + OH— = СuOHCl ↓ + Na+ + Cl— Сокращенное ионное уравнение
Cu2+ + Cl— + Na+ + OH— = СuOHCl ↓ + Na+ 1.Взаимодействие основных солей со щелочами
CuOHCl↓ + NaOH = Cu(OH)2 ↓ + NaCl CuOHCl↓ + Na+ + OH— = Cu(OH)2↓+ Na+ + Cl—
Сокращенное ионное уравнение
CuOHCl↓ + OH— = Cu(OH)2↓+ Cl— — образуется гидроксид
2.Взаимодействие основных солей с кислотами
2CuOHCl↓ + H2SO4 = CuSO4 ↓ + CuCl2 + 2H2O
Ионная реакция
2CuOHCl↓+2H+ + SO42- = 2Cu2+ + SO42- + 2Cl— + 2H2O
Сокращенное ионное уравнение
2CuOHCl↓+2H+ = 2Cu2+ + 2Cl— + H2O – образуется средняя соль.
Реакции амфотерных гидроксидов
Zn(OH)2+NaOH = Na2[Zn(OH)4]
Ионное уравнение
Zn(OH)2+ 2Na+ + 2OH— = 2Na+ + [Zn(OH)4]2-
Сокращенное ионное уравнение Zn(OH)2+ 2OH— = [Zn(OH)4]2-
Для пояснения характеристики «амфотерный гидроксид» модель таких реакций записывают следующим образом:
Zn(OH)2 – основная форма
H2ZnO2 – кислая форма
Реакция кислой формы со щелочами H2ZnO2+2NaOH= Na2ZnO2+2H2O
Ионная реакция
H2ZnO2 +2Na+ + 2OH— = 2H2O + ZnO22- + 2Na+
Сокращенное ионное уравнение
H2ZnO2 + 2OH— = H2O + ZnO22-
Соседние файлы в предмете Химия
- #
- #
- #
- #
- #
- #
- #
- #
- #
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–
2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K2CO3 + H2O
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4
6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Все нитраты:
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20
8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль кислая
соль; например:
K2СО3 KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) :
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, 1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)• = 120 (г)•0,09 = 10,8 г.
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
(H3PO4)
= 1 +
2 = 0,11 + 0,04 = 0,15
моль.
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
(H3PO4)
: (NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M• = 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: (KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
(P2O5):
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
(P2O5):
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
(P2O5):
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P2O5)
= 0,1 моль.
m(KOH) = •m(р-ра)
= 0,084•200 (г) = 16,8 г,
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
(Р2О5):
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим (Р2О5)
в уравнении (2) как х моль, а (Р2О5) в уравнении (3)
как у моль, тогда потребуется: (KОН) = 4х + 2у.
Составим систему уравнений:
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
(P2O5)2
= 0,05 моль —> (K2НРО4)
= 0,1 моль,
(Р2О5)3
= 0,05 моль —> (KН2РО4)
= 0,1 моль.
Ответ: (K2НРО4) = 0,1 моль,
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, (Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, (NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ((NH4)2HPO4) = 43,8 %,
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Реакции ионного обмена
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Реакции ионного обмена – наиболее знакомая для большинства людей тема из курса химии. H2O, H2SO4, C2H5OH и то, что реакция идет, если выделяется газ, осадок или вода – вот «багаж знаний», которым обладает среднестатистический выпускник.
На самом деле все, конечно, несколько сложнее. Рассмотрим вопрос подробнее.
Реакции обмена – это процессы вида AB + CD → AD + CB, в которых участвуют оксиды и гидроксиды, обладающие кислотными или основными свойствами (амфотерные соединения могут выступать как в роли кислоты, так и в роди основания), а так же соли.
1) Взаимодействие основного или амфотерного (оксида или гидроксида) с кислотным называется реакцией нейтрализации. Но не каждая пара кислота + основание вступают в реакцию друг с другом.
а) Растворимые гидроксиды – щелочи и гидроксид аммония – взаимодействуют с любой кислотой и кислотным оксидом. Для нерастворимой кремниевой кислоты реакция возможна только при нагревании.
NaOH + HCl → NaCl + H2O
LiOH + CH3COOH → CH3COOLi + H2O
Ba(OH)2 + CO2 → BaCO3↓ + H2O .
Также щелочи взаимодействуют с амфотерными оксидами и гидрокидами с образованием комплексных солей (в растворе) и смешанных оксидов, которые можно отнести и к классу солей (при сплавлении):
б) Нерастворимые основания и амфотерные гидроксиды не взаимодействуют со слабыми кислотами. Правило, действующее в большинстве случаев: реакция протекает, если предполагаемый продукт растворим. Исключение – взаимодействие с фосфорной кислотой, с ней реагируют даже оксиды и гидроксиды металлов, образующих нерастворимые ортофосфаты.
Mg(OH)2 + 2HCL → MgCl2 + 2H2O
Ag2 O+2CH3COOH → 2CH3COOAg+H2O
CuO + H2S реакция не идет, так как H2S – слабая кислота и сульфид меди нерастворим.
2) Обменные процессы с участием солей:
а) Растворимые соли взаимодействуют с другими растворимыми солями и гидроксидами, если в результате образуется газ или осадок:
2Na3PO4+3CuSO4 → 3Na2SO4+Cu3(PO4)2↓
FeCl3+3NaOH → 3NaCl+Fe(OH)3↓
BaSO4 + K2CO3 реакция не идет, так как реагент сульфат бария нерастворим
MnSO4 + KNO3 реакция не идет, так как не образуется ни газа, ни осадка, ни малодиссоциирующего вещества.
б) Соли взаимодействуют с кислотами, если в результате сильная кислота может вытеснить из соли слабую или нелетучая ‑ летучую:
CH3COONa + HCl → NaCl+CH3COOH
CaCO3 + H2SO4 → CaSO4 + H2O + CO2↑
CaSO4 + HCl реакция не идет, так как серная кислота – сильная и вытеснить ее из соли другой кислотой нельзя.
в) Соли многоосновных кислот взаимодейсвуют с той же кислотой с образованием кислых солей:
CaCO3 + H2O + CO2 → Ca(HCO3 )2
г) Растворимые кислые соли нейтрализуются щелочами:
KHCO3 + KOH → K2CO3 + H2O
Итого:
если вещество растворимо, оно легко вступает в реакцию обмена.
Если же нерастворимо, то оно вступает в обменный процесс только в агрессивной среде: сильная кислота или щелочь (только для амфотерных соединений).
Потренируйтесь:
Закончить уравнения реакций ионного обмена (внимание, идут не все реакции!)
MgCl2 + AgNO3 →
ZnSO4 + Ba(NO3)2 →
K2SO3 + H3PO4 →
CaSO4 + BaCl2 →
NaOH + ZnCl2 →
Li2SO4 + CuCl2 →
NH4NO3 + KOH →
MgO+HCl →
Ba(OH)2 + SO3→
BaCl2 + HCl →
NH4Br + AgNO3 →
Cu(NO3)2 + Rb2S →
(NH4)2SO4 + NaCl→
CaCO3 + H2O + CO2 →
HCl + NaOH →
H2SiO3 + NaOH →
MnHPO4 + NaOH →
Na2SO4 + H2SO4 →
Fe(NO3)2 + K2S→
NaHCO3 + NaOH →
KCl + ….. → KNO3 + ……
ZnSO4 + …… → ZnCl2 + …..
Ba(NO3)2 + ….. → KNO3 + …..
LiCl + ….. → NaCl + …..
HCl + ….. → CO2 + H2O + ….
Внимание! Идут не все реакции!
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Реакции ионного обмена» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
07.05.2023