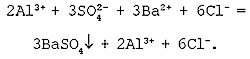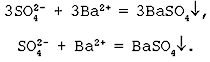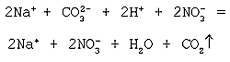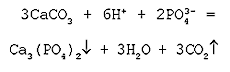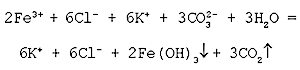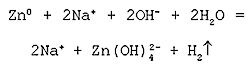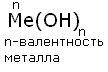Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации — вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl — ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br — (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая «обычные» (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl — . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо «виртуальных» молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы — катионы Na + и анионы Cl — . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH — = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH — c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку — 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O — молекулярное уравнение («обычное» уравнения, схематично отражающее суть реакции);
- H + + Cl — + Na + + OH — = Na + + Cl — + H 2 O — полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH — = H 2 O — краткое ионное уравнение (мы убрали весь «мусор» — частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем «в виде молекул».
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ — краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия — это две соли. Заглянем в раздел справочника «Свойства неорганических соединений». Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в «молекулярной форме» (о причинах этого — чуть позже!) Получаем следующее:
Ba 2+ + 2Cl — + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl — + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl — . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник — раздел «Свойства неорганических соединений». Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% — это некоторые «специфические» реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника «Названия кислот и солей».
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме «Химические свойства основных классов неорганических соединений».
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие — оставить в «молекулярной форме». Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин «все остальные вещества», и которые, следуя примеру героя известного фильма, требуют «огласить полный список» даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение — растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) — нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие — в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) — нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl — сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 — растворимая соль. Записываем в ионной форме. Вода — только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl — = Cu 2+ + 2Cl — + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода — типичный кислотный оксид, NaOH — щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 — оксид, газообразное соединение; сохраняем молекулярную форму. NaOH — сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 — растворимая соль; пишем в виде ионов. Вода — слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH — = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка — это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl — = ZnS↓ + 2Na + + 2Cl — .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Например, нитрат серебра взаимодействует с бромидом калия
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3 — , Н2РО4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
- Комплексные катионы и анионы: [Al(OH)4] —
Например, взаимодействие сульфида цинка и серной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
Например, взаимодействие гидрокарбоната натрия и гидроксида натрия
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Реакции ионного обмена и
условия их протекания до конца
В курсе химии средней школы первоначальное знакомство с реакциями обмена у школьников происходит в 8-м классе. Здесь дается понятие реакций обмена как реакций, при которых два сложных вещества обмениваются своими составными частями. А уже в курсе химии 9-го класса акцентируется внимание учащихся на том, что это тип реакций, протекающих без изменения степеней окисления элементов у веществ. В нашей школе химия преподается по учебнику Ф.Г.Фельдмана и Г.Е.Рудзитиса, естественно, с дополнительным включением всех недостающих тем и вопросов в соответствии с госстандартом. Для облегчения работы с материалами курса «Химия-9» я уже в 8-м классе изучаю этот материал в полном объеме, с подробным разбором сложных примеров реакций ионного обмена. А сэкономленное время использую в 9-м классе на изучение органической химии (хотя считаю введение ее в программу на этой ступени изучения химии нецелесообразным).
Предлагаю свой вариант изложения этой темы в 8-м классе с большим числом примеров и трехуровневой проверочной работой.
Правила написания уравнений реакций в ионном виде
Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ, обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
Условия, при которых реакции ионного обмена
протекают до конца
1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O.
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 + 6H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2.
Полное ионное уравнение реакции:
Cu 2+ + 2Cl – + 2K + + 2OH – = 2K + + 2Cl – + Cu(OH)2.
Cокращенное ионное уравнение реакции:
Cu 2+ + 2OH – = Cu(OH)2.
Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 + 3BaCl2 = 3BaSO4 + 2AlCl3.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 + H3PO4 = FePO4 + 3H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
3. Если в результате реакции выделяется газообразное вещество.
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S.
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S.
Cокращенное ионное уравнение реакции:
S 2– + 2H + = H2S.
Молекулярное уравнение реакции растворимой соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода(IV).
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2 + 3H2O + 3CO2
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Запись сложных химических уравнений реакций в ионном виде
Молекулярное уравнение реакции обмена с участием воды:
2FeCl3 + 3K2CO3 + 3H2O = 6KCl + 2Fe(ОН)3 + 3СО2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Данная реакция ионного обмена протекает до конца, о чем свидетельствуют сразу два признака: выделение газа и образование осадка.
Молекулярное уравнение реакции металлического цинка с водной щелочью:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции амфотерного оксида с водной щелочью:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции нерастворимого карбоната с растворимой в воде солью:
СaCO3 + CuCl2 + H2O = Cu(OH)2 + CaCl2 + CO2
Полное ионное уравнение реакции:
СaCO3 + Cu 2+ + 2Cl – + H2O = Cu(OH)2+ Ca 2+ + 2Cl – + CO2
Cокращенное ионное уравнение реакции:
СaCO3 + Cu 2+ + H2O = Cu(OH)2 + Ca 2+ + CO2
Проверочная работа по теме «Ионный обмен»
Вариант на оценку «5»
1. Приведите полные ионные и молекулярные уравнения реакций, соответствующие сокращенным ионным уравнениям:
ZnO + 2H + = Zn 2+ + H2O,
Ag + + Cl – = AlCl,
2. Приведите по одному примеру реакции ионного обмена, протекающей до конца с: а) выделением воды; б) образованием осадка; в) одновременным выделением газа и воды.
Вариант на оценку «4»
1. Напишите в молекулярном, полном и сокращенном ионных видах следующие уравнения реакций:
2. Приведите пример реакции, для которой полное ионное уравнение совпадает с сокращенным.
Вариант на оценку «3»
1. Назовите условия, при которых реакции ионного обмена протекают до конца, приведите по одному примеру на каждое условие.
2. Покажите на конкретных примерах, что реакции ионного обмена не являются окислительно-восстановительными.
ЛИТЕРАТУРА
Рудзитис Г.Е., Фельдман Ф.Г. Химия-8, 9. М.: Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1988;
Макареня А.А. Повторим химию. М.: Высшая школа, 1989;
Романцева Л.М. Сборник задач и упражнений по общей химии. М.: Высшая школа, 1991.
В.А.ДЕМИДОВ,
учитель химии
Синегорской средней школы
(Нагорский р-н, Кировская обл.)
http://chemege.ru/reakcii-ionnogo-obmena/
http://him.1sept.ru/article.php?ID=200300207
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
HNO3 + KOH = KNO3 + H2O (1)
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O (2)
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3− и K+ . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H+ и OH− в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
H+ + NO3− + K+ + OH‑ = K+ + NO3− + H2O
мы получим:
H+ + OH‑ = H2O (3)
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
2HCl+ Ba(OH)2 = BaCl2 + 2H2O
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H+ + 2Cl− + Ba2+ + 2OH− = Ba2+ + 2Cl− + 2H2O
Сократим одинаковые ионы слева и справа и получим:
2H+ + 2OH− = 2H2O
Разделив и левую и правую часть на 2, получим:
H+ + OH− = H2O,
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
2Fe(OH)3+ 3H2SO4 = Fe2(SO4)3 + 6H2O
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
Сократив сульфат-ионы слева и справа, получаем:
2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na+ + CO32- + Ca2+ + 2Cl− = CaCO3↓+ 2Na+ + 2Cl−
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
CO32- + Ca2+ = CaCO3↓
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
CuS + Fe(NO3)2 ≠ FeS + Cu(NO3)2
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
А вот, например,
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
Cu(OH)2 + Na2S – не протекает,
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
2NaOH + Cu(NO3)2 = Cu(OH)2 ↓+ 2NaNO3
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
Другими словами:
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
K2S + 2HBr = 2KBr + H2S↑
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
H2CO3 = H2O + CO2 ↑
«NH4OH» = H2O + NH3 ↑
H2SO3 = H2O + SO2 ↑
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
NH4NO3 + KOH = KNO3 + H2O + NH3 ↑
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
K2S + 2HBr = 2KBr + H2S↑
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K+ + S2- + 2H+ + 2Br— = 2K+ + 2Br— + H2S↑
Сократив одинаковые ионы получаем:
S2- + 2H+ = H2S↑
2) Для уравнения:
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
2Na+ + CO32- + 2H + + SO42- = 2Na+ + SO42 + H2O + CO2 ↑
CO32- + 2H + = H2O + CO2↑
3) для уравнения:
NH4NO3 + KOH = KNO3 + H2O + NH3↑
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
NH4+ + NO3−+ K+ + OH− = K+ + NO3− + H2O + NH3↑
NH4+ + OH− = H2O + NH3↑
Для уравнения:
Na2SO3 + 2HCl = 2NaCl + H2O + SO2 ↑
Полное и сокращенное уравнение будут иметь вид:
2Na+ + SO32- + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2O + SO2 ↑
SO32- + 2H+ = H2O + SO2 ↑
Тонкости взаимодействия кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрены в данной публикации.
переписка с читателем
Реакции ионного обмена и
условия их протекания до конца
В курсе химии средней школы первоначальное
знакомство с реакциями обмена у школьников
происходит в 8-м классе. Здесь дается понятие
реакций обмена как реакций, при которых два
сложных вещества обмениваются своими составными
частями. А уже в курсе химии 9-го класса
акцентируется внимание учащихся на том, что это
тип реакций, протекающих без изменения степеней
окисления элементов у веществ. В нашей школе
химия преподается по учебнику Ф.Г.Фельдмана и
Г.Е.Рудзитиса, естественно, с дополнительным
включением всех недостающих тем и вопросов в
соответствии с госстандартом. Для облегчения
работы с материалами курса «Химия-9» я уже в 8-м
классе изучаю этот материал в полном объеме, с
подробным разбором сложных примеров реакций
ионного обмена. А сэкономленное время использую
в 9-м классе на изучение органической химии (хотя
считаю введение ее в программу на этой ступени
изучения химии нецелесообразным).
Предлагаю свой вариант изложения этой темы в 8-м
классе с большим числом примеров и трехуровневой
проверочной работой.
Правила написания уравнений реакций в ионном
виде
Записывают формулы
веществ, вступивших в реакцию, ставят знак
«равно» и записывают формулы образовавшихся
веществ. Расставляют коэффициенты.
Пользуясь таблицей
растворимости, записывают в ионном виде формулы
веществ, обозначенных в таблице растворимости
буквой «Р» (хорошо растворимые в воде),
исключение – гидроксид кальция, который, хотя и
обозначен буквой «М», все же в водном растворе
хорошо диссоциирует на ионы.
Нужно помнить, что на ионы
не разлагаются металлы, оксиды металлов и
неметаллов, вода, газообразные вещества,
нерастворимые в воде соединения, обозначенные в
таблице растворимости буквой «Н». Формулы этих
веществ записывают в молекулярном виде. Получают
полное ионное уравнение.
Сокращают одинаковые ионы
до знака «равно» и после него в уравнении.
Получают сокращенное ионное уравнение.
Условия, при которых реакции ионного обмена
протекают до конца
1. Если в результате реакции выделяется
малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с
кислотой:
Неизменность степеней окисления элементов во
всех веществах до и после реакции говорит о том,
что реакции обмена не являются
окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl–
= K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
Молекулярное уравнение реакции основного
оксида с кислотой:
CaO + 2HNO3 = Ca(NO3)2 + H2O.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Молекулярное уравнение реакции
нерастворимого основания с кислотой:
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 + 6H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного
оксида с кислотой:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Полное ионное уравнение реакции:
Al2O3 + 6H+ + 6Cl–
= 2Al3+ + 6Cl– + 3H2O.
Cокращенное ионное уравнение реакции:
Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется
нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой
соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2.
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH–
= 2K+ + 2Cl– + Cu(OH)2.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2.
Молекулярное уравнение реакции двух
растворимых солей:
Al2(SO4)3 + 3BaCl2 = 3BaSO4 +
2AlCl3.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции
нерастворимого основания с кислотой:
Fe(OH)3 + H3PO4 = FePO4 + 3H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
реакции совпадает с сокращенным. Эта реакция
протекает до конца, о чем свидетельствуют сразу
два факта: образование вещества, нерастворимого
в воде, и выделение воды.
3. Если в результате реакции выделяется
газообразное вещество.
Молекулярное уравнение реакции растворимой
соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+
+ 2Cl– + H2S.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S.
Молекулярное уравнение реакции растворимой
соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O +
CO2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца
свидетельствуют два признака: выделение воды и
газа – оксида углерода(IV).
Молекулярное уравнение реакции
нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2 + 3H2O + 3CO2
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
реакции совпадает с сокращенным уравнением. Эта
реакция протекает до конца, о чем
свидетельствуют сразу три признака: выделение
газа, образование осадка и выделение воды.
Запись сложных химических уравнений реакций в
ионном виде
Молекулярное уравнение реакции обмена с
участием воды:
2FeCl3 + 3K2CO3 + 3H2O = 6KCl + 2Fe(ОН)3 + 3СО2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Данная реакция ионного обмена протекает до
конца, о чем свидетельствуют сразу два признака:
выделение газа и образование осадка.
Молекулярное уравнение реакции
металлического цинка с водной щелочью:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции амфотерного
оксида с водной щелочью:
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)6].
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции
нерастворимого карбоната с растворимой в воде
солью:
СaCO3 + CuCl2 + H2O = Cu(OH)2 + CaCl2 + CO2
Полное ионное уравнение реакции:
СaCO3 + Cu2+ + 2Cl– + H2O =
Cu(OH)2+ Ca2+
+ 2Cl– + CO2
Cокращенное ионное уравнение реакции:
СaCO3 + Cu2+ + H2O = Cu(OH)2 + Ca2+ + CO2
Проверочная работа по теме «Ионный обмен»
Вариант на оценку «5»
1. Приведите полные ионные и молекулярные
уравнения реакций, соответствующие сокращенным
ионным уравнениям:
ZnO + 2H+ = Zn2+ + H2O,
3Na2O + 6H+ = 6Na+ + 3H2O,
Ag+ + Cl– = AlCl,
2. Приведите по одному примеру реакции ионного
обмена, протекающей до конца с: а) выделением
воды; б) образованием осадка; в) одновременным
выделением газа и воды.
Вариант на оценку «4»
1. Напишите в молекулярном, полном и сокращенном
ионных видах следующие уравнения реакций:
K2O + HNO3 = … ,
CaCO3 + HCl = … ,
Al(OH)3 + H3PO4 = … .
2. Приведите пример реакции, для которой полное
ионное уравнение совпадает с сокращенным.
Вариант на оценку «3»
1. Назовите условия, при которых реакции ионного
обмена протекают до конца, приведите по одному
примеру на каждое условие.
2. Покажите на конкретных примерах, что реакции
ионного обмена не являются
окислительно-восстановительными.
ЛИТЕРАТУРА
Рудзитис Г.Е., Фельдман Ф.Г. Химия-8, 9. М.:
Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1988;
Макареня А.А. Повторим химию. М.: Высшая
школа, 1989;
Романцева Л.М. Сборник задач и упражнений по
общей химии. М.: Высшая школа, 1991.
В.А.ДЕМИДОВ,
учитель химии
Синегорской средней школы
(Нагорский р-н, Кировская обл.)
Записывают формулы
веществ, вступивших в реакцию, ставят
знак «равно» и записывают формулы
образовавшихся веществ. Расставляют
коэффициенты.
Пользуясь таблицей
растворимости, записывают в ионном виде
формулы веществ, обозначенных в таблице
растворимости буквой «Р» (хорошо
растворимые в воде), исключение –
гидроксид кальция, который, хотя и
обозначен буквой «М», все же в водном
растворе хорошо диссоциирует на ионы.
Нужно помнить, что
на ионы не разлагаются металлы, оксиды
металлов и неметаллов, вода, газообразные
вещества, нерастворимые в воде соединения,
обозначенные в таблице растворимости
буквой «Н». Формулы этих веществ
записывают в молекулярном виде. Получают
полное ионное уравнение.
Сокращают одинаковые
ионы до знака «равно» и после него в
уравнении. Получают сокращенное ионное
уравнение.
Условия, при
которых реакции ионного обмена
протекают до
конца
1. Если в результате
реакции выделяется малодиссоциирующее
вещество – вода.
Молекулярное
уравнение реакции щелочи с кислотой:
Неизменность
степеней окисления элементов во всех
веществах до и после реакции говорит о
том, что реакции обмена не являются
окислительно-восстановительными.
Полное ионное
уравнение реакции:
K+
+ OH–
+ H+
+ Cl–
=
K+
+ Cl–
+ H2O.
Cокращенное ионное
уравнение реакции:
H+
+ OH– =
H2O.
2. Если в результате
реакции выделяется нерастворимое в
воде вещество.
Молекулярное
уравнение реакции растворимой соли со
щелочью:
CuCl2
+ 2KOH = 2KCl + Cu(OH)2.
Полное ионное
уравнение реакции:
Cu2+
+
2Cl–
+
2K+
+ 2OH–
=
2K+
+ 2Cl–
+ Cu(OH)2.
Cокращенное ионное
уравнение реакции:
Cu2+
+ 2OH–
= Cu(OH)2.
3. Если в результате
реакции выделяется газообразное
вещество.
Молекулярное
уравнение реакции растворимой соли
(сульфида) с кислотой:
K2S
+ 2HCl = 2KCl + H2S.
Полное ионное
уравнение реакции:
2K+
+ S2–
+ 2H+
+ 2Cl–
= 2K+
+ 2Cl–
+ H2S.
Cокращенное ионное
уравнение реакции:
S2–
+ 2H+
= H2S.
10) По химическим свойствам оксиды подразделяют на следующие типы:
основные — им
соответствуют основания;
амфотерные — им
соответствуют амфотерные гидроксиды,
которые сочетают свойства оснований и
кислот;
кислотные — им
соответствуют кислоты;
несолеобразующие
или безразличные— они не имеют своих
гидроксидов и не вступают в реакции
обмена (запомните их формулы: N2О,
NO, CO, SiO и др.);
вода — занимает
особое положение, по своим свойствам
она является одновременно и амфотерным,
и несолёобразующим оксидом.
Существуют
соединения элементов с кислородом,
которые не считаются оксидами. Например,
пероксид водорода Н2О2;
фторид кислорода OF2
— тоже не оксид.
Оксидами же
называются сложные вещества, состоящие
из двух элементов, один из которых
кислород, т.е. оксид — это соединение
элемента с кислородом.
Название оксидов
образуется от названия элемента,
входящего в состав оксида. Например,
BaO — оксид бария. Если образующий оксид
элемент имеет переменную валентность,
то после названия элемента в скобках
указывается его валентность римской
цифрой. Например, FeO — оксид железа (I),
Fe2О3
— оксид железа (III).
Элементы, обладающие
постоянной валентностью, образуют
только основные, кислотные или амфотерные
оксиды. Элементы с переменной валентностью
могут образовывать различные оксиды.
Все оксиды делятся
на солеобразующие и несолеобразующие.
Немногочисленные несолеобразующие
оксиды не взаимодействуют ни с кислотами,
ни с основаниями. К ним относятся оксид
азота N2O
(I), оксид азота NO (II).
По своим химическим
свойствам оксиды делятся на основные,
кислотные и амфотерные.
Основными называются
оксиды, которые образуют соли при
взаимодействии с кислотами или кислотными
оксидами:
CuO + H2SO4
= CuSO4
+ H2O
Растворимые в
воде основные оксиды вступают в реакцию
с водой, образуя основания:
CaO + H2O
= Ca(OH)2
Большинство
основных оксидов с водой не взаимодействуют,
но им также соответствуют основания,
которые можно получить косвенным путем.
Основные оксиды
реагируют с кислотными оксидами, образуя
соли:
Na2O
+ SO3
= Na2SO4
Кислотными
называются оксиды, которые образуют
соли при взаимодействии с основаниями
или основными оксидами. Кислотные оксиды
также называются ангидридами кислот.
Кислотными являются оксиды типичных
неметаллов, а также оксиды ряда металлов
в высших степенях окисления (B2O3;
N2O5).
Многие кислотные
оксиды соединяются с водой, образуя
кислоты:
N2O3
+ H2O
= 2HNO2
SO3
+ H2O
= H2SO4
Не все ангидриды
реагируют с водой, в этом случае
соответствующие им кислоты добываются
косвенным путем.
Кислотные оксиды
реагируют с основными оксидами с
образованием соли:
CO2
+ CaO = CaCO3
Кислотные оксиды
взаимодействуют с основаниями, образуя
соль и воду:
CO2
+ Ba(ОН)2=
BaCO3
+ H2O
Амфотерными
называются оксиды, которые образуют
соли при взаимодействии как с кислотами,
так и с основаниями. Соединения этих
оксидов с водой могут иметь кислотные
и основные свойства одновременно,
например — Al2O3,
Cr2O3,
MnO2;
Fe2O3
, ZnO. К примеру, амфотерный характер
оксида цинка проявляется при взаимодействии
его как с соляной кислотой, так и с
гидроксидом натрия:
ZnO + 2HCl = ZnCl2
+ H2O
ZnO + 2NaOH = Na2ZnO2
+ H2O
Так как далеко не
все амфотерные оксиды расворимы в воде,
то доказать амфотерность таких оксидов
заметно сложнее. Например, оксид алюминия
(III) в реакции сплавления его с дисульфатом
калия проявляет основные свойства, а
при сплавлении с гидроксидами кислотные:
Al2O3
+ 3K2S2O7
= 3K2SO4
+ A12(SO4)3
Al2O3
+ 2KOH = 2KAlO2
+ H2O
У различных
амфотерных оксидов двойственность
свойств может быть выражена в различной
степени. Например, оксид цинка одинаково
легко растворяется и в кислотах, и в
щелочах, а оксид железа (III) — Fe2O3
— обладает преимущественно основными
свойствами.
Способы получения
оксидов из простых веществ — это либо
прямая реакция элемента с кислородом:
2Ca + O2
= 2CaO
либо разложение
сложных веществ:
а) оксидов
4CrO3
= 2Cr2O3
+ 3O2
б) гидроксидов
Ca(OH)2
= CaO + H2O
в)
кислот
H2CO3
= H2O
+ CO2
г) солей
CaCO3
= CaO +CO2
А также взаимодействие
кислот — окислителей с металлами и
неметаллами:
Cu +
4HNO3(конц)
= Cu(NO3)
2
+ 2NO2
+ 2H2O
11) Кислота
– это сложные вещества, состоящие из
атомов водорода, способных замещаться
на атомы металла, и кислотных остатков.
С точки зрения
теории электролитической диссоциации,
кислота – это электролит , который при
растворении в воде диссоциирует на
катионы водорода и анион кислотного
остатка.
Кислоты классифицируют
по таким признакам: а) по наличию или
отсутствию кислорода в молекуле и б) по
числу атомов водорода.
По первому признаку
кислоты делятся на кислородсодержащие
и бескислородные (табл. 8-1).
Таблица 8-1.
Классификация кислот по составу.
|
Кислородсодержащие |
Бескислородные |
|
H2SO4 H2SO3 HNO3 H3PO4 H2CO3 H2SiO3 |
HF HCl HBr HI H2S |
По количеству
атомов водорода, способных замещаться
на металл, все кислоты делятся на
одноосновные (с одним атомом водорода),
двухосновные (с 2 атомами Н) и трехосновные
(с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2.
Классификация кислот по числу атомов
водорода.
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 HF HCl HBr HI |
H2SO4 H2SO3 H2S H2CO3 H2SiO3 |
H3PO4 |
** Термин «одноосновная
кислота» возник потому, что для
нейтрализации одной молекулы такой
кислоты требуется «одно основание»,
т.е. одна молекула какого-либо простейшего
основания типа NaOH или KOH:
HNO3
+
NaOH = NaNO3
+
H2O
HCl + KOH =
KCl + H2O
Двухосновная
кислота требует для своей нейтрализации
уже «два основания», а трехосновная
– «три основания»:
H2SO4
+ 2 NaOH = Na2SO4
+ 2 H2O
H3PO4
+ 3 NaOH = Na3PO4
+ 3 H2O
Рассмотрим важнейшие
химические свойства кислот.
1. Действие растворов
кислот на индикаторы. Практически все
кислоты (кроме кремниевой) хорошо
растворимы в воде. Растворы кислот в
воде изменяют окраску специальных
веществ – индикаторов. По окраске
индикаторов определяют присутствие
кислоты. Индикатор лакмус окрашивается
растворами кислот в красный цвет,
индикатор метиловый оранжевый – тоже
в красный цвет.
Индикаторы
представляют собой вещества сложного
строения. В растворах оснований и в
нейтральных растворах они имеют иную
окраску, чем в растворах кислот. Об
индикаторах мы более подробно расскажем
в следующем параграфе на примере их
реакций с основаниями.
2. Взаимодействие
кислот с основаниями. Эта реакция, как
вы уже знаете, называется реакцией
нейтрализации. Кислота реагируют с
основанием с образованием соли, в которой
всегда в неизменном виде обнаруживается
кислотный остаток. Вторым продуктом
реакции нейтрализации обязательно
является вода.
Для реакций
нейтрализации достаточно, чтобы хотя
бы одно из реагирующих веществ было
растворимо в воде. Поскольку практически
все кислоты растворимы в воде, они
вступают в реакции нейтрализации не
только с растворимыми, но и с нерастворимыми
основаниями. Исключением является
кремниевая кислота, которая плохо
растворима в воде и поэтому может
реагировать только с растворимыми
основаниями – такими как NaOH и KOH: H2SiO3
+ 2 NaOH = Na2SiO3
+ 2H2O
3. Взаимодействие
кислот с основными оксидами. Поскольку
основные оксиды – ближайшие родственники
оснований – с ними кислоты также вступают
в реакции нейтрализации:
Как и в случае
реакций с основаниями, с основными
оксидами кислоты образуют соль и воду.
Соль содержит кислотный остаток той
кислоты, которая использовалась в
реакции нейтрализации.
Например, фосфорную
кислоту используют для очистки железа
от ржавчины (оксидов железа). Фосфорная
кислота, убирая с поверхности металла
его оксид, с самим железом реагирует
очень медленно. Оксид железа превращается
в растворимую соль FePO4,
которую смывают водой вместе с остатками
кислоты.
4. Взаимодействие
кислот с металлами. Как мы видим из
предыдущего примера, для взаимодействия
кислот с металлом должны выполняться
некоторые условия (в отличие от реакций
кислот с основаниями и основными
оксидами, которые идут практически
всегда).
Во-первых, металл
должен быть достаточно активным
(реакционноспособным) по отношению к
кислотам. Например, золото, серебро,
ртуть и некоторые другие металлы с
кислотами не реагируют. Такие металлы
как натрий, кальций, цинк – напротив –
реагируют очень активно с выделением
газообразного водорода и большого
количества тепла. По реакционной
способности в отношении кислот все
металлы располагаются в ряд активности
металлов (табл. 8-3). Слева находятся
наиболее активные металлы, справа –
неактивные. Чем левее находится металл
в ряду активности, тем интенсивнее он
взаимодействует с кислотами
Табл. 8-3. Ряд
активности металлов.
|
Металлы, |
Металлы, |
|
Li |
Cu самые |
Во-вторых, кислота
должна быть достаточно сильной, чтобы
реагировать даже с металлом из левой
части табл. 8-3. Под силой кислоты понимают
ее способность отдавать ионы водорода
H+.
Например, кислоты
растений (яблочная, лимонная, щавелевая
и т.д.) являются слабыми кислотами и
очень медленно реагируют с такими
металлами как цинк, хром, железо, никель,
олово, свинец (хотя с основаниями и
оксидами металлов они способны
реагировать).
С другой стороны,
такие сильные кислоты как серная или
соляная (хлороводородная) способны
реагировать со всеми металлами из левой
части табл. 8-3.
В связи с этим
существует еще одна классификация
кислот – по силе. В таблице 8-4 в каждой
из колонок сила кислот уменьшается
сверху вниз.
Таблица 8-4.
Классификация кислот на сильные и слабые
кислоты.
|
Сильные |
Слабые |
|
HI HBr HCl H2SO4 HNO3 |
HF H3PO4 H2SO3 H2S H2CO3 H2SiO3 |
** Следует помнить,
что в реакциях кислот с металлами есть
одно важное исключение. При взаимодействии
металлов с азотной кислотой водород не
выделяется. Это связано с тем, что азотная
кислота содержит в своей молекуле
сильный окислитель – азот в степени
окисления +5. Поэтому с металлами в первую
очередь реагирует более активный
окислитель N+5,
а не H+,
как в других кислотах. Выделяющийся все
же в каком-то количестве водород
немедленно окисляется и не выделяется
в виде газа. Это же наблюдается и для
реакций концентрированной серной
кислоты, в молекуле которой сера S+6
также выступает в роли главного
окислителя. Состав продуктов в этих
окислительно-восстановительных реакциях
зависит от многих факторов: активности
металла, концентрации кислоты, температуры.
Например:
Cu + 4
HNO3(конц.)
=Cu(NO3)2
+
2 NO2
+ 2 H2O
3 Cu + 8HNO3(разб.)
= 3
Cu(NO3)2
+ 2 NO + 4 H2O
8 K + 5
H2SO4(конц.)
= 4 K2SO4
+ H2S
+ 4 H2O
3 Zn + 4
H2SO4(конц.)
= 3 ZnSO4
+ S + 4 H2O
Есть металлы,
которые реагируют с разбавленными
кислотами, но не реагирует с
концентрированными (т.е. безводными)
кислотами – серной кислотой и азотной
кислотой.
Эти металлы – Al,
Fe, Cr, Ni и некоторые другие – при контакте
с безводными кислотами сразу же
покрываются продуктами окисления
(пассивируются). Продукты окисления,
образующие прочные пленки, могут
растворяться в водных растворах кислот,
но нерастворимы в кислотах концентрированных.
1. Бескислородные
кислоты могут быть получены непосредственным
синтезом из элементов, с последующим
растворением полученного соединения
в воде:
H2
+ Cl2
= 2HCl
H2
+ S = H2S.
2. Кислородсодержащие
кислоты могут быть получены взаимодействием
кислотных оксидов (ангидридов кислот)
с водой:
SO3
+ H2O
= H2SO4
N2O5
+ H2O
= 2HNO3
3. Как бескислородные,
так и кислородсодержащие кислоты можно
получить по реакции обмена между солями
и другими кислотами:
Na2SiO3
+
H2SO4
= Na2SO4
+ H2SiO3
AgNO3
+ HCl = AgCl + HNO3
12) Основания
— это сложные вещества, состоящие из
атома металла, связанного с одной или
несколькими гидроксогруппами-ОН. Общая
формула:
По номенклатуре
основания называют гидроксидами:
Формула Название
Формула Название
LiOH гидроксид лития
Ca(OH)2 гидроксид
кальция
NaOH гидроксид
натрия Cu(OH)2 гидроксид
меди(II)
KOH гидроксид калия
Fe(OH)2 гидроксид
железа(III)
К щелочам относят
гидроксиды щелочных и щелочноземельных
металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2,
Sr(OH)2,
Ba(OH)2.Остальные
— нерастворимые.
К нерастворимым
относят так называемые амфотерные
гидроксиды, которые при взаимодействии
с кислотами выступают как основания, а
со щёлочью-как кислоты.
Получение оснований.
Щелочи
1.Металл+вода
2Na+H2O=2NaOH+H2
Ba+2H2O=Ba(OH)2+H2
2.Оксид+вода
Li2O+H2O=2LiOH
CaO+H2O=Ca(OH)2
3.Электролиз
растворов щелочных металлов
2NaCl+2H2O=2NaOH+Cl2+H2
Нерастворимые
основания
Соль+щелочь CuSO4+2NaOH=Cu(OH)2+Na2SO4
Химические свойства
оснований.
|
Щёлочи |
Нерастворимые |
|
1.Взаимодействие KOH+HCl=KCl+H2O |
Cu(OH)2+2HCl=CuCl2+2H2O |
|
2.Взаимодействие 2KOH+CO2=K2CO3+H2O |
не |
|
3.Действие лакмус-синяя, |
окраска |
|
4.Взаимодействие 2KOH+ZnO=K2ZnO2+H2O |
не |
|
5.Взаимодействие NaOH+CuCl2=Cu(OH)2 |
не |
|
6.При не |
Cu(OH)2=CuO+H2O |
|
Zn(OH)2+2HCl=ZnCl2+2H2O |
Al(OH)3+NaOH=Na[Al(OH)4] |
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Например, нитрат серебра взаимодействует с бромидом калия
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3K+ + 3Cl—
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3K+ + 3Cl—
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH— = Fe(OH)3
На ионы мы не разбиваем:
- Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
- Анионы кислотных остатков кислых солей слабых кислот (НСО3—, Н2РО4— и т.п.) и катионы основных солей слабых оснований Al(OH)2+
- Комплексные катионы и анионы: [Al(OH)4]—
Например, взаимодействие сульфида цинка и серной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
н р р р
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H+ + SO42— = Zn2+ + SO42— + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H+ = Zn2+ + H2S
Например, взаимодействие гидрокарбоната натрия и гидроксида натрия
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na+ + НСО3— + Na+ + ОН— = 2Na+ + CO32- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3—+ ОН— = CO32- + H2O
Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты
Составляем уравнение реакции и проверяем растворимость всех веществ:
р р р р
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na+ + [Al(OH)4]— + 4H+ + 4Cl— = Na+ + Cl— + Al3+ + 3Cl— + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4]— + 4H+ = Al3+ + 4H2O