Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Строение, изомерия и гомологический ряд алкадиенов
Химические свойства алкадиенов
Получение алкадиенов
Строение алкадиенов
Свойства алкадиенов определяются их строением и взаимных расположением двойных связей в молекуле.
Изолированные двойные связи разделены в углеродной цепи двумя или более σ-связями С–С. Например, в пентадиене-1,4:
CH2=CH–CH2–CH=CH2
Изолированные алкадиены проявляют свойства алкенов.
Кумулированные двойные связи расположены в углеродной цепи у одного атома углерода. Например, пропадиен:
CH2=C=CH2
Кумулированные алкадиены неустойчивы.
Сопряженные двойные связи разделены одной σ-связью С-С. Например, бутадиен-1,3:
CH2=CH–CH=CH2
Сопряженные алкадиены обладают характерными свойствами, которые отличаются от свойств алкенов.
Строение сопряженных алкадиенов
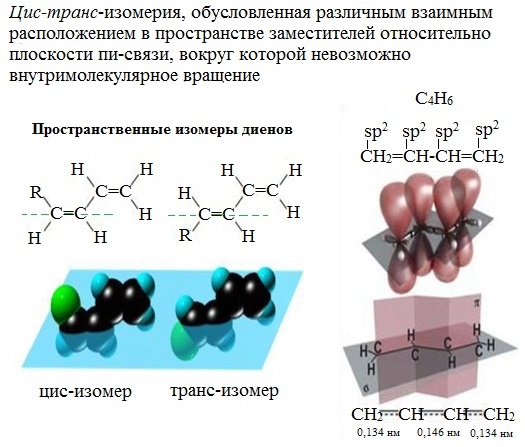
Молекула бутадиена-1,3 содержит четыре атома углерода в sp2—гибридизованном состоянии.
π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы (равномерно распределены) между всеми атомами углерода.
Это соответствует плоскому строению молекулы бутадиена-1,3.
Образуется единая сопряженная π-система, которая может вступать во взаимодействие целиком, используя все четыре р-орбитали π-связей.
Реальное строение бутадиена более точно отражает формула с делокализованными «полуторными» связями.
Аналогичное устроены и другие сопряженные алкадиены.
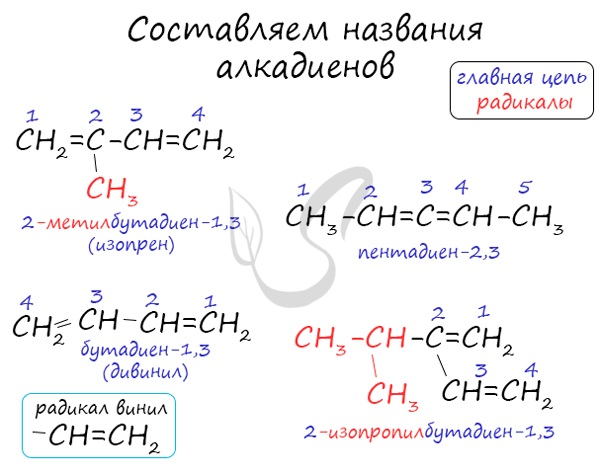
Например, 2-метилбутадиен-1,3:
Сопряжение в молекуле алкадиенов можно также схематично изобразить так:
Изображение с сайта orgchem.ru
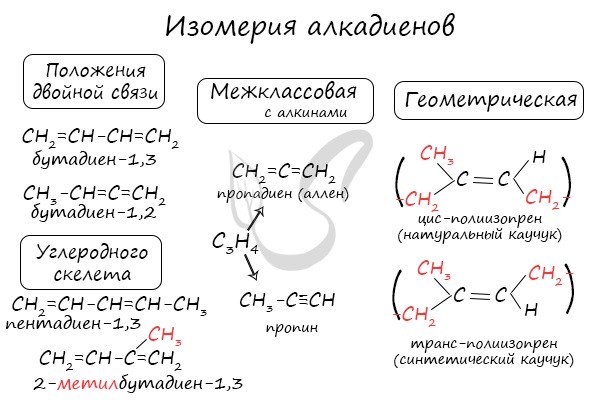
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратных связей и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры положения двойных связей отличаются положением двойных связей.
Изомеры положения двойных связей с формулой С6Н10 — гексадиен-1,3 и гексадиен-2,4
| Гексадиен-1,3 |
Гексадиен-2,4 |
 |
 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкадиены являются межклассовыми изомерами с алкинами и циклоалкенами с общей формулой — CnH2n-2.
Межклассовые изомеры с общей формулой С4Н6 — бутадиен-1,3, бутин-1, циклобутен
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры углеродного скелета, которые соответствуют формуле С5Н8 — пентадиен-1,3 и 2-метилбутадиен-1,3 (изопрен)
Пространственная изомерия
Для некоторых алкадиенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкадиены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкадиена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у некоторых алкадиенов.
Алкадиены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкадиены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкадиены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
| цис-Алкадиен |
транс-Алкадиен |
 |
 |
Цис-транс-изомерия не характерна для тех алкадиенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для бутадиена-1,3 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
CH2=CH–CH=CH2
Номенклатура алкадиенов
В названиях алкадиенов для обозначения двух двойных связей используется суффикс -ДИЕН.
Например, алкадиен имеет название бутадиен-1,3.
При этом правила составления названий (номенклатура) для алкадиенов в целом такие же, как и для алканов.
Для простейших алкадиенов применяются также исторически сложившиеся (тривиальные) названия:
Алкадиены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С.
Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда — пропадиен — CH2=C=CH2.
Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкадиенов
Названия алкадиенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом:
пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация
атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В зависимости от того, как чередуются двойные связи в молекуле алкадиена, они подразделяются на следующие типы:
- Кумулированные двойные связи
- Сопряженные двойные связи
- Изолированные двойные связи
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
Пример — пропадиен-1,2 (аллен) — CH2=C=CH2
В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом — sp-гибридизации.
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в
молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией
плоскости (линией, соединяющей центры атомов).
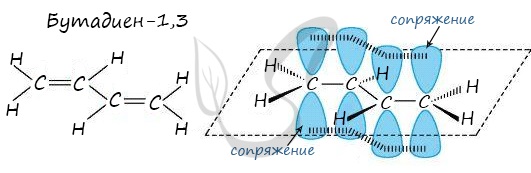
Пример — бутадиен-1,3 — CH2=CH-CH=CH2
В случае, если две двойные связи разделены двумя и более одинарными связями.
Пример — пентадиен-1,4 — CH2=CH-CH2-CH=CH2
Получение алкадиенов
Алкадиены получают несколькими способами:
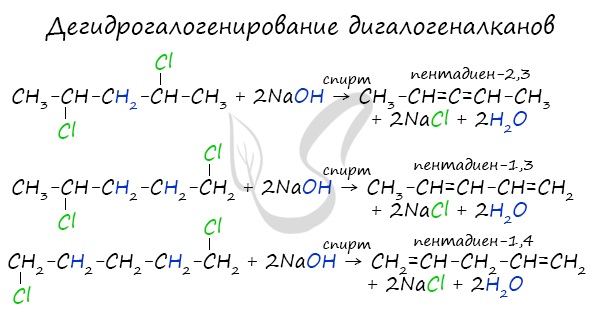
- Дегидрогалогенирование дигалогеналканов
- Синтез С.В. Лебедева
- Дегидрирование алканов
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи
получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из
этилового спирта.
2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O
+ H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и
способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит
при повышенной температуре и в присутствии катализатора.

Химические свойства алкадиенов
Алкадиены — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
Наличие сопряженных двойных связей увеличивает реакционную способность молекулы и обуславливает необычный механизм некоторых реакций.
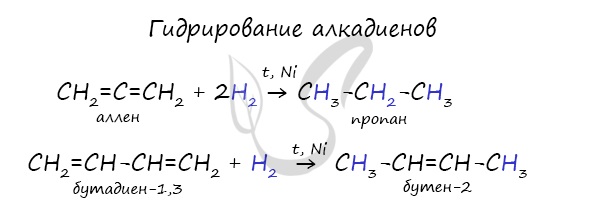
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
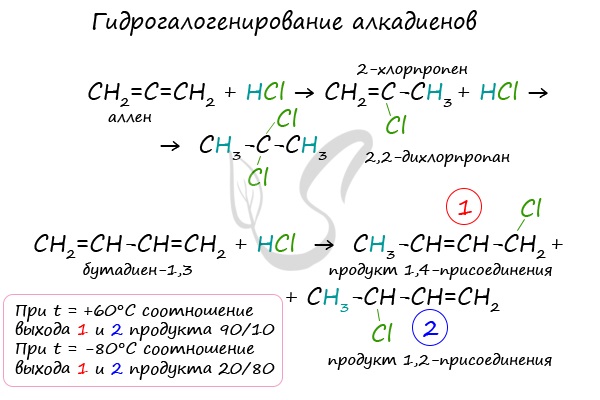
В случае, если двойные связи находятся в сопряжении, выход продуктов во многом зависит от температуры. Например, в ходе галогенирования бутадиена-1,3
при -80°C преимущественно получается продукт 1,2-присоединения, а при +60°C — продукт 1,4-присоединения.

Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.
При горении алкадиены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление.
2CH2=CH-CH=CH2 + 11O2 → 8CO2 + 6H2O
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Диенам характерна как структурная, так и пространственная изомерия.
Виды структурной изомерии диенов:
- изомерия углеродной цепи;
- изомерия положения двойной связи;
- межклассовая изомерия с алкинами и циклоалкенами.
Изомерия углеродной цепи и положения двойной связи возможна при числе атомов углерода не меньше (4).
В молекулах структурных изомеров атомы углерода соединяются в разном порядке. Молекулы могут иметь линейное или разветвлённое строение, а двойные связи могут располагаться в разных местах.
Межклассовые изомеры существуют у всех диенов. Например, пропадиену
CH2=C=CH2
изомерен пропин
CH≡C−CH3
.
Для некоторых диенов и их производных возможна пространственная изомерия. У веществ, в молекулах которых при одной или двух двойных связях оба атома углерода соединены с разными группами, существуют геометрические изомеры (цис-транс-изомеры).
В таблице приведены формулы некоторых структурных и пространственных изомеров, имеющих состав
C5H8
.
|
Структурная формула изомера |
Название |
|
|
пентадиен-(1),(2) |
|
|
пентадиен-(1),(3) |
|
|
пентадиен-(1),(4) |
|
|
(2)-метилбутадиен-(1),(3) |
|
|
пентин-(1) |
|
|
пентин-(2) |
|
|
(3)-метилциклобутен |
|
|
цис-пентадиен-(1),(3) |
|
|
транс-пентадиен-(1),(3) |
Главная » Алкадиены » Изомерия алкадиенов
Изомерия алкадиенов
Для алкадиенов характерна структурная и пространственная изомерия.
Структурная изомерия
Пространственная изомерия
Алкадиены


« Строение алкадиенов
Номенклатура алкадиенов »
Написать комментарий
Имя (обязательно)
Почта (скрыта) (обязательно)
Сайт
Диеновые
углеводороды – это непредельные углеводороды, в
составе которых есть кратные связи.
Алкадиены,
или диены – это углеводороды, содержащие в составе молекул две двойные связи.
Диены
довольно широко распространены в природе: это растительные пигменты моркови,
помидоров, листьев деревьев, плодов шиповника. Здесь растительным пигментом
является β-каротин.
Простейшим
представителем диенов, у которого двойные связи разделены одной одинарной,
является бутадиен-1,3.
Из
этой формулы видно, что общая формула алкадиенов будет CnH2n-2.
В бутадиене-1,3 все атомы углерода находятся в состоянии sp2-гибридизации
и молекула имеет плоскостное строение. р-Электроны двойных связей
образуют единое р-электронное облако (сопряжённую систему) и делокализовано
между всеми атомами углерода. Здесь нет чисто одинарных и число двойных связей.
В молекуле бутадиена-1,3 длина одинарной С – С-связи равна 0,148 нм, что
короче С – С-связи в алканах, но длиннее, чем в алкенах. Это всё приводит к
особым химическим свойствам диенам.
Рассмотрим
алкадиены, имеющие пять атомов углерода.
H2C = C = CH – CH2
– CH3
пентадиен-1,2 (кумулятивные)
H2C = CH – CH = CH – CH3
пентадиен-1,3 (сопряжённые)
H2C = CH – CH2
– CH
= CH2
пентадиен-1,4 (изолированные)
По
правилам IUPAC
главная
цепь диенов должна содержать обе двойные связи. Нумерацию проводят так, чтобы
двойные связи получили наименьшие номера. Суффикс –ан заменяется на суффикс
–диен. Цифры, указывающие положение двойных связей, записывают после суффикса,
а названия заместителей указывают вначале. Например, пронумеруем углеводород:
Выбираем
для этого самую длинную цепь. В главной цепи 4 атома углерода и здесь один
заместитель – метил у второго атома углерода. Поэтому данный углеводород
называется 2-метилбутадиен-1,3, или изопрен.
Кроме
изопрена, тривиальное название имеет и бутадиен-1,3, который называют
дивинилом.
CH2 =
CH – CH = CH2 бутадиен-1,3
Для
диенов характерны следующие виды изомерии: структурная (изомерия углеродного
скелета и изомерия положения двойной связи), а также межклассовая
изомерия с алкинами и циклоалкенами.
Составим
изомеры к диену, содержащему 6 атомов углерода. Рассмотрим изомерию углеродного
скелета. Диену, у которого 6 атомов углерода, соответствует гексадиен-1,3 и
4-метилпентадиен-1,3.
H3C –
CH2 – CH = CH – CH = CH2
H3C – C
= CH – CH = CH2
CH3
Если
составить к диену с 6-ю атомами углерода изомеры по положению двойных связей,
то такими изомерами будут гексадиен-2,4 и гексадиен-1,3.
H3C –
CH = CH – CH = CH – CH3
H3C – CH2
– CH = CH – CH = CH2
Межклассовым
изомерами бутадиена-1,3 будут: бутин-1 и циклобутен.
CH ≡ C – CH2
– CH3
CH = CH
CH2
– CH2
Для
алкадиенов характерна и пространственная цис-транс-изомерия. Эта
изомерия обусловлена различным расположением заместителей в пространстве
относительно π-связи, вокруг которой невозможно внутримолекулярное
вращение.
Таким
образом, общая формула алкадиенов CnH2n-2.
В молекулах диенов длина одинарной С – С-связи равна 0,148 нм. Для диенов характерны
следующие виды изомерии: структурная (изомерия углеродного скелета и изомерия
положения двойной связи), а также межклассовая изомерия с алкинами и
циклоалкенами.