Алкены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствует одна двойная связь между атомами углерода С=С.
Наличие двойной связи между атомами углерода очень сильно меняет свойства углеводородов.
Строение, изомерия и гомологический ряд алкенов
Химические свойства алкенов
Получение алкенов
Гомологический ряд алкенов
Все алкены имеют некоторые общие или похожие физические и химические свойства. Схожие по строению алкены, которые отличаются на одну или несколько групп –СН2–, называют гомологами. Такие алкены образуют гомологический ряд.
Самый первый представитель гомологического ряда алкенов – этен (этилен) C2H4, или СH2=СH2.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкена | Формула алкена |
| Этилен (этен) | C2H4 |
| Пропилен (пропен) | C3H6 |
| Бутилен (бутен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
Общая формула гомологического ряда алкенов CnH2n.
Первые четыре члена гомологического ряда алкенов – газы, начиная с C5 – жидкости.
Алкены легче воды, не растворимы в воде и не смешиваются с ней.
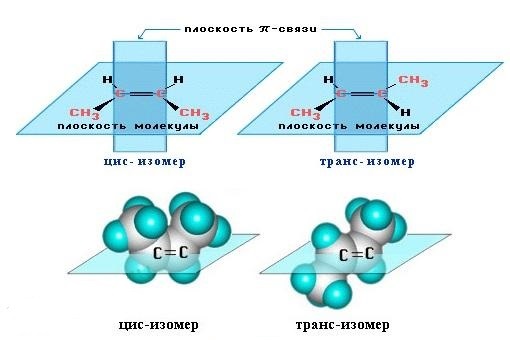
Строение алкенов
Рассмотрим особенности строения алкенов на примере этилена.
В молекуле этилена присутствуют химические связи C–H и С=С.
Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С=С – двойная, ковалентная неполярная, одна из связей σ, вторая π-связь. Атомы углерода при двойной связи образуют по три σ-связи и одну π-связь. Следовательно, гибридизация атомов углерода при двойной связи в молекулах алкенов – sp2:
При образовании связи σ-связи между атомами углерода происходит перекрывание sp2-гибридных орбиталей атомов углерода:
При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три гибридные орбитали атомов углерода при двойной связи в алкенах направлены в пространстве под углом 120о друг к другу:
Изображение с сайта orgchem.ru
Это соответствует плоско-треугольному строению молекулы.
Например, молекуле этилена C2H4 соответствует плоское строение.
Изображение с сайта orgchem.ru
Молекулам линейных алкенов с большим числом атомов углерода соответствует пространственное строение.
Например, в молекуле пропилена присутствует атом углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение и располагается вне плоскости двойной связи.
Изображение с сайта orgchem.ru
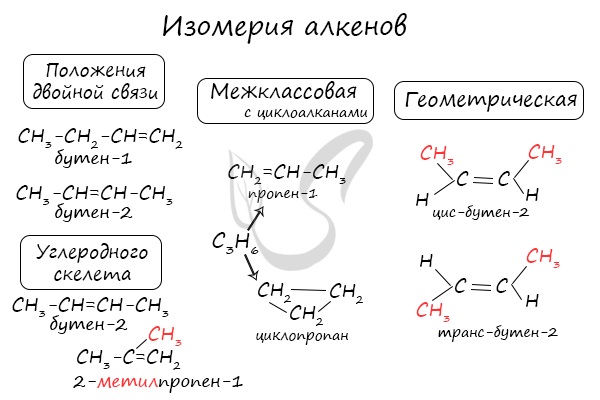
Изомерия алкенов
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия
Для алкенов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения кратной связи и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Изомеры с различным углеродным скелетом и с формулой С4Н8 — бутен-1 и метилпропен
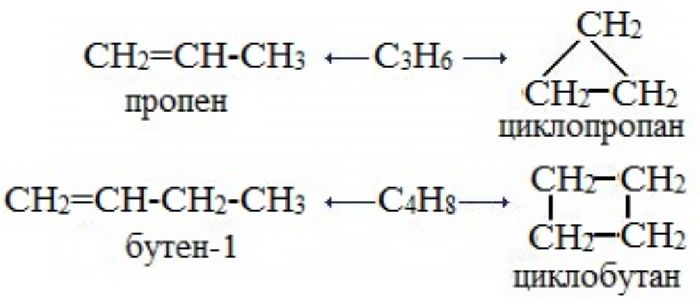
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Алкены являются межклассовыми изомерами с циклоалканами. Общая формула и алкенов, и циклоалканов — CnH2n.
Межклассовые изомеры с общей формулой С3Н6 — пропилен и циклопропан
Изомеры с различным положением двойной связи отличаются положением двойной связи в углеродном скелете.
Изомеры положения двойной связи, которые соответствуют формуле С4Н8 — бутен-1 и бутен-2
Пространственная изомерия
Для алкенов характерна пространственная изомерия: цис-транс-изомерия и оптическая.
Алкены, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкена должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
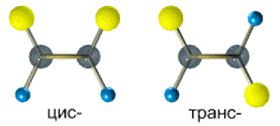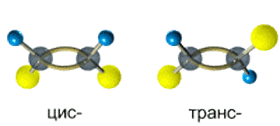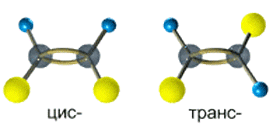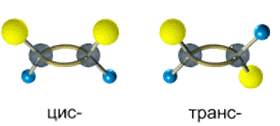
Цис-транс-изомерия обусловлена отсутствием вращения по двойной связи у алкенов.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Алкены, в которых одинаковые заместители располагаются по одну сторону от плоскости двойной связи, это цис-изомеры. Алкены, в которых одинаковые заместители располагаются по разные стороны от плоскости двойной связи, это транс-изомеры.
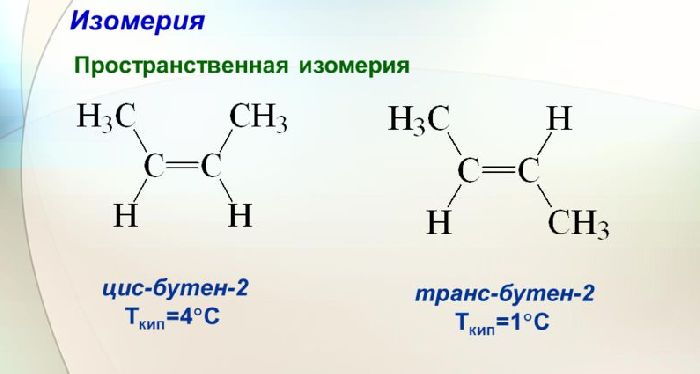
Для бутена-2 характерна цис- и транс-изомерия. В цис-изомере метильные радикалы CH3 располагаются по одну сторону от плоскости двойной связи, в транс-изомере — по разные стороны.
| цис-Бутен-2 | транс-Бутен-2 |

|
Цис-транс-изомерия не характерна для тех алкенов, у которых хотя бы один из атомов углерода при двойной связи имеет два одинаковых соседних атома.
Для пентена-1 цис-транс-изомерия не характерна, так как у одного из атомов углерода при двойной связи есть два одинаковых заместителя (два атома водорода)
Алкенам характерна как структурная, так и пространственная изомерия.
Виды структурной изомерии алкенов:
- изомерия углеродной цепи;
- изомерия положения двойной связи;
- межклассовая изомерия с циклоалканами.
Обрати внимание!
Изомерия углеродной цепи и положения двойной связи возможна при числе атомов углерода не меньше (4).
В молекулах структурных изомеров атомы углерода соединяются в разном порядке. Молекулы могут иметь линейное или разветвлённое строение. Двойная связь в них может располагаться в разных местах.
Межклассовые изомеры существуют у всех алкенов, кроме этилена. Например, пропену
CH2=CH−CH3
изомерен циклопропан, структурная формула которого выглядит следующим образом:
Для некоторых алкенов и их производных возможна пространственная изомерия. Она обусловлена невозможностью вращения частей молекулы вокруг двойной связи.
У веществ, в молекулах которых оба атома углерода при двойной связи соединены с разными группами, существуют геометрические изомеры (цис-транс-изомеры). В молекулах этих веществ порядок соединения атомов одинаковый, но их пространственное расположение различается. Приведём пример пространственных изомеров для галогенпроизводного — (1), (2)-дихлорбутена.
|
|
|
|
Цис-(1), (2)-дихлорбутен-(2) |
Транс-(1), (2)-дихлорбутен-(2) |
Составим структурные формулы изомеров, имеющих состав
C4H8
.
|
Структурная формула изомера |
Название |
Вид изомерии |
|
|
бутен-(1) |
структурная, положения двойной связи |
|
|
бутен-(2) |
структурная, положения двойной связи |
|
|
метилпропен |
структурная, углеродной цепи |
|
|
циклобутан |
структурная, межклассовая |
|
|
метилциклопропан |
структурная, межклассовая |
|
|
цис-бутен-(2) |
пространственная, цис-транс-изомерия |
|
|
транс-бутен-(2) |
пространственная, цис-транс-изомерия |
Значит, всего существует шесть веществ, имеющих состав
C4H8
, — пять структурных изомеров, один из которых (бутен-(2)) представлен двумя цис-транс-изомерами.
Для алкенов характерна структурная и пространственная изомерия.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8).
Первые два члена гомологического ряда – этен и пропен – изомеров, относящихся к классу алкенов, не имеют.
Простейший алкен, для которого характерны структурные изомеры, — это бутен:
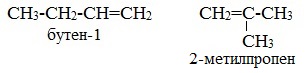
2. Изомерия положения двойной связи (начиная с С4Н8):
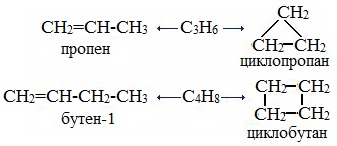
3. Межклассовая изомерия, начиная с С3Н6 (алкены изомерны другому классу соединений — циклоалканам):
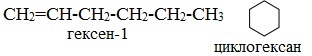
Пространственная изомерия
Геометрическая или цис-транс изомерия
Цис-транс изомерия обусловлена различным положением заместителей относительно плоскости двойной связи.
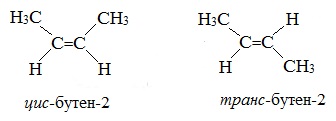
Эти два изомера нельзя перевести друг в друга без вращения вокруг двойной связи С=С, а это вращение требует разрыва π-связи и затраты большого количества энергии. Поэтому цис- и транс-изомеры – это разные вещества, которые отличаются друг от друга физическими и химическими свойствами.
Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере.
Алкены, у которых хотя бы один из атомов углерода при связи С=С имеет два одинаковых заместителя, не имеют цис-транс- изомеров.
Например,бутен-1 СН2=СН–СН2–СН3 не имеет цис— и транс-изомеров, т.к. первый атом С связан с двумя одинаковыми атомами Н.
Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис— и транс— .
Алкены (непредельные углеводороды)
Изомерия алкенов

4.5
Средняя оценка: 4.5
Всего получено оценок: 1434.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1434.
Алкены – класс непредельных углеводородов, содержащих одну двойную связь. Начиная с пропена для алкенов характерна изомерия. Благодаря строению молекулы возможны все виды изомерии алкенов.
Структурная
Для алкенов характерны три вида структурной изомерии. Подробнее виды с примерами описаны в таблице.
|
Название |
Описание |
Примеры |
|
Углеродного скелета |
Изменения строения углеродного скелета характерны гомологам алкенов, начиная с бутена. Метильная группа прикрепляется к любому атому углерода в цепи, образуя изомеры |
При переносе группы -СН2 ко второму атому цепи бутена образуется 2-метил-пропен |
|
Положения двойной связи |
Изменение расположения двойной связи в углеродной цепи. Характерно для гомологов с четырьмя и более атомами углерода. Цифра, соответствующая номеру атома углерода, у которого находится двойная связь, ставится после названия изомера |
В молекуле бутена-1 двойная связь расположена у первого атома углерода, в молекуле бутена-2 – у второго |
|
Межклассовая |
Алкены, начиная с пропена, за счёт разрыва двойной связи образуют изомеры с циклоалканами |
Пропен, зацикливаясь, превращается в цикплопропан, бутен-1 – в циклобутан, гексен-1 – в циклогексан |
При составлении названий по международной номенклатуре нумерация атомов в неразветвлённой цепи начинается с того края, к которому ближе двойная связь. В разветвлённой цепи нумерация начинается с разветвлённого конца.
Пространственная
Для алкенов возможен один вид пространственной изомерии, а именно цис-транс-изомерия. Атомы углерода, сцепленные двойной связью лежат в одной плоскости, которая условно делит молекулу пополам. Одинаковые радикалы, прикреплённые к атомам углерода, могут находиться по одну сторону этой плоскости или по двум разным сторонам. В первом случае говорят о цис-изомерии, во втором – о транс-изомерии.
Аналогично цис-транс-изомерия характерна циклоалканам, родственным алкенам. Плоскость проходит по сцепленным в кольцо атомам углерода.
Примеры изомерии алкенов являются цис-бутен-2 и транс-бутен-2. У молекуле цис-бутена-2 заместители -СН3 расположены по одну сторону от атомов углерода (условно сверху). В молекуле транс-бутена-2 группы -СН3 лежат по разным сторонам от атомов углерода (условно вверху и внизу).
Цис- и транс-изомеры нельзя перевести друг в друга без разрыва π-связи и затрата энергии. Поэтому цис- и транс-изомеры – разные вещества, отличающиеся физическими и химическими свойствами.
Что мы узнали?
Для алкенов характерно два типа изомерии – структурная и пространственная. Первый вид связан с изменением строения молекулы вещества, за счёт прикрепления к атомам углерода групп -СН2, перемещения двойных связей, разрыва двойных связей с образованием циклоалканов. Изменение молекулы в пространстве происходит благодаря цис-транс-изомерии, в результате чего образуются цис-изомеры с расположенными по одну сторону радикалами и транс-изомеры, радикалы которых лежат по разным сторонам плоскости.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Светлана Пузанкевич
5/5
-
Захар Харитонов
5/5
-
Светлана Сирина
5/5
-
Миткевич Наталья
5/5
-
Арайка Қуанышқызы
5/5
-
Лиля Шакирова
4/5
-
Надежда Поляница
5/5
-
Никита Украинский
1/5
-
Ник Столяров
5/5
-
Ульяна Гаврилова
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1434.
А какая ваша оценка?
Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит
одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2.
Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
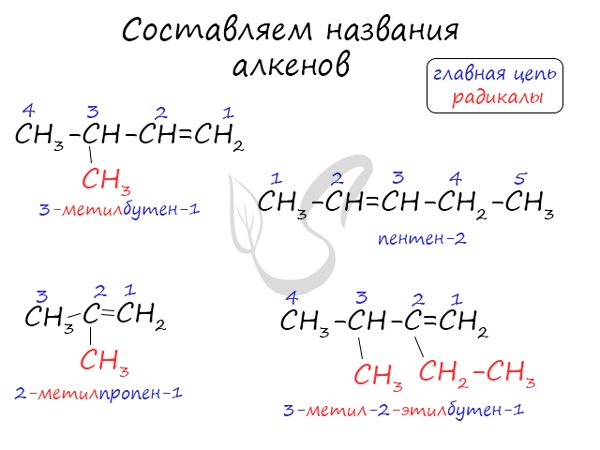
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом:
этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию
атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого
начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая
изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко
водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород
отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные
рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими
свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная
вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
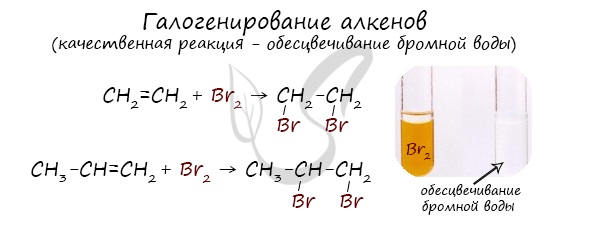
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а
атом галогена — к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода,
гидроксогруппа — к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном
окислении образуются окиси.

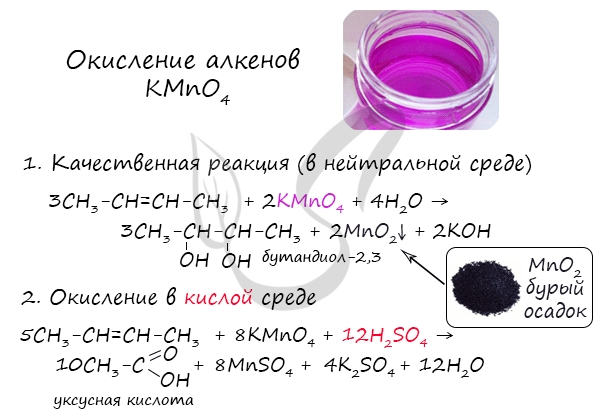
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные
углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2.
В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной
связи.
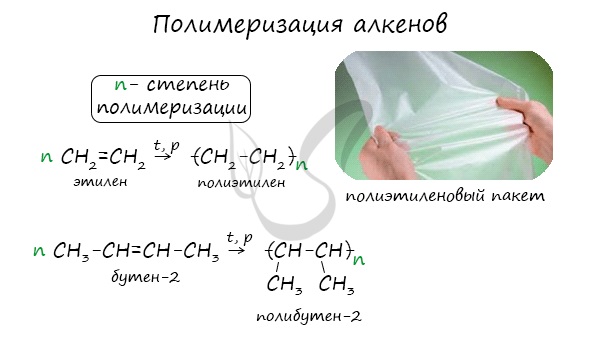
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения
молекул мономеров.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.