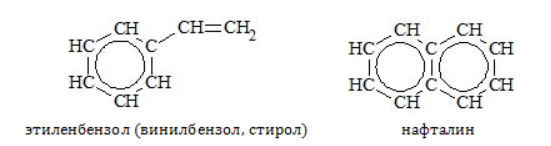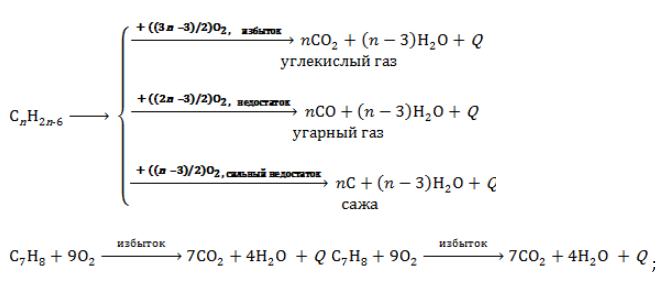Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
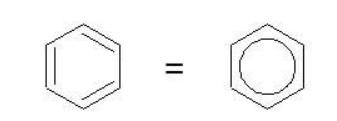
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
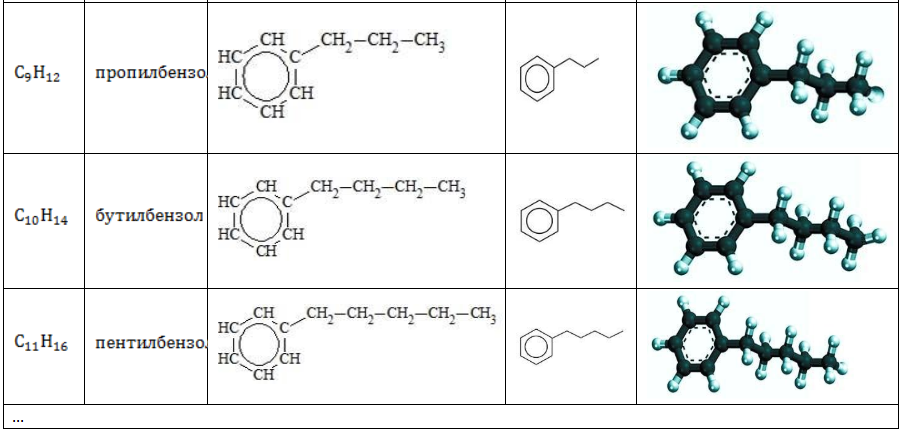
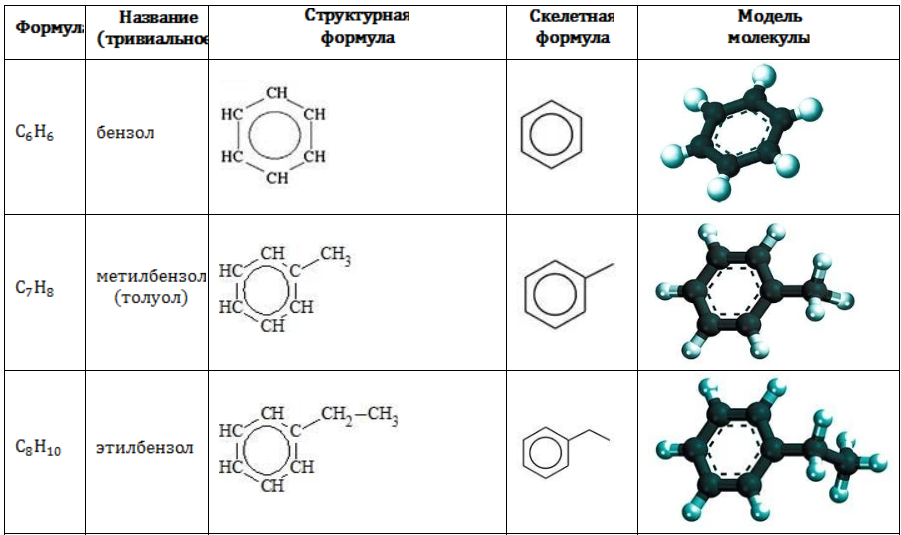
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
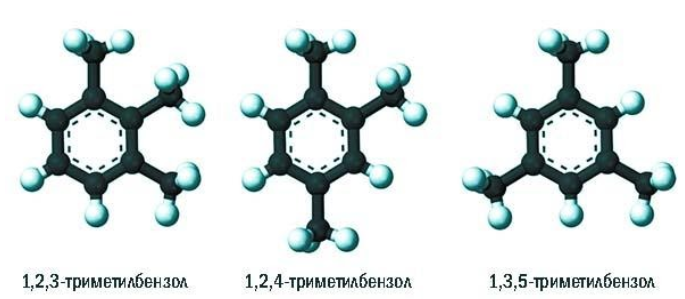
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
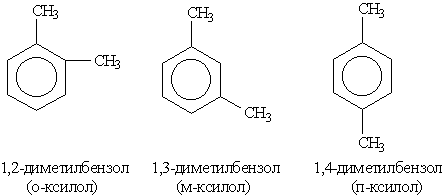
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
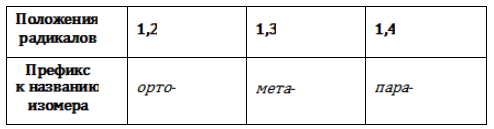
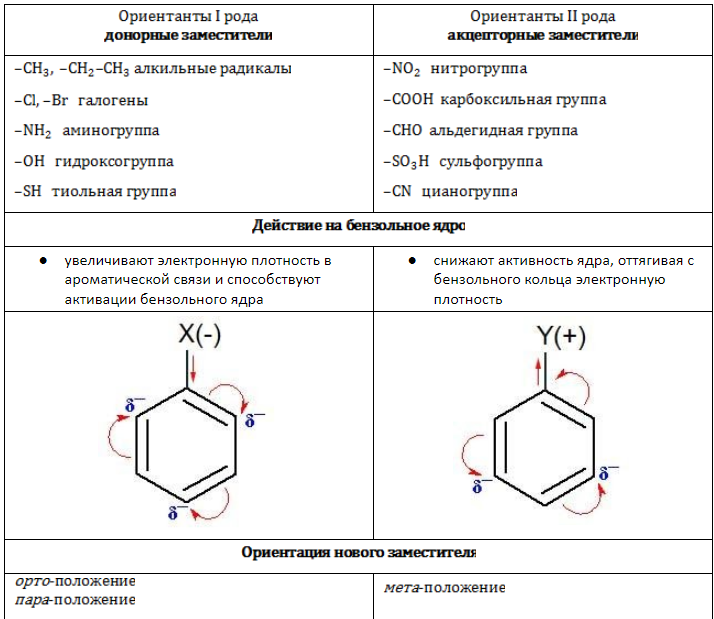
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
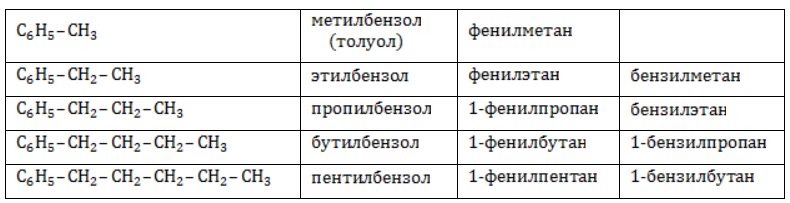
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
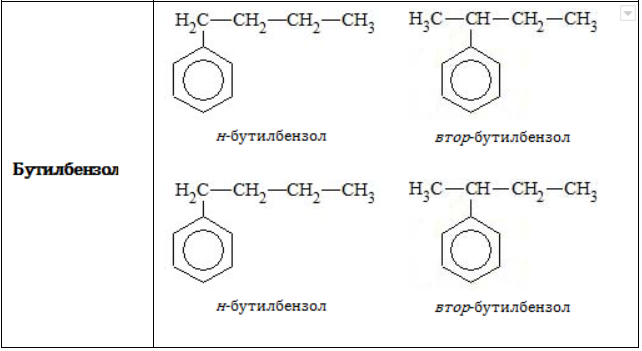
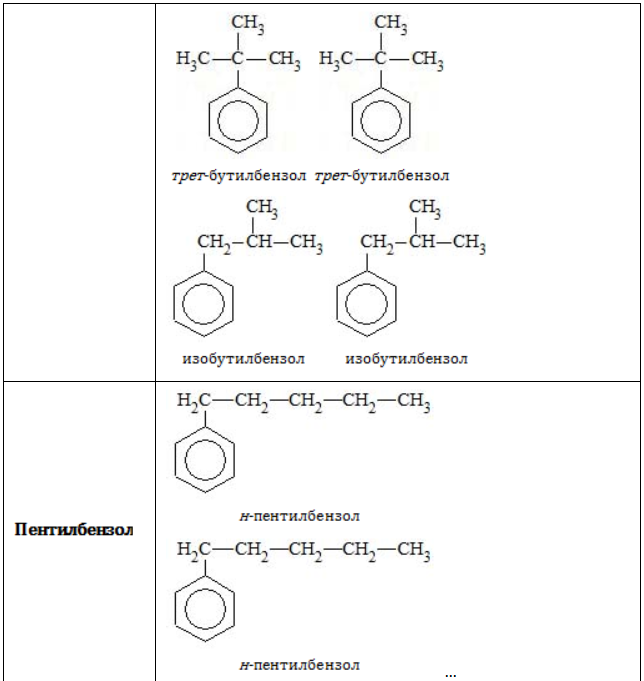
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол
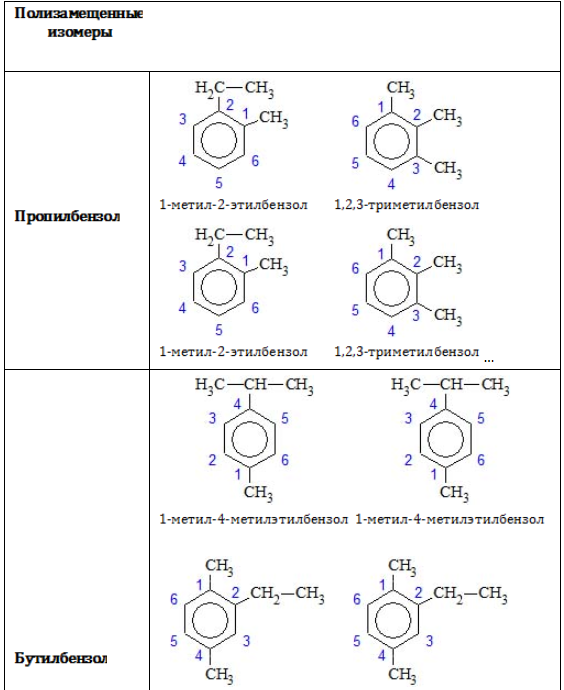
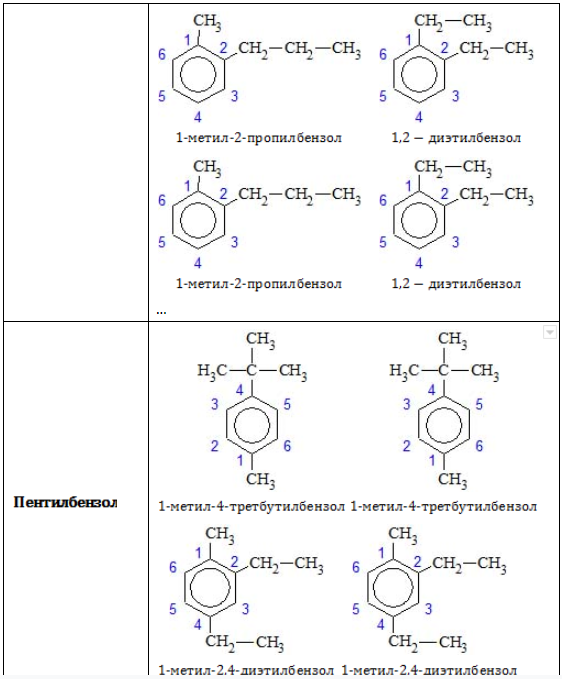
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Ароматические углеводороды рассматриваются как производные бензола, в молекуле которого атомы водорода замещены на радикалы. Если таких радикалов несколько, то атомы углерода бензольного кольца нумеруются так, чтобы сумма цифр в названии была наименьшей. Начинают нумерацию от старшего заместителя к младшему.
Используются также рациональные названия: толуол (метилбензол), ортоксилол ((1),(2)-диметилбензол), метаксилол ((1),(3)-диметилбензол), параксилол ((1),(4)-диметилбензол), кумол (изопропилбензол) и др.
В таблице показаны примеры нумерации атомов углерода в бензольном кольце и приведены названия веществ.
|
Структурная формула арена |
Название |
|
|
(1),(3)-диметилбензол (метаксилол) |
|
|
(1)-метил-(2)-этилбензол |
Гомологам бензола характерна структурная изомерия, которая может быть обусловлена:
- разным расположением углеводородных радикалов в бензольном кольце;
- разным строением боковых углеводородных радикалов.
Структурная изомерия в гомологическом ряду бензола возможна при числе атомов углерода не меньше (8). Бензол и метилбензол изомеров не имеют.
В таблице приведены формулы и названия некоторых изомеров, имеющих состав
C9H12
.
|
Структурная формула изомера |
Название |
|
|
пропилбензол |
|
|
изопропилбензол (кумол) |
|
|
(1)-метил-(2)-этилбензол |
|
|
(1)-метил-(3)-этилбензол |
|
|
(1),(2),(3)-триметилбензол |
|
|
(1),(2),(4)-триметилбензол |
План урока:
Определение и формула аренов
Строение молекулы бензола
Изомерия и номенклатура аренов
Методы получения аренов
Физические свойства ароматических соединений
Химические реакции ароматических углеводородов
Области применения аренов
Определение и формула аренов
Арены (ароматические углеводороды) – соединения, включающие устойчивый цикл из шести атомов углерода (бензольное кольцо). Важнейший представитель – бензол.
Общая формула ароматических углеводородов: CnH2n-6
Молекула бензола.
Строение молекулы бензола
Бензол – первый представитель гомологического ряда ароматических углеводородов, открытый в 1825 году Майклом Фарадеем. Т.к. его молекулярная формула – С6Н6, значит, в основе лежат двойные связи. Поэтому было предположено, что бензолу свойственна ненасыщенность. В 1865 году Фридрих Кекуле предположил структурную формулу бензола.
Но в экспериментах было доказано, что бензол входит в реакции присоединения только в жестких условиях и устойчив к реакциям окисления. Для него наиболее свойственно замещение, что доказывает принадлежность к предельным соединениям.
Парадоксальное электронное строение было доказано с помощью получения бензола из ацетилена. Его особенность заключается в том, что все атомы в кольце равноценны и имеют характер одинарных и кратных связей. Это можно отразить формулой с равномерным распределением электронной плотности.
Углеродные атомы в кольце имеют по четыре валентных электрона и им свойственна sp2-гибридизация. Атомы располагаются в единой плоскости. Особенности строения бензола состоят в том, что электроны составляют единую π-систему и все связи равноценны. Т.е. формула Кекуле неточна, т.к. отражает наличие двойных связей. Бензольное кольцо – это циклическая сопряженная система, связи которой перекрываются между собой.
Пространственное строение бензола Источник
Изомерия и номенклатура аренов
Для бензола и его гомологов характерна только структурная изомерия, которая включает:
- изомерию углеродного скелета боковой цепи,
- изомерию положения заместителей в кольце.
Источник
Главной цепью в названии аренов принимается ароматическое кольцо, от которого отходят заместители. В следующем представителе гомологического ряда ксилоле (диметилбензоле) имеет значение положение заместителей в кольце. Для его обозначения используются различные приставки:
- орто- (о-) – заместители находятся у соседних углеродных атомов в кольце,
- мета- (м-) – заместители находятся через один атом,
- пара- (п-) – заместители находятся через два атома.
Методы получения аренов
В промышленности бензол и его гомологи можно получить несколькими способами.
- Из каменноугольной смолы.
- Дегидрирование и циклизация алканов при катализаторе и под действием высоких температур.
- Дегидрирование циклоалканов при катализаторе и под действием высоких температур
В лаборатории моноциклические соединения также получают несколькими путями.
- Циклотримеризация ацетилена и его гомологов при катализаторе и под действием высоких температур (реакция получения бензола)
- Реакция Вюрца-Фиттига – взаимодействие галогеналканов и арилгалогенидов с металлическим натрием
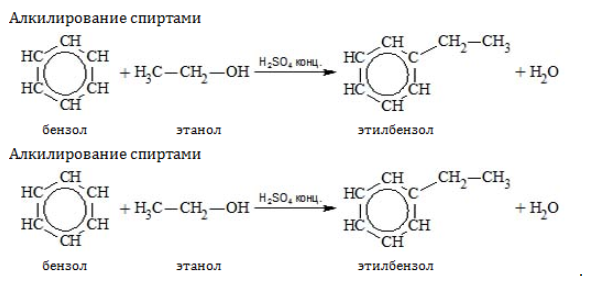
- Алкилирование галогеналканами, алкенами и спиртами в присутствии кислот Льюиса
Физические свойства ароматических соединений
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом. Нерастворимы в воде, но растворимы в органических растворителях. Их плотность меньше плотности воды. Они огнеопасны и токсичны для животных и человека.
Химические реакции ароматических углеводородов
Несмотря на то, что бензол включает систему из сопряженных кратных связей, аренам не характерны реакции обесцвечивания бромной воды и перманганата калия.
Реакции присоединения
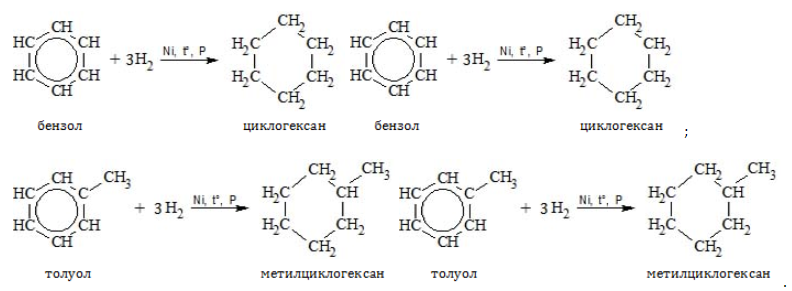
Бензолу характерны реакции присоединения, образуя циклогексан или его производные.
Реакции замещения
Аренам характерны реакции замещения.
Окисление аренов
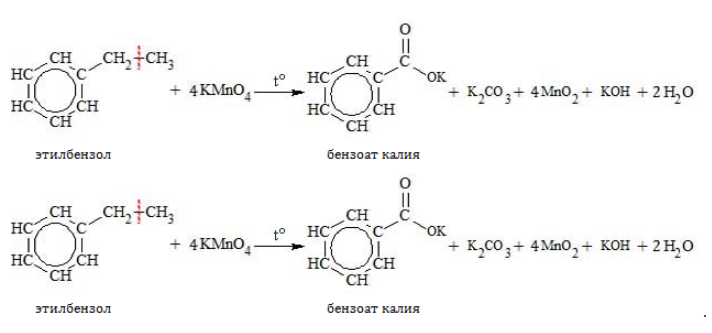
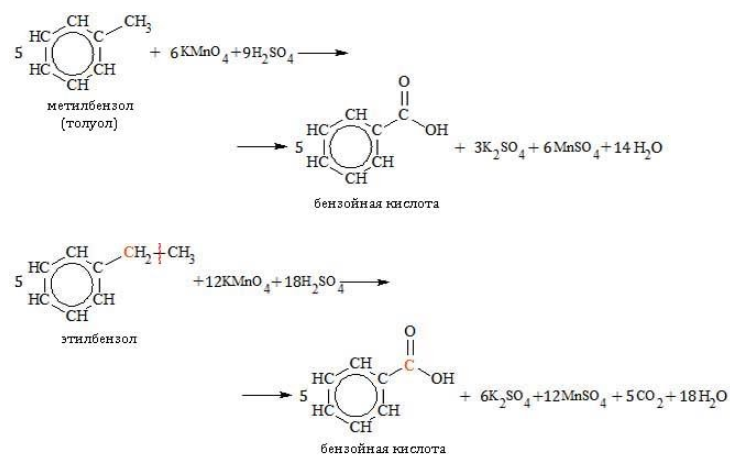
При неполной химической реакции окисления гомологи бензола образуется бензойная кислота. Самому бензолу реакции окисления перманганатом калия не характерны.
Полимеризация аренов
В реакции полимеризации способен вступать стирол, образуя полистирол.
Области применения аренов
Без бензола и его гомологов невозможно представить современное промышленное производство. Основные области применения бензола – производство этилбензола, кумола и циклогексана и анилина.
Содержание
- 1 Строение ароматической связи
- 2 Гомологический ряд бензола
- 3 Номенклатура и изомерия алкилбензолов
- 3.1 Строение углеродного скелета
- 3.2 Позиции одинаковых заместителей
- 4 Физические свойства некоторых алкилбензолов
- 5 Химические свойства алкилбензолов
- 5.1 Замещение
- 5.2 Присоединение
- 5.3 Окисление
- 6 Взаимодействие радикалов с бензольным ядром
- 7 Заключение
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи
Химическая формула бензола – C6H6. Бензольная молекула – это циклическое образование, построенное из шести -гибридизованных углеродных атомов, каждый из которых соединен с одним атомом водорода.
Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных
-связей и
-облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.
При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.
Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено
углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:
Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:
Арильные (содержащие бензольное ядро) радикалы носят следующие названия:
Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов
Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета
В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.
При наименовании алкилбензолов соблюдаются следующие правила:
- ароматический цикл считается главной цепью и носит название «бензол»;
- алкильный заместитель указывается перед главной цепью: «метилбензол»;
- в случае если радикалов более одного, их позиции нумеруются в направлении кратчайшего промежутка между ними: «1,2», «1,3», «1,4», но не «1,5» или «1,6»;
- количество одинаковых заместителей обозначается после их номеров греческими численными приставками: «1,2-диметилбензол»;
- разные заместители перечисляются по старшинству: «1,2-диметил-4-бутилбензол»;
- посредством приставок «н-», «втор-» или «трет-» указывается, по какому углеродному атому в заместителе (первичному, вторичному или третичному) осуществляется связь с бензольным ядром: «1,2-диметил-4-трет-бутилбензол».
Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:
Например, дизамещенные изомеры этилбензола (имеют распространенное тривиальное наименование «ксилолы») образуют следующие изомеры по позициям метильных заместителей:
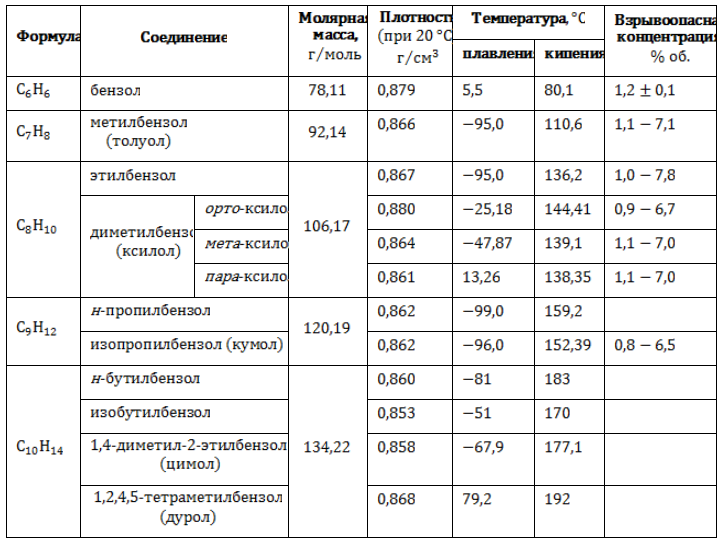
Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
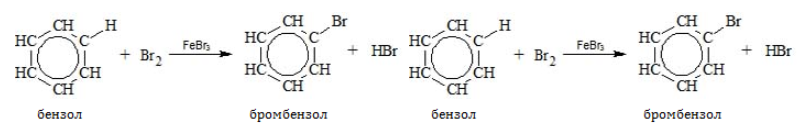
- Галогенирование
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:
В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:
Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:
При этом галоген атакует ближайший к кольцу углеродный атом.
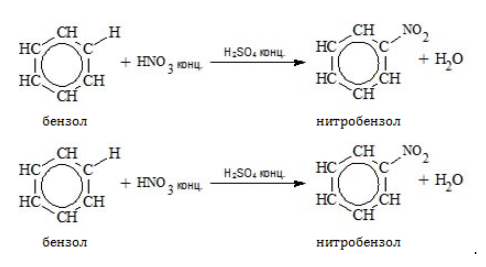
- Нитрование
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:
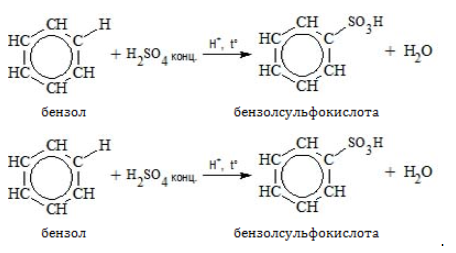
- Сульфирование
Бензол сульфируется концентрированной или «дымящей» кислотой (олеумом):
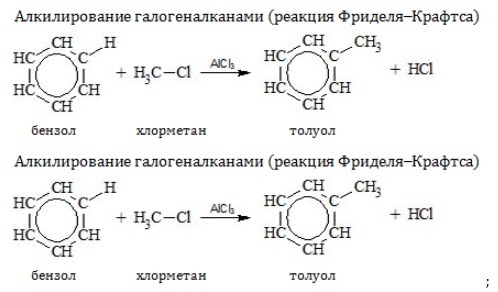
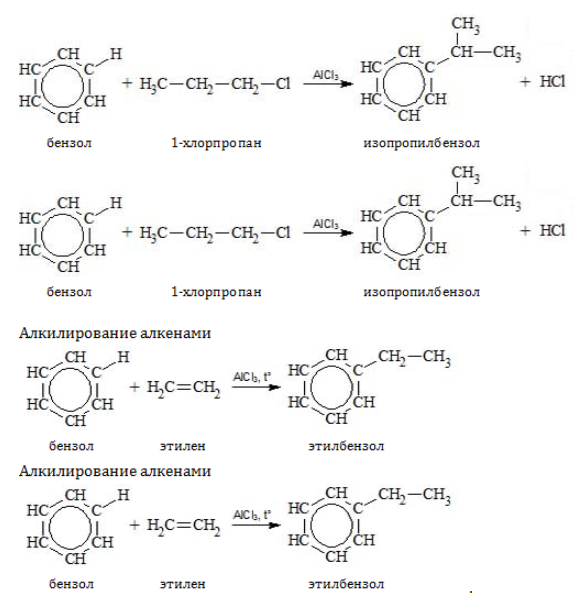
- Алкилирование
Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:
Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:
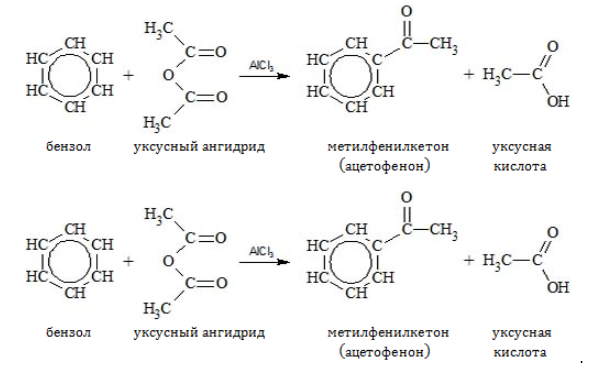
- Ацилирование
Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.
- Гидрирование
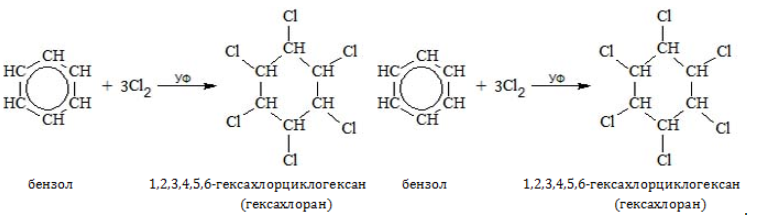
- Хлорирование
Из всех соединений гомологического ряда хлор присоединяется только к бензолу:
При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
- Жесткое окисление
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:
В кислой среде происходит образование бензойной кислоты:
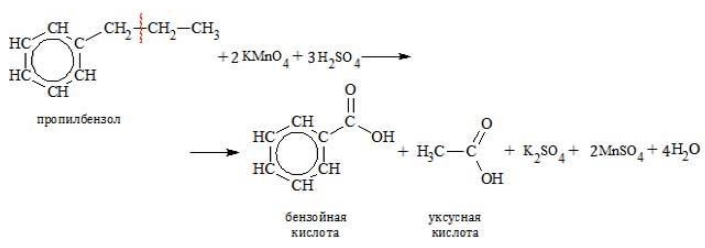
Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:
Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:
- Полное окисление
Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:
Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Это интересно:
Изомеры пентена
Общая формула циклоалканов
Окисление алкенов перманганатом калия
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Ароматические
углеводороды (арены)
— углеводороды, в молекулах которых
есть одно или несколько бензольных
колец. Состав аренов с одним бензольным
кольцом отвечает общей формуле CnH2n-6.
В
молекуле простейшего арена — бензола
(C6H6)
—
-связи
образуют единую делокализованную
сопряженную (ароматическую) систему
-связей.
Строение
молекулы простейшего арена — бензола
— может быть передано структурными
формулами различных типов:
Номенклатура
и изомерия. Условно
арены можно разделить на два ряда. К
первому относят производные бензола
(например, толуол или дифенил), ко второму
— конденсированные
(полиядерные)
арены (простейший из них — нафталин):
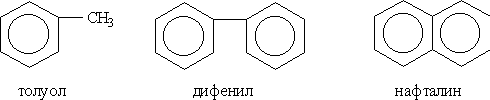
Гомологический
ряд бензола отвечает общей формуле
С6Н2n-6.
Структурная
изомерия
в гомологическом ряду бензола обусловлена
взаимным расположением заместителей
в ядре. Монозамещенные производные
бензола не имеют изомеров положения,
так как все атомы в бензольном ядре
равноценны. Дизамещенные производные
существуют в виде трех изомеров,
различающихся
взаимным расположением заместителей.
Положение заместителей указывают
цифрами или приставками: орто-
(о-), мета- (м-), пара- (п-).
Радикалы
ароматических углеводородов называют
арильными
радикалами.
Радикал С6Н5
— называется фенил.
Ароматические
углеводороды —
исходное сырьё для промышленного
получения кетонов, альдегидов и кислот
ароматического ряда, а также многих
других веществ.
Практически
всегда соблюдается Правило
Хюккеля:
ароматичной может быть лишь система,
содержащая (в кольце) 4n+2 электронов
(где n = 0, 1, 2, …). Система, содержащая 4n
электронов является антиароматичной
(в упрощенном понимании это обозначает
избыток энергии в молекуле, неравенство
длин связей, низкая стабильность —
склонность к реакциям присоединения).
В то же время, в случае пери-сочленения
(есть атом(ы), принадлежащий(е) одновременно
3 циклам, то есть возле него нет атомов
водорода или заместителей), общее число
пи-электронов не соответствует правилу
Хюккеля (фенален, пирен, коронен). Также
предсказывается, что если удастся
синтезировать молекулы в форме ленты
Мёбиуса (кольцо достаточно большого
размера, дабы закручивание в каждой
паре атомных орбиталей было мало), то
для таких молекул система из 4n электронов
будет ароматичной, а из 4n+2 электронов —
антиароматичной.
24.Химические свойства бензола.
Для
бензола характерны реакции замещения —
бензол реагирует с алкенами, хлоралканами,
галогенами, азотной и серной кислотами.
Реакции разрыва бензольного кольца
проходят в жёстких условиях (температура,
давление).
-
Взаимодействие
с хлором в присутствии катализатора:
С6H6
+ Cl2
-(FeCl3)→
С6H5Cl
+ HCl образуется хлорбензол
Катализаторы
содействуют созданию активной
электрофильной частицы путём поляризации
между атомами галогена.
Cl-Cl
+ FeCl3
→ Clઠ—[FeCl4]ઠ+
С6H6
+ Clઠ—-Clઠ+
+ FeCl3
→ [С6H5Cl
+ FeCl4]
→ С6H5Cl
+ FeCl3
+ HCl
В
отсутствие катализатора при нагревании
или освещении идёт радикальная реакция
замещения.
С6H6
+ 3Cl2
-(освещение)→ C6H6Cl6
образуется смесь изомеров
гексахлорциклогексана
-
Взаимодействие
с бромом (чистый):
С6H6
+ Br2
-(FeBr3
или AlCl3)→
С6H5Br
+ HBr образуется бромбензол
-
Взаимодействие
с галогенопроизводными алканов
(алкилирование бензола, реакция
Фриделя-Крафтса):
С6H6
+ С2H5Cl
-(AlCl3)→
С6H5С2H5
+ HCl образуется этилбензол
С6H6
+ HNO3
-(H2SO4)→
С6H5NO2
+ H2O
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #