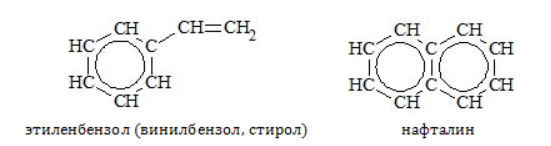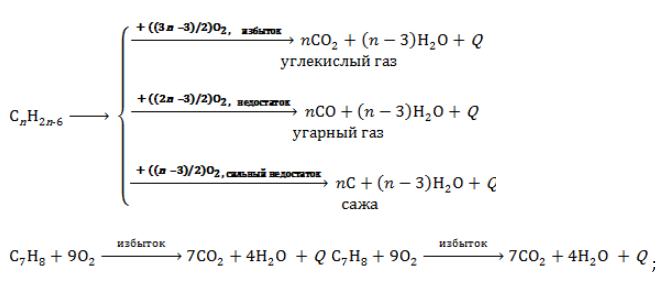Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
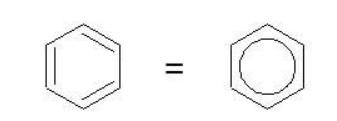
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
Структурная формула бензола:
Сокращенная структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов
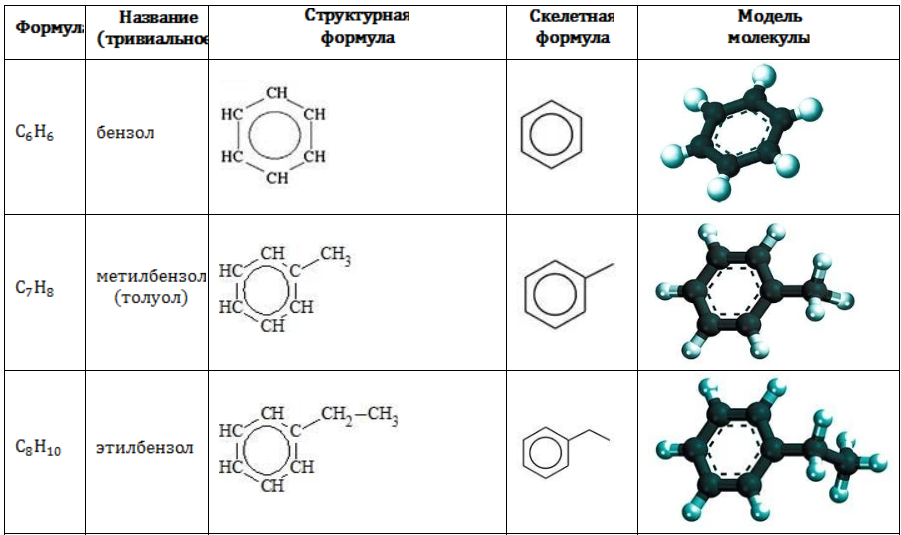
Простейший представитель гомологического ряда аренов — бензол:
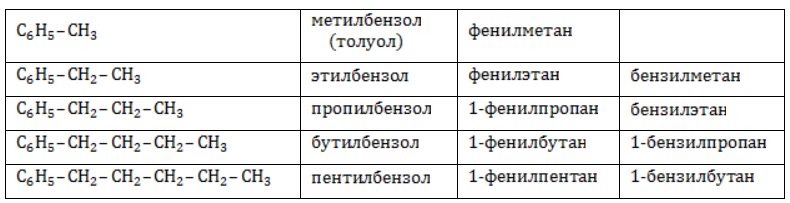
Ближайший гомолог бензола – толуол (метилбензол):
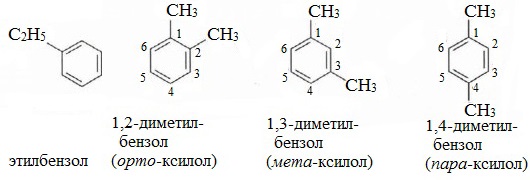
Еще один представитель гомологического ряда бензола – этилбензол:
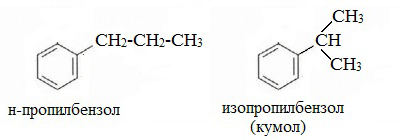
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
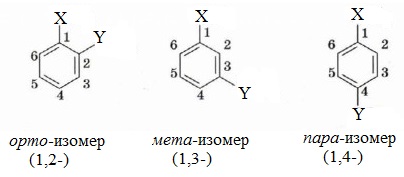
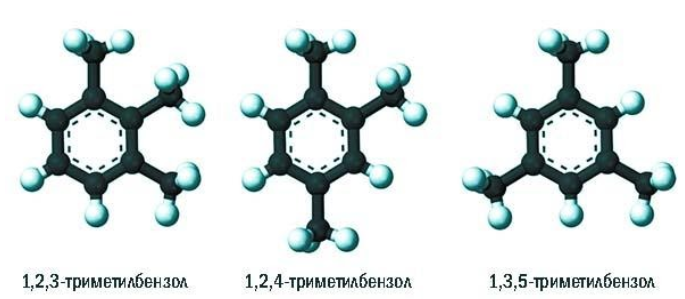
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
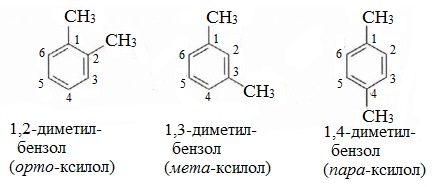
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
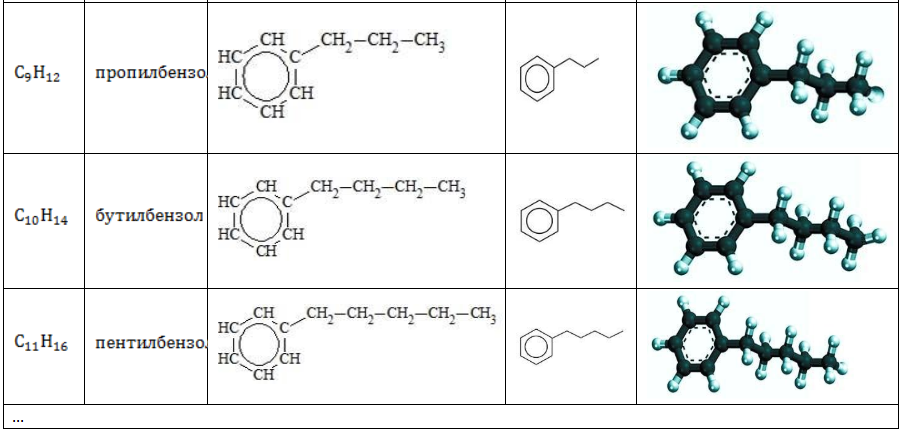
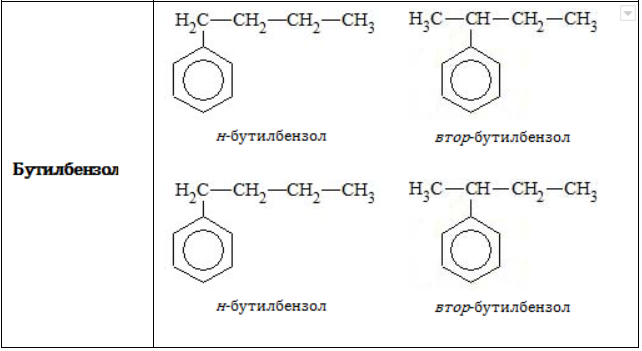
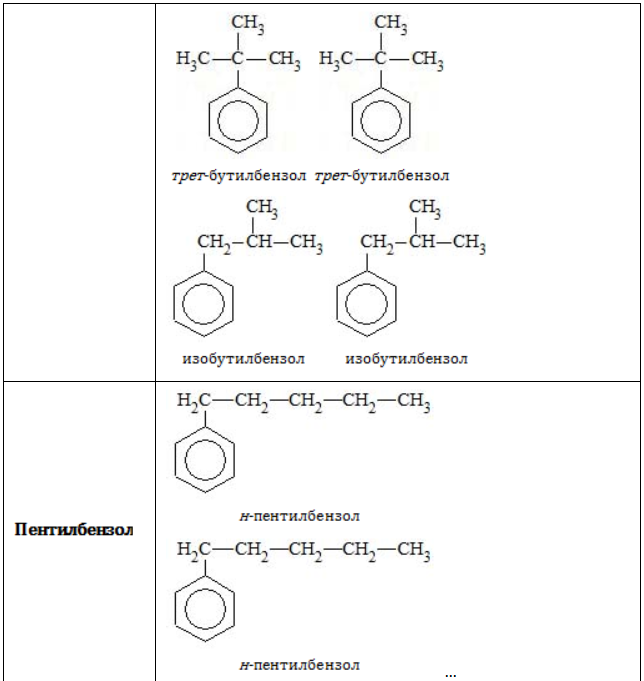
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол
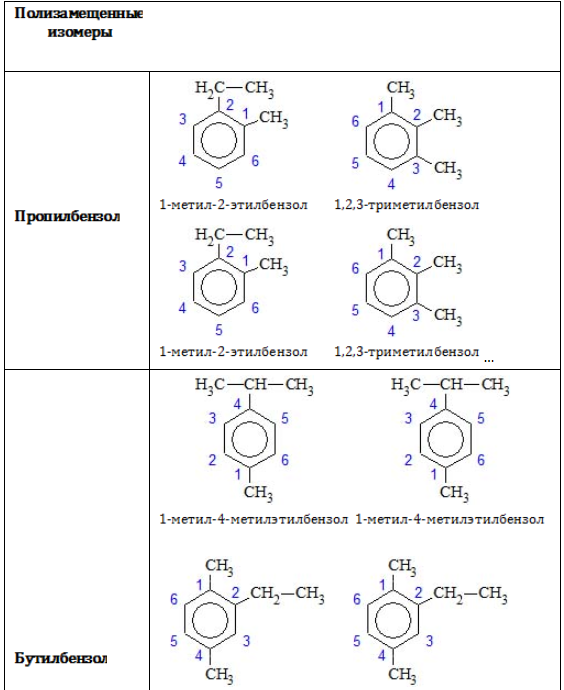
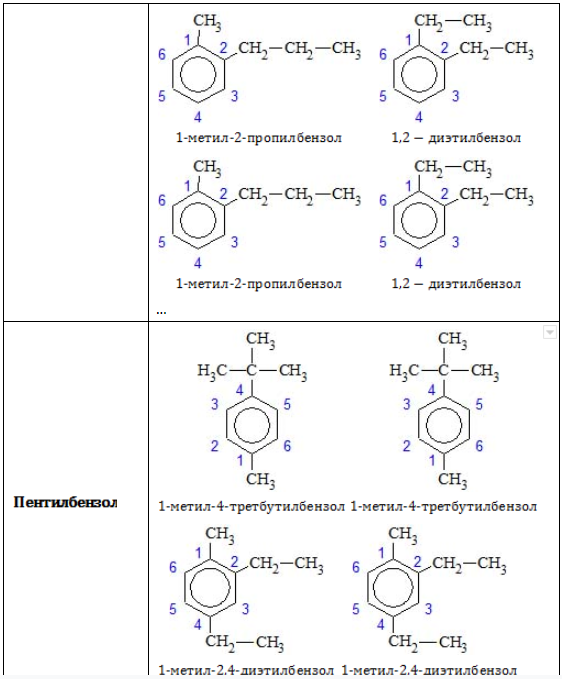
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Кристина Фанилевна Садыкова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
При обсуждении строения бензола ранее уже было отмечено, что во второй половине XIX в. помимо формулы Кекуле для него было предложено несколько других альтернативных структурных формул, важнейшими из которых являются формулы Дьюара, Ладенбурга и Хюккеля:
Рисунок 1.
На протяжении почти ста лет эти структурные формулы рассматривались исключительно как плод изощренного и богатого воображения химиков-органиков, не способные к реальному существованию в качестве валентных изомеров бензола. Однако в период 1963-1973 гг. все они были получены благодаря блестящим работам Ван-Тамелена, Вильцбаха, Катца и других исследователей.
Изомерия бензола
Проблема изомерии бензола довольно стара, но тем не мение продолжает оставаться актуальной и в наши дни.
Теоретическое число изомеров бензола достаточно велико — оно составляет 217 возможных конфигураций. Однако говоря об изомерах бензола обычно выделяют только валентные изомеры. Термин «валентный» в данном случае означает, что рассматриваются те структуры, которые состоят только из групп $C-H$, то есть общую формулу можно записать как $(C-H)_6$. Разница между отдельными представителями состоит, в перераспределении связей между атомами углерода. Это резко сокращает число рассматриваемых изомерных структур, делая задачу реально выполнимой.
Валентные изомеры бензола сведены в отдельную таблицу:
Рисунок 2.
«Получение валентных изомеров бензола» 👇
Первая дата в нижней строке таблицы показывает, когда была предложена данная формула, вторая — когда осуществлен синтез и доказано строение.
О валентных изомерах бензола известно недостаточно. Некоторые из них были получены и охарактеризованы лишь недавно.
Бензол
Изомер № 1 — бензол — бесцветная жидкость со своеобразным «ароматическим» запахом. Открыт Майклом Фарадием в 1825 году в продуктах пиролиза китового жира. Синтезировал его Ейльгард Мичерлих в 1833 году с бензойной кислоты. Формулу предложил Фридрих Август Кекуле в 1858 году. Смешивается со многими органическими жидкостями, ограниченно растворим в метаноле, слегка растворим в воде (0,7 г в 100 г воды) и сам немного растворяет воду (0,5 г на 100 г бензола). Почти не растворим в этиленгликоль и глицерине. Растворяет жиры, каучуки, серу, белый фосфор, йод. Горит сильно коптят небо пламенем. Участвует, как правило, в реакциях замещения, при которых сохраняется «ароматический секстет» (6 $pi$-электронов в кольце). Реакции присоединения известны, но ограничены небольшим числом реагентов.
Долгое время бензол добывали из каменноугольной смолы. В настоящее время его получают пиролизом фракции нефти, выкипает при 62-85$^circ$ С. Из-за канцерогенных свойств его использование строго регламентировано: предельно допустимая концентрация в воздухе — 5 мг/м$^3$. Бензол резко отличается от других соединений с общей формулой $C_6H_6$. Имея секстет $pi$-электронов, высокую симметрию плоской молекулы с наиболее благоприятными длинами связей и величинами валентных углов, только он один обладает ароматическими свойствами и намного превосходит по устойчивости все другие изомеры.
Бициклопропил-2-енил
Изомер № 2 — 1-(циклопропил-2-енил)-циклопропил-2-ен (бициклопропил-2-енил) был синтезирован В.Е. Биллапсом с сотрудниками в 1989 году только в виде растворов. Он оказался довольно нестабильным: выше -10$^circ$С полимеризуется, а в присутствии $AgBF_4$ при 0$^circ$С — изомеризуется в бензол Дьюара (3). Его строение было доказано на основании спектров ЯМР.
Бицикло [2.2.0]гексадиен-2,5
Изомер №3 (бицикло [2.2.0]гексадиен-2,5) назван в честь Джеймса Дьюара, который обсуждал в 1867 году возможные формулы бензола. Получил его впервые Е.Е. Ван Тамела с сотрудниками в 1963 году с выходом 20%, причем только в виде растворов, так как он очень неустойчив. Строение доказано спектральными методами. При 90$^circ$ С углеводород (3) за 30 минут полностью изомеризуется в единый продукт — бензол. При комнатной температуре полупериод преобразования составляет около двух суток. Более устойчивый во времени гексаметилбензол Дьюара получают из 2-бутина и безводного $AlCl_3$.
Бензвален
Изомер № 4 — бензвален (трицикло гекс-3-ен). Его формулу предсказал Эрих Хюккель еще в 1937 году. Синтезировал этот углеводород Т.Дж. Кац с сотрудниками только в 1999 году (выход 45%). Это бесцветная жидкость, способная взрываться от трения или удара, однако его растворы вполне стабильны. В небольшом количестве получается при облучении бензола УФ-светом. Известны устойчивые производные бензвалена с трет-бутильными заместителями.
Призман
Изомер №5 (Призман, трипризман, тетрациклогексан) назван в честь Альберта Ладенбурга, который предложил эту структуру. Его также получили в чистом виде Т.Дж. Кац с сотрудниками в 1973 году с выходом 2%.
Рисунок 3.
Это бесцветная взрывоопасная жидкость, устойчивая, однако, при комнатной температуре. При 90$^circ$С в толуоле за 11 часов наполовину превращается в бензол.
Бензмебиусстрипан
Изомер № 6 заслуживает особого рассмотрения. Его можно назвать по номенклатуре IUPAC как тетрацикло [2.2.0.02,5 — .03,6] гексан. Теоретически возможную формулу (6) придумал румынский ученый Александру Балабан в 1965 году, назвав ее бензмебиусстрипаном за сходства с лентой Мебиуса. Одно из отличительных свойств этой ленты — хиральность, то есть она может быть правой и левой. Согласно с этим названием и в отличие от валентных изомеров (1) — (5), модель изомера № 6 также может быть представлена парой зеркально симметричных структур (6а) и (6б) (для большей наглядности только два атома углерода показаны черным цветом, а атомы водорода опущены):
Рисунок 4.
Примечательно, что модели типа (6а) и (6б) удается собрать и оптимизировать только с помощью примитивных методов молекулярной механики (например, ММ+). Если отвлечься от исходных для расчета связностей атомов углерода и принять во внимание вычисленные порядки связей, получается, что в результате оптимизации геометрии бензол Балабана (6) перешел в бензол Дьюара (7), или то же, что и (3):
Рисунок 5.
Исходя из сказанного следует, что стабильное вещество с формулой № 6 вряд ли когда-нибудь будет получено. Попытки его получить, скорее всего, приведут к бензолу Дьюара или обычному бензолу. Таким образом, изомер № 6 следует квалифицировать как «теоретический», поскольку он может существовать только в виде короткоживущего переходного состояния.
Диагональная формула бензола
Формулы (6а) и (6б) непосредственно связаны с так называемой диагональной формуле бензола (8), предложенной еще в 1867 году А.Клаусом:
Рисунок 6.
Формула Клауса была давно отвергнута и почти забыта, поскольку считалась плоской и предусматривала физически невозможно сечение химических связей $C-C$. Теперь ее можно вернуть, поставив в один ряд с формулами других валентных изомеров бензола как одну из проекций трехмерных структур (6а) и (6б).
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Ароматические углеводороды рассматриваются как производные бензола, в молекуле которого атомы водорода замещены на радикалы. Если таких радикалов несколько, то атомы углерода бензольного кольца нумеруются так, чтобы сумма цифр в названии была наименьшей. Начинают нумерацию от старшего заместителя к младшему.
Используются также рациональные названия: толуол (метилбензол), ортоксилол ((1),(2)-диметилбензол), метаксилол ((1),(3)-диметилбензол), параксилол ((1),(4)-диметилбензол), кумол (изопропилбензол) и др.
В таблице показаны примеры нумерации атомов углерода в бензольном кольце и приведены названия веществ.
|
Структурная формула арена |
Название |
|
|
(1),(3)-диметилбензол (метаксилол) |
|
|
(1)-метил-(2)-этилбензол |
Гомологам бензола характерна структурная изомерия, которая может быть обусловлена:
- разным расположением углеводородных радикалов в бензольном кольце;
- разным строением боковых углеводородных радикалов.
Структурная изомерия в гомологическом ряду бензола возможна при числе атомов углерода не меньше (8). Бензол и метилбензол изомеров не имеют.
В таблице приведены формулы и названия некоторых изомеров, имеющих состав
C9H12
.
|
Структурная формула изомера |
Название |
|
|
пропилбензол |
|
|
изопропилбензол (кумол) |
|
|
(1)-метил-(2)-этилбензол |
|
|
(1)-метил-(3)-этилбензол |
|
|
(1),(2),(3)-триметилбензол |
|
|
(1),(2),(4)-триметилбензол |
Изомерия гомологов бензола
Структурная изомерия в ряду бензола обусловлена взаимным расположением заместителей в кольце.
Простейший гомолог бензола — толуол (метилбензол) не имеет таких изомеров, т.к. все шесть атомов водорода в молекуле бензола совершенно одинаковы и при замещении любого из них на один и тот же радикал образуется одно и то же соединение.
Если с кольцом связаны два заместителя, то они могут находиться в трех разных положениях относительно друг друга. Положения заместителей указывают цифрами или обозначают словами: (положение 1, 2-) орто (о-), (положение 1, 3-) мета (м-), (положение 1, 4-) пара (п-):
Структурная изомерия
1) Положения заместителей для ди- , три- и тетра-замещенных бензолов (например, о- , м- и п-ксилолы).
2) Углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода.
3) Изомерия заместителей.
Например, молекулярной формуле С8Н10 соответствует 4 изомера:
этилбензол C6H5-C2H5 и три ксилола CH3-C6H4-CH3 (о- , м- , п-изомеры).
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Ароматические углеводороды (арены)
Содержание
- 1 Строение ароматической связи
- 2 Гомологический ряд бензола
- 3 Номенклатура и изомерия алкилбензолов
- 3.1 Строение углеродного скелета
- 3.2 Позиции одинаковых заместителей
- 4 Физические свойства некоторых алкилбензолов
- 5 Химические свойства алкилбензолов
- 5.1 Замещение
- 5.2 Присоединение
- 5.3 Окисление
- 6 Взаимодействие радикалов с бензольным ядром
- 7 Заключение
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи
Химическая формула бензола – C6H6. Бензольная молекула – это циклическое образование, построенное из шести -гибридизованных углеродных атомов, каждый из которых соединен с одним атомом водорода.
Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных
-связей и
-облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.
При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.
Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено
углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:
Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:
Арильные (содержащие бензольное ядро) радикалы носят следующие названия:
Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов
Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета
В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.
При наименовании алкилбензолов соблюдаются следующие правила:
- ароматический цикл считается главной цепью и носит название «бензол»;
- алкильный заместитель указывается перед главной цепью: «метилбензол»;
- в случае если радикалов более одного, их позиции нумеруются в направлении кратчайшего промежутка между ними: «1,2», «1,3», «1,4», но не «1,5» или «1,6»;
- количество одинаковых заместителей обозначается после их номеров греческими численными приставками: «1,2-диметилбензол»;
- разные заместители перечисляются по старшинству: «1,2-диметил-4-бутилбензол»;
- посредством приставок «н-», «втор-» или «трет-» указывается, по какому углеродному атому в заместителе (первичному, вторичному или третичному) осуществляется связь с бензольным ядром: «1,2-диметил-4-трет-бутилбензол».
Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:
Например, дизамещенные изомеры этилбензола (имеют распространенное тривиальное наименование «ксилолы») образуют следующие изомеры по позициям метильных заместителей:
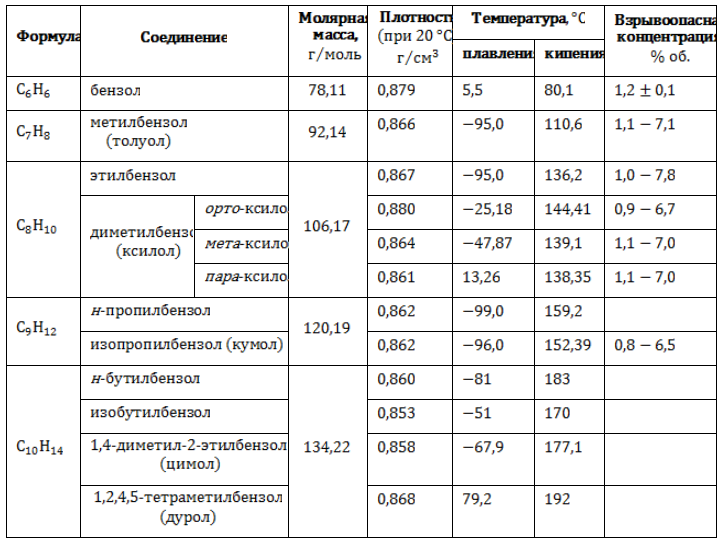
Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
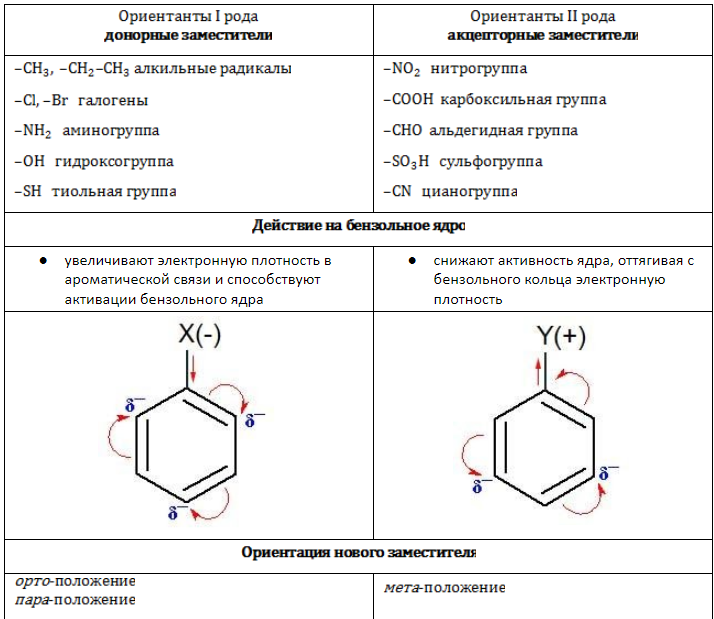
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
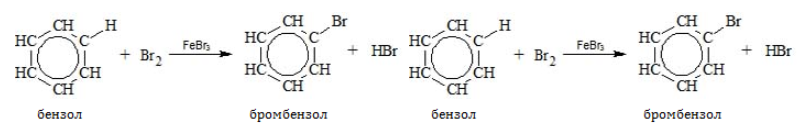
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
- Галогенирование
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:
В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:
Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:
При этом галоген атакует ближайший к кольцу углеродный атом.
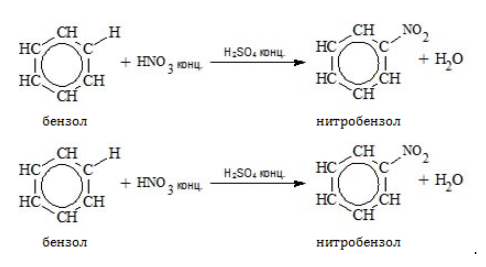
- Нитрование
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:
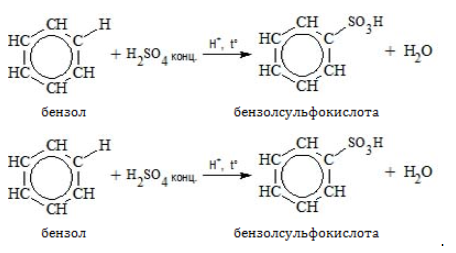
- Сульфирование
Бензол сульфируется концентрированной или «дымящей» кислотой (олеумом):
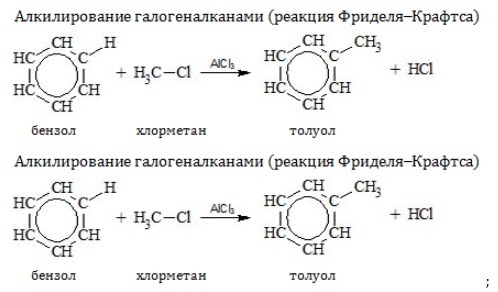
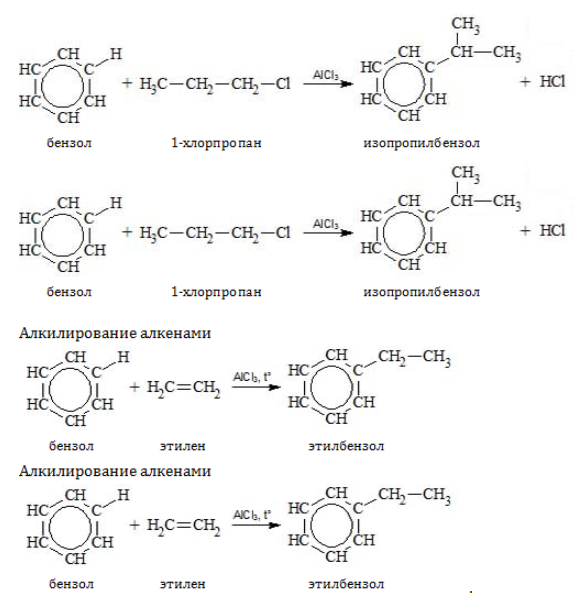
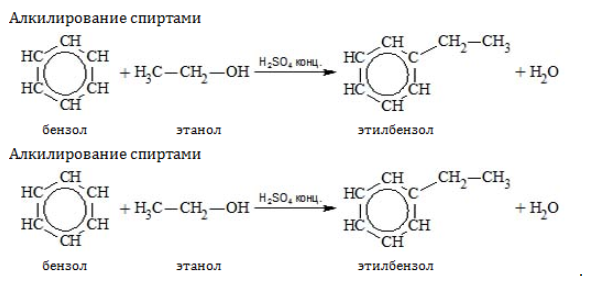
- Алкилирование
Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:
Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:
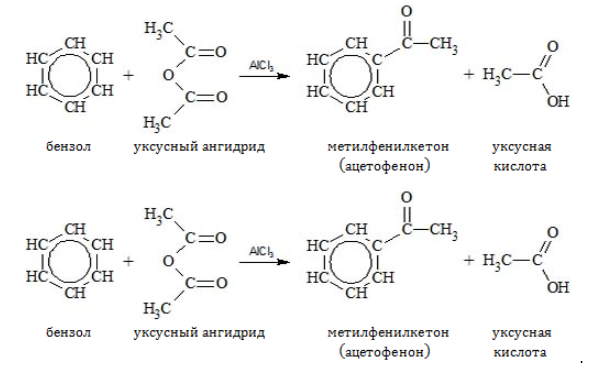
- Ацилирование
Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
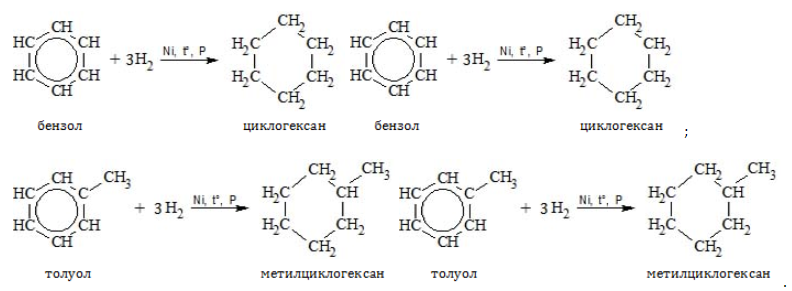
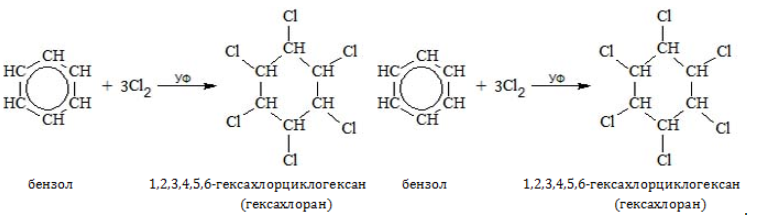
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.
- Гидрирование
- Хлорирование
Из всех соединений гомологического ряда хлор присоединяется только к бензолу:
При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
- Жесткое окисление
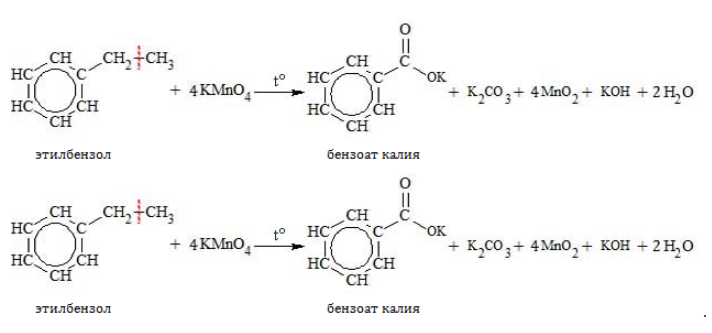
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:
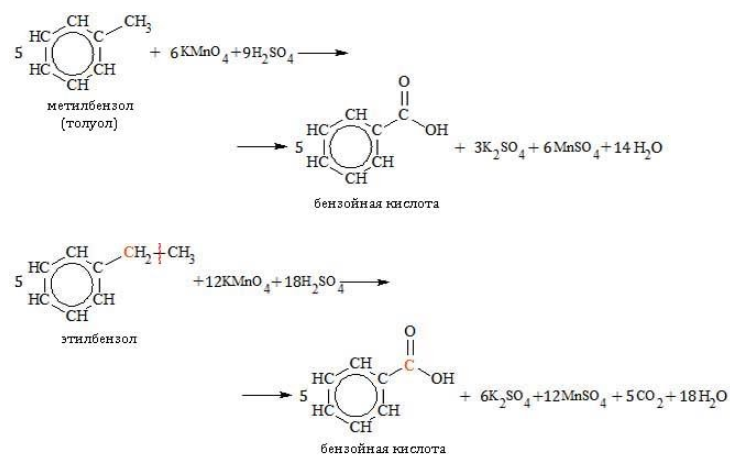
В кислой среде происходит образование бензойной кислоты:
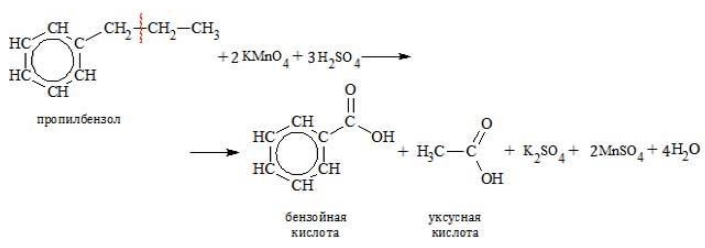
Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:
Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:
- Полное окисление
Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:
Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Это интересно:
Изомеры пентена
Общая формула циклоалканов
Окисление алкенов перманганатом калия
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.