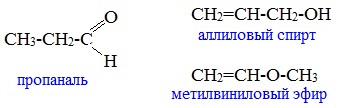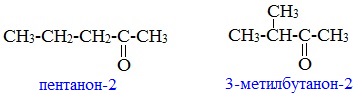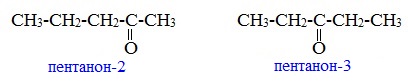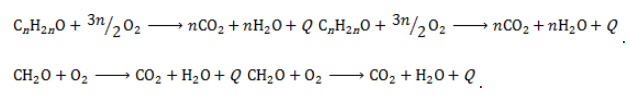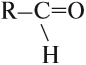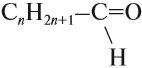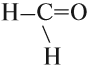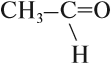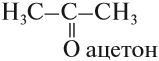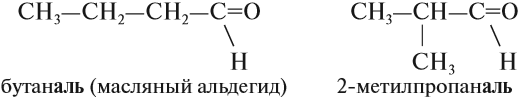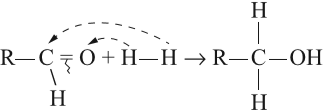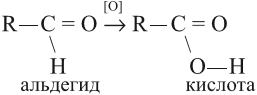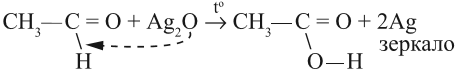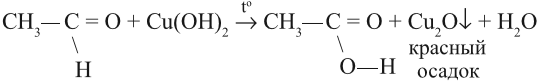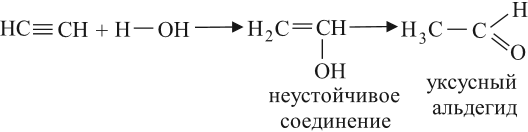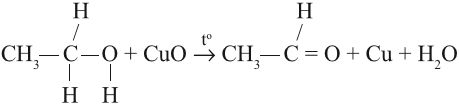Изомерия альдегидов и кетонов
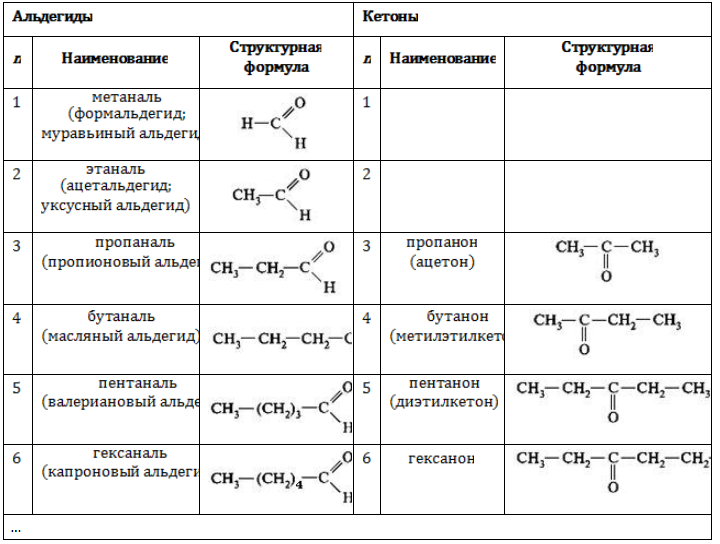
Для альдегидов и кетонов характерна структурная изомерия.
Для карбонильных соединений возможна пространственная изомерия: оптическая (если углеводородный радикал содержит асимметрический углеродный атом, как, например, в глицериновом альдегиде CHO-C*H (OH) -CH2OH) и цис-транс-изомерия (например, в кротоновом альдегиде CH3-CH=CH-CHO).
Изомерия альдегидов
1. Изомерия углеродного скелета, начиная с С4
с кетонами, начиная с С3
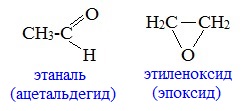
с циклическими оксидами (с С2)
с непредельными спиртами и простыми эфирами (с С3)
Изомерия кетонов
1. Изомерия углеродного скелета (c C5)
2. Изомерия положения карбонильной группы (c C5)
3. Межклассовая изомерия (аналогично альдегидам).
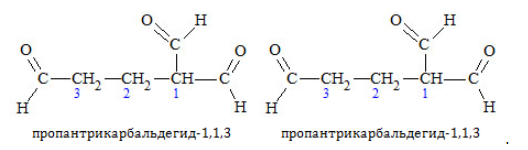
Изомеры валерианового альдегида
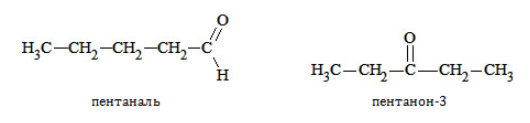
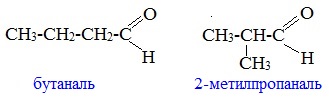
Пример – изомеры масляного альдегида
Альдегиды и кетоны
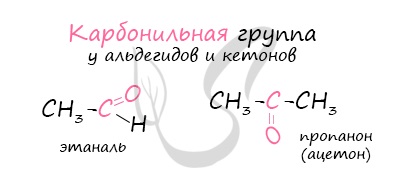
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Строение карбонильных соединений
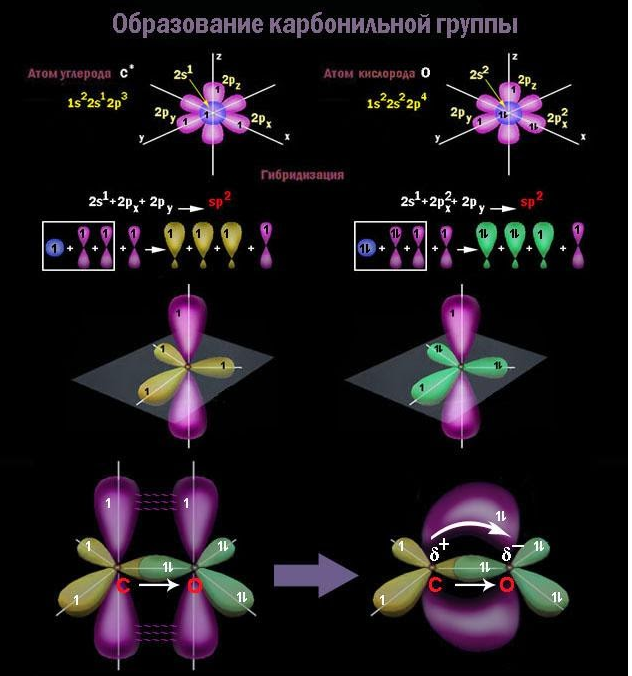
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.
π-Связь образована р-электронами атомов углерода и кислорода.
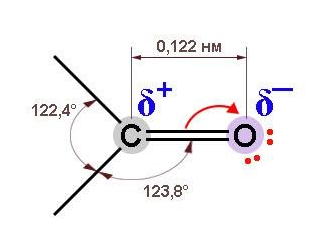
Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
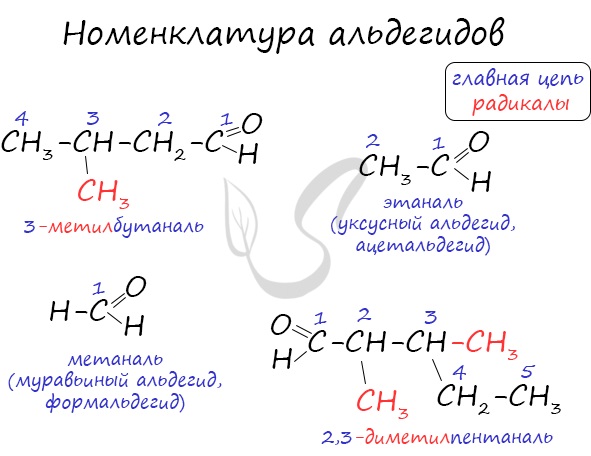
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь
- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.
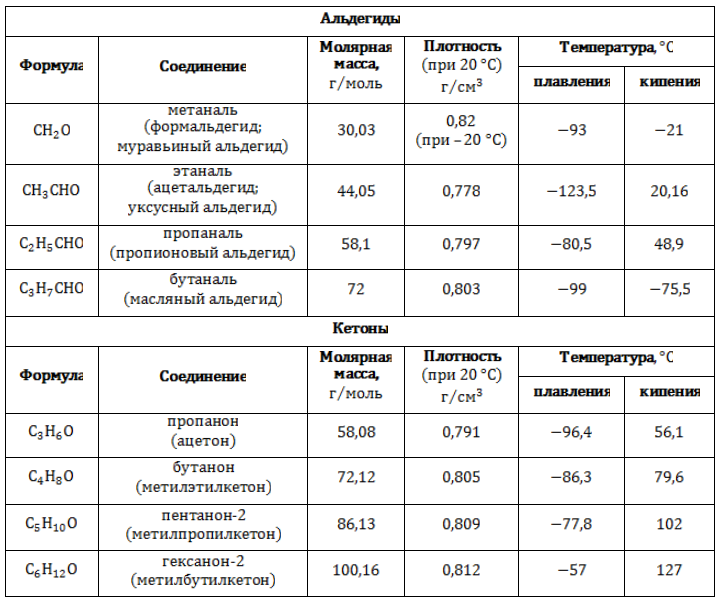
- Тривиальные названия альдегидов и кетонов приведены в таблице.
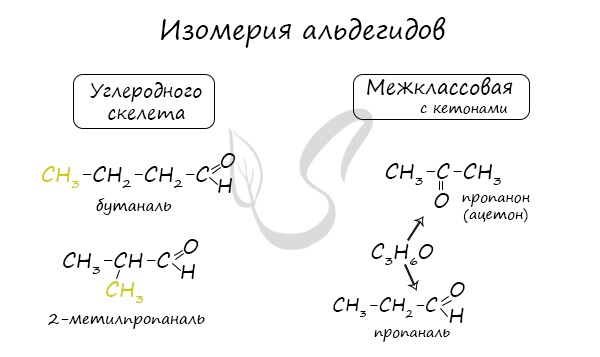
Изомерия карбонильных соединений
Изомерия альдегидов
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
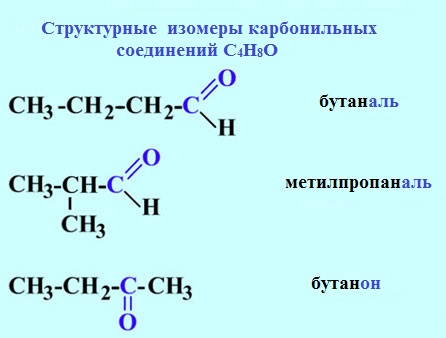
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
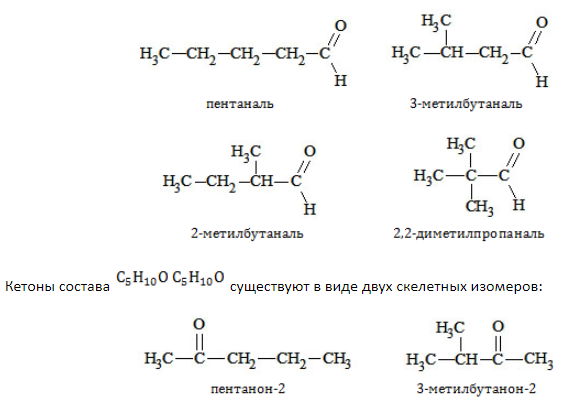
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
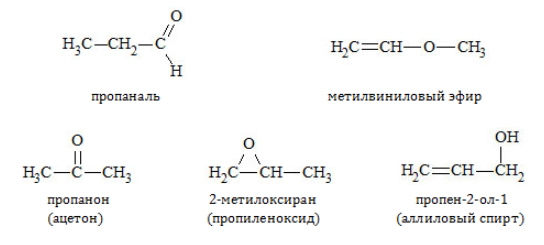
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Содержание
- 1 Строение альдегидов и кетонов
- 1.1 Карбонильная группа
- 1.2 Общая структура молекул альдегидов и кетонов
- 2 Номенклатура
- 3 Гомологические ряды альдегидов и кетонов
- 4 Изомерия кетонов и альдегидов
- 4.1 Позиция функциональной группы
- 4.2 Строение углеродного скелета
- 4.3 Межклассовая изомерия
- 5 Физические свойства
- 6 Химические свойства
- 7 Получение альдегидов и кетонов
- 8 Применение карбонильных соединений
К кислородсодержащим производным углеводородов, содержащим в молекуле функциональную группу , относятся альдегиды и кетоны. Отличаясь друг от друга по ряду свойств, эти вещества характеризуются заметным сходством. Изомерия альдегидов и кетонов также имеет общие черты, обусловленные близостью строения.
Строение альдегидов и кетонов
Определяющий элемент структуры производных углеводородов – функциональная группа атомов. Она служит критерием для отнесения соединения к тому или иному классу органических веществ.
Карбонильная группа
Группа называется карбонилом. Она образована посредством двойной связи, поскольку оба входящих в ее состав атома – углерод и кислород – sp2-гибридизованы.
В карбонильной группе атом углерода затрачивает на -связь одну из трех валентностей, образованных гибридными sp2-облаками, и на
-связь – валентность, создаваемую единственным негибридным 2p-облаком. Кислородный атом вступает в
-связь с углеродом, затрачивая единственную свободную гибридную орбиталь, и в
-связь – через 2p-орбиталь аналогично углероду. Два оставшихся гибридных облака кислорода содержат неподеленные электронные пары и не создают свободных валентностей.
Благодаря высокой электроотрицательности кислород оттягивает в свою сторону электронную плотность по обоим компонентам двойной связи, и она оказывается сильно поляризованной. За счет -электронов, обладающих большой подвижностью и легко смещающихся к кислороду, дипольный момент связи C=O почти вчетверо выше, чем у одинарной связи С-O, характерной для спиртов.
На диполе C=O кислород обладает частичным отрицательным, а углерод – положительным зарядом. Это приводит к поляризации связей С-O у соседнего с карбонилом углеродного атома (отрицательный индуктивный, или I-эффект) и оказывает влияние на химические свойства.
Общая структура молекул альдегидов и кетонов
Состав карбонильных соединений описывается общей формулой . Различия между альдегидами и кетонами состоят в разном строении углеводородных остатков.
В альдегидах одна из свободных валентностей углерода группы присоединяет алкильный радикал, а вторая – атом водорода. В кетонах обе валентности связывают карбонил с алкильными остатками. Общее строение молекул соединений обоих классов имеет следующий вид:
Номенклатура
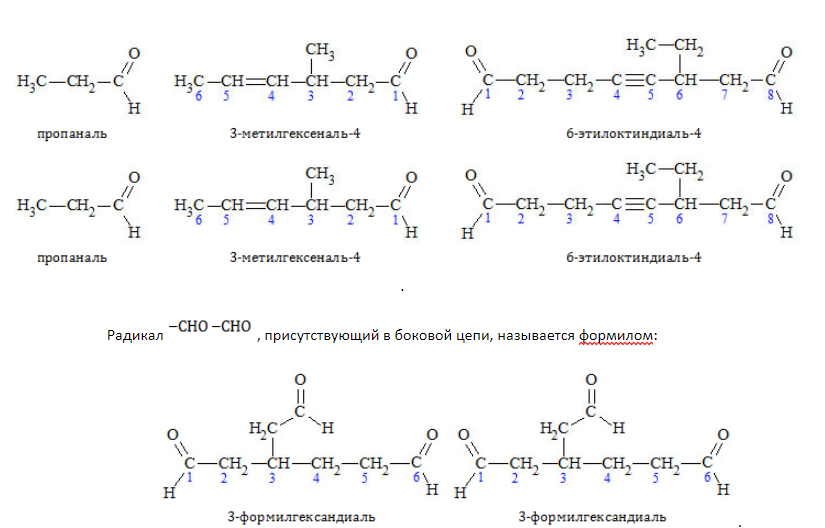
Наименования альдегидов строятся путем прибавления суффикса «-аль» либо «-диаль» к названию углеводорода, представляющего алкильный остаток. Нумерацию цепи начинают от углеродного атома, входящего в состав карбонила, но в наименовании локант «1» не указывается:
Если радикал -CHO (альдегидная группа) присоединяется непосредственно к одному из атомов углеродной цепи, он считается равноправным с другими альдегидными группами. В этом случае группы -CHO получают наименование «карбальдегид», не участвуют в нумерации и указываются после названия углеводорода:
Наименования кетонов составляются путем добавления суффикса «-он» либо «-дион» к названию образующего главную цепочку углеводорода:
Гомологические ряды альдегидов и кетонов
Ряды, образуемые насыщенными карбонильными соединениями, представлены в таблице:
Это интересно:
Гомологический ряд алкенов
Гомологический ряд алкадиенов
Гомологический ряд алканов
Изомерия кетонов и альдегидов
Соединения состава образуют изомеры по структурным признакам: строению образующей молекулу углеродной цепи, местоположению карбонильных групп и наличию изомеров в других классах органических веществ.
Позиция функциональной группы
Изомерия данного типа свойственна кетонам с :
Строение углеродного скелета
Изомерия по отсутствию либо наличию и характеру ветвления углеродной цепи свойственна всем карбонильным соединениям: альдегидам с и кетонам с
. Ацетальдегид и формальдегид изомеров не имеют.
Например, альдегиды состава образуют изомеры:
Межклассовая изомерия
Из единой для двух классов соединений общей формулы следует, что альдегиды и кетоны одинакового атомного состава – взаимные изомеры:
Кроме того, они обладают межклассовой изомерией с такими соединениями, как:
Физические свойства
Формальдегид и уксусный альдегид в стандартных условиях – токсичные газы с резким запахом. Альдегиды и кетоны с C3 по C12– жидкости.
Поскольку в группе отсутствует поляризованный водород, молекулы не могут быть ассоциированы посредством водородных связей, и жидкие карбонильные соединения более летучи, чем соответствующие спирты. Однако они растворяются в воде за счет взаимодействия кислорода карбонильной группы и поляризованных водородных атомов молекулы воды.
Химические свойства
Химические свойства альдегидов и кетонов определяются в первую очередь группой , благодаря которой эти вещества химически активны. При этом альдегиды отличаются большей реакционной способностью, чем кетоны.
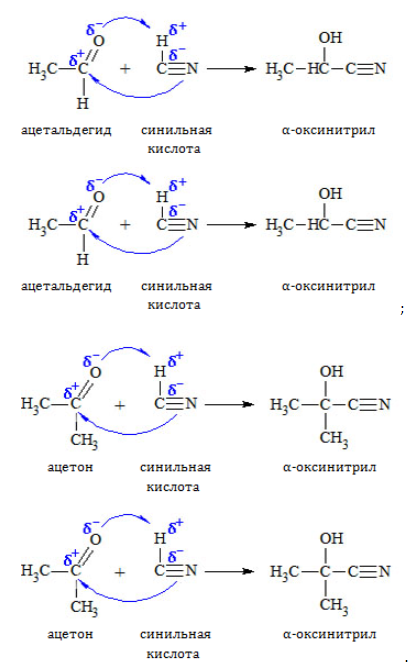
1. Присоединение к карбонилу по месту двойной связи
Синильная кислота присоединяются по нуклеофильному механизму:
Аналогично протекают реакции присоединения солей и спиртов.
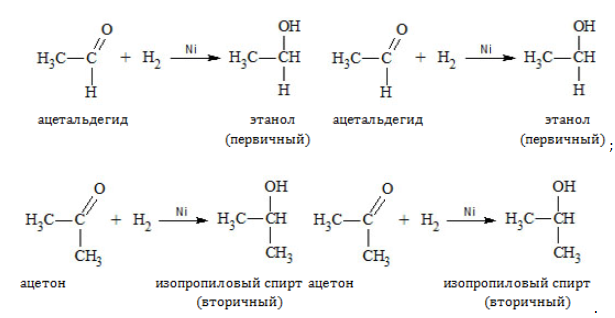
При восстановлении (гидрировании) присоединение водорода идет на катализаторе:
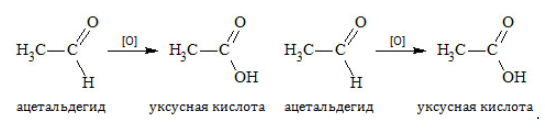
2. Окисление
К действию окислителей альдегиды и кетоны относятся различно. Альдегиды охотно вступают в реакцию и в мягких условиях благодаря наличию водорода при карбонильной группе, которая окисляется до карбоксильной. Продукт реакции – кислота:
Альдегиды дают качественные реакции при окислении свежеприготовленным гидроксидом меди или реактивом Толленса (оксид серебра в аммиачном растворе):
Кетоны ведут себя подобно третичным спиртам и не реагируют со слабыми окислителями. Под действием сильных окислителей происходит распад молекулы кетона.
Карбонильные соединения горят с выделением тепла по схеме:
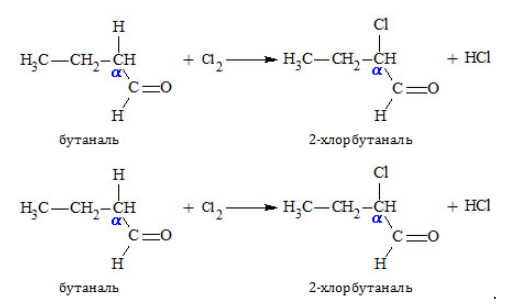
3. Реакции в алкильном радикале
Карбонил оказывает влияние на реакционную активность углеводородного остатка, сообщая особую подвижность водородным атомам, стоящим при α-расположенном (соседнем с группой ) углероде. Этот водород легко подвергается замещению, например, галогеном:
Получение альдегидов и кетонов
- Окисление и дегидрирование спиртов
- Гидролиз дигалогенпроизводных
- Гидратация алкинов
- Дегидрирование спиртов. Процесс протекает на катализаторе (оксид меди) с нагреванием:
Применение карбонильных соединений
Благодаря высокой реакционной активности соединения, содержащие карбонил, широко используются в различных сферах.
- Альдегиды
Формальдегид лидирует по объемам мирового производства. Он применяется в фармацевтике, производстве полиуретанов, смол, взрывчатых веществ. Используется в качестве консерванта биопрепаратов и в сельском хозяйстве для обработки зерна.
Ацетон
Уксусный альдегид – основа для получения этанола, уксусной кислоты, бутадиена и других востребованных промышленностью веществ.
Альдегиды играют значительную роль в синтезе спиртов и карбоновых кислот, душистых веществ и антиоксидантов.
- Кетоны
Ацетон – один из самых распространенных органических растворителей, компонент лаков, красок, клеев. Используется в производстве различных реактивов.
Бутанон (метилэтилкетон) и другие низшие кетоны также являются эффективными растворителями и находят применение в химической промышленности, например, в производстве полимерных материалов.
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа
в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных.
Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь,
этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь —
CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином
называется 40% раствор формальдегида.
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
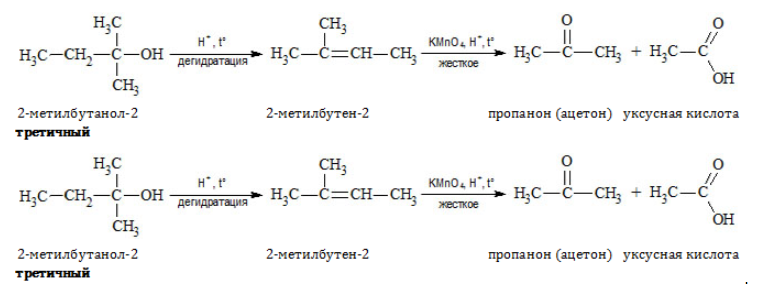
Получение альдегидов и кетонов
- Окисление спиртов
- Пиролиз солей карбоновых кислот
- Каталитическое дегидрирование спиртов
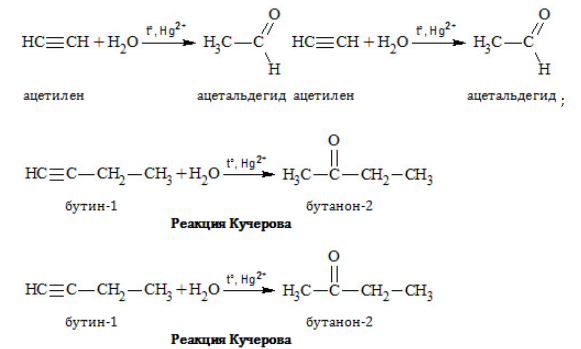
- Реакция Кучерова
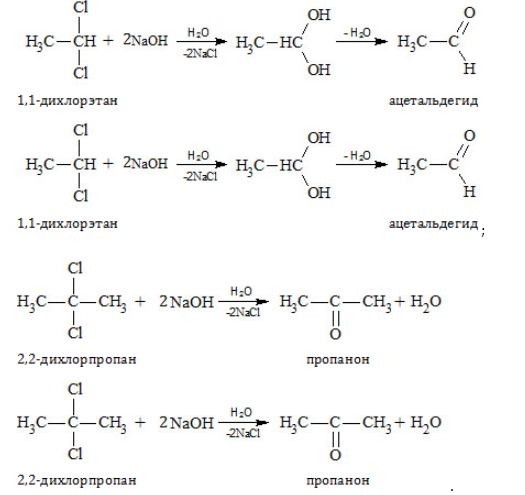
- Гидролиз дигалогеналканов
- Окисление метана
- Кумольный способ получения ацетона (и фенола)
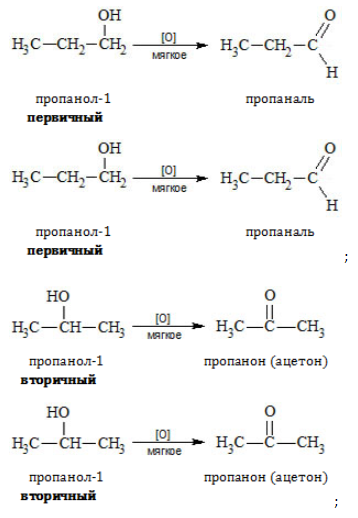
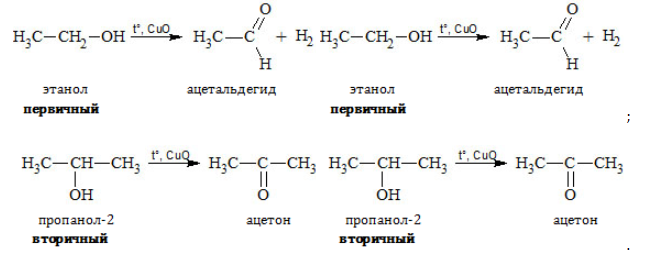
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
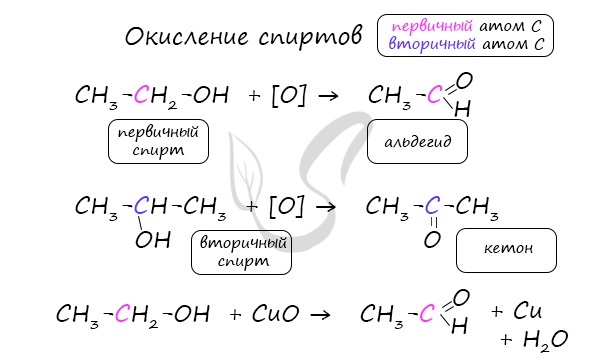
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или
бариевых солей карбоновых кислот возможно получение кетонов.

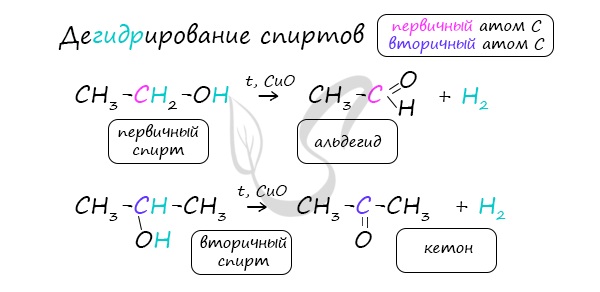
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по
атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в
соответствующие кетоны.

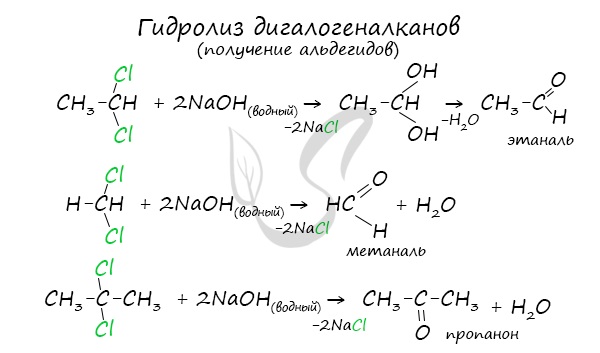
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы
и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
- Реакции присоединения
- Окисление альдегидов
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный
элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме
углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить
при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
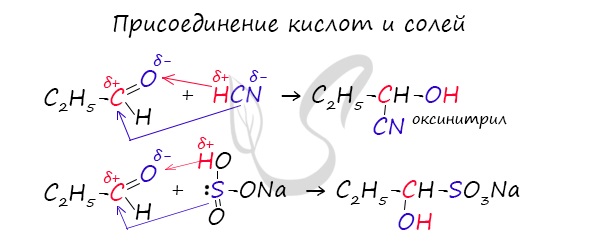
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе.
Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
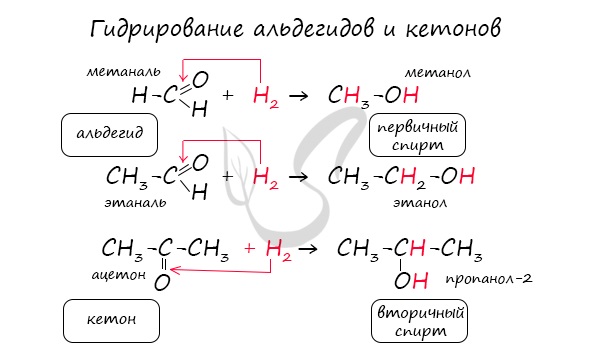
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH3CHO + 5O2 → 4CO2 + 4H2O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции
серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая
распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для
альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Содержание
- Определение. Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства альдегидов
- Физические свойства
- Химические свойства
- Получение и применение альдегидов на примере уксусного альдегида
- Выводы
Определение. Гомологический ряд, номенклатура, изомерия
Альдегиды — это производные углеводородов, которые содержат альдегидную группу:
Альдегидная группа состоит из карбонильной группы С=О, соединённой с атомом водорода. Карбонильная группа в молекулах альдегидов всегда находится на конце углеродной цепи.
Предельные альдегиды образуют гомологический ряд с общей формулой:
Если использовать эту общую формулу, то следует помнить, что минимальное значение n (числа атомов углерода) равно нулю.
Если n = 0 получаем
метанАЛЬ, муравьиный альдегид, формальдегид;
Если n = 1 получаем
этанАЛЬ, уксусный альдегид, ацетальдегид.
Вопрос. Какой суффикс обозначает наличие в молекуле альдегидной группы?
Названия альдегидов составляют, добавляя суффикс АЛЬ к названию соответствующего углеводорода. При этом учитываются все атомы углерода. Кроме того, используются тривиальные названия, которые совпадают с названиями соответствующих кислот (см. урок 24.1). И, наконец, для некоторых альдегидов используют названия, имеющие латинский корень, например формальдегид — от лат. formika — «муравей».
Задание 23.1. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
Начиная с n = 3 у альдегидов появляются изомеры положения карбонильной группы:
Задание 23.2. Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры. Является ли вещество (2) альдегидом?
Но при перемещении карбонильной группы в середину молекулы исчезает альдегидная группа: вещество (2) не альдегид, это — кетон:
По номенклатуре ИЮПАК кетоны называют, добавляя суффикс ОН к названию соответствующего углеводорода.
Задание 23.3. Составьте формулы и названия альдегидов с n = 4. Дайте им названия.
Изомерия альдегидов связана со строением углеводородного радикала:
Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.
Свойства альдегидов
Физические свойства
В альдегидах отсутствует гидроксогруппа, за счёт которой между молекулами спиртов возникали водородные связи.
Вопрос. Какие соединения (спирты или альдегиды) имеют бОльшую температуру кипения?
Поэтому альдегиды, в отличие от спиртов, легче испаряются, имеют меньшие температуры кипения. Например, формальдегид — газ с резким запахом, а метанол — жидкость. Низшие альдегиды могут растворяться в воде. Раствор формальдегида в воде (формалин) применяется в медицине, кожевенной промышленности. Его применение основано на том, что формальдегид активно реагирует с белками, вызывая в них необратимые изменения (денатурацию). Следовательно, формальдегид сильно ядовит.
Химические свойства
При рассмотрении строения молекулы альдегидов были сделаны выводы, что для них должны быть характерны реакции присоединения, замещения (в углеводородном радикале), и окисления.
Примером реакции присоединения к карбонильной группе может служить реакция гидрирования, т. е. присоединения водорода:
Вопрос. К какому классу относится полученное соединение? Назовите его.
При окислении альдегидов образуются кислоты:
Окисление альдегидов происходит даже при их хранении, т. е. в обычных условиях. Реакции окисления альдегидов используют для того, чтобы обнаружить их в растворах. Например, если к раствору альдегида добавить аммиачный раствор оксида серебра и нагреть, то на стенках сосуда появится зеркало. Это выделилось чистое серебро, которое блестящим тонким слоем покрыло стекло:
Эта реакция получила название «реакция серебряного зеркала».
Альдегид можно превратить в кислоту (окислить) и при помощи гидроксида меди (II). Если к осадку Сu(ОН)2 добавить раствор альдегида и нагреть, то образуется жёлтый осадок СuОН, переходящий в красный оксид меди (I). В результате образуется оранжевый осадок:
Если эту же смесь долго греть, то на стенках пробирки выделится в виде блестящего слоя чистая медь «медное зеркало». Поэтому эту реакцию часто называют реакцией «медного зеркала».
Запомните: реакции «серебряного зеркала» и «медного зеркала» — качественные реакции на альдегидную группу.
Задание 23.4. Составьте уравнения качественных реакций для формальдегида.
Вопрос. Можно ли при помощи гидроксида меди (II) различить растворы глицерина и уксусного альдегида? Укажите условия и эффекты обеих реакций.
Получение и применение альдегидов на примере уксусного альдегида
Уксусный альдегид получают в больших количествах при помощи реакции Кучерова*:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик, открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
В небольших количествах этот альдегид можно получить окислением этанола:
Задание 23.5. В уроках 20.3 и 22.4 посмотрите на соответствующие уравнения реакций; обратите внимание, за счёт каких атомов они происходят, и попробуйте составить аналогичные уравнения реакций:
- пропин + вода →
- пропанол-1 + СuО →
- пропанол-2 + СuО →
Сделайте вывод: всегда ли в этих реакциях получаются альдегиды?
Если Вы всё сделали правильно, в реакциях 1 и 3 получается ацетон (кетон), а в реакции 2 — пропаналь.
Уксусный альдегид применяют для получения уксусной кислоты, этилового спирта, лекарств и других веществ.
Выводы
Альдегиды — это производные углеводородов, содержащие альдегидную группу. Для них должны быть характерны реакции
- присоединения (за счёт карбонильной группы);
- замещения (в углеводородном радикале);
- окисления.