Как составлять изомеры
Одним из важнейших понятий в органической химии является — изомерия. Ее смысл заключается в том, что существуют вещества, различающиеся пространственным расположение своих атом или атомных групп, при этом обладающих одинаковой молекулярной массой и составом. В этом и заключается главная причина того что в природе наблюдается огромное разнообразие органических веществ.

Вам понадобится
- Как составить изомер рассмотрим на примере алкана C6H14
Инструкция
Сначала нужно составить формулу углеводородного скелета в неразветвленном виде, исходя из данных его молекулярной формулы.
С – С – С – С – С — С
Пронумеровать все атомы углерода.
1 2 3 4 5 6
С – С – С — С – С — С
Зная о том, что углерод четырехвалентен, подставить атомы водорода углеродную цепь.
1 2 3 4 5 6
СН3 — СН2 — СН2 — СН2 — СН2 — СН3
Уменьшите углеродную цепочку на один атом, расположив его в виде бокового ответвления. Важно понимать, что боковые атомы цепочки углерода не могут стать боковыми ответвлениями.
С — С — С — С — С
С
Со стороны, к которой ближе боковое ответвление начните нумерацию цепочки, а затем расставьте атомы водорода, соблюдая правила валентности.
1 2 3 4 5
СН3 – СН — СН2 — СН2 — СН3
СН3
Если есть возможность чтобы расположить боковое ответвление у других атомов углеродной цепи, составьте все возможные изомеры.
1 2 3 4 5
СН3 — СН2 – СН — СН2 — СН3
СН3
Если для бокового ответвления больше нет возможностей, уменьшите изначальную цепочку углерода на один его атом, при этом расположив его как боковое ответвление. Не забывайте, что при одном атоме в углеродной цепочке находятся не больше двух ответвлений.
С
С — С — С — С
С
Пронумеруйте новую цепь атом с того же края, к которому ближе ответвление. Добавьте атомы водорода, помня о четырехвалентности атома углерода.
СН3
1 2 3 4
СН3 — С — СН2 – СН3
СН3
Проверяйте дальше можно ли расположить еще боковые ответвления к углеродной цепочке. Если можно составьте формулы изомеров. Если нельзя продолжайте уменьшать цепочку атомов углерода, постепенно на один атом, располагая его как боковое ответвление. Пронумеровав цепочку, продолжайте составлять формулы изомеров. Нумерация, в случае если боковые ответвления, находятся на одинаковом расстоянии от краев цепи, будет начинаться с края, у которого больше боковых ответвлений.
1 2 3 4
СН3 – СН – СН — СН3
СН3 СН3
Продолжайте последовательность всех действий, пока будет иметься возможность для расположения боковых ответвлений.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Органическая химия — раздел, который вызывает больше всего вопросов. Сложность заключается в первую очередь в огромном количестве веществ: ученым известно более миллиона. Но не нужно пугаться. В органике соединения поделены на классы, свойства внутри которых очень похожи. Выучив общие реакции для каждой группы веществ, вы сможете с легкостью решать задания. Первая тема в рамках подготовки к ЕГЭ — изомерия и номенклатура органических соединений. В статье мы разберем основы этого раздела. Более подробно материал рассматривается на подготовительных курсах. Там изучаются все сложные вопросы органической химии, поэтому выпускники набирают высокие баллы на ЕГЭ.
Изомерия
Первый вопрос, который мы рассмотрим — изомерия органических соединений в химии. Под этим термином понимают явление существования веществ-изомеров. Изомеры — это соединения, имеющие одинаковый качественный и количественный состав (то есть молекулярную формулу), но разное строение и свойства (то есть структурную формулу).
Для начала разберемся в формулах органических соединений. Молекулярная показывает только тип атомов и их количество. Например, C5H10OH. Структурная отражает взаимное расположение атомов в молекуле. Приведенная молекулярная формула может принадлежать сразу нескольким веществам, так как гидроксильная группа может располагаться у разных атомов. Под формулой может скрываться пентанол-1 CH3-CH2-CH2-CH2-CH2-OH, пентанол-2 CH3-CH2-CH2-CH(OH)-CH3 или пентанол-3 CH3-CH2-CH(OH)-CH2-CH3. Эти вещества, имеющие разное взаимное расположение атомов, и называются изомерами.
Различают два вида изомерии — пространственную и структурную. Структурная изомерия подразумевает различный порядок расположения атомов в молекуле. Делится на несколько типов:
- углеродного скелета. Различное расположение радикалов в молекуле: СН3— СН2-СН2-СН2-CH3 (н-пентан) и СН3-СН2-СН(CH3)-CH3 (2-метилбутан);
- положения кратной связи. Двойные и тройные связи могут располагаться у разных атомов. Изомерами являются бутен-1 СН2=СН-СН2-СН3 и бутен-2 СН3-СН=СН2-СН3;
- положения функциональной группы. Пример — уже рассмотренный выше пентанол;
- межклассовая. Иногда под одной формулой скрываются вещества разных классов. Такими изомерами являются алкины и алкадиены, алкены и циклоалканы, спирты и простые эфиры, альдегиды и кетоны, сложные эфиры и карбоновые кислоты. Пример: метилацетат CH3-COO-CH3 и пропановая кислота CH3-CH2-COOH;
- взаимного расположения заместителей. Характерна для циклических соединений (аренов, циклоалканов, циклов с кратными связями). Когда в кольцо вносится второй заместитель, он может располагаться в одном из трех положений: орто (у соседних атомов углерода), мета (через один атом) и пара (напротив друг друга). Это касается ароматических соединений. В циклоалканах заместители обозначают цифрами, например, 1,2-диметилциклобутан;
- метамерия. Связана с разным положением гетероатома в молекуле. Гетероатом — это азот, сера, кислород. Такими изомерами могут быть амины, например, этиламин СН3–СН2–NH2 и диметиламин СН3–NH–СН3;
- таутомерия. Это явление, при котором два изомера легко переходят друг в друга. В таком случае вещество состоит сразу из нескольких молекул, устанавливается равновесие, которое смещается под действием внешних факторов. Пример веществ — пропанон и пропенол-2.
Вторым типом изомерии в органике является пространственная. Она связана с различным взаимным расположением атомов в молекуле. При этом сама структура остается прежней. Оптическая изомерия возникает при вращении атомов вокруг кратной связи. Она характерна для алкенов и алкинов. Аналогичное явление обнаружено у циклов с несколькими заместителями. В цис-изомерах одинаковые группы атомов расположены по одну сторону кратной связи или цикла, в транс — по разные стороны.
Оптическая изомерия характеризуется различным расположением молекул относительно одного атома. Это должен быть ассиметричный углерод — с четырьмя разными заместителями. Он называется хиральным центром. Изомеры являются зеркальным отражением друг друга, как правая и левая рука. Это дает им разные химические свойства.
Номенклатура
Переходим к классификации и номенклатуре органических соединений в химии. В рамках этой темы нужно понимать, какие классы соединений существуют и как их называть. В органике используется систематическая номенклатура ИЮПАК. Основа названия — корень, обозначающий самую длинную углеродную цепь. Первые 10 веществ в гомологическом ряду:
-
С1 — мет-;
-
С2 — эт-;
-
С3 — проп-;
-
С4 — бут-;
-
С5 — пент-;
-
С6 — гекс-;
-
С7 — гепт-;
-
С8 — окт-;
-
С9 — нон-;
-
С10 — дек-.
Далее идет суффикс. Самая простая номенклатура у углеводородов. Алканы имеют суффикс -ан (пропан), алкены — -ен (пропен), алкины — -ин (пропин). Если кратных связей 2 и больше, перед суффиксом добавляется соответствующая цифра — ди, три, тетра, пента и т.д. (бутадиен). У циклических соединений добавляется приставка цикло- (циклопропан). Суффиксами обозначают также наличие заместителей. Для этого используется -ил (этил). Расположение заместителя указывается цифрой, реже используются греческие буквы альфа, бета, гамма. Важный момент: за начало цепочки берется тот конец, у которого ближе кратная связь. Если ее нет, то учитывается близость заместителя. Названия аренов исходят от первого представителя — бензола. К нему добавляются соответствующие заместители, например, 1,2-диметилбензол.
В номенклатуру органических соединений в химии входят и функциональные группы. При нумерации атомов за начало принимается тот конец, ближе к которому располагается группа. Самая старшая указывается в суффиксе, остальные в приставке. Обозначения групп в порядке старшинства:
|
Класс |
Формула |
Название в приставке |
Название в суффиксе |
Пример |
|
Карбоновые кислоты |
-COOH |
карбокси- |
-овая кислота |
CH3COOH этановая кислота карбоксиэтан |
|
Сульфокислоты |
-SO3H |
сульфо- |
-сульфокислота |
CH3-SO3H Сульфометан Метилсульфокислота |
|
Нитрил |
-CN |
циано- |
-нитрил |
CH3-CN цианометан метилнитрил |
|
Альдегиды |
-CHO |
оксо- |
-аль |
CH3-CHO этаналь 1-оксоэтан |
|
Кетоны |
-CO |
оксо- |
-он |
CH3-CO-CH3 пропанон 2-оксопропан |
|
Спирты |
-OH |
гидрокси- |
-ол |
CH3OH метанол гидроксиметан |
|
Амины |
-NH2 |
амино- |
-амин |
CH3-CH2-NH2 этиламин аминоэтан |
|
Простые эфиры |
-OR |
алкокси- |
— |
CH3-O-CH3 алкоксиэтан |
|
Галогениды |
-F, -Cl, -Br, -I |
фтор-, хлор-, бром-, йод- |
-фторид, -хлорид, -бромид, -йодид |
CH3-Cl метилхлорид хлорметан |
|
Нитросоединения |
-NO2 |
нитро- |
— |
CH3-NO2 Нитрометан |
Пример названия
Мы разобрали изомерию и номенклатуру. Попробуем назвать сложное органическое вещество.
-
Определяем главную цепь. В этом случае возьмем за основу бензольное кольцо. У него есть группа -OH, поэтому в названии можем использовать корень -фенол.
-
Нумеруем атомы. Первым будет углерод с группой -OH, потому что мы взяли за основу фенол. Старшим заместителем является карбоксильная группа, но она находится напротив, то есть на равном расстоянии с обеих сторон. Следующий по старшинству заместитель — CH2Cl, он будет вторым. Далее идем по циклу.
-
Называем все заместители. CH2Cl — хлорметил, CH2-CH2-COOH — карбоксипропил, NO2 — нитрогруппа.
-
Записываем название соединения. Все группы указываются в алфавитном порядке. Не забываем указывать, около какого атома они стоят: 4-карбоксипропил-5-нитро-2-хлорметилфенол.
Итак, мы разобрались в классификации, изомерии и номенклатуре органических соединений. Это основы химии, поэтому представленный материал нужно знать наизусть. Обязательно решайте типовые задания из ЕГЭ по химии и тренируйтесь называть сложные вещества. Тема показалась вам трудной? Запишитесь на подготовительные курсы. Там преподаватели ответят на вопросы и разберут все сложные моменты. Желаем вам успехов на итоговой аттестации!
Прежде чем анализировать, как составлять изомеры предельных углеводородов, выявим особенности данного класса органических веществ.
Насыщенные углеводороды
В органической химии выделяется множество классов CxHy. У каждого есть своя общая формула, гомологический ряд, качественные реакции, применение. Для насыщенных углеводородов класса алканов характерны одинарные (сигма) связи. Общая формула данного класса органических веществ CnH2n+2. Этим объясняются основные химические свойства: замещение, горение, окисление. Для парафинов не характерны присоединение, так как связи в молекулах этих углеводородов одинарные.
Изомерия
Такое явление, как изомерия объясняет многообразие органических веществ. Под изомерией принято понимать явление, при котором существует несколько органических соединений, имеющих одинаковый количественный состав (число атомов в молекуле), но различное расположение их в молекуле. Получаемые вещества называют изомерами. Они могут быть представителями нескольких классов углеводородов, а потому отличаются химическими свойствами. Разное соединение в молекуле алканов атомов С приводит к возникновению структурной изомерии. Как составлять изомеры алканов? Существует определенный алгоритм, согласно которому можно изобразить структурные изомеры данного класса органических веществ. Появляется подобная возможность только с четырех углеродных атомов, то есть, с молекулы бутана С4Н10.
Разновидности изомерии
Для того чтобы понять, как составлять формулы изомеров, важно иметь представление о ее видах. При наличии внутри молекулы одинаковых атомов в равном количестве, располагающихся в пространстве в разном порядке, идет речь о пространственной изомерии. Иначе ее называют стереоизомерией. В подобной ситуации применения одних только структурных формул будет явно недостаточно, потребуется использование специальных проекционных или пространственных формул. Предельные углеводороды, начиная с H3C–СН3 (этана), имеют различные пространственные конфигурации. Это обусловлено вращением внутри молекулы по связи С–С. Именно простая σ-связь создает конформационную (поворотную) изомерию.
Структурная изомерия парафинов
Поговорим о том, как составлять изомеры алканов. Класс имеет структурную изомерию, то есть, атом углерода образует разные цепи. Иначе возможность изменения положения в цепи атомов углерода называют изомерией углеродного скелета.
Изомеры гептана
Итак, как оставлять изомеры для вещества, имеющего состав C7H16? Для начала можно расположить все атомы углерода в одну длинную цепочку, добавить для каждого определенное число атомов С. Сколько? Учитывая, что валентность углерода равна четырем, у крайних атомов будет по три атома водорода, а у внутренних – по два. Полученная молекула имеет линейное строение, такой углеводород называют н – гептаном. Буква «н» подразумевает прямой углеродный скелет в данном углеводороде.
Теперь меняем расположение углеродных атомов, «укорачивая» при этом прямую углеродную цепочку в C7H16. Составить изомеры можно в развернутом либо сокращенном структурном виде. Рассмотрим второй вариант. Сначала один атом С расположим в виде радикала метил в разных положениях.
Данный изомер гептана имеет следующее химическое название: 2-метилгексан. Теперь «передвигаем» радикал к следующему углеродному атому. Полученный предельный углеводород называется: 3-метилгексан.
Если мы будем далее передвигать радикал, нумерация будет начинаться с правой стороны (ближе к началу располагается углеводородный радикал), то есть, мы получим такой изомер, который у нас уже есть. Поэтому думая над тем, как составлять формулы изомеров для исходного вещества, попробуем сделать скелет еще «короче».
Оставшиеся два углерода можно представить в виде двух свободных радикалов — метил.
Расположим сначала их у разных углеродов, входящих в главную цепь. Назовем полученный изомер -2,3 диметилпентан.
Теперь оставим один радикал на том же месте, а второй перенесем к следующему углеродному атому главной цепи. Данное вещество называется 2,4 диметилпентан.
Теперь расположим углеводородные радикалы у одного углеродного атома. Сначала у второго, получим 2,2 диметилпентан. Затем у третьего, получив 3,3 диметилпентан.
Теперь оставляем в основной цепи четыре атома углерода, оставшиеся три используем в качестве радикалов метил. Располагаем их следующим образом: два у второго атома С, один – у третьего углерода. Называем полученный изомер: 2,2, 3 триметилбутан.
На примере гептана мы разобрали, как правильно составлять изомеры для предельных углеводородов. На фото представлены примеры структурных изомеров для бутена6 его хлорпроизводных.
Алкены
Данный класс органических веществ имеет общую формулу CnH2n. Помимо насыщенных связей С-С в данном классе есть также двойная связь. Именно она определяет основные свойства данного ряда. Поговорим о том, как оставлять изомеры алкенов. Попробуем выявить их отличия от предельных углеводородов. Помимо изомерии главной цепи (структурные формулы) для представителей данного класса органических углеводородов также характерны еще три разновидности изомеров: геометрические (цис- и трансформы), положения кратной связи, а также межклассовая изомерия (с циклоалканами).
Изомеры C6H12
Попробуем выяснить, как составить изомеры c6h12, учитывая тот факт, что вещество с данной формулой может принадлежать сразу к двум классам органических веществ: алкенам, циклоалканам.
Для начала подумаем, как составлять изомеры алкенов, если есть двойная связь в молекуле. Ставим прямую углеродную цепочку, поставим кратную связь после первого углеродного атома. Попробуем не только составить изомеры с6н12, но и назвать вещества. Данное вещество — гексен – 1. Цифрой указывается положение в молекуле двойной связи. При ее передвижении по углеродной цепочке, получаем гексен -2, а также гексен — 3
Теперь порассуждаем, как составлять изомеры для данной формулы, меняя количество атомов в главной цепи.
Для начала укоротим углеродный скелет на один углеродный атом, его будет рассматривать в качестве радикала метил. Двойную связь оставим после первого атома С. Полученный изомер по систематической номенклатуре будет иметь следующее название: 2 метилпентен – 1. Теперь передвигаем углеводородный радикал по главной цепи, оставив положение двойной связи неизменным. Данный непредельный углеводород разветвленного строения называют 3 метилпентен -1.
Возможен без изменения основной цепи и положения двойной связи еще один изомер: 4 метилпентен -1.
Для состава C6H12 можно попробовать переместить двойную связь из первого во второе положение, не преобразуя саму главную цепочку. Радикал при этом будет передвигать по углеродному скелету, начиная со второго атома С. Данный изомер имеет название 2 метилпентен-2. Кроме того, можно поместить радикал CH3 третьего атома углерода получив при этом 3 метилпентен-2
Если поместить радикал у четвертого углерода атома в данной цепи, образуется еще одно новое вещество непредельный углеводород с извилистым углеродным скелетом – 4 метилпентен-2.
При дальнейшем сокращении числа С в главной цепи, можно получить еще один изомер.
Двойную связь оставим после первого углеродного атома, а два радикала поставим к третьему атому С основной цепи, получаем 3,3 диметилутен-1.
Теперь поставим радикалы у соседних углеродных атомов, не меняя положения двойной связи, получим 2,3 диметилбутен-1. Попробуем, не меняя размер главной цепи, передвинуть двойную связь во второе положение. Радикалы при этом мы может поставить только у 2 и 3 атомов С, получив 2,3 диметилбутен-2.
Других структурных изомеров для данного алкена нет, любые попытки их придумать приведут к нарушению теории строения органических веществ А. М. Бутлерова.
Пространственные изомеры C6H12
Теперь выясним, как составлять изомеры и гомологи с точки зрения пространственной изомерии. Важно понимать, что цис- и трансформы алкенов возможны только для положения двойной связи 2 и 3.
При нахождении в одной плоскости углеводородных радикалов, образуется цис – измер гексена -2, а при расположении радикалов в разных плоскостях, транс-форма гексена – 2.
Межклассовые изомеры C6H12
Рассуждая над тем, как составлять изомеры и гомологи, нельзя забывать и о таком варианте, как межклассовая изомерия. Для непредельных углеводородов ряда этилена, имеющих общую формулу CnH2n, такими изомерами являются циклоалканы. Особенностью данного класса углеводородов является наличие циклической (замкнутой) структуры при насыщенных одинарных связях между атомами углерода. Можно составить формулы циклогексана, метилциклопентана, диметилциклобутана, триметилциклопропана.
Заключение
Органическая химия многогранна, загадочна. Количество органических веществ превышает в сотни раз число неорганических соединений. Данный факт легко объясняется существованием такого уникального явления, как изомерия. Если в одном гомологическом ряду располагаются сходные по свойствам и строению вещества, то при изменении положения атомов углерода в цепи, появляются новые соединения, названные изомерами. Только после появления теории химического строения органических веществ удалось классифицировать все углеводороды, понять специфику каждого класса. Одно из положений данной теории, непосредственно касается явления изомерии. Великий русский химик сумел понять, объяснить, доказать, что именно от расположения углеродных атомов зависят химические свойства вещества, его реакционаня активность, практическое применение. Если сравнивать количество изомеров, образуемых предельными алканами и непредельными алкенами, лидируют, безусловно, алкены. Объясняется это тем, что в их молекулах есть двойная связь. Именно она позволяет этому классу органических веществ образовывать не только алкены разного вида и строения, но и вести речь о меклассовой изомерии с циклоалканами.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
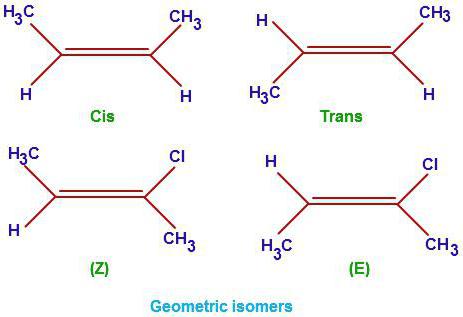
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Постараемся выяснить, как составить изомеры органических веществ. Для примера возьмем углеводороды предельного и непредельного ряда.
Определение
Сначала выясним, что представляет собой явление изомерии. В зависимости от того, какое количество углеродных атомов находится в молекуле, возможно образование соединений, отличающихся по строению, физическим и химическим свойствам. Изомерия — это явление, которое объясняет многообразие органических веществ.
Изомерия насыщенных углеводородов
Как составить изомеры, назвать представителей данного класса органических соединений? Для того чтобы справиться с поставленной задачей, для начала выделим отличительные характеристики данного класса веществ. Предельные углеводороды имеют общую формулу СпН2п+2, в их молекулах присутствуют только простые (одинарные) связи. Изомерия для представителей ряда метана предполагает существование различных органических веществ, которые обладают одинаковым качественным и количественным составом, но отличаются последовательностью расположения атомов.
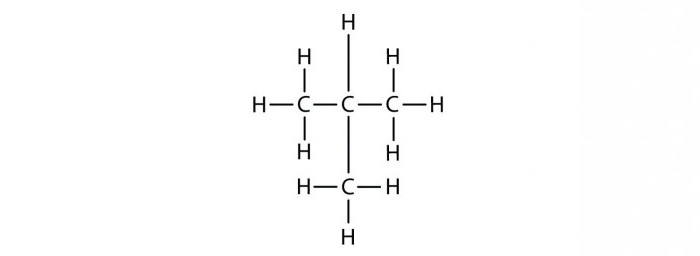
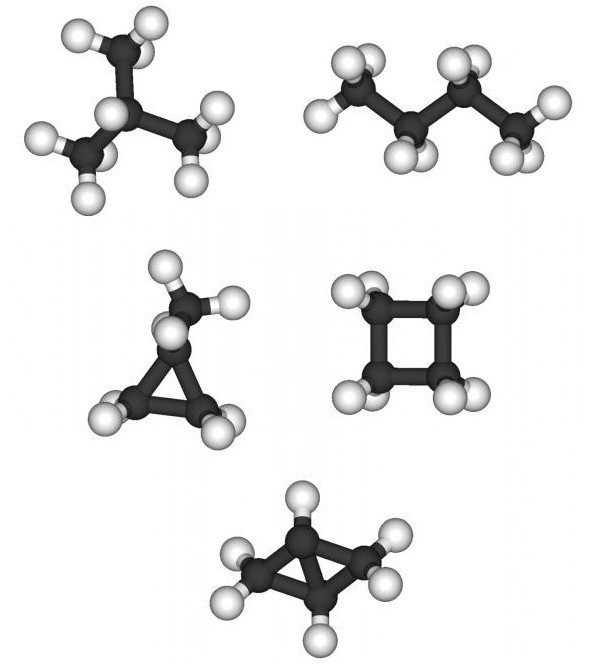
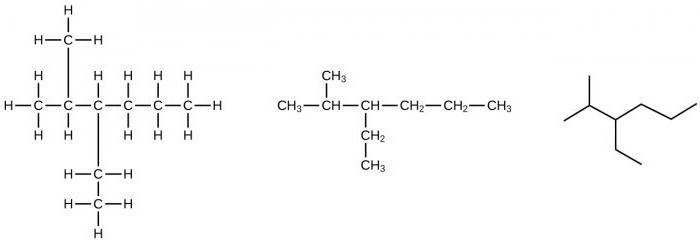
При наличии в составе предельных углеводородов от четырех и более атомов углерода для представителей данного класса наблюдается изомерия углеродного скелета. Например, можно составить формулу веществ изомеров состава С5Н12 в виде нормального пентана, 2-метилбутана, 2,2-диметилпропана.
Последовательность
Структурные изомеры, характерные для алканов, составляют, используя определенный алгоритм действий. Для того чтобы понять, как составить изомеры насыщенных углеводородов, остановимся на этом вопросе подробнее. Сначала рассматривается прямая углеродная цепочка, не имеющая дополнительных разветвлений. Например, при наличии в молекуле шести углеродных атомов, можно составить формулу гексана. Поскольку у алканов все связи одинарные, для них можно записать только структурные изомеры.
Структурные изомеры
Чтобы составить формулы возможных изомеров, углеродный скелет укорачивается на один атом С, он превращается в активную частицу – радикал. Метильная группа может располагаться у всех атомов в цепочке, исключая крайние атомы, образуя при этом различные органические производные алканов.
Например, можно составить формулу 2-метилпентана, 3-метилпентана. Затем количество атомов углерода в основной (главной) цепи уменьшается еще на один, в итоге появляется две активные метильные группы. Их можно располагать при одном или соседних углеродных атомах, получая различные изомерные соединения.
Например, можно составить формулы двух изомеров: 2,2-диметилбутана, 2,3-диметилбутана, отличающихся по физическим характеристикам. При последующем укорачивании основного углеродного скелета можно получить и другие структурные изомеры. Итак, для углеводородов предельного ряда явление изомерии объясняется наличием в их молекулах одинарных (простых) связей.
Особенности изомерии алкенов
Для того чтобы понять, как составить изомеры, необходимо отметить специфические особенности данного класса органических веществ. Мы имеем общую формулу СпН2п. В молекулах данных веществ, помимо одинарной связи, присутствует и двойная связь, которая оказывает влияние на количество изомерных соединений. Помимо структурной изомерии, характерной для алканов, для данного класса можно также выделить изомерию положения кратной связи, межклассовую изомерию.
Например, для углеводорода состава С4Н8 можно составить формулы двух веществ, которые будут отличаться по расположению двойной связи: бутена-1 и бутена-2.
Чтобы понять, как составить изомеры с общей формулой С4Н8, нужно иметь представление о том, что, помимо алкенов, такую же общую формулу имеют и циклические углеводороды. В качестве изомеров, принадлежащих к циклическим соединениям, можно представить циклобутан, а также метилциклопропан.
Кроме того, у непредельных соединений ряда этилена можно записать формулы геометрических изомеров: цис и транс форм. Для углеводородов, которые имеют двойную связь между углеродными атомами, характерно несколько видов изомерии: структурная, межклассовая, геометрическая.
Алкины
У соединений, которые принадлежат к данному классу углеводородов, общая формула – СпН2п-2. Среди отличительных характеристик этого класса можно упомянуть наличие тройной связи в молекуле. Одна из них является простой, образованной гибридными облаками. Две связи образуются при перекрывании негибридных облаков, они определяют особенности изомерии данного класса.
Например, для углеводорода состава С5Н8 можно составить формулы веществ, имеющих неразветвленную углеродную цепочку. Поскольку в исходном соединении есть кратная связь, она может располагаться по-разному, образуя пентин-1, пентин-2. Например, можно записать развернутую и сокращенную формулу соединения с заданным качественным и количественным составом, в котором углеродная цепочка будет сокращена на один атом, который будет представлен в соединении в виде радикала. Кроме того, для алкинов существуют и межклассовые изомеры, в качестве которых выступают диеновые углеводороды.
Для углеводородов, которые имеют тройную связь, можно составить изомеры углеродного скелета, написать формулы диенов, а также рассмотреть соединения с разным расположением кратной связи.
Заключение
При составлении структурных формул органических веществ можно по-разному располагать атомы кислорода, углерода, получая вещества, называемые изомерами. В зависимости от специфики класса органических соединений количество изомеров может быть различным. Например, для углеводородов предельного ряда, к которым относятся соединения ряда метана, характерна только структурная изомерия.
Для гомологов этилена, которые характеризуются наличием кратной (двойной) связи, помимо структурных изомеров, также можно рассмотреть изомерию положения кратной связи. Кроме того, такую же общую формулу имеют и другие соединения, которые относятся к классу циклоалканов, то есть возможна межклассовая изомерия.
Для кислородсодержащих веществ, например, для карбоновых кислот, также можно записать формулы оптических изомеров.