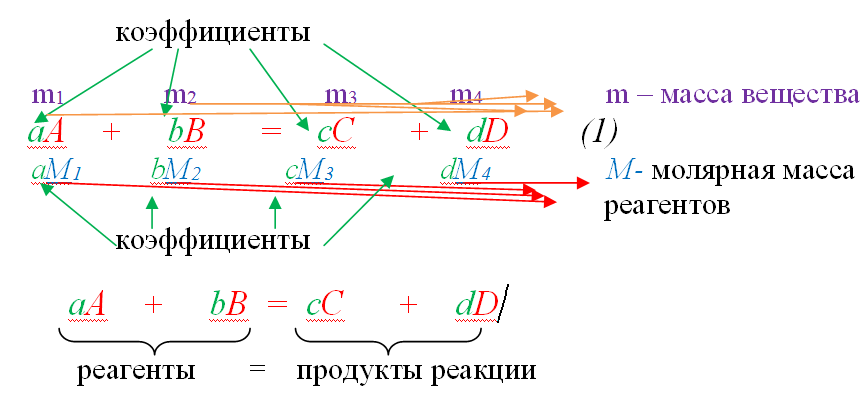
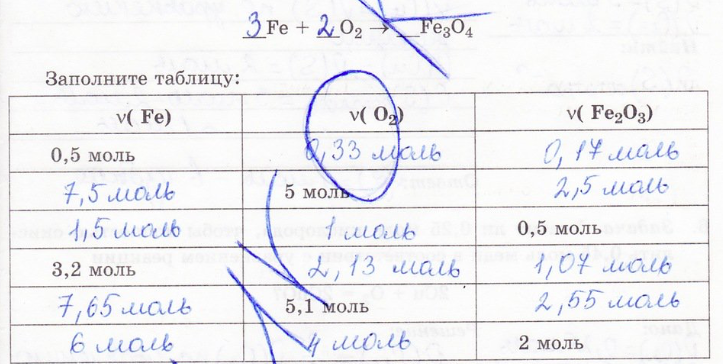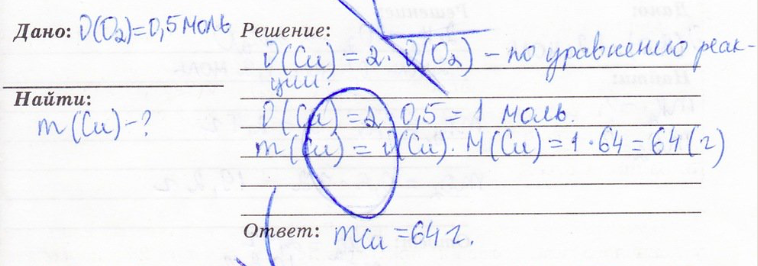В основе расчётов по химическим уравнениям лежит прямая пропорциональная зависимость между количеством вещества, массами или объёмами реагирующих или получающихся в реакции веществ. Рассмотрим между веществами в
обобщённом
виде.
В этой схеме a, b, c, d обозначены соответствующие коэффициенты. Как известно, коэффициент, стоящий
перед
химической формулой, означает
количество вещества.
Произведение aM1, bM2, cM3, dM4 , соответствует приведённому выше уравнению связи (1), так как M1, M2, M3, M4 являются молярными массами реагентов A и B и продуктов реакции C и D соответственно. Значит, для данного уравнения реакции можно составить следующее отношения:
m1 / aM1 = m2 / bM2 ; m1 / aM1 = m3 / cM3; и т.п. (2)
Из первого отношения можно определить m1 , если условия задачи известна m2 , и из второго — m3, если известна масса m1,
m1 = aM1 * m2 / bM2 ; m3 = m1 * cM3 / aM1
Вместо массы в условии задачи речь может идти о количестве вещества или объёме реагента (продукта реакции). Задачи усложняются, если в условие вводятся дополнительные сведения: массовая доля примесей в реагенте, массовая доля растворённого вещества в растворе, массовая доля практического выхода и др.
Универсального способа решения всех химических задач не существует и не может быть, однако следует придерживаться наиболее общего алгоритма решения.
Например:
1. Внимательно прочитайте текст задачи.
2. Запишите условия задачи: что дано, что надо найти.
3. Составьте уравнение реакции, описанной в задаче.
4. В уравнении реакции подчеркните формулы тех веществ, о идёт речь в задаче.
5. Под формулами отмеченных веществ укажите следующие величины:
а) количества вещества (определить по коэффициентам;
б) молярные массы (подсчитывается по формулам веществ);
в) массы веществ в соответствии с указанным количеством вещества;
6. Над формулами отмеченных веществ запишите массы, заданные условием задачи.
7. Составьте рассуждение на основе условия задачи.
8. Составьте пропорцию на основе рассуждения и решите её.
9. Дайте ответ в соответствии с главным вопросом задачи.
Задача 1
Какова масса оксида кальция получено при разложении гидроксида кальция массой 60 г?
|
Дано: |
Найти: |
|
m (Ca(OH)2)= 60г |
60г х г 1 моль 1 моль 74 г/моль 56 г/моль 74 г 56 г Рассуждаем: Из 74 г Ca(OH)2 получается 56г CaO А из 60г Ca(OH)2 — х г CaO Составляем пропорцию
х = 60г . 56г / 74г = 45.4 г |
|
Найти: m (массу)- CaO? |
|
|
Ответ: |
х- это масса CaO она равна 45.4 грамма |
Или изменим задачу. Какова масса воды полученной при разложении гидроксида кальция массой 60 г?
|
Дано: |
Найти: |
|
m (Ca(OH)2)= 60г |
60г х г 1 моль 1 моль 74 г/моль 18 г/моль 74 г 18 г Рассуждаем: Из 74 г Ca(OH)2 получается 18 гH2O (б) А из 60 г Ca(OH)2 — х г H2O Составляем пропорцию
х = 60 . 18 / 74 = 14.6 г х- это масса воды |
|
Найти: m (массу)-H2O? |
|
|
Ответ: |
m (H2O)- = 14.6г |
Чтобы убедится в правильности решения задач, суммируем количество оксида кальция и воды с
двух
задач масса m(Ca(OH)2) = m (CaO) + m (H2O)
45.4г + 14.6г
60г
Ca(OH)2
Эту задачу можно решить другим способом- применяя физическую величину количество вещества.
Выполняются пункты 1-5 (а и б) указанного выше алгоритма. Далее вычисляются количество вещества Ca(OH)2
v(Ca(OH)2) = m (Ca(OH)2) .
v(Ca(OH)2) = 60г : 74г/моль = 0, 8 моль
По уравнению реакции: v(Ca(OH)2) один моль = v(H2O) один моль
Следовательно, можно найти массу воды:
m (H2O) = v(H2O) . М(H2O)
m (H2O) = 0,8моль . 18г/моль = 14.4г
Ответ: при разложении 60 г гидроксида кальция получится 14.4г
Удачи Вам!
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
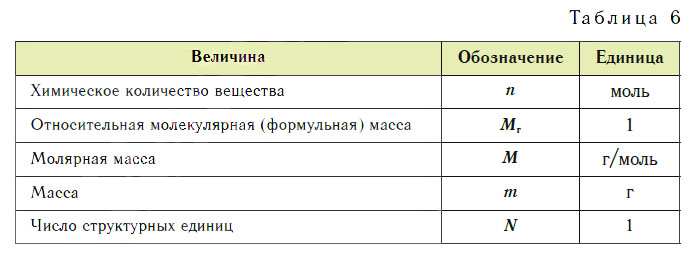
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо массой 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 2. Определите массу алюминия, прореагировавшего с кислородом, если в результате реакции образовалось вещество Al2O3 химическим количеством 3,5 моль.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 3. Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания фосфора массой 93 г.
Спойлер
[свернуть]
Надеюсь урок 14 «Расчеты по уравнениям химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Химические реакции».
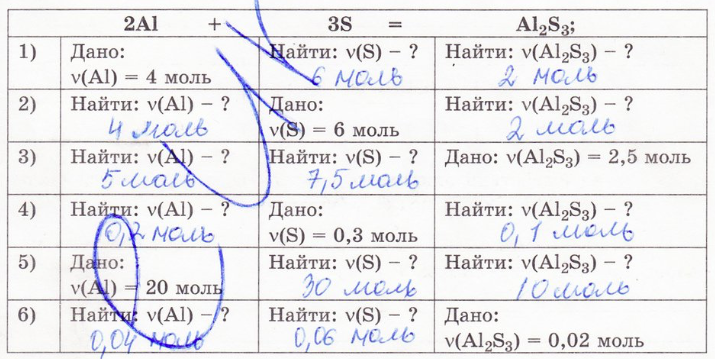
1. Заполните таблицу, решив 6 задач (условия приведены по горизонтали).
2. Расставьте коэффициенты в уравнении химической реакции, составьте количественные отношения веществ по уравнению:
3. Расставьте коэффициенты в уравнении химической реакции, составьте количественные отношения веществ по уравнению:
4. При взаимодействии алюминия с кислородом образовался оксид алюминия (4Al+3O2=2Al2O3). Определите:
а) количество вещества алюминия, если в реакцию вступил кислород количеством вещества 3 моль.
v(AC) = 3 моль:3*4 = 4 моль.
б) количество вещества кислорода, вступившего в реакцию, если в результате образовалось 6 моль оксида алюминия.
О(О2) = 6:2*3 = 9 моль.
в) количество вещества образовавшегося оксида алюминия, если в реакцию вступил алюминий, количеством вещества 5 моль.
О(Al2O3) = 5:2 = 2,5 моль.
5. Задача. Смешали 3 моль серы и 2 моль порошка меди и нагрели. Полностью ли вещества вступят в реакцию в соответствии с уравнением реакции
6. Задача. Хватит ли 0,25 моль кислорода, чтобы полностью окислить 0,45 моль меди в соответствии с уравнением реакции
7. Задача. Каково количество вещества кислорода требуемого для получения оксида железа (Fe3O4) из 2,5 моль железа в соответствии с уравнением реакции 3Fe+2O2 = Fe3O4?
8. Задача. Уравнение реакции между соляной кислотой и оксидом кальция: 2HCl+CaO = CaCl2+H2O. Вычислите количество вещества соляной кислоты, требуемое для получения 0,25 моль хлорида кальция.
9. Задача. По уравнению химической реакции 2Cu+O2 = 2CuO вычислить массу меди, вступившей в реакцию с 0,5 моль кислорода.
10. Задача. По уравнению химической реакции 2Al+3S = Al2S3 найдите массу сульфида алюминия, образовавшегося из 3,5 моль алюминия.
11. Задача. При взаимодействии алюминия с хлором Cl2 образуется 0,3 моль хлорида алюминия AlCl3. Вычислить массу алюминия и хлора, вступивших в реакцию.
12. Задача. При реакции водорода Н2 с кислородом О2 образуется вода, количеством вещества 1,2 моль. Вычислить массы веществ, вступивших в реакцию.
13. Задача. При разложении малахита (CuOH)2CO3 образуются вода, оксид меди (II) и углекислый газ. Вычислите, сколько граммов малахита разложили, если образовалось 0,25 моль оксида меди (II)?
14. Задача. По уравнению химической реакции 2Cu+O2 = 2CuO вычислить массу меди, вступившей в реакцию с 8 г кислорода.
15. Задача. По уравнению химической реакции, 2Al+3S = Al2S3, найдите массу сульфида алюминия, образовавшегося из 5,4 г алюминия.
16. Задача. При взаимодействии алюминия с хлором Cl2 образуется 26,7 г хлорида алюминия AlCl2. Вычислить массу алюминия и хлора, вступивших в реакцию.
17. Задача. При реакции водорода H2 с кислородо О2 образуется вода массой 72 г. Вычислить массы веществ, вступивших в реакцию.
18. Задача. При разложении малахита (CuOH)2CO3 образуется вода, оксид меди (II) и углекислый газ. Вычислите массу разложившегося малахита, если образовалось 10 г оксида меди (II).
Дополнительные задачи
1. Какое количество вещества водорода и кислорода нужно взять, чтобы получить воду количеством вещества 6 моль?
2H2+O2 -> 2H2O
v(H2) = 6 моль.
v(O2) = 3 моль.
2. Какое количество вещества оксида магния получится при реакции 3 моль магния с кислородом?
2Mg+O2 -> 2MgO
v(MgO) = v(Mg) = 3 моль.
3. Какое количество вещества алюминия потребуется для замещения хрома в 1,5 моль его оксида (III)?
2Al+Cr2O3 -> Al2O3+2Cr
v(Al) = 2*O(Cr2O3) = 2*1,5 = 3 моль.
4. Какое количество вещестав малахита подверглось разложению, если в результате реакции образовалось 0,4 моль оксида меди.
(CuOH)2CO3 -> 2CuO+H2O+CO2
v(CuOH)2CO3 = 1/2v(CuO) = 1/2*0,4 = 0,2 моль.
5. В результате какой реакции выделяется большое количество вещества кислорода в расчете на 1 моль исходного вещества:
6. Кислород в лаборатории можно получать по реакции, уравнение которой 2H2O2=2H2O+O2. Хватит ли кислорода, полученного из 0,4 моль перекиси водорода, для сжигания 0,4 моль фосфора по уравнению 4Р+5О2 = 2Р2О5?
v(O2) = 0,2 моль. Для 0,4 моль Р необходимо 0,4:4*5 = 0,5 моль.
Не хватит.
7. Какое количество вещества цинка может вступить в реакцию с хлором, выделившимся пр взаимодействии 0,15 моль оксида марганца (IV) с концентрированной соляной кислотой по уравнению 4HCl+NgO2 = NgCl2+2H2O+Cl2?
v(Cl2) = v(MnO2) = 0,15 моль.
Zn+Cl2 -> ZnCl2
v(Zn) = v(Cl2) = 0,15 моль.
8. Какое количество вещества метана сгорит (с образованием углекислого газа и воды) в кислороде, образовавшемся из 0,2 моль перманганата калия по уравнению 2KMnO4 = MnO2 + K2MnO4 + O2?
v(O2) = 1/2v(KMnO4) = 1/2*0,2 = 0,1 моль
CH4+2O2 -> CO2+2H2O
v(CH4) = 1/2)vO2) = 0,05 моль
9. Какое количество вещества углерода потребуется для получения в лаборатории 414 г свинца из его оксида по уравнению: PbO+C = Pb+CO?
v(C) = v(Pb) = 414/207 = 2 моль.
10. Для получения меди используют реакцию, уравнение которой CuO+H2 = Cu + H2O. Какое количество вещества оксида меди (II) надо взять, чтобы получить 128 г меди?
Сохраните или поделитесь с одноклассниками:
Между количествами веществ, участвующих в химической реакции, существует прямо пропорциональная зависимость: чем большее количество одного из веществ принимает участие в данном превращении, тем большее количество других веществ в нём участвует, и наоборот.
Если в химической реакции участвуют вещества (A) и (B), то уравнение реакции имеет вид
(…aA) (+) (…bB), где (a) и (b) — коэффициенты, относящиеся к формулам соответствующих веществ.
Прямо пропорциональную зависимость, существующую между количествами веществ (A) и (B), можно выразить математически:
, отсюда:
n(A)=a⋅n(B)b
или
n(B)=b⋅n(A)a
.
Для того чтобы произвести простейший расчёт по уравнению химической реакции, следует, как правило, сделать четыре шага:
1. написать уравнение химической реакции, упомянутой в условии задачи: (…aA) (+) (…) (…bB).
2. Если в условии задачи не указано количество вещества ((A)), участвующего в превращении, следует, исходя из того, что дано, сделать такой расчёт:
а) если известна масса вещества, его количество можно рассчитать путём деления массы на его молярную массу:
n(A)=m(A)M(A)
.
б) Если известен объём газообразного вещества, измеренный при нормальных условиях (н. у.), количество вещества можно рассчитать путём деления объёма на молярный объём:
n(A)=V(A)Vm
, где
Vm=22,4
л/моль.
в) Если известно число частиц вещества (атомов, молекул или др.), принимающих участие в реакции, его количество можно рассчитать путём деления числа частиц на число Авогадро:
n(A)=N(A)NA
, где
NA=6,02⋅1023
1/моль.
3. Зная количество одного вещества ((A)), участвующего в реакции, можно рассчитать количество второго вещества ((B)), принимающего участие в этой реакции:
n(B)=b⋅n(A)a
.
4. Если требуется рассчитать не количество второго вещества ((B)), а численное значение другой физической величины (его массу, объём газа (н. у.) или др.), следует сделать такой расчёт:
а) чтобы рассчитать массу второго вещества, участвующего в реакции, следует его количество умножить на молярную массу данного вещества:
m(B)=n(B)⋅M(B)
.
б) Чтобы рассчитать объём газа (н. у.), участвующего в химической реакции, нужно его количество умножить на молярный объём:
V(B)=n(B)⋅Vm
.
в) Чтобы рассчитать число частиц (атомов, молекул или др.) второго вещества, принимающего участие в данной химической реакции, нужно его количество умножить на число Авогадро:
N(B)=n(B)⋅NA
.
г) Чтобы рассчитать молярную массу второго вещества, участвующего в химической реакции, следует его массу разделить на количество этого вещества:
M(B)=m(B)n(B)
.
Обрати внимание!
Все вышеупомянутые вычисления можно сделать, не пользуясь расчётными формулами, а составляя пропорции.
Пример:
для того чтобы рассчитать, какое количество вещества содержится в (4,9) г серной кислоты (её молярная масса равна (98) г/моль), следует составить такую пропорцию:
в (98) г серной кислоты содержится (1) моль этого вещества,
а в (4,9) г серной кислоты содержится (x) моль вещества;
.

Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_{2}SO_{4} + NaOH → Na_{2}SO_{4} + H_{2}O
Расставим коэффициенты:
H_{2}SO_{4} + 2NaOH → Na_{2}SO_{4} + 2H_{2}O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅1023 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
begin{matrix}H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end{matrix}
Следом запишем молярные массы для этих веществ
begin{matrix} H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end{matrix}
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin{matrix}49 : г & & X : г & & & & \ H_{2}SO_{4} & + & 2NaOH & → & Na_{2}SO_{4} & + & 2H_{2}O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end{matrix}
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
frac{49}{98} = frac{X}{80}
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!