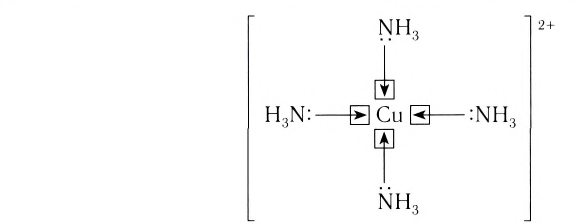
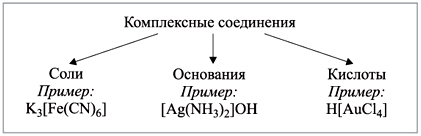
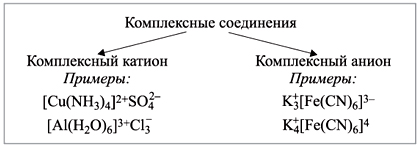
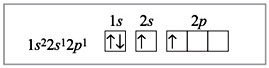
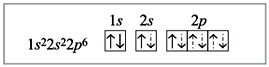
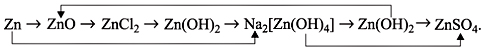
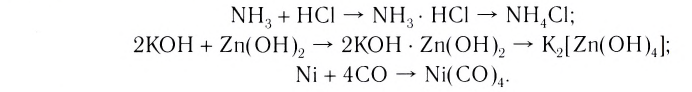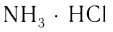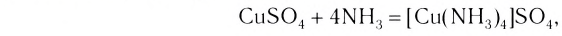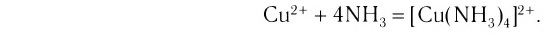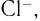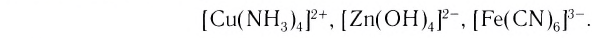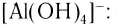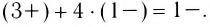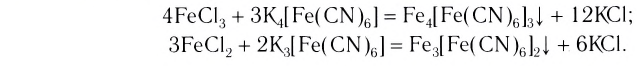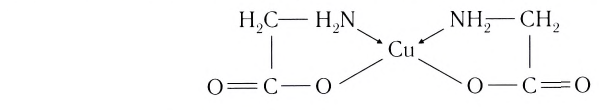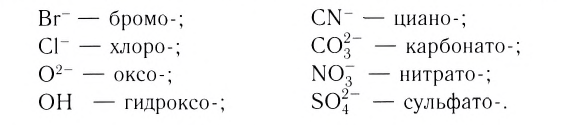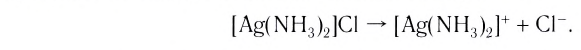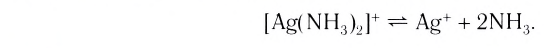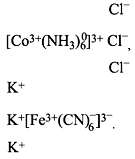Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
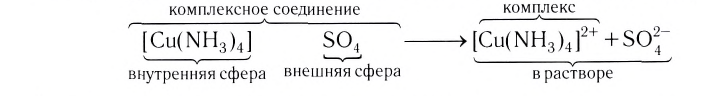
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
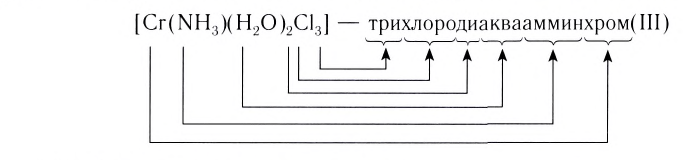
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
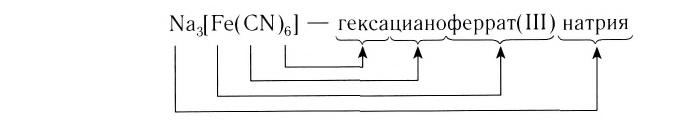
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Добавил:
mrPutin
Обнуляй!
Feat. Kravz and Tereshkova
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Составление комплексов
Скачиваний:
109
Добавлен:
10.05.2017
Размер:
587.03 Кб
Скачать
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ивановская государственная текстильная академия» (ИГТА)
Кафедра химии
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Методические указания для студентов технологических специальностей
Иваново 2012

Методические указания предназначены для самостоятельного изучения раздела «Комплексные соединения» в рамках курса химии.
В них даются основные понятия о составе, классификации, номенклатуре, строении, получении и химических свойствах комплексных соединений. Образование химической связи в комплексных соединениях подробно рассматривается с позиций метода валентных схем и метода кристаллического поля.
Методические указания могут быть использованы студентами первого курса технологических специальностей очной и заочной форм обучения.
Составители: канд. хим. наук, проф. В.В. Васильев, канд. техн. наук, доц. В.Р. Ополовников
Научный редактор канд. техн. наук, проф. Г.М. Прияткин Редактор И.Н. Худякова Корректор К.А. Торопова
Подписано в печать_11.05.2011. Формат 1/16 60х84. Бумага писчая. Плоская печать. Усл.печ.л. 2,55_. Уч.-изд.л._2,44. Тираж 100 экз.
Заказ№
Редакционно-издательский отдел Ивановской государственной текстильной академии
Копировально-множительное бюро 153000 г. Иваново, пр.Ф. Энгельса, 21
2
ВВЕДЕНИЕ
Все сложные вещества можно подразделить на две большие группы:
а) соединения первого порядка или БИНАРНЫЕ; б) соединения высшего порядка или МОЛЕКУЛЯРНЫЕ.
К первой группе относятся сложные вещества, которые получаются из простых веществ. Например:
N2 + 3H2 = 2NH3
S + O2 = SO2 и т.д.
Ко второй группе относятся сложные вещества, которые получаются при соединении сложных веществ.
Например, оксид кальция может присоединять к себе воду, образуя новое химическое вещество. Если строение этого вещества неизвестно, его формулу можно записать в виде CaO∙H2O. Точка между формулами обозначает не умножение, а присоединение. Таким образом записываются, в частности, формулы многих минералов.
Однако такая формула мало что говорит о химических свойствах соединения. Поэтому, для того чтобы четко обозначить класс соединения (в данном случае – основание) и, следовательно, его химические свойства, формулу пишут в виде Ca(OH)2.
Аналогично:
SO3 + H2O = SO3·H2O = H2SO4
NH3 + HCl = NH3·HCl = NH4Cl и т.д.
К соединениям такого рода относятся и комплексные соединения. В школьном курсе они встречались в тех разделах, где речь шла, например, о взаимодействии амфотерного гидроксида со щелочью:
Al(OH)3 + NaOH = Al(OH)3∙NaOH = Na[Al(OH)4] Zn(OH)2 + 2NaOH = Zn(OH)2∙2NaOH = Na2[Zn(OH)4]
О том, что в данном случае мы имеем дело с комплексными соединениями, говорят характерные для формул комплексных со-
3
единений квадратные скобки. Чем же комплексные соединения отличаются от других соединений высшего порядка?
Основоположником теории комплексных соединений можно считать немецкого ученого Альфреда Вернера, опубликовавшего в 1893 году свою работу «О координационной теории комплексных соединений». Большой вклад в развитие учения о комплексных со-
|
единениях сделан |
русскими и советскими учеными – |
||
|
Л.А. Чугаевым, |
А.А. |
Гринбергом, |
Н.С. Курнаковым, |
К.Б. Яцимирским и др.
Согласно современным представлениям, для комплексных соединений характерно, во-первых, определенное строение, вовторых, специфически протекающий процесс диссоциации.
1. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Строение комплексных соединений рассмотрим на примере вещества Na2[Zn(OH)4]. Схематично строение этого вещества показано на рис.1.
В центре комплексного соединения находится комплексообразователь. В данном случае это ион Zn2+. В формуле комплексного соединения комплексообразователь записывается сразу же после первой квадратной скобки.
К комплексообразователю прочно присоединяются частицы с
|
противоположным знаком заряда. |
Они называются лигандами. |
|
В рассматриваемом соединении это ионы ОН—. |
|
|
Число лигандов называется |
координационным числом. |
В нашем случае координационное число равно 4. Комплексообразователь вместе с лигандами образует внут-
реннюю сферу комплексного соединения или комплексный ион.
Внутренняя сфера в химической формуле выделяется квадратными скобками.
Как правило, положительный заряд комплексообразователя и отрицательные заряды лигандов не уравновешивают друг друга. Поэтому образующаяся частица имеет заряд (почему и называется комплексным ионом). Заряд комплексного иона можно рассчитать как сумму зарядов всех входящих в него частиц.
4
В нашем случае заряд комплексного иона равен -2:
|
+2 |
+ 4(-1) = -2 , то есть [Zn(OH)4]2-. |
|
(заряд цинка) |
(заряд четырех |
групп ОН)
Заряд комплексного иона компенсируется противоположным зарядом присоединенных к нему ионов внешней сферы. В рассматриваемом соединении это ионы Na+. Число ионов внешней сферы определяется их зарядом и зарядом комплексного иона. В нашем случае комплексный ион имеет заряд 2-, ион натрия 1+. Поэтому формула имеет вид Na2[Zn(OH)4].
Формула комплексного соединения, записанная таким образом,
называется координационной формулой (рис.2).

|
OH— |
OH— |
||
|
Na |
+ |
Zn2+ |
Na+ |
Ионы
OH— OH—
внешней
сферы
Лиганды
Комплексообразователь
Рис.1. Строение комплексного соединения
Внутренняя
сфера
Na2[Zn(OH)4]
внешней
сферы
Лиганды
Рис.2. Координационная формула комплексного соединения
При написании реакций комплексообразования возникает необходимость определить, какая именно частица будет комплексообразователем, какие – лигандами. Нужно уметь правильно опреде-
5
лить координационное число в образующемся комплексном соединении. Рассмотрим эти вопросы более подробно.
КОМПЛЕКСООБРАЗОВАТЕЛЬ
Чаще всего комплексообразователями являются положительно заряженные ионы d-элементов. Ими также могут быть и ионы р-элементов. f-элементы редко встречаются сами по себе. S-элементы в качестве комплексообразователей выступают довольно редко.
ЛИГАНДЫ
Так как комплексообразователь имеет положительный заряд, то лигандами обычно бывают отрицательно заряженные ионы (анионы). Кроме того, ими могут быть некоторые нейтральные (не имеющие заряда) полярные молекулы. Наиболее часто встречающиеся нейтральные лиганды – молекулы воды (Н2О) и аммиака
(NH3).
КООРДИНАЦИОННОЕ ЧИСЛО
Величина координационного числа зависит от размера и заряда комплексообразователя и лигандов.
Чем больше размер комплексообразователя и чем меньше размер лигандов, тем больше координационное число, и наоборот.
Чем больше заряд комплексообразователя и чем меньше заряд лигандов, тем больше координационное число, и наоборот.
Сравним, например, два комплексообразователя с одинаковым зарядом, но с разными радиусами – B3+ и Al3+. В качестве лигандов в обоих случаях используем одинаковые ионы F—.
Как показано на рис.3, больший размер ионов Al3+ позволяет расположить возле него большее количество лигандов. Поэтому в этих соединениях координационное число алюминия равно 6, а бора
– только 4.
Если же в качестве лигандов используются более крупные ионы йода I—, то координационное число алюминия снижается до 4.
6

|
F— |
I— |
||||
|
F— |
F— |
Al3+ |
F— |
||
|
F— B3+ |
F— |
I— |
Al3+ |
I— |
|
|
F— |
F— |
||||
|
F— |
F— |
I— |
|||
|
[BF4]— |
[AlF6]3- |
[AlI4]— |
|
К.Ч.= 4 |
К.Ч. = 6 |
К.Ч. = 4 |
Рис.3. Влияние размера комплексообразователя и лигандов на величину координационного числа
Для самых распространенных комплексообразователей наиболее часто встречающиеся значения координационных чисел приведены в табл.1.
Таблица 1
|
Комплексо- |
Коорд. |
Комплексо- |
Коорд. |
Комплексо- |
Коорд. |
|
образователь |
число |
образователь |
число |
образователь |
число |
|
Ag+ |
2 |
Cr3+ |
6 |
Fe3+ |
6 |
|
Cu+ |
2 |
Co2+ |
4 |
Ni2+ |
4 |
|
Cu2+ |
4 |
Co3+ |
6 |
Zn2+ |
4 |
|
Cd2+ |
4 |
Fe2+ |
6 |
Если значение координационного числа не известно, в первом приближении можно принять его равным удвоенному заряду комплексообразователя, то есть
К.Ч. = 2Z,
где Z – заряд комплексообразователя.
7
2.КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Взависимости от природы лигандов можно выделить следующие наиболее часто встречающиеся виды комплексных соединений:
1.Аквакомплексы. Лигандами в этих соединениях являются моле-
кулы воды (H2O). Например, [Ti(H2O)6]Cl3.
2.Аммиакатные комплексы. Лигандами в этом случае служат молекулы аммиака (NH3). Например, [Cu(NH3)4]SO4.
3.Гидроксокомплексы. Роль лигандов играют гидроксильные ио-
ны (ОН—). Например, Na[Al(OH)4].
4.Ацидокомплексы. Лиганды – кислотные остатки. Например,
K3[AlF6] или K4[Fe(CN)6]. Ионы F— — кислотные остатки фтороводородной кислоты (HF), ионы CN— — кислотные остатки циановодородной кислоты (HCN).
5.Смешанные комплексы. Лиганды – разные частицы. Например, [Co(NH3)5Cl]SO4.
3. НОМЕНКЛАТУРА (НАЗВАНИЯ) КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Для того чтобы назвать комплексное соединение, используют следующие правила:
1.Сначала указывают название аниона, а затем катиона, то есть действует то же правило, что и в названии обычных неорганических веществ (хлорид натрия, сульфат меди и т.д.).
2.В названии комплексного иона сначала указывают лиганды, а потом комплексообразователь. Число лигандов обозначают с помо-
щью частиц моно-(1), ди-(2), три-(3), тетра-(4), пента-(5), гек- са-(6) и т.д.
3.Если комплексный ион имеет отрицательный заряд, то к названию металла-комплексообразователя добавляют -ат.
4.Если металл-комплексообразователь может иметь переменную валентность, то ее величина указывается с помощью римской цифры в скобках после названия металла.
8
Примеры названий различных комплексных соединений:
[Cr(H2O)6]Cl3 – хлорид гексааква хрома (III); [Cu(NH3)4]SO4 – сульфат тетрааммин меди; K4[Zn(OH)4] – тетрагидроксоцинкат калия; K3[Fe(CN)6] – гексацианоферрат (III) калия; K4[Fe(CN)6] – гексацианоферрат (II) калия; Na[AuCl4] – тетрахлороаурат (III) натрия;
[Pt(NH3)4Cl2](NO3)2 – нитрат тетраамминодихлор платины (IV).
4. ПРИЗНАКИ ОБРАЗОВАНИЯ КОМПЛЕКСНЫХ
СОЕДИНЕНИЙ
О протекании реакции комплексообразования могут свидетельствовать следующие наблюдаемые явления.
1. ИЗМЕНЕНИЕ ЦВЕТА РАСТВОРА
При добавлении к бледно-голубому раствору сульфата меди избытка бесцветного раствора аммиака образуется раствор с яркосиней окраской. Это говорит о том, что произошло не просто смешивание двух растворов, а образовалось новое вещество. Этот химический процесс выражается уравнением реакции:
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
бледнобесцветный ярко-синий голубой
2. РАСТВОРЕНИЕ ОБРАЗУЮЩИХСЯ ОСАДКОВ
Если к раствору нитрата ртути (II) по каплям добавлять иодид калия, то образуется осадок иодида ртути краснокирпичного цвета:
Hg(NO3)2 + 2KI = HgI2 + 2KNO3
При добавлении избытка иодида калия образовавшийся сначала осадок растворяется за счет образования комплексного соединения ртути:
|
HgI2 |
+ 2KI = |
K2[HgI4] |
|
осадок |
раствор |
раствор |
9
3. «ИСЧЕЗНОВЕНИЕ» ИОНОВ ИЗ РАСТВОРА
При добавлении к любому раствору, содержащему ионы серебра Ag+, любого раствора, содержащего ионы хлора Cl—, образуется белый творожистый осадок хлорида серебра AgCl. Эта реакция является качественной реакцией на ионы серебра:
AgNO3 + NaCl = AgCl + NaNO3
Однако, если к раствору нитрата серебра сначала добавить избыток раствора аммиака, то при последующем добавлении раствора хлорида натрия осадка не образуется. Качественная реакция на ионы серебра не протекает. Ионы серебра «исчезают» из раствора. Это связано с протеканием реакции комплексообразования, в которой образуется аммиакатный комплекс – нитрат диаммино серебра:
AgNO3 + 2NH3 = [Ag(NH3)2]NO3
При этом ионы серебра не исчезают бесследно, а превращаются в комплексный ион, для которого реакция с хлорид-ионом не характерна.
5. ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Все растворимые комплексные соединения – сильные электролиты, полностью диссоциирующие в растворах на комплексный ион и ионы внешней сферы.
Это так называемая первичная диссоциация. Например:
[Zn(NH3)4]Cl2 [Zn(NH3)4]2+ + 2Cl—
Na3[Co(NO2)6] 3Na+ + [Co(NO2)6]3-
Заряд комплексного иона легко определить по суммарному заряду ионов внешней сферы.
Комплексные соединения частично подвержены и вторичной диссоциации (диссоциация по второй ступени). При этом происходит диссоциация комплексного иона на ионы комплексообразователя и лигандов. Например:
[Zn(NH3)4]2+ 
10
Содержание:
Комплексные соединения:
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные соединения. В переводе с латинского complexus означает «сочетание». И действительно, большинство комплексных соединений образуется в результате соединения (сочетания) более простых веществ:
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) элекрезультате соединения (сочетания) более простых веществ:
- NH, + HCI — NH3 • HCI — NH4CI;
- 2КОН + Zn(OH)2 — 2KOH • Zn(OH), — K2[Zn(OH)4);
- Ni + 4CO — Ni(CO)4.
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a NH3 ■ HCI — твердая соль, Ni — металл, СО — газ, а продукт их взаимодействия — бесцветная, легко испаряющаяся жидкость.
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов и способные к самостоятельному существованию в растворах.
Альфред Вернер
(1866—1919)
Швейцарский химик-неорганик. Один из создателей координационной теории комплексных соединений. Лауреат Нобелевской премии (1913).
Основные представления о строении комплексных соединений
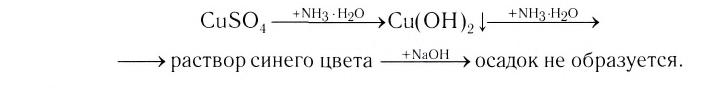
Проведем следующий эксперимент: каплю концентрированного раствора аммиака прильем к раствору сульфата меди(II) CuS04. Образуется голубой осадок гидроксида меди(II) Си(ОН)2, Продолжим добавлять раствор аммиака — осадок растворяется, а раствор приобретает ярко-синий цвет. Если затем добавить к полученному раствору раствор гидроксида натрия — осадок гидроксида меди(II) не образуется:
Значит, ионов Си2+ в растворе практически нет. В то же время, ионы S04 легко обнаруживаются в растворе при добавлении BaCl2. Следовательно, при приливании избытка аммиака к осадку гидроксида меди(II) образовалось новое соединение.
Как показывает химический анализ, из раствора можно выделить кристаллы 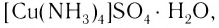

или в сокращенном ионном виде:
Рассмотрим структуру комплексных соединений. В составе комплексного иона выделяют центральный атом (или ион) — комплексообразователь. В нашем примере — это ион меди(II). В качестве комплексообразователей могут в принципе выступать любые атомы или ионы, но наиболее характерна способность к комплексообразованию для катионов переходных металлов (d-элементов).
Вокруг комплексообразователя группируются (координируются) другие атомы, ионы (чаще анионы) или нейтральные молекулы, которые называются лигандами. Например, лигандами могут выступать нейтральные молекулы: воды Н20, аммиака NH3, оксида углерода(II) СО, этилендиамина 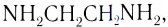
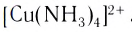
Слово «лиганд» образовано от латинского «ligo» — «связываю». Впервые этот термин в химическую литературу был введен немецким химиком А. Штоком в начале XX в. Однако в современном его значении слово «лиганд» ввел в научную литературу датский ученый Н. Бьеррум.
Число, показывающее, сколько лигандов (ионов или молекул) присоединено к данному комплексообразователю, называется его координационным числом. Так, в комплексном ионе 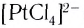
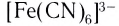
Лиганды могут образовывать химические связи с комплексообразователей посредством одного или нескольких атомов, входящих в их состав. В зависимости от количества таких атомов лиганды подразделяют на монодентатные и полидентатные (от лат. dentatus — «имеющий зубы»). Пример монодентатного лиганда — аммиак NH3, молекулы которого присоединяются к комплексообразователю посредством атома азота, имеющего одну неподеленную пару электронов:
Бидентатными лигандами являются карбонат-ионы 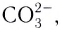
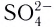
Центральный атом и лиганды образуют внутреннюю сферу — комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе. При написании формул комплексных соединений внутреннюю сферу обычно заключают в квадратные скобки:
Такие формулы называются координационными.
Заряд комплексного иона определяется алгебраической суммой заряда комплексообразователя и зарядов всех лигандов. Например, в ионе 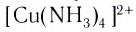
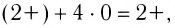
Ионы, окружающие комплексный ион, составляют внешнюю сферу:
Поскольку комплексные соединения в целом электронейтральны, то частицы внешней сферы нейтрализуют заряд внутренней сферы. При диссоциации комплексного соединения в водных растворах образуются комплексные ионы и ионы внешней сферы. Комплексные соединения могут быть кислотами (например, 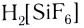
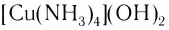
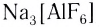
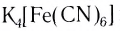
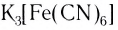
При взаимодействии хлорида железа (III) с раствором желтой кровяной соли 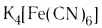
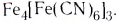
- Соединения, имеющие в своем составе комплексные ионы, называются комплексными соединениями.
- В составе комплекса выделяют центральный атом (или ион) — комплексообразователь, к которому присоединено определенное число лигандов — нейтральных молекул или ионов.
- Число лигандов, соединенных с центральным атомом, называют его координационным числом.
Классификация, номенклатура и устойчивость комплексных соединений
Комплексные соединения весьма разнообразны по составу, строению и свойствам. Существует несколько способов классификации комплексных соединений, основанных на различных принципах.
Классификация комплексных соединений
Наиболее распространенной является классификация по природе лигандов. В зависимости от природы лигандов различают:
Выделяют также циклические, или хелатные (клешневидные), комплексные соединения, содержащие би- и полидеитатные лиганды, связанные с центральным атомом связями, образованными по разным механизмам:
Лиганд, подобно клешням рака, как бы захватывает центральный атом.
На этих и последующих схемах ковалентные связи, образованные за счет неспаренных электронов, обозначены черточками, а образованные по донорно-акцепторному механизму — стрелками.
К хелатным соединениям относятся и важнейшие природные комплексы — гемоглобин и хлорофилл. Они имеют примерно одинаковую структуру ядра (порфириновое кольцо). Разница заключается только в том, что у хлорофилла 
По знаку электрического заряда внутренней сферы различают комплексы:
Нейтральные комплексы не имеют внешней сферы и являются неэлектролитами.
Существуют также координационные соединения, состоящие из комплексных катионов и комплексных анионов, например 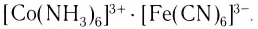
Номенклатура комплексных соединений
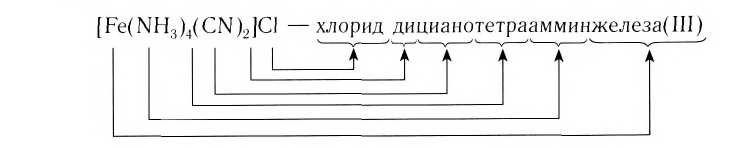
Знакомясь с новым классом химических соединений — комплексными соединениями, рассмотрим более подробно основные принципы их номенклатуры.
При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n. При этом лиганды, в зависимости от их заряда, располагаются в следующем порядке. Сначала записываются электронейтральные лиганды, а затем — лиганды с отрицательным зарядом:
Название комплексного соединения состоит из названия комплексного иона и названия противоиона. При этом сначала указывается анион в именительном падеже, а затем катион в родительном, независимо от того, какой из этих ионов комплексный (Согласно номенклатурным правилам ИЮПАК порядок названия комплексного соединения обратный. При этом и катион, и анион называют в именительном падеже).
Название комплексного иона строится по схеме 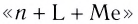
Затем называют лиганд. Названия анионных лигандов состоят из полного названия или корня названия соответствующего аниона и соединительной гласной -о-:
Нейтральные лиганды называют так же, как молекулы, например 
И, наконец, называют центральный атом или ион, указывая римской цифрой в круглых скобках степень окисления центрального атома. Если это комплексный катион, то название центрального атома не меняется:
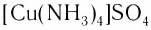
В названии комплексного аниона к корню латинского названия комплексообразователя добавляют суффикс -aт:
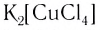
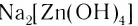
В названии нейтрального комплекса перечисляются все лиганды, а затем указывается русское название комплексообразователя в именительном падеже:
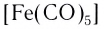
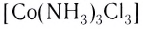
Устойчивость комплексных соединений
Большинство комплексных соединений при обычных условиях представляют собой твердые вещества, как правило, хорошо растворимые в воде. Ионная связь между внешней и внутренней сферами комплексного соединения при растворении вещества в воде легко разрушается. Происходит первичная диссоциация, которая протекает по типу диссоциации сильных электролитов:
Диссоциация внутренней сферы комплекса, называемая вторичной, протекает по типу диссоциации слабых электролитов и характеризуется наличием равновесия между комплексом, центральным ионом и лигандами:
- При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n.
- Название комплексного соединения состоит из названия комплексного иона и названия противоиона. Название комплексного иона строится по схеме
(справа налево по формуле).
- Различают первичную и вторичную диссоциацию комплексного соединения. Вторичная диссоциация характеризуется наличием равновесия между комплексом, центральным ионом и лигандами.
- Высоко-молекулярные соединения
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Оксигенсодержащие органические соединения
- Нитрогенсодержащие органические соединения
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
Комплексные соединения
Занятие, представленное на конкурс «Я иду на
урок», я провожу в 11-м биолого-химическом классе,
где на изучение химии отводится 4 часа в неделю.
Тему «Комплексные соединения» я взяла,
во-первых, потому что эта группа веществ имеет
исключительно большое значение в природе;
во-вторых, многие задания ЕГЭ включают понятие о
комплексных соединениях; в-третьих, учащиеся из
этого класса выбирают профессии, связанные с
химией, и будут встречаться с группой
комплексных соединений в будущем.
Цель. Сформировать понятие о составе,
классификации, строении и основах номенклатуры
комплексных соединений; рассмотреть их
химические свойства и показать значение;
расширить представления учащихся о многообразии
веществ.
Оборудование. Образцы комплексных
соединений.
План урока
I. Организационный момент.
II. Изучение нового материала (лекция).
III. Подведение итогов и постановка домашнего
задания.
План лекции
1. Многообразие веществ.
2. Координационная теория А.Вернера.
3. Строение комплексных соединений.
4. Классификация комплексных соединений.
5. Природа химической связи в комплексных
соединениях.
6. Номенклатура комплексных соединений.
7. Химические свойства комплексных соединений.
8. Значение комплексных соединений.
ХОД УРОКА
I. Организационный момент
II. Изучение нового материала
Многообразие веществ
Мир веществ многообразен, и мы уже знакомы с
группой веществ, которые принадлежат к
комплексным соединениям. Данными веществами
стали заниматься с XIX в., но понять их строение с
позиций существовавших представлений о
валентности было трудно.
Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником
Альфредом Вернером (1866–1919) была сформулирована
теория, позволившая понять строение и некоторые
свойства комплексных соединений и названная координационной
теорией*. Поэтому
комплексные соединения часто называют
координационными соединениями.
Соединения, в состав которых входят сложные
ионы, существующие как в кристалле, так и в
растворе, называются комплексными, или
координационными.
Строение комплексных соединений
Согласно теории Вернера центральное положение
в комплексных соединениях занимает, как правило,
ион металла, который называют центральным ионом,
или комплексообразователем.
Комплексообразователь – частица (атом,
ион или молекула), координирующая (располагающая)
вокруг себя другие ионы или молекулы.
Комплексообразователь обычно имеет
положительный заряд, является d-элементом,
проявляет амфотерные свойства, имеет
координационное число 4 или 6. Вокруг
комплексообразователя располагаются
(координируются) молекулы или кислотные
остатки – лиганды (адденды).
Лиганды – частицы (молекулы и ионы),
координируемые комплексообразователем и
имеющие с ним непосредственно химические связи
(например, ионы: Cl–, I–, NO3–,
OH–; нейтральные молекулы: NH3, H2O,
CO).
Лиганды не связаны друг с другом, так как между
ними действуют силы отталкивания. Когда
лигандами являются молекулы, между ними возможно
молекулярное взаимодействие. Координация
лигандов около комплексообразователя является
характерной чертой комплексных соединений (рис.
1).
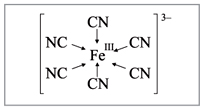 |
Рис. 1. Координация цианид-ионов
|
Координационное число – это
число химических связей, которые
комплексообразователь образует с лигандами.
![Рис. 2. Тетраэдрическая структура иона [AlBr4]–](https://him.1sept.ru/2009/08/28-3.jpg) |
Рис. 2. Тетраэдрическая структура иона
|
Значение координационного числа
комплексообразователя зависит от его природы,
степени окисления, природы лигандов и условий
(температура, концентрация), при которых
протекает реакция комплексообразования.
Координационное число может иметь значения от 2
до 12. Наиболее распространенными являются
координационные числа 4 и 6. Для координационного
числа 4 структура комплексных частиц может быть
тетраэдрической [AlBr4]– (рис. 2) и в виде
плоского квадрата [Pt(NH3)2Cl2] (рис.
3). Комплексные соединения с координационным
числом 6 имеют октаэдрическое строение [AlF6]3–
(рис. 4).
![Рис. 3. Соединение [Pt(NH3)2Cl2] со структурой плоского квадрата](https://him.1sept.ru/2009/08/28-2.jpg) |
Рис. 3. Соединение [Pt(NH3)2Cl2]
|
![Рис. 4. Ион [AlF6]3– октаэдрического строения](https://him.1sept.ru/2009/08/28-4.jpg) |
Рис. 4. Ион [AlF6]3–
|
Комплексообразователь и окружающие
его лиганды составляют внутреннюю сферу
комплекса. Частица, состоящая из
комплексообразователя и окружающих лигандов,
называется комплексным ионом. При изображении
комплексных соединений внутреннюю сферу
(комплексный ион) ограничивают квадратными
скобками. Остальные составляющие комплексного
соединения расположены во внешней сфере (рис.
5).
Суммарный заряд ионов внешней сферы должен
быть равен по значению и противоположен по знаку
заряду комплексного иона:
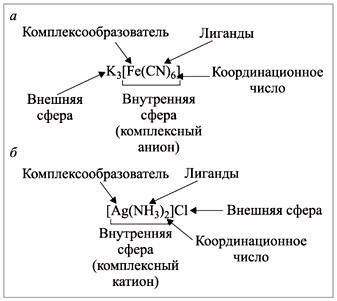 |
Рис. 5. Пояснения к изображению формул
|
Заряд комплексного иона легко
подсчитать, зная степень окисления составляющих
его частей.
Классификация комплексных
соединений
Большое многообразие комплексных соединений и
их свойств не позволяет создать единую
классификацию. Однако можно группировать
вещества по некоторым отдельным признакам.
1) По составу.
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные
катионы, в которых лигандами являются молекулы H2O.
Их образуют катионы металлов со степенью
окисления +2 и больше, причем способность к
образованию аквакомплексов у металлов одной
группы периодической системы уменьшается сверху
вниз.
Примеры аквакомплексов:
[Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б)Гидроксокомплексы – это комплексные
анионы, в которых лигандами являются
гидроксид-ионы OH–.
Комплексообразователями являются металлы,
склонные к проявлению амфотерных свойств – Be,
Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в
которых лигандами являются молекулы NH3.
Комплексообразователями являются d-элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные
анионы, в которых лигандами являются анионы
неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4],
K4[Fe(CN)6].
3) По заряду внутренней сферы.
Природа химической связи в
комплексных соединениях
Во внутренней сфере между
комплексообразователем и лигандами существуют
ковалентные связи, образованные в том числе и по
донорно-акцепторному механизму. Для образования
таких связей необходимо наличие свободных
орбиталей у одних частиц (имеются у
комплексообразователя) и неподеленных
электронных пар у других частиц (лиганды). Роль
донора (поставщика электронов) играет лиганд, а
акцептором, принимающим электроны, является
комплексообразователь. Донорно-акцепторная
связь возникает как результат перекрывания
свободных валентных орбиталей
комплексообразователя с заполненными
орбиталями донора.
Между внешней и внутренней сферой существует
ионная связь. Приведем пример.
Электронное строение атома бериллия:
Электронное строение атома бериллия в
возбужденном состоянии:
Электронное строение атома бериллия в
комплексном ионе [BeF4]2–:
Пунктирными стрелками показаны электроны
фтора; две связи из четырех образованы по
донорно-акцепторному механизму. В данном случае
атом Be является акцептором, а ионы фтора –
донорами, их свободные электронные пары
заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных
соединений
Наибольшее распространение имеет
номенклатура, рекомендованная IUPAC. Название комплексного
аниона начинается с обозначения состава
внутренней сферы: число лигандов обозначается
греческими числительными: 2–ди, 3–три, 4–тетра,
5–пента, 6–гекса и т.д., далее следуют названия
лигандов, к которым прибавляют соединительную
гласную «о»: Cl– – хлоро-, CN– –
циано-, OH– – гидроксо- и т.п. Если у
комплексообразователя переменная степень
окисления, то в скобках римскими цифрами
указывают его степень окисления, а его название с
суффиксом -ат: Zn – цинкат, Fe – феррат(III),
Au – аурат(III). Последним называют катион
внешней сферы в родительном падеже.
Примеры:
K3[Fe(CN)6] – гексацианоферрат(III)
калия,
K4[Fe(CN)6] – гексацианоферрат(II)
калия,
K2[Zn(OH)4] – тетрагидроксоцинкат
калия.
Названия соединений, содержащих комплексный
катион, строятся из названий анионов внешней
среды, после которых указывается число лигандов,
дается латинское название лиганда (молекула
аммиака NH3 – аммин, молекула воды H2O –
аква от латинского названия воды) и русское
название элемента-комплексообразователя;
римской цифрой в скобках указывается степень
окисления элемента-комплексообразователя, если
она переменная. Например:
[Cu(NH3)4]SO4 – сульфат
тетраамминмеди(II),
[Al(H2O)6]Cl3 – хлорид
гексаакваалюминия.
Химические свойства комплексных
соединений
1. В растворе комплексные соединения ведут
себя как сильные электролиты, т.е. полностью
диссоциируют на катионы и анионы:
[Pt(NH3)4]Cl2 = Pt(NH3)4]2+
+ 2Cl–,
K2[PtCl4] = 2K+ + [PtCl4]2–.
Диссоциация по такому типу называется
первичной.
Вторичная диссоциация связана с удалением
лигандов из внутренней сферы комплексного иона:
[PtCl4]2– PtCl3– + Cl–.
Вторичная диссоциация происходит ступенчато:
комплексные ионы ([PtCl4]2–) являются
слабыми электролитами.
2. При действии сильных кислот происходит
разрушение гидроксокомплексов, например:
а) при недостатке кислоты
Na3[Al(OH)6] + 3HCl = 3NaCl + Al(OH)3 + 3H2O;
б) при избытке кислоты
Na3[Al(OH)6] + 6HCl = 3NaCl + AlCl3 +
6H2O.
3. Нагревание (термолиз) всех аммиакатов
приводит к их разложению, например:
[Cu(NH3)4]SO4 CuSO4 + 4NH3
.
Значение комплексных соединений
Координационные соединения имеют
исключительно большое значение в природе.
Достаточно сказать, что почти все ферменты,
многие гормоны, лекарства, биологически активные
вещества представляют собой комплексные
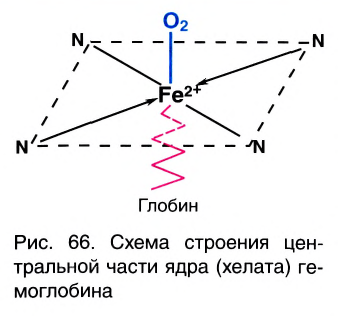
соединения. Например, гемоглобин крови,
благодаря которому осуществляется перенос
кислорода от легких к клеткам ткани, является
комплексным соединением, содержащим железо (рис.
6), а хлорофилл, ответственный за фотосинтез в
растениях, – комплексным соединением магния
(рис. 7).
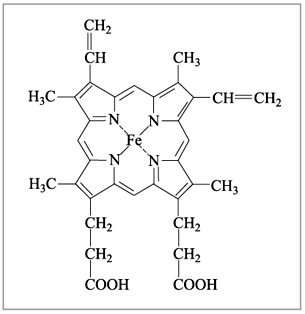 |
Рис. 6. Гем-группа в молекуле
|
Значительную часть природных
минералов, в том числе полиметаллических руд и
силикатов, также составляют координационные
соединения. Более того, химические методы
извлечения металлов из руд, в частности меди,
вольфрама, серебра, алюминия, платины, железа,
золота и других, также связаны с образованием
легкорастворимых, легкоплавких или летучих
комплексов. Например: Na3[AlF6] –
криолит, KNa3[AlSiO4]4 – нефелин
(минералы, комплексные соединения, содержащие
алюминий).
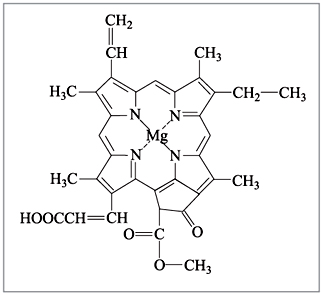 |
Рис. 7. Хлорофилл c1 |
Современная химическая отрасль
промышленности широко использует
координационные соединения как катализаторы при
синтезе высокомолекулярных соединений, при
химической переработке нефти, в производстве
кислот.
III. Подведение итогов и постановка
домашнего задания
Домашнее задание.
1) Приготовиться по лекции к уроку-практикуму по
теме: «Комплексные соединения».
2) Письменно дать характеристику следующим
комплексным соединениям по строению и
классифицировать по признакам:
K3[Cr(OH)6], [Cr(H2O)6](NO3)3,
Na2[Zn(CN)4], [Ag(NH3)2]OH.
3) Написать уравнения реакций, при помощи
которых можно осуществить превращения:
* За открытие этой
новой области науки А.Вернер в 1913 г. был
удостоен Нобелевской премии.
Н.Н.ТОПОЕВА,
учитель химии
Аскизского лицея-интерната
(с. Аскиз, Республика Хакасия)
…
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
- Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl– соответственно.
- Центральный атом или ион внутренней сферы называют комплексообразователем. Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы. Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+.
- Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др. В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
- Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
- Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
По электрическому заряду: катионные, анионные и нейтральные комплексы
- Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
- Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4]
- Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.
По количеству комплексообразователей
- Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
- Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
По типу лиганда
- Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
- Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
- Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], .
- Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4]
- Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
По химическим свойствам: кислоты, основания, соли, неэлектролиты:
- Кислоты — H[AuBr4], H2[PtCl6]
- Основания — [Cu(NH3)4](OH)2,[Ag(NH3)2]OH
- Соли — Cs3[Al(OH)6], [Ni(H2O)4]Cl2
- Неэлектролиты — [Pt(NH3)2Cl2]
По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
- Монодентатные лиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN−, F−, Cl−, OH−, SCN−, и др.
- Бидентатные лиганды. К такому типу лигандов относятся ионы H2N—CH2—COO−, СО32−, SO42−, S2O32−, молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
- Полидентатные лиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантные лиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
- В названиях комплексных соединений, как и ионных солей, первым указывают анион, а затем – катион.
- В названии комплекса сначала указывают лиганды, а после – комплексообразователь. Лиганды перечисляют в алфавитном порядке.
- Нейтральные лиганды называются также, как молекулы, к анионным лигандам прибавляют окончание –о. В таблице ниже даны названия наиболее распространенных лигандов
| Лиганд | Название лиганда | Лиганд | Название лиганда |
| en | этилендиамин | O2- | Оксо |
| H2O | Аква | H— | Гидридо |
| NH3 | Аммин | H+ | Гидро |
| CO | Карбонил | OH— | Гидроксо |
| NO | Нитрозил | SO42- | Сульфато |
| NO— | Нитрозо | CO32- | Карбонато |
| NO2— | Нитро | CN— | Циано |
| N3— | Азидо | NCS— | Тиоционато |
| Cl— | Хлоро | C2O42- | Оксалато |
| Br— | Бромо |
4. Если количество лигандов больше единицы, то их число указывают греческими приставками:
2-ди-, 3-три-, 4-тетра-, 5-пента-, 6-гекса-, 7-гепта-, 8-окта-, 9-нона-, 10-дека-.
5. Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
6. Названия комплексных анионов оканчиваются суффиксом – ат
После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем комплексные соединения:
[Cr(H2O)4Cl2]Cl
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
K4[Ni(CN)4]
Начнем с лигандов: в комплексном анионе содержится 4 лиганда CN—, которые называются тетрациано.
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия