Разработка урока по
предмету химии.
Тема
урока:
Спирты: строение, классификация, изомерия, номенклатура.
Класс:
10
Дата:
12.09.
Предмет
: химия
Тип
урока: урок изучения нового материала
Цели
урока:
установить основные признаки строения органических веществ класса спиртов,
рассмотреть многообразие веществ данного класса, научиться называть спирты по
«тривиальной» и международной номенклатурам.
Задачи
Образовательные:
—
сформировать у учащихся знания о строении спиртов на основе понятия
«функциональная группа»;
—
на основе многообразия данного класса соединений, выяснить принципы
классификации спиртов;
—
используя знания учащихся о видах изомерии, выяснить какие её виды существуют у
класса спиртов;
—
научиться называть спирты по «тривиальной» и международной номенклатурам;
—
закрепить знания и практические навыки учащихся об основных правилах техники
безопасности при ознакомлении с незнакомыми веществами.
Развивающие:
—
развивать аналитическое логическое мышление учащихся, умение делать
самостоятельные выводы на основе имеющихся знаний и полученной новой
информации;
—
побуждать учащихся к самостоятельному выдвижению личных умозаключений,
предположений, поддерживать их стремление находить правильные пути в решении
проблемных ситуаций;
—
развивать практические умения и навыки учащихся;
—
развивать способности обучающихся к осмысленному чтению и умению делать выводы
на основе научной информации, полученной при работе с учебной и дополнительной
литературой;
—
развивать умение учащихся выделять наиболее важные значимые сведения в
изучаемом учебном материале;
—
развивать коммуникативные способности обучающихся.
Воспитательные:
—
способствовать формированию в сознании учащихся активной гражданской позиции в
потребности ведения здорового образа жизни;
—
воспитывать чувство коллективизма и взаимопомощи;
—
способствовать формированию толерантного поведения в коллективе;
—
формировать основы научного мировоззрения.
Планируемые
результаты обучения
Учащиеся
научатся:
—
определять принадлежность веществ к классу спиртов;
—
составлять формулы изомеров и гомологов одноатомных предельных спиртов;
—
называть вещества класса спиртов по «тривиальной» и международной номенклатуре.
Учащиеся
получат возможность научиться:
—
прогнозировать, сравнивать и объяснять физические и химические свойства
различных спиртов на основании электронного строения молекул этих веществ;
—
составлять формулы спиртов различных видов по их названиям;
—
вести (составлять) конспект изученного материала на уроке.
Формирование
УУД
Личностные:
—
готовность учащегося к выполнению установленных в образовательном учреждении
норм, правил и требований к учебному процессу;
—
умение строить равноправные уважительные отношения с товарищами;
—
развитие познавательного интереса на основе личностного осмысления важности
изучаемого материала;
—
умение аргументированно определять личное отношение к отдельным изучаемым
вопросам темы урока.
Регулятивные:
—
целепологание: на основе темы урока, а также уже имеющихся знаний и жизненного
опыта определять и ставить перед собой учебные задачи;
—
составлять план и определять последовательность своих действий для решения
поставленных задач;
—
адекватно оценивать правильность своих действий, вносить при необходимости в
них коррективы;
—
сравнивать собственные полученные результаты с истинным эталоном, давать оценку
своим познавательным действиям;
—
готовность к участию и умение выполнять краткосрочные тематические проекты.
Коммуникативные:
—
умение учитывать и уважать мнения и позиции других участников учебного
процесса;
—
умение формулировать и тактично отстаивать свою позицию, соотносить её с
мнением и позицией своих товарищей;
—
умение вырабатывать и принимать решения для совместных действий;
—
аргументировать и отстаивать свою позицию, уметь спорить, тактично критиковать
мнение других;
—
уметь выстраивать в процессе учебной деятельности свои взаимоотношения с
учителем, сверстниками;
—
коллективно планировать общие действия в учебной деятельности;
—
вырабатывать умение сотрудничать, кооперироваться, интегрироваться в учебном
коллективе;
—
умение вести монолог и диалог в рабочей группе;
—
брать на себя ответственность лидера, а также выстраивать равноправные
отношения с товарищами.
Познавательные
—
умение осмысленно работать с различными источниками научных знаний: учебник,
научная литература, справочники, интернет ресурсы;
—
осуществлять поиск и извлекать нужную информацию из различных источников знаний;
—
уметь выделять главные мысли, делать выводы, составлять планы, тезисы и
конспекты на основе полученной научной информации;
—
уметь решать проблемные ситуации на основе имеющихся и приобретаемых знаний;
—
уметь устанавливать причинно-следственные связи в ходе учебного процесса;
—
находить наиболее рациональные, эффективные способы и пути решения задач,
поставленных проблемных ситуаций;
—
приобретать навыки исследовательских действий;
—
правильно строить собственную научную речевую и письменную информацию на основе
научной терминологии.
Оборудование:
—
образцы имеющихся спиртов: этанол, пропанол, амиловый, изоамиловый, глицерин;
—
мультимедийный проектор, ноотбук;
—
презентация «Спирты: строение, изомерия, номенклатура»;
—
печатная таблица «Водородная связь»;
—
учебные наборы для сборки шаростержневых моделей молекул веществ;
—
пустограмма «Конспект урока» (прилагается).
Ход
урока
1.
Организационный момент.
Учитель приветствует учащихся, настраивает
класс на деловой рабочий лад.
2.
Определение темы урока, целепологание.
2.1.
Фронтальная беседа учителя с классом.
— Какие органические соединения вы изучили? (п/о – Углеводороды).
— Какие органические соединения относятся к углеводородам? (п/о – К
углеводородам относятся органические вещества, состоящие из углерода и
водорода).
— Какие углеводороды вы знаете? (п/о – Алканы, алкены, алкины, диены,
арены).
— Изучая различные углеводороды, что вы узнавали об этих веществах? (п/о –
Мы
изучали их строение, гомологические ряды, характерные для них виды изомерии,
номенклатуру, получение углеводородов, их физические и химические свойства,
применение).
— Чему вы научились, изучая углеводороды? (п/о – Мы учились составлять
структурные формулы этих веществ, называть углеводороды по международной
номенклатуре, составлять формулы различных изомеров и называть их, писать
уравнения химических реакций и т.д.).
2.2.
Учитель сообщает, что на сегодняшнем уроке мы начинаем изучать новый класс
органических соединений – спирты (аканолы, алкоголи). (Тема урока
записывается на доске, учащиеся записывают её в тетрадь).
2.3.
Беседа с классом. Ребята, что вы знаете о спиртах из своей повседневной жизни?
Учащиеся указывают, что спирты известны человеку с
древних времен, они нашли широкое применение в различных областях.
В ходе беседы учитель обращает особое внимание учащихся к существованию
социальной проблемы в современном обществе, связанной с злоупотреблением
спиртных напитков, пагубном влиянии спиртов на организм человека, особенно
молодежи. Движение в современной молодежной среде «За здоровый образ жизни!».
2.4.
Целеполагание.
Ребята, мы выяснили, что спирты играют большую роль в жизни человека, в
современном обществе. Что бы вы хотели узнать о спиртах как химических
соединениях на уроках химии? Запишите свои вопросы в тетради.
(п/о – Какие вещества относятся к спиртам? Строение спиртов. Как получают
спирты? Свойства спиртов. Представители класса спиртов. Влияние спиртов на
организм человека и др.).
Анализируя вопросы учащихся, формулируются
образовательные цели урока по данной теме.
2.5.
Учитель обращает внимание учащихся, что изучая тему «Спирты» учащиеся получат
ответы на все поставленные вопросы. На данную тему отводится три часа. Тема
сегодняшнего урока и его цели – демонстрация слайда 1.
2.6.
Беседа учителя с классом.
Ребята, для более полного понимания изучаемого учебного материала по любому
предмету, для приобретения прочных знаний очень важно научиться выделять
наиболее важную и значимую научную информацию, делать обобщающие выводы. Во
всем этом поможет вам умение составлять конспект.
Что
такое конспект? Наиболее простое и понятное для вас определение конспекта
следующее: «Конспект – краткое изложение, запись основных вопросов темы,
изученной на уроке, лекции, другом учебном занятии».
Составляли ли вы конспект по каким-либо предметам? Пригодится ли вам в дальнейшей
жизни умение вести конспект?
(Проводили конспектирование на уроках истории, литературы. Умение
конспектировать пригодится в дальнейшей учебе в школе, колледже, вузе и тд.)
Учитель предлагает учащимся вести конспект
сегодняшнего урока. Раздает им пустограммы конспекта.
3.
Изучение нового материала.
3.1.
Строение спиртов. Отвечаем на вопрос: «Какие вещества относятся к спиртам?»
Слайд 2.
Учитель предлагает учащимся провести анализ молекулярной формулы этанола С2Н6О.
(На основе качественного и количественного анализа молекулярной формулы
этанола учащиеся делают вывод: СПИРТЫ – КИСЛОРОДОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ).
3.2.
Учитель предлагает учащимся выполнить в тетради задание на слайде 2.
На основе имеющихся навыков и знаний теории строения органических соединений
А.М. Бутлерова составить возможные структурные формулы этанола.
Учащиеся выполняют задание в тетради самостоятельно, при этом возможна
совместная работа в парах.
Учитель следит за ходом работы, может оказывать некоторую помощь отдельным
учащимся.
Учащиеся составляют следующие возможные структурные формулы этанола:
Н Н Н Н
Н – С – О –
С – Н Н – С – С – О — Н
Н Н Н Н
Формулы записываются на доске.
3.3.
Создание проблемной ситуации. Какая из составленных учащимися структурных
формул этанола отражает истинное строение спирта? Работа со слайдом 3.
Учащиеся проводят анализ структурных формул. Устанавливают их различия.
В
первой формуле: два углеводородных радикала метила связаны атомом кислорода,
весь водород в молекуле имеет равное положение.
Во
второй формуле: радикал этил связан группой атомов – ОН. Водород в группе – ОН
занимает особое положение.
3.4.
Решение проблемной ситуации.
Учитель предлагает учащимся внимательно прочитать и осмыслить текст в учебнике
Рудзитиса на стр. 76-77 о лабораторном эксперименте, позволяющем найти
правильный ответ об установлении истинной структурной формулы этанола.
Учащиеся работают с текстом учебного пособия. Делают выводы. Один из учащихся
сообщает о своих выводах классу.
(Структурная формула этанола № 2 является истинной).
3.5.
Работа со слайдом 4. Введение понятие «функциональной группы». Наличие в
молекулах спиртов функциональной группы — ОН. Определение понятия
функциональной группы.
3.6.
Работа со слайдом 5. Установление общих формул предельных одноатомных спиртов.
Определение данного класса соединений.
(Учащиеся
записывают определение спиртов по памяти в тетрадь).
3.7.
Слайд 6. Учащимся предлагается, работая в парах, собрать шаростержневую модель
молекулы этанола.
(Учащиеся демонстрируют собранные модели молекул, дают пояснения).
3.8.
Слайд 7. Многообразие класса спиртов, их классификация:
— по количеству функциональных групп;
— по положению функциональных групп;
— по углеводородному радикалу.
На каждый вид классификации приводятся примеры, и учитель называет спирты.
3.9.
Знакомство с представителями спиртов. Слайд 8. Работа с таблицей. Особое
внимание обращается на то, что все спирты ядовиты для организма человека.
Учитель предлагает учащимся ознакомиться с имеющимися образцами спиртов:
выяснить их агрегатное состояние, наличие запаха.
(Учащиеся работают с выданными образцами спиртов. Во время работы они
вспоминают и отрабатывают навыки по ТБ при работе с незнакомыми веществами).
3.10.
Номенклатура спиртов. Слайд 9. На слайде изображен «?».
Учитель обращается к классу с вопросом.
Ребята, кто из вас был внимательным и заметил какую-то закономерность, когда мы
произносили или вы читали названия спиртов ?
(п/о – В названиях спиртов присутствует суффикс –ОЛ, цифры в конце названия
указывают положение функциональной группы).
Выполняется упражнение: назвать спирты по
международной номенклатуре.
3.11.
Объяснение жидкого агрегатного состояние многих спиртов. Отработка понятия
«Водородная связь». Слайд 10.
Объяснение учителя с использованием слайда и печатной таблицы «Водородная
связь».
3.12.
Изомерия спиртов. Слайд 11.
На основе имеющихся знаний учащиеся и информации слайда, учащиеся устанавливают
виды изомерии спиртов:
— структурная,
— положение функциональной группы,
— межклассовая.
На каждый вид изомерии учащиеся приводят примеры, записывая формулы изомеров в
тетради, дают им названия.
4.
Закрепление. Проверка усвоения учебного материала учащимися.
4.1.
Краткая беседа учителя с классом по основным понятиям изученного материала:
—
основные признаки строения спиртов,
—
что такое функциональная группа?,
—
виды спиртов,
—
изомерия спиртов,
—
номенклатура спиртов.
4.2.Самостоятельная
работа учащихся по составлению конспекта. (Заполнение пустограммы).
5.
Итоги урока.
Учитель подводит итоги урока. Оценивает работу класса в целом и отдельных
учащихся, комментирует полученные учащимися оценки.
6.
Домашнее задание.
— учебник п. 11, с.76-78, упр.1,2,5.
— индивидуальное задание: подготовить сообщение на тему «Влияние спиртов на
организм человека».
7.
Заключение.
Учитель благодарит учащихся за работу на уроке.
Составила: Абдуова
Райхан Юрьевна
Список
используемой литературы:
1. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2014.
2. Волков В.А., Вонский Е.В., Кузнецова Г.И. Выдающиеся химики мира.
– М.: Химия, 2011.
3. Габриелян О.С., Остроумов И.Г., Соловьев С.Н., Маскаев Ф.Н. Общая
химия: Учебник для 11 класса общеобразовательных учреждений с углубленным
изучением химии. – М.: Просвещение, 2015.
4. Глинка Н.Л. Общая химия. – Л.: Химия, 2013.
5. Демонстрационные опыты по общей и неорганической химии. / Под ред.
Б.Д. Степина. – М.: Владос, 2013.
6. Кузьменко Н.Е. Еремин В.В. Химия. 2400 задач для школьников и поступающих
в вузы. – М.:Дрофа, 2009.
7. Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии: Современный
курс для поступающих в вузы. – М.: Экзамен, 2014.
8. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия: Для школьников
старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование,
2012.
9. Неорганическая химия: в 3 т. / Под ред. Ю.Д. Третьякова. Т.
2: Химия непереходных элементов. – М.: Академия, 2014.
10. Популярная библиотека химических элементов. В 2 кн. – М.: Наука,
2003.
11. Рабинович В.А., Хавин З.Я. Краткий химический справочник. – Л.:
Химия, 2007.
12. Фримантл М. Химия в действии. В 2 ч. – М.: Мир, 2008.
13. Химическая энциклопедия: в 5 т. – М.: БРЭ, 1988 – 2008.
14. Энциклопедический словарь юного химика. / Под ред. Д.Н. Трифонова.
– М.: Педагогика-Пресс, 2009.
15. Энциклопедия для детей. Том 17. Химия. / Под ред. В.А. Володина –
М.: Аванта+, 2010.
Обновлено: 26.05.2023
Персональный сайт учителя химии Сазонова В.В.
Вопросно-ответный конспект
Алгоритм
1. Запишите название конспектируемого текста и его выходные данные.
2. Прочитайте текст, осмысливая его содержание.
3. Прочитайте текст второй раз, разбивая его на отрывки.
4. Выделите в каждом отрывке основную мысль.
5. Составьте вопрос к основной мысли для каждого отрывка.
6. Запишите точный ответ на каждый из вопросов.
Плановый конспект
Основой планового конспекта является план, каждому пункту которого соответствует определённая часть конспекта) текста.
Алгоритм
1. Запишите название конспектируемого текста и его выходные данные.
2. Прочитайте текст, осмысливая его основное содержание.
3. Составьте сложный план текста — основу конспекта.
4. Запишите своими словами основные положения и выводы, факты и доказательства, примеры и иллюстрации, соответствующие пунктам и подпунктам плана. ( Обратите внимание! Если пункт плана не требует дополнительных пояснений, он не сопровождается текстом.)
5. Прочитайте ещё раз текст параграфа и проверьте полноту составленного конспекта.
6. Прочитайте конспект и при необходимости исправьте стилистические ошибки, расставьте знаки препинания.
7. Доработайте конспект, используя:
а) систему выделений в тексте (подчёркивание, отступы, пустые строки, рамки), сокращений, условных обозначений;
б) определённые цвета для выделения той или иной информации (формулы, даты, заголовки, цитаты и др.).
1) оставляйте большие поля для дополнений, за- меток, записи незнакомых терминов имён, требующих разъяснений;
2) соблюдайте правила цитирования (цитату заключайте в кавычки, давайте ссылку на источник с указанием страницы);
3) пишите компактно, чтобы на странице умещалось как можно больше текста;
4) избегайте излишнего цитирования, стремления сохранить стилистическую особенность текста.
Обзорный конспект
Обзорный конспект раскрывает конкретную тему с использованием нескольких источников.
Алгоритм
1. Запишите название конспекта.
2. Подберите и проанализируйте источники информации, содержащие материал по данной теме.
3. Составьте простой план по рассматриваемой теме, включающий все основные положения (ключевые понятия), которые она охватывает.
4. Составьте сложный план текста — основу конспекта, обобщая близкие по содержанию пункты простого плана.
5. Запишите своими словами основные положения и выводы, факты и доказательства, примеры и иллюстрации, соответствующие пунктам и подпунктам плана. (Обратите внимание! Если пункт плана не требует дополнительных пояснений, он не сопровождается текстом.)
6. Прочитайте конспект, проверяя полноту раскрытия темы.
7. Прочитайте конспект и при необходимости исправьте стилистические ошибки, расставьте знаки препинания.
8. Доработайте конспект, используя:
а) систему выделений (подчёркивание, отступы, пустые строки, рамки), сокращений, условных обозначений;
б) определённые цвета для выделения той или иной информации (формулы, даты, заголовки, цитаты и др.).
9. Составьте список литературы.
Текстуальный (цитатный) конспект
Текстуальный конспект построен из высказываний автора, изложенных им фактов.
Алгоритм
1. Запишите название конспектируемого текста и его выходные данные.
2. Прочитайте текст и отметьте в нём основное содержание, главные мысли.
3. Выделите те цитаты, которые войдут в конспект.
4. Выпишите цитаты, используя правила их сокращения (можно использовать разные формы записи).
Хронологический конспект
Хронологический конспект отражает хронологическую последовательность событий на фоне показа самих событий.
Алгоритм
1. Запишите название конспектируемого текста и его выходные данные.
2. Прочитайте текст, осмысливая его содержание.
3. Прочитайте текст второй раз, разбивая его на отрывки, в которых описываются определённые временные интервалы.
4. Выделите в каждом отрывке основное событие и кратко охарактеризуйте его.
5. Сформулируйте итоговый вывод о развитии событий в течение определённого времени.
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.
1. Предмет химии. вещества
Химия 8 класс
2. Роль химии в нашей жизни
Химия 8 класс
3. Знаки химических элементов
Химия 8 класс
4. Химическая формула. Относителная атомная и молекулярная масса
Химия 8 класс
5. Основные сведения о строении атома. состав атомных ядер
Химия 8 класс
6. Порядковый номер элемента. Изотопы
Химия 8 класс
7. Структура периодической таблицы элементов
Химия 8 класс
8. Строение электронных оболочек атома
Химия 8 класс
9. Ионная связь
Химия 8 класс
10. Ковалентная неполярная связь
Химия 8 класс
Получайте новое первыми
Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
Химия 8 класс
Первоначальные химические понятия. Кислород. Горение. Водород. Вода. Растворы. Количественные отношения в химии. Важнейшие классы неорганических соединений. Периодический закон и строение атома. Строение вещества. Химическая связь.
Химия 9 класс
Электролитическая диссоциация. Кислород и сера. Азот и фосфор. Углерод и кремний. Общие свойства металлов. Металлы IA—IIIA-групп периодической таблицы химических элементов. Железо. Металлургия. Краткий обзор важнейших органических веществ (Углеводороды, производные углеводородов).
Справочники для ОГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Основному Государственному Экзамену по химии.
Химия 10 класс
Химия 11 класс
Справочники для ЕГЭ
Специальные конспекты по химии, в которых в сжатой форме повторяются основные школьные темы, для экспресс-подготовки к Единому Государственному Экзамену по химии.
Решения задач по химии
Источники идей и источники цитат для конспектов по Химии:
(с) Цитаты из вышеуказанных учебных пособий использованы на сайте в незначительных объемах, исключительно в учебных и информационных целях (пп. 1 п. 1 ст. 1274 ГК РФ).
Выберите удобный метод и повысьте эффективность занятий.
Для чего нужен конспект? Конспектирование — отличная возможность систематизировать знания и запомнить самую важную информацию на уроке, вебинаре или при подготовке доклада. В этой статье мы поговорим о том, как составлять конспекты, используя различные методы.
Что такое конспект
Конспектирование — это процесс осмысленной переработки текста, аудио- и видеоматериала с целью улучшить запоминание информации. Написание конспекта позволяет выделить смысловые части, зафиксировать ключевые идеи, выявить закономерности и систематизировать информацию. Конспекты составляются в виде тезисов, выписок, вопросов, в сжатом виде отражающих и уточняющих необходимую информацию.
Виды конспектов
Ведение конспектов существенно облегчает усвоение учебного материала. Выделяют несколько видов конспектов:
- Плановый конспект строится на основе плана, информация в конспекте раскрывает каждый его пункт.
- Конспект-схема помогает за счёт схем сформировать логические связи.
- Текстуальный конспект состоит из цитат, логически связанных между собой.
- Свободный конспект содержит выписки, тезисы, цитаты.
- Тематический конспект раскрывает определённую тему, например, отражает хронологию событий.
Методы конспектирования
Существует несколько методов конспектирования, которые подразумевают под собой способы записи конспектов. Остановимся подробнее на самых популярных и эффективных методах конспектирования.
Метод Корнелла
В середине прошлого века профессор Корнелльского университета Вальтер Паук разработал метод конспектирования, ставший впоследствии суперпопулярным у студентов. Он так и называется — метод Корнелла.
Когда полезен
Для обработки больших объёмов информации, например, на продолжительных и информативных вебинарах.
Предметы
- история,
- обществознание,
- литература,
- русский язык,
- биология,
- химия,
- география.
Как использовать этот метод конспектирования:
- Возьмите лист А4 или обычный тетрадный лист. Проведите две горизонтальные линии: одну вверху (там будет дата и заголовок), вторую — внизу, чтобы под ней можно было записать 5-6 предложений, суммирующих содержание конспекта на этой странице.
- Затем проведите вертикальную линию и разделите середину листа на две части. Правая колонка должна быть в два раза шире левой.
- Во время вебинара в правую широкую колонку нужно записывать основные сведения, которые сообщает учитель. Между предложениями лучше оставлять немного пустого пространства, чтобы была возможность в них ещё что-то дописать. После занятия в левую колонку перенесите всю самую важную информацию: правила, формулы, даты, имена.
- В течение суток после урока заполните нижнее поле, там нужно записать краткое резюме всей лекции.
Метод боксов
Этот метод составления конспектов схож с предыдущими, но суть в том, чтобы заключать каждый блок темы в небольшие квадраты. Так проще воспринимать информацию, поскольку фокусируешься только на выделенном аспекте темы. Факты не путаются между собой, их легче запомнить.
Когда полезен:
- при изучении иностранных слов, дат, биографий исторических личностей;
- для сопоставления нескольких понятий.
Предметы:
- история,
- обществознание,
- литература,
- русский язык,
- английский язык.
Как использовать:
Метод нумерации
Суть этого вида конспектирования заключается в том, чтобы присваивать порядковый номер каждой записываемой мысли. При этом тренируется лаконичность и чёткость мышления, а в конспекте потом легко ориентироваться.
Когда полезен метод
Для записывания длинных лекций, особенно если преподаватель порой перескакивает с одной мысли на другую.
Предметы:
- история,
- обществознание,
- литература,
- русский язык,
- английский язык,
- химия,
- биология,
- география,
- геометрия,
- физика.
Как использовать:
Метод таблиц
Таблицы — это очень наглядно. Их можно использовать не только на истории, но и на других уроках.
Когда полезен:
- при рассмотрении тем с одинаковыми критериями,
- при конспектировании большого количества фактов,
- чтобы свести несколько элементов в одну систему,
- чтобы разобраться в плюсах и минусах чего-либо.
Предметы:
- история,
- обществознание,
- литература,
- русский язык,
- английский язык,
- биология,
- география.
Как использовать этот метод написания конспекта:
- Возьмите тетрадный лист или лист А4 и, расположив его горизонтально, начертите нужное количество столбцов. При вертикальном расположении листа колонки могут получиться слишком узкими, будет неудобно писать.
- Изучая те или иные темы, вносите данные в соответствующие столбцы.
- Когда таблица будет готова, отложите конспект на несколько часов, а потом вновь обзорно взгляните на него. Сравните факты и понятия, отметьте сходства и различия, плюсы и минусы, проанализируйте связи.
Метод индексов
Стрелочки, рамки, схемы, таблицы, графики, рисунки и прочие визуальные средства — прекрасные помощники в понимании связей и запоминании ключевых понятий. Используйте их при оформлении конспектов.
Можно вкраплять их в текст или ставить на полях для привлечения внимания. Например, если преподаватель продиктовал незнакомое понятие и не дал определение, можно поставить рядом яркий значок, чтобы потом разобраться с новым термином.
Когда полезен
Когда нужно записывать быстро, но при этом структурировать информацию.
Предметы:
- история,
- обществознание,
- литература,
- русский язык,
- английский язык,
- химия,
- биология,
- география,
- геометрия,
- физика,
- информатика.
Как конспектировать методом индексов:
Метод ментальных карт
Карта мыслей, на первый взгляд, кажется гораздо сложнее и запутаннее обычного конспекта. В ней ключевая идея находится в центре, а от неё тянутся ветки мыслей и объяснений. Но на самом деле она намного эффективнее: во время составления и отрисовки ментальной карты вы пропускаете информацию через себя и лучше её запоминаете.
Когда полезен:
- для разбора больших сложных тем,
- для анализа литературных произведений,
- при написании эссе,
- в подготовке докладов.
Предметы:
- история,
- обществознание,
- литература,
- русский язык,
- английский язык,
- биология,
- география.
Как использовать этот метод ведения конспектов:
- В центре карты напишите главную мысль. От неё проведите несколько линий и отметьте все ключевые идеи, относящиеся к теме. На эти ветки добавляйте новые пункты, раскрывающие предыдущие, и так далее.
- Пишите кратко и старайтесь не расширять карту дальше четвёртого уровня. Объединяйте темы из разных веток, добавляйте заметки и идеи. Делайте всё, чтобы не только удобно расположить мысли на карте, но и заставить её работать на вас.
Инструкции по составлению карты мыслей у нас посвящена отдельная статья. Обязательно прочтите и используйте этот эффективный метод создания конспектов!
Надеемся, что наша статья была для вас полезна, и вы поняли основные правила конспектирования. Использование конспектов существенно облегчит ваше обучение и поможет лучше запоминать материал по разным предметам. Теперь вы знаете, как правильно писать конспекты, и сможете успешно применять в учёбе самые эффективные методы конспектирования.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.
Записали!
Скоро с вами свяжется консультант, расскажет об обучении в нашей онлайн-школе.
Проверьте вашу электронную почту — там письмо о том, что стоит сделать перед консультацией.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.
Простейшие понятия: вещество, молекула, атом, химический элемент
Что такое химия? Где мы встречаемся с химическими явлениями? Везде. Сама жизнь — это бесчисленное множество разнообразных химических реакций, благодаря которым мы дышим, видим голубое небо, ощущаем изумительный запах цветов…
Что изучает химия? Химия изучает вещества, а также химические процессы, в которых участвуют эти вещества.
Что такое вещество — понятно: это то, из чего состоит окружающий нас мир и мы сами. Но что такое химический процесс (явление)?
К химическим явлениям относятся процессы, в результате которых изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество (оно стало другим!), — изменились его свойства:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
Все эти изменения — следствие сложных и многообразных химических процессов. Итак,
химия — это наука о веществах и их превращениях.
При этом исследуются не всякие превращения, а только такие, при которых
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
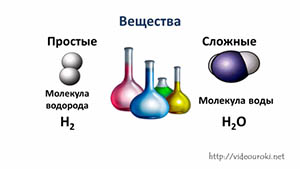
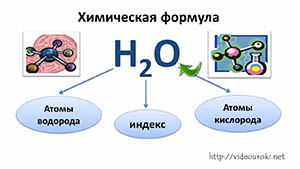
Вещество — это то, из чего состоят окружающие нас предметы. Каждому абсолютно чистому веществу (таких в природе, кстати, не существует) приписывают определённую химическую формулу, которая отражает его состав, например:
Наименьшая частица вещества, которая отражает его качественный и количественный состав, называется молекулой.
Молекулы состоят из атомов. Атомы в молекуле соединены при помощи химических связей. Каждый атом обозначается при помощи символа (химического знака):
Число атомов в молекуле обозначают при помощи индекса:
- О2 — это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Но! Если атомы не связаны химической связью, то их число обозначают при помощи коэффициента:
Аналогично изображают число молекул:
- 2Н2 — две молекулы водорода;
- 3Н2О — три молекулы воды.
Почему атомы водорода и кислорода имеют разное название, разный символ? Потому что это атомы разных химических элементов.
Химический элемент — это частицы с одинаковым зарядом ядер их атомов.
Что такое ядро атома? Почему заряд ядра является признаком принадлежности атома к данному химическому элементу? Чтобы ответить на эти вопросы, следует уточнить: изменяются ли атомы в химических реакциях? Из чего состоит атом*?
* Подробнее о строении атома будет рассказано в уроке 3.
Атом не имеет заряда, хотя и состоит из положительно заряженного ядра и отрицательно заряженных электронов:
В ходе химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ!
Каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева (порядковый номер равен заряду ядра атома); определённое название и, для некоторых химических элементов, особое прочтение символа в химической формуле (табл. 1).
Подведём итог. Вещества состоят из молекул, молекулы состоят из атомов, атомы с одинаковым зарядом ядра относятся к одному и тому же химическому элементу.
Но, если вещество состоит из молекул, то любое изменение состава или строения молекулы приводит к изменению самого вещества, его свойств.
Вопрос. Чем отличаются химические формулы веществ: Н2О и Н2О2?
Хотя по составу молекулы этих веществ отличаются на один атом кислорода, сами вещества по свойствам сильно отличаются друг от друга. Воду Н2О мы пьём и жить без неё не можем, а Н2О2 — перекись водорода, пить нельзя, а в быту её используют для обесцвечивания волос.
Вопрос. А чем отличаются химические формулы веществ:
Состав этих веществ — аллозы (А) и глюкозы (Б) — одинаков — С6Н12О6. Отличаются они строением молекул, в данном случае — расположением групп ОН в пространстве. Глюкоза — универсальный источник энергии для большинства живых организмов, а аллоза практически не встречается в природе и не может быть источником энергии.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
- Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
- Графит — атомы углерода находятся в одной плоскости;
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
Строго говоря, по нижеизложенным правилам определяют не валентность, а степень окисления (см. урок 7). Но поскольку в некоторых соединениях числовые значения этих понятий совпадают, то иногда по формуле можно определять и валентность.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях.
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
- Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
- Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
Задание 1.4. Составьте химические формулы соединений:
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Выводы
Вещества бывают простые и сложные. Состав веществ показывают при помощи химических формул. Формулы веществ составляют, учитывая валентности составных частей этих веществ. Запись химического процесса при помощи формул называется уравнением химической реакции. Химические реакции бывают разных типов: обмена, замещения, разложения, соединения и другие.
Читайте также:
- Кубический сантиметр и измерение объема 4 класс пнш конспект
- В с высоцкий песня о волге конспект урока
- План конспект урока географическая карта 3 класс
- Конспект занятия по развитию речи в старшей группе на тему профессии родителей
- Spotlight 9 illusions конспект урока
План-конспект урока химии в 8 классе в соответствии с требованиями ФГОС, представленный Карповой Стеллой Сергеевной, учителем химии Алексеевской СОШ №1 Алексеевского муниципального района
Тема урока: «Оксиды»
Класс: 8
УМК: О.С. Габриелян
Тип урока: урок изучения нового материала
Цель урока: сформировать понятие об оксидах как об одном из классов химических соединений; рассмотреть состав, строение, номенклатуру, свойства.
Задачи:
Образовательные задачи:
-
дать понятие об оксидах
-
продолжить формирование умения составлять формулы веществ, используя валентность элементов, названия веществ.
-
закрепить знания химической номенклатуры для бинарных соединений
-
показать значение оксидов в природе и жизни человека.
Развивающие задачи:
-
Развивать речевые навыки, наблюдение и умение делать выводы
-
Развивать умение работать коллективно
-
Развивать критическое мышление
-
Развивать интерес к химической науке
Воспитательные задачи:
-
Воспитывать умение работать в атмосфере поиска, творчества, прививать чувство ответственности за выполненную работу, самостоятельность, общительность, коммуникабельность.
ТАВСО:
Оборудования: ПК учителя, мультимедийная установка, дидактические карточки.
Реактивы: оксида кальция, оксид кремния (IV) SiO2, оксид меди (I) CuO, оксид железа (III) Fe2O3, вода, бусы из агата, углекислый газ; лотки для лабораторного оборудования, протоколы для выполнения лабораторного опыта.
Планируемые результаты обучения:
Предметные:
-
продолжить формировать систему предметных знаний;
-
сформировать умение переводить из одной знаковой системы в другую (формула-название, название-формула);
-
овладение терминологией;
-
сформировать способность применять знания для практических задач.
Метапредметные:
-
научить планировать собственную деятельность;
-
научить осуществлять контроль и оценку своей деятельности.
Личностные:
-
сформировать устойчивый интерес к поиску решения проблемы;
-
саморазвитие и самосовершенствование.
Литература для учителя: Габриелян. И.Г. Остроумов. Настольная книга для учителя. Дрофа, М.-2008.
Литература для учащихся: Габриелян О.С. Химия — 8 класс. Учебник для общеобразовательных учебных заведений. Дрофа, М.-2012.
План-конспект урока
|
Этапы урока |
Время |
Деятельность учителя |
Деятельность учащихся |
|
1. Организационный момент |
1 мин. |
Здравствуйте, ребята! (проверка готовности к уроку) |
Приветствуют учителя. |
|
2. Мотивация |
2 мин. |
На демонстрационном столе находятся разные на первый взгляд вещи: вода, речной песок, негашеная известь, бусы из агата. Как вы считаете, почему сегодня на уроке я демонстрирую их вам? Что же их объединяет? Ответ на вопрос предполагаю получить в конце урока после изучения новой темы. |
Ученики рассматривают вещи: воду, речной песок, негашеную известь, бусы из агата и предполагают, что их объединяет. |
|
3. Актуализация знаний. |
7 мин. |
На предыдущих уроках вы научились определять степень окисления элементов по формуле и составлять формулы по степеням окисления. Вспомните эти действия и выполните задания на карточках №1 (Приложение*). |
Выполняют задания на карточках, делают самопроверку. |
|
4. Изучение нового материала |
23 мин. |
-Что вы заметили общего в формулах, с которыми работали? -Верно. Эти вещества называются оксиды. И тема нашего урока: «Оксиды». (Тема записывается на доске) -Сформулируем определение оксидов, ответив на 3 вопроса. а) какие вещества по составу? б) сколько элементов в составе? в) какой элемент обязательно входит в состав оксидов, его валентность? — (создание проблемной ситуации и ее решение) Ребята, а это оксид? H2O2 -Дайте определение оксидам. — Сейчас мы попытаемся понять, каким же образом образуются оксиды? (На доске написаны формулы пяти оксидов). Взгляните на формулу первого оксида СО, как вы думаете, какие простые вещества вступали в реакцию, чтобы образовался данный оксид? Запишем уравнение реакции: C + O2 = 2CO (учитель записывает уравнение реакции). -Значит оксиды образуются в результате реакции простых веществ с кислородом. Кто хочет на доске записать уравнения реакций получения остальных оксидов? -Итак, ребята, теперь давайте посмотрим, как же давать названия оксидам. Единственный момент, на который вы должны обратить внимание: постоянную или переменную валентность имеет элемент, входящий в состав оксида. Давайте дадим название оксиду СО. Это соединение сложное, состоит из двух элементов, один из которых кислород. Значит, это оксид. -Оксид какого элемента? -Углерод имеет постоянную или переменную валентность? -В данном случае его валентность II. Оксид СО называют «оксид углерода (II)». -Кто хочет попробовать у доски дать название другим оксидам? -Сейчас ребята, переходим к изучению физических свойств оксидов. Для этого выполним лабораторный опыт. В ваших лабораторных лотках стоят образцы оксидов, а на столах лежат протоколы (Приложение*), которые необходимо заполнить, вы будете определять агрегатное состояние, цвет и запах выданных вам оксидов. Но прежде чем приступить к выполнению опыта вспомним основные правила техники безопасности, которые вы должны соблюдать. |
— Учащиеся выделяют общие признаки в формулах, работая в паре (Вещества, состоящие из двух элементов, один из которых кислород). — Записывают тему урока в тетради. -Учащиеся в тетради делают краткую запись, отвечая на вопросы. (1. Сложные вещества. 2. Состоят из 2 х.э. 3. О, II) -Это не оксид, т.к. валентность кислорода равна 1. -(Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород c валентностью II) Учащиеся записывают определение в тетрадь. -Углерод и кислород. (один ученик работает у доски): 2Cl2 + 7O2 = 2Cl2O7 4Fe + 3O2 = 2Fe2O3 Ca + O2 = 2CaO 4Al + 3O2 = 2Al2O3 -Углерода. — Переменную. (один ученик работает у доски) 2Cl2 + 7O2 = 2Cl2O7 (оксид хлора (VII)) 4Fe + 3O2 = 2Fe2O3 (оксид железа (III)) Ca + O2 = 2CaO (оксид кальция) 4Al + 3O2 = 2Al2O3 (оксид алюминия). Один из учащихся отвечает с места. Учащиеся заполняют протокол. |
|
5. Закрепление изученного материала. |
8 мин. |
А теперь – физкультминутка. Но она у нас сегодня необычная и напрямую связана с темой нашего урока. На слайде вам будет показана формула вещества. Если оно является оксидом — вам нужно встать. Н2SO4, FeО, NН3, P2О3, NaН, Li2О, NO2, Н2, О2, НNО3, PbO Присаживайтесь. Продолжаем наш урок. Итак, с какими бинарными соединениями мы познакомились на сегодняшнем уроке? — Какие вещества мы называем оксидами? Мы научились с вами отличать оксиды от других веществ, называть их, составлять их формулы. Я предлагаю вам проверить себя: насколько хорошо вы овладели новыми знаниями. У вас на столах лежат карточки №2 (Приложение*) |
Ученики делают физкультминутку. -Оксиды. Один ученик отвечает с места. Учащиеся работают в парах. Самоконтроль по шаблону. |
|
6. Домашнее задание |
1 мин. |
Учитель озвучивает и комментирует домашнее задание: Изучить §41, упр.1; 2 (письменно) |
Записывают домашнее задание |
|
7. Подведение итогов. Рефлексия. |
3 мин. |
Наш урок подошел к завершению. Посмотрите, какие цели поставили в начале урока. Можно ли считать, что наши цели на урок достигнуты? Д. Хевелси говорил: «Мыслящий ум не чувствует себя счастливым, пока ему не удается связать воедино разрозненные факты им наблюдаемые». Посмотрим на демонстрационный стол. Надеюсь, что теперь вы можете ответить на вопрос, что объединяет воду, речной песок, негашеную известь и бусы из агата? Какую оценку вы поставите классу за работу на уроке и почему? Оцените свою деятельность на уроке и класса, нарисуйте в тетради смайлик веселый, грустный или нейтральный. Спасибо за урок! До свидания! |
Учащиеся делают выводы. Ответы учеников (их объединяет то, что все эти вещи – оксиды). Самооценка учеников. |
Приложение*
Карточка №1
1.Определите степень окисления по формуле:
Al2O3, Ag2O, FeO, N2O, SO2
2.Составьте формулы веществ по степеням окисления: CuO SiO ZnO SO PO.
Карточка №2
Выпишите в столбик из перечня химических формул веществ формулы оксидов и дайте им названия:
MgO, KOH, O3, SO3, SO2, Al2S3, CaCO3, Аl2O3, Mg(OH)2, CO2, Na2N, HCl, CaO, H2CO3, P2O5, FeCl3, Na2O, H2SO4, СuО, Cu2O, HNO3, NH3.
Лабораторный опыт №5
Ознакомление с образцами оксидов
Выполнение опыта:
1) Рассмотрите выданные вам образцы оксидов и ознакомьтесь с ними по плану: а) агрегатное состояние б) цвет в) запах
2) Занесите результаты в таблицу:
Таблица 1.
Физические свойства оксидов
|
Формула оксида |
Название оксида |
Агрегатное состояние |
Цвет |
Запах |
|
CaO |
||||
|
SiO2 |
||||
|
CuO |
||||
|
Fe2O3 |
||||
|
H2O |
||||
|
CO2 |
Сделайте вывод: в каком агрегатном состоянии могут быть оксиды? Какого они могут быть цвета?
Вывод: План-конспект нужен учителю, так как он поможет не сбиться с ритма урока, правильно рассчитать продолжительность того или иного этапа, своевременно его завершить. Я думаю, что мой план конспект урока по химии для 8 класса достаточно хороший и его можно использовать на уроке.
Использованная литература:
1. Урок химии по теме «Оксиды» // Интернет-ресурс: https://videouroki.net/razrabotki/urok-khimii-po-tiemie-oksidy.html
2. Урок по теме «Оксиды» // https://nsportal.ru/shkola/khimiya/library/2012/01/21/urok-po-teme-oksidy
3. Урок химии в 8 классе «Оксиды» (ФГОС) // Интернет-ресурс: https://multiurok.ru/files/urok-khimii-v-8-klassie-oksidy-fgos.html
4. Конспект урока химии для 8 класса по теме «Оксиды» // Интернет-ресурс: https://www.alllessons.ru/chemistry/konspekt-uroka-himii-dlya-8-klassa-po-teme-oksidy.html
5. Урок химии по теме «Оксиды» 8 класс // Интернет-ресурс: https://kopilkaurokov.ru/himiya/uroki/urok-khimii-po-tiemie-oksidy-8-klass
6. План-конспект урока по теме «Оксиды. Классификация. Получение и свойства». 8-й класс // Интернет-ресурс: http://открытыйурок.рф/статьи/651563/
7. Конспект урока по химии в 8 классе «Оксиды» // http://инфо-дети.рф/publikatsii/414-konspekt-uroka-po-khimii-v-8-klasse-oksidy
8. Конспект урока химии для 8 класса по теме «Оксиды» УМК «Химия. 8 класс» // Интернет-ресурс: http://pandia.ru/text/80/009/19082.php
9. Конспект открытого урока по химии в 8-м классе «Оксиды. Состав. Классификация» // Интернет-ресурс: http://открытыйурок.рф/статьи/573574/
10. Урок химии 8 класс Тема «Оксиды» // Интернет-ресурс: https://nsportal.ru/shkola/khimiya/library/2018/01/22/urok-himii-8-klass-tema-oksidy
11. Личный опыт.
ИНСТРУКЦИОННАЯ КАРТА (9 кл).
Практическая работа №2 «Получение аммиака и исследование его свойств».
ЦЕЛЬ: Получить газообразное вещество-аммиак ,собрать его и изучить свойства».
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками , зажим для пробирок, пробка с газоотводной трубкой, вата, фарфоровая ступка с пестиком, ложечка для сжигания веществ, спиртовка, кристаллизатор с водой, индикаторная бумага, гидроксид кальция, хлорид аммония, раствор фенолфталеина.
ОПЫТ№1. Получение, собирание и распознавание аммиака.
ИНСТРУКЦИЯ ПО ПРАВИЛАМ БЕЗОПАСНОСТИ.
1.Нагревание ведите в верхней трети пламени спиртовки, сначала прогрейте всю пробирку(2-3 движения пламени), а затем в том месте,где находится смесь, не касаясь фитилём пробирки.
2.Будьте осторожны со смесью, не касайтесь её руками.
3. Определение запаха аммиака проводите осторожно, не наклоняйтесь над сосудом, не делайте глубоких вдохов, направляйте смесь воздуха и аммиака к себе плавными движениями руки.
Поместите в ступку по одной ложке для сжигания хлорида аммония и гидроксида кальция. Разотрите смесь пестиком. Что ощущаете ? Смесь высыпьте в сухую пробирку, закройте пробкой с газоотводной трубкой. Проверьте прибор на герметичность. Закрепите пробирку в зажиме , на другой конец газоотводной трубки наденьте сухую пробирку для собирания аммиака, направленную вверх дном. Почему вверх? Пробирку со смесью хлорида аммония и гидроксида кальция нагрейте.
Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную индикаторную бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газообразной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты. Немедленно закройте отверстие снятой пробирки большим пальцем, и опустите в сосуд с водой, и на секунду откройте пробирку под водой. Выньте пробирку , продолжая закрывать её большим пальцем, слегка встряхните воду в ней, затем опять опустите в кристаллизатор с водой и отпустите палец. Что наблюдаете? Почему вода поднялась в пробирке? Добавьте в полученный раствор 2-3 капли раствора фенолфталеина. Что наблюдаете?
Результаты работы оформите в виде таблицы:
|
№ |
Ход работы. Что делал. |
Что наблюдал. |
Вывод. Уравнение реакции. |
ИНСТРУКЦИОННАЯ КАРТА (11кл).
Практическая работа №2. «Получение, собирание и распознавание газов и изучение их свойств».
ВАРИАНТ 1.
« Получение, собирание и распознавание водорода».
ЦЕЛЬ: Получить и собрать водород, доказать его наличие.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками(2шт), спички, цинк (гранулы), раствор соляной кислоты.
В пробирку поместите 2 гранулы цинка и прилейте 1-2мл (20-40капель) соляной кислоты. Что наблюдаете? Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1-2 минуты поднимите большую пробирку вверх и, не переворачивая её, поднесите к пламени спиртовки. Что наблюдаете? Результаты работы оформите в виде таблицы:
|
№ |
ХОД РАБОТЫ. Что делали. |
ЧТО НАБЛЮДАЛИ |
ВЫВОД. Уравнения реакций. |
Дополнительное задание: Почему водород собирали в перевёрнутую пробирку?
ВАРИАНТ 2.
« Получение, собирание и распознавание кислорода».
ЦЕЛЬ: Получить и собрать газ кислород и доказать его наличие.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробиркой, зажим, кусочек ваты, пробка с газоотводной трубкой, стеклянный стакан, лучинка, спиртовка, спички, перманганат калия (KMnO4).
Насыпьте в пробирку примерно ¼ её объёма перманганата калия. Вставьте в отверстие пробирки рыхлый комок ваты и закройте пробирку пробкой с газоотводной трубкой. Проверьте прибор на герметичность! Пробирку закрепите в зажиме, конец газоотводной трубки опустите в стакан. Прогрейте пробирку пламенем спиртовки , а затем нагревайте пробирку в том месте где находиться перманганат калия. Каким способом вы собираете кислород? Как проверить наличие кислорода в стакане?
Результаты работы оформите в виде таблицы.
Дополнительное задание: Какие свойства кислорода, вы подтвердили, выполнив эту работу?
ВАРИАНТ 3.
« Получение, собирание и распознавание углекислого газа».
ЦЕЛЬ: Получить и распознать углекислый газ.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с двумя пробирками, стеклянная трубка, лучинка, спички, известковая вода(Ca(OH)2), кусочки мрамора(CaCO3), уксусная кислота(CH3COOH) .
В пробирку поместите 2-3 кусочка мрамора и прилейте раствор уксусной кислоты. Что наблюдаете? Через 1-2 минуты внесите в верхнюю часть пробирки горящую лучину. Что наблюдаете? В чистую пробирку налейте 1-2мл прозрачного раствора известковой воды. Через чистую трубочку, осторожно продувайте в раствор выдыхаемый вами воздух. Что наблюдаете? Результаты работы оформите в таблице. Уравнения реакций запишите в молекулярной и ионной формах.
ВАРИАНТ 4.
«Получение, собирание и распознавание аммиака».
ЦЕЛЬ: Получить и собрать газ аммиак, доказать его наличие.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробиркой, зажим, спиртовка, спички, индикаторная бумага, растворы — хлорид аммония (NH4Cl), гидроксид натрия (NaOH).
В пробирку прилейте 1-2мл раствора хлорида аммония, а затем такой же объём раствора гидроксида натрия. Закрепите пробирку в зажим, и осторожно нагрейте на пламени спиртовки. Как правильно нужно нагревать?
Что наблюдаете?
Поднесите влажную индикаторную бумагу к отверстию пробирки. Что наблюдаете? Осторожно, правильно понюхайте выделяющийся газ!
Оформите таблицу. Уравнения реакций запишите в молекулярном и ионном виде.
ИНСТРУКЦИОННАЯ КАРТА №2.
Практическая работа№2. «Скорость химических реакций».
ЦЕЛЬ: Повторить понятие о скорости химической реакции; исследовать факторы , влияющие на скорость химической реакции.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с 12 пробирками, зажим, спиртовка, спички, лучина, растворы соляной кислоты, уксусной кислоты, сульфата меди, перекиси водорода, CaCO3(кусочки и порошок мрамора), гранулы цинка, медные и железные опилки, диоксид марганца.
Что такое скорость химической реакции ?
Какие факторы влияют на скорость химической реакции?
ОПЫТ №1.Зависимость скорости химической реакции от площади соприкосновения реагирующих веществ.
В две пробирки налейте раствор соляной кислоты. Одновременно в одну пробирку поместите кусочек мрамора, а в другую мрамор растёртый в порошок. В какой из пробирок реакция пройдёт быстрее? Как это можно объяснить с точки зрения атомно-молекулярного учения?
ОПЫТ №2. Зависимость скорости химической реакции от природы реагирующих веществ.
В две пробирки поместите по грануле цинка, в первую прилейте раствор соляной кислоты , а во вторую- раствор уксусной кислоты.
В какой из пробирок выделение газа (какого?) протекает более бурно? Почему?
В две пробирки налейте равные количества соляной кислоты. В первую опустите железные опилки, а во вторую медные. В какой из пробирок протекает реакция? И почему?
ОПЫТ №3.Влияние концентрации реагирующих веществ на скорость химической реакции.
В две пробирки налейте растворы сульфата меди различной концентрации. Определив большую или меньшую концентрацию по насыщенности цвета раствора. В каждую из пробирок поместите гранулу цинка.
В какой из пробирок выделение меди на цинке началось быстрее?
ОПЫТ №4. Зависимость скорости химической реакции от температуры.
В две пробирки налейте раствор соляной кислоты и поместите в них по грануле цинка. Одну из пробирок осторожно нагрейте. В какой из пробирок реакция протекает более бурно?
ОПЫТ№5. Влияние некоторых веществ на скорость химической реакции.
В две пробирки налейте перекись водорода, в одну из пробирок осторожно присыпьте несколько кристаллов диоксида марганца.
В какой из пробирок наблюдается бурное выделение газа? Какой это газ? Тлеющую лучинку по очереди опустите в первую и вторую пробирки. Что наблюдаете?
Результаты работы оформите в виде таблицы.
Инструкционная карта №3.
Практическая работа №3. «Решение экспериментальных задач на распознавание важнейших катионов и анионов»
ЦЕЛЬ: Сформировать умения и навыки проведения и составления качественных реакций на различные катионы и анионы».
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, растворы – сульфат меди(II) CuSO4, нитрат алюминия Al(NO3)3, хлорид железа(III) FeCl3,
хлорид бария BaCl2, гидроксид натрия NaOH, серная кислота H2SO4, роданид калия KSCN, соляная кислота HCl, фенолфталеин, нитрат серебра AgNO3
твёрдые вещества – хлорид аммония NH4Cl, карбонат калия K2CO3, гидроксид натрия NaOH.
Актуализация знаний.
Что называют качественными реакциями?
При помощи каких реактивов можно определить-
Катионы: NH4+, K+, Ca2+, H+, Fe2+ Fe3+, Cu2+, Al3+
Анионы: SO42-, SO32-, Cl—, OH—, CO32-.
Ход работы.
ОПЫТ №1.
Даны растворы: CuSO4, Al(NO3)3, FeCl3, BaCl2, AgNO3
Проведите качественные реакции на катионы.
Оформите таблицу. Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
ОПЫТ №2.
Даны твёрдые вещества: NaOH, NH4Cl, K 2CO3.
Проведите реакции, подтверждающие их состав. Составьте молекулярные и ионные уравнения реакций.
|
Что делал |
Что наблюдал |
Вывод. Уравнения реакций. |
ИНСТРУКЦИОННАЯ КАРТА №3.
Практическая работа №3 «Решение экспериментальных задач на качественные реакции неорганических и органических соединений».
ЦЕЛЬ: Продолжить работу по отработке умения проводить и составлять качественные реакции на неорганические и органические соединения.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, спиртовка, зажим, спички, растворы (хлорид натрия, карбонат натрия, сульфат натрия, ацетат натрия, нитрат серебра, соляная кислота, хлорид бария, хлорид аммония, хлорид алюминия, хлорид меди(II), хлорид железа(III), сульфат меди, гидроксид натрия, глюкоза, глицерин, яичный белок.
ОПЫТ №1. Используя реактивы на вашем рабочем столе, проведите качественные реакции для следующих соединений:
NaCl, Na2CO3, Na2SO4, (CH3COO)Na.
Оформите работу в таблице. Запишите уравнения реакций и составьте полные и сокращённые ионные уравнения.
ОПЫТ №2. Осуществите качественные реакции для следующих растворов: NH4Cl, BaCl2, AlCl3, CuCl2, FeCl3
Оформите работу в таблице. Составьте молекулярные, полные и сокращённые ионные уравнения.
ОПЫТ №3. Проведите качественные реакции на растворы следующих органических веществ: глюкоза, глицерин, белок.
Оформите таблицу. Составьте уравнения реакций.
|
№ |
Что делал. Ход работы. |
Что наблюдал. |
Вывод. Уравнения реакций. |
ПРАКТИЧЕСКАЯ РАБОТА №4 « Решение экспериментальных задач по теме ГИДРОЛИЗ».
ЦЕЛЬ: Повторить гидролиз солей и экспериментальным путём подтвердить pH в растворах солей.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, индикаторная бумага, растворы солей (карбонат натрия, сульфат цинка, хлорид натрия).
Актуализация знаний. Что такое гидролиз? Типы гидролиза?
ОПЫТ №1. В три пробирки прилейте 1-2мл растворов: Na2CO3, ZnSO4, NaCl.
Испытайте действие растворов на универсальную индикаторную бумагу. Что наблюдаете? Объясните результаты наблюдений и запишите уравнения реакций гидролиза в молекулярном и ионном виде.
ОПЫТ №2. С помощью индикаторной бумаги определите, в какой из выданных вам пробирок, находятся растворы солей: CH3COONa, NH4NO3, K2SO4. Результаты занесите в таблицу.
ПРАКТИЧЕСКАЯ РАБОТА №4 «Решение экспериментальных задач на распознавание важнейших катионов и анионов»
ЦЕЛЬ: Продолжить работу по отработке умения проводить и составлять качественные реакции.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, растворы – соляной кислоты, гидроксида натрия, фенолфталеина, пробирки под номерами 1. 2. 3. 4. (AgNO3, K2CO3, ZnSO4, NaOH).
ОПЫТ №1. Решить экспериментальную задачу.
Даны пробирки с растворами под номерами 1. 2. 3. 4.
Растворы прозрачные, бесцветные, без запаха. Известно, что это растворы
AgNO3, K2CO3, ZnSO4, NaOН .
. ЗАДАЧА
Опытным путём определите, какое вещество находится в каждой из пробирок.
РЕШЕНИЕ. От каждой пробирки с растворами отлейте по несколько капель в чистые пробирки с соответствующими номерами.
В каждую из этих пробирок добавьте соляную кислоту. Что наблюдаете? Результаты занесите в таблицу.
Сделайте соответствующие выводы.
В оставшиеся пробирки прилейте гидроксид натрия(NaOH) , что наблюдаете? Результаты занесите в таблицу.
В оставшийся раствор капните фенолфталеин. Малиновое окрашивание будет доказывать щелочную среду.
|
K2CO3 |
AgNO3 |
ZnSO4 |
NaOH |
|
|
+ HCl |
? |
? |
||
|
+ NaOH |
? |
|||
|
+ фенолфталеин |
? |
Запишите вывод. Составьте молекулярные, полные и сокращённые ионные уравнения, проделанных вами реакций.
ВЫВОД: В пробирке №1-
№2-
№3-
№4-
ИНСТРУКЦИОННАЯ КАРТА №4.
Практическая работа №5 « Практическое осуществление переходов».
ЦЕЛЬ: повторить понятие «генетическая связь неорганических веществ» путём решения экспериментальных задач, состоящих из цепочек превращений.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, медная проволока, спиртовка, спички, зажим, ложечка для сжигания, колба, красный фосфор, растворы –H2SO4, NaOH, H2O, Na2SO4.
Актуализация знаний:
- Что называется генетической связью ?
- Запишите генетический ряд металла.
- Запишите генетический ряд неметалла.
Ход работы.
ОПЫТ №1. «Генетический ряд металла»
Проведите реакции, в которых осуществляются предложенные ниже химические превращения.
Cu CuO CuSO4 Cu(OH)2 CuO
Составьте уравнения соответствующих реакций. Р.И.О. запишите в полном и сокращённом ионном виде.
ОПЫТ №2. «Генетический ряд неметалла».
Проведите реакции, осуществляющие следующие превращения:
+NaOH
P P2O5 H3PO4 Na3PO4
+Na2CO3
Na3PO4
Составьте уравнения соответствующих реакций. Отчёт о работе оформите в таблице.
|
№ |
Ход работы. Что делал. |
Что наблюдал. |
Вывод. Уравнения реакций. |
План-конспект урока
План-конспект
составляется для личного пользования
учителя. Но завуч, учитель-методист
имеют право проверить этот план у
начинающего учителя, учителя-стажера,
практиканта.
При подготовке к
уроку учителю значительно поможет
методический материал, который может
быть самым разнообразным:
1) таблицы
к каждому уроку;
2) картотека
дидактических средств;
3) картотека
статей из журнала «Химия в школе»;
4) картотека
индивидуальных знаний;
5) картотека
самостоятельных письменных работ;
6) материалы
по использованию химических веществ и
процессов в жизни.
В соответствии с
содержанием темы определяется, какие
материалы, литературу использовать.
Здесь большую помощь могут оказать
составленные учителем картотеки.
Учителю перед
составлением плана-конспекта урока
необходимо еще раз просмотреть программу,
календарный план, методические
руководства, учебник и т.д. и:
1) уточнить круг
знаний, подлежащих усвоению учащимися;
2) выбрать метод
проведения урока;
3) решить вопрос о
последовательности изложения темы.
При прочих равных
условиях рекомендуют предпочитать тот
порядок изложения, который принят в
учебнике, так как это облегчает выполнение
учащимися домашнего задания. Но это не
значит, что учитель должен следовать
за учебником от параграфа к параграфу.
Он имеет право вносить изменения в
последовательность изложения, если
убежден в рациональности их, оживлять
материал дополнительными примерами и
т.д.
В плане-конспекте
каждого урока необходимо:
а) указать цели
урока;
б) по возможности
полно указать тот минимум знаний и
умений, которыми должны овладеть учащиеся
на данном уроке;
в) указать, что
необходимо повторить, какие знания и
умения проверить;
г) четко выделить
формулировки подтем урока, сделать
пометки, как и какой вопрос предполагается
решить, что рассказать, какие опыты
показать.
Все опыты должны
быть предварительно проверены и выводы
из них записаны в плане-конспекте;
д) в плане
заключительной части урока должны быть
записаны вопросы и задачи для проверки
и закрепления результатов урока;
е) должно быть
сформулировано домашнее задание.
Форма плана
произвольная, лучше писать на листах,
чтобы можно было добавлять, делать
пометки на обратной стороне или полях.
Обычно при типовом
построении урока план-конспект содержит
следующие разделы:
1. Дата.
Тема урока.
2. Задачи
(цели урока):
а) учебные задачи
– какие новые понятия ввести, закрепить,
какие навыки сформировать или закрепить;
б) воспитательные
задачи – формирование естественнонаучного
мировоззрения, привитие трудолюбия,
патриотическое воспитание т.д.;
в) развивающие
задачи – умение наблюдать и др.
3. Метод проведения
урока – лекция, беседа.
4. Оборудование.
5. Ход урока
(примерный):
а) организационный
момент – 1 минута;
б) вводная часть
– 10 минут;
в) основная часть
– 15 минут;
г) заключительная
часть – 12 минут;
д) домашнее задание
– 2 минуты.
Учитель может
пользоваться планом-конспектом во время
урока, но чтобы не быть в полной зависимости
от конспекта, необходимо знать основные
разделы плана, держать в голове основной
ход урока и выводы, которые должен
учитель сделать на уроке.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #



















-p-1080.jpg)
.jpg)


%D0%B0.jpg)
.jpg)
















































