Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
528
Создан на
07 января, 2022 От Admin
Тренировочный тест «Химические связи»
1 / 10
Из предложенного перечня выберите два вещества, в которых есть и ковалентные полярные, и ионные связи.
1) серная кислота
2) хлорид аммония
3) сульфид кальция
4) фосфат лития
5) озон
2 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) CaO
2) BaO2
3) C2H6
4) Na2O
5) Na
3 / 10
Из предложенного перечня веществ выберите два вещества, для каждого из которых характерно наличие водородной связи между молекулами.
1) формальдегид
2) глицерин
3) бензол
4) уксусная кислота
5) толуол
4 / 10
Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную неполярную химическую связь.
1) пероксид водорода
2) ацетон
3) кремний
4) фенолят натрия
5) медь
5 / 10
Из предложенного перечня выберите два вещества молекулярного строения с ковалентной полярной связью.
1) CH4
2) Na2SO4
3) Cl2
4) HCOOH
5) CaО
6 / 10
Из предложенного перечня выберите два свойства, которые характеризуют вещества с ионной кристаллической решёткой.
1) высокая электропроводность в кристаллическом состоянии
2) высокая температура плавления
3) пластичность,
4) высокая электропроводность в расплаве
5) летучесть
Запишите в поле ответа номера выбранных свойств.
7 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) оксид кремния
2) оксид бария
3) бромид бария
4) нитрат бария
5) белый фосфор
8 / 10
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решетку.
1) H2
2) NaH
3) SiO2
4) NO2
5) PbO2
9 / 10
Из предложенного перечня выберите два вещества с молекулярной кристаллической решёткой, которые имеют ковалентную неполярную химическую связь.
1) метан
2) карбид кальция
3) пероксид водорода
4) формальдегид
5) циклопентан
10 / 10
Из предложенного перечня веществ выберите два вещества, которые в твёрдом состоянии имеют молекулярную кристаллическую решётку.
1) фтороводород
2) хлорид натрия
3) уксусная кислота
4) гидроксид натрия
5) оксид кремния
Ваша оценка
The average score is 43%
План урока:
Ковалентная связь
Ионная связь
Металлическая связь
Водородная связь
Типы кристаллических решёток
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.

Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Источник
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s22p6.
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Н 1s1
Cl 3s2 3p5
Проанализировав значения, Э(Н) < Э(Cl), приходим к выводу, чтобы принять конфигурацию благородного газа, хлор будет притягивать на себя единственный электрон водорода.
Схема ковалентной связи, образованной разными элементами, записывается в таком виде.
Столь важно отметить, что в этой ситуации Cl и Н не будут равноправными партнёрами, поскольку общая плотность электронов сосредоточена у Cl. Водород в неравном бою, уступает 1 электрон хлору, у которого в наличии их целых 7. Водород приобретает положительный заряд, хлор – отрицательный. Валентности Н и Cl равны I.В то время степени окисления будут Н+Cl−.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) <ЭО (С) <ЭО(O). Определим степени окисления каждого элемента. Н+2С+4О−23. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2+С+4О3−2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
H 1s1
N 2s2 2p3
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N−3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н+. Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н+. Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО32−, если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Me0 — ne = Men+
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Источник
Водородная связь
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н+ одной молекулы и анионом N3-, O-2, F—. Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Источник
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
Источник
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Источник
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Источник
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Источник
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
Итак, из вышесказанного сделаем вывод.
Механизмы образования химической связи
Обменный
механизм. К
обменному механизму образования
химической связи относятся случаи,
когда в образовании электронной пары
от каждого атома участвует по одному
электрону.
В
молекулах Н2,
Li2,
F2
и Cl2
связи образуются за счет неспаренных
s- и
р-электронов
этих атомов. В молекулах HF и HCl связи
образуются
s-электронами
водорода и p-электронами галогенов.
Особенностью образования соединений
по обменному механизму является
насыщаемость, которая показывает, что
атом образует не любое, а ограниченное
количество связей. Их число, в частности,
зависит от количества неспаренных
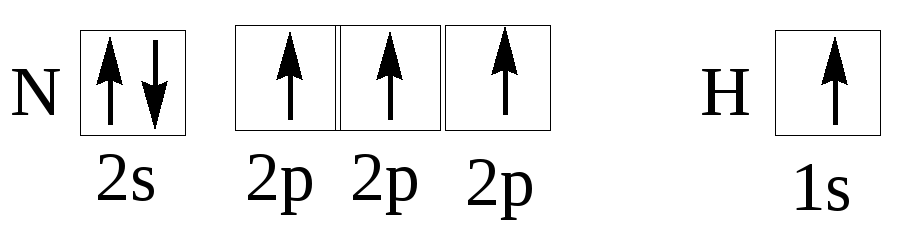
валентных электронов. Из квантовых
ячеек N
и Н
можно
видеть, что атом азота имеет 3 неспаренных
электрона, а атом водорода – один.
Принцип насыщаемости указывает на то,
что устойчивым соединением должен быть
NH3,
а не NH2,
NH или NH4.
Донорно-акцепторный
механизм –
образование ковалентной связи за счёт
двухэлектронного облака одного атома
(донор) и свободной орбитали
другого(акцептор). Примером образования
химической связи по донорно-акцепторному
механизму является реакция аммиака с
ионом водорода:
H+
+ ׃NH3
= NH4+
Роль
акцептора электронной пары играет
пустая орбиталь иона водорода. В ионе
аммония NH4+
атом азота четырехвалентен. В молекуле
аммиака заселены все четыре орбитали
азота, из них три – по обменному механизму
электронами азота и водорода, а одна
содержит электронную пару, оба электрона
которой принадлежат азоту. Такая
электронная пара называется неподеленной
электронной парой.
Донорно-акцeпторная
связь отличается только способом
образования; по свойствам она одинакова
с остальными ковалентными связями
Гибридизация атомных орбиталей и геометрия молекул
Важной
характеристикой молекулы, состоящей
более чем из двух атомов, является ее
геометрическая
конфигурация.
Она определяется взаимным расположением
атомных орбиталей, участвующих в
образовании химических связей.
Для
объяснения геометрической конфигурации
молекулы используется представление
о гибридизации АО центрального атома.
Возбужденный атом бериллия имеет
конфигурацию 2s12p1,
возбужденный атом бора – 2s12p2
и возбужденный атом углерода – 2s12p3.
Поэтому можно считать, что в образовании
химических связей могут участвовать
не одинаковые, а различные атомные
орбитали. Например, в таких соединениях
как BeCl2,
BCl3,CCl4
должны быть неравноценные по энергии
и направлению связи. Однако экспериментальные
данные показывают, что в молекулах,
содержащих центральные атомы с различными
валентными орбиталями
(s,
p, d), все связи равноценны. Для устранения
этого противоречия Полинг и Слейтер
предложили концепцию гибридизации
Основные
положения концепции гибридизации:
1.
Гибридные орбитали образуются из
различных атомных орбиталей, не сильно
отличающиеся по энергиям,
2.
Число гибридных орбиталей равно числу
атомных орбиталей, участвующих в
гибридизации.
3.
Гибридные орбитали одинаковы по форме
электронного облака и по энергии.
4
По сравнению с атомными орбиталями
они более вытянуты в направлении
образования химических связей и поэтому
обусловливают лучшее перекрывание
электронных облаков.
Следует
отметить, что как физический процесс
гибридизация орбиталей не существует.
Метод гибридизации представляет собой
удобную модель наглядного описания
молекул.
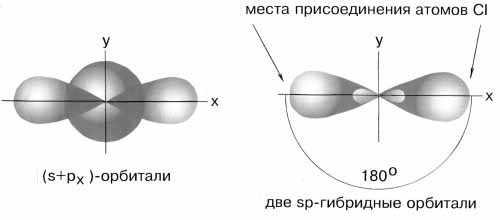
sp—
гибридизация
sp–Гибридизация
имеет место, например, при образовании
галогенидов Be, Zn, Co и Hg (II). В валентном
состоянии все галогениды металлов
содержат на соответствующем энергетическом
уровне s — и p-неспаренные электроны. При
образовании молекулы одна s- и одна
р-орбиталь образуют две гибридные
sp-орбитали под углом 180о(рис.5).
Рис.5
sp-гибридные
орбитали
Экспериментальные
данные показывают, что все галогениды
Be, Zn, Cd и Hg (II) линейны, и обе связи имеют
одинаковую длину.
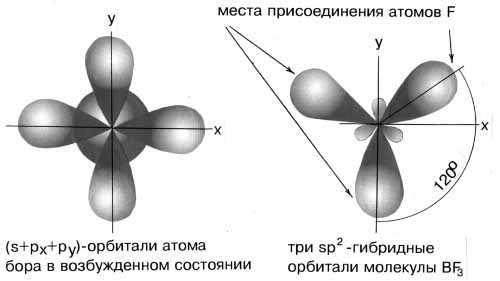
sp2-гибридизация
В
результате комбинации одной s-орбитали
и двух p-орбиталей образуются три
гибридные sp2-орбитали,
расположенные в одной плоскости под
углом 120о
друг к другу. Такова, например, конфигурация
молекулы BF3
(рис.6):
Рис.6
sp2-гибридные
орбитали
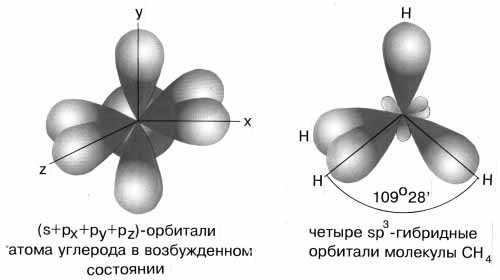
sp3-гибридизация
sp3-Гибридизация
характерна для соединений углерода. В
результате комбинации одной s-орбитали
и трех р-орбиталей образуются четыре
гибридные sp3-орбитали,
направленные к вершинам тетраэдра с
углом между орбиталями 109,5о.
Гибридизация проявляется в полной
равноценности связей атома углерода с
другими атомами в соединениях, например,
в CH4,
CCl4,
C(CH3)4
и др.(рис.7).
Рис.7
sp3-гибридные
орбитали
Метод
гибридизации объясняет геометрию
молекулы аммиака. В результате комбинации
одной 2s
и трёх 2p
орбиталей азота образуются четыре
гибридные орбитали sp
3 .
Конфигурация
молекулы представляет из себя искажённый
тетраэдр, в котором три гибридных
орбитали участвуют в образовании
химической связи, а четвёртая с парой
электронов – нет. Углы между связями
N-H
не равны 90
о как в
пирамиде, но и не равны 109,5
о
,соответствующие тетраэдру(рис.8):
Рис.8
sp3—
гибридизация в молекуле аммиака
При
взаимодействии аммиака с ионом водорода
H+
+ ׃NH3
= NH4+
в результате
донорно-акцепторного взаимодействия
образуется ион аммония, конфигурация
которого представляет собой тетраэдр.
Гибридизация
объясняет также отличие угла между
связями О–Н в угловой молекуле воды. В
результате комбинации одной 2s
и трёх 2p
орбиталей кислорода образуются четыре
гибридных орбитали sp3,
из которых только две участвуют в
образовании химической связи, что
приводит к искажению угла, соответсвующего
тетраэдру (рнс.9):
Рис 9 sp3—
гибридизация
в молекуле воды
В
гибридизацию могут включаться не только
s- и р-, но и d- и f-орбитали.
При
sp3d2-гибридизации
образуется 6 равноценных облаков. Она
наблюдается в таких соединениях как
[SiF6]4-,
[Fe(CN)6]4-(рис.10).
При этом молекула имеет конфигурацию
октаэдра:
Рис. 10
d2sp3-гибридизация
в ионе [Fe(CN)6]4-
Представления
о гибридизации дают возможность понять
такие особенности строения молекул,
которые не могут быть объяснены другим
способом. Гибридизация атомных орбиталей
(АО) приводит к смещению электронного
облака в направлении образования связи
с другими атомами. В результате области
перекрывания гибридных орбиталей
оказываются больше, чем для чистых
орбиталей и прочность связи увеличивается.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
12.02.201517.78 Mб845Polunina_N_V_Obschestvennoe_zdorovye.pdf
- #
- #
- #
12.02.20151.51 Mб20POSOBIE_DLQ_PODGOTOVKI_K_EKZAMENU.rtf
- #
12.02.20153.69 Mб1918Posobie_dlya_10kl_gl_var.doc
- #
- #
- #
- #
- #
- #