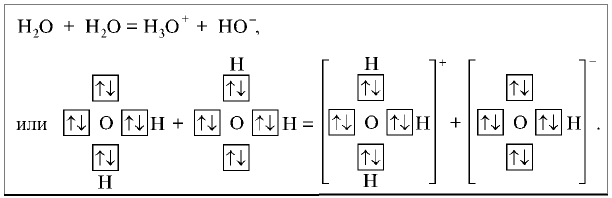
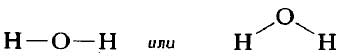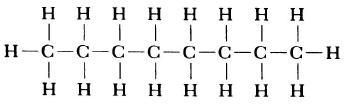В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
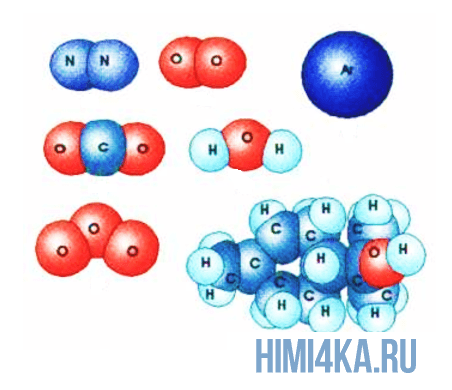
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
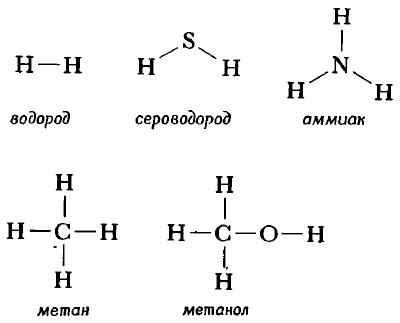
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
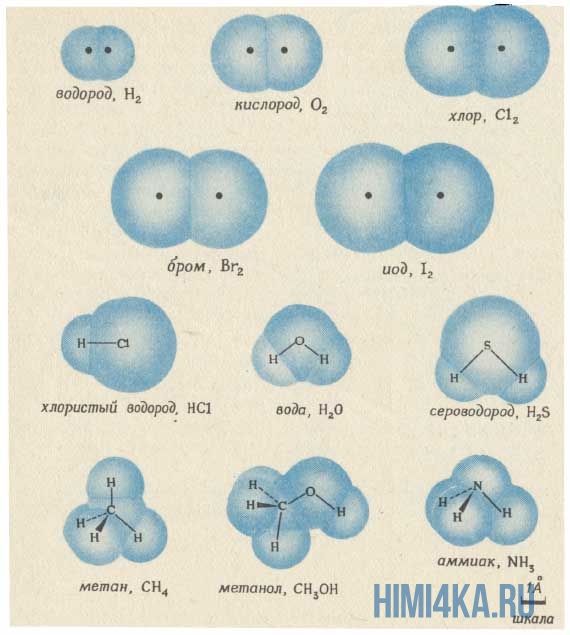
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
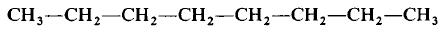
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
На чтение 18 мин Просмотров 6 Опубликовано 11 апреля 2023 Обновлено 11 апреля 2023
Содержание
- Урок 3. Схема образования молекул
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
- Атомы и электроны
- Метод молекулярных орбиталей
- Основные положени я метода молекулярных орбиталей (МО ЛКАО)
- Электронное строение гомоядерных двухатомных молекул и ионов
- Электронное строение гетероядерных молекул и ионов
- Задачи для самостоятельного решения
Урок 3. Схема образования молекул
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла , потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность , и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
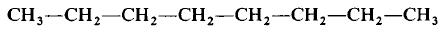
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Атомы и электроны
Атомно-молекулярное учение
Мы приступаем к изучению химии — мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а — отриц. частица + tomos — отдел, греч. atomos — неделимый) — электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos — первый) — положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter — ни тот, ни другой) — нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron — янтарь) — стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома — порядковый номер в таблице Менделеева — равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
Состоит из s-подуровня: одной «1s» ячейки, в которой помещаются 2 электрона (заполненный электронами — 1s 2 )
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь — клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода — 6, у серы — 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод — 1s 2 2s 2 2p 2
- Серы — 1s 2 2s 2 2p 6 3s 2 3p 4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне — это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод — 2s 2 2p 2 (4 валентных электрона)
- Сера -3s 2 3p 4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью — способностью атомов образовывать определенное число химических связей.
- Углерод — 2s 2 2p 2 (2 неспаренных валентных электрона)
- Сера -3s 2 3p 4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний — 1s 2 2s 2 2p 6 3s 2
- Скандий — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Источник
Метод молекулярных орбиталей
Материалы с портала onx.distant.ru
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положени я метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются s s. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
Процесс образования частицы H2 + можно представить следующим образом:
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2 + равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2 — имеет электронную конфигурацию:
H2 — [(σ 1s) 2 (σ *1s) 1 ]
Кратность связи в H2 — составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s) 2 ]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s 2 ) Ве2 [KK*(σ 2s) 2 (σ *2s) 2 ]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s) 2 (π *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 ]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2 + и O2 — . В ионе O2 + на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
Кратность связи в ионе О2 + равна (8–3):2 = 2,5. В ионе O2 — на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
Кратность связи в ионе О2 — равна (8 – 5):2 = 1,5. Ионы О2 — и О2 + являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2 — , О2, О2 + кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO + , CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2px) 1 ] или
NO [KK*(σ 2s) 2 (σ *2s) 2 (π2px) 2 (π2py) 2 (σ 2pz) 2 (π*2py) 1 ]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO — :
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO + имеет следующее электронное строение:
NO + [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO + равна трём.
В ряду NO — , NO, NO + избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF + ; NF — ; NF.
Энергия химической связи уменьшается в ряду:
NF + ; NF; NF — .
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO — ; CO; CO + .
Энергия химической связи увеличивается в ряду:
CO + ; CO; CO — .
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2 + ; Be2; Be2 + .
Молекулы He2 и Be2 не существуют, так как по методу МО они имеют нулевую кратность связи.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
B2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 1 (π2py) 1 ].
Кратность связи в B2 составляет (4–2):2=1.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в N2 составляет (8–2):2=3.
6. Используя метод МО, определите кратность связи в молекуле С2.
Электроны располагаются на молекулярных орбиталях следующим образом:
С2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 ].
Кратность связи в С2 составляет (6–2):2=2.
7. На основе метода МО объясните, почему не существует молекулы Ne2.
Электроны располагаются на молекулярных орбиталях следующим образом:
Ne2 [KK*(σ 2s) 2 (σ *2s) 2 (σ 2pz) 2 (π2px) 2 (π2py) 2 (π*2px) 2 (π*2py) 2 (σ* 2pz) 2 ].
Кратность связи в Ne2 составляет (8–8):2=0.
Нулевая кратность связи объясняет тот факт, что данная молекула не существует.
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 — .
Электроны располагаются на молекулярных орбиталях следующим образом:
N2 [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ];
N2 — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 (π*2px) 1 ].
Кратность связи в N2 составляет (8–2):2=3;
Кратность связи в N2 — составляет (8–3):2=2,5.
Уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2 —
связано с уменьшением кратности связи.
9. Распределите электроны на молекулярных орбиталях для иона CN — . Определите кратность связи в этом ионе.
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2px) 2 (π2py) 2 (σ2pz) 2 ].
Кратность связи в CN — составляет (8–2):2=3.
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN + , CN, CN — .
Электроны располагаются на молекулярных орбиталях следующим образом:
CN + [KK*(σ2s) 2 (σ*2s 2 (π2p x ) 2 (π2p y ) 2 ];
CN [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 1 ];
CN — [KK*(σ2s) 2 (σ*2s) 2 (π2p x ) 2 (π2p y ) 2 (σ2p z ) 2 ].
Избыток связывающих электронов в CN + , CN, CN — соответственно составляет 4, 5, 6.
Увеличение избытка связывающих электронов приводит к увеличению энергии связи
(прочности связи). При переходе от CN + к CN — длина связи уменьшается,
что обусловлено усилением прочности связи.
Источник
Молекула
Ранее в статье «Атом» [1]
речь шла о необходимости изучения химии в
периодически повторяющейся последовательности
по вертикали: атом ® молекула ® макросистема (твердое, жидкое и
газообразное состояния вещества) и по
горизонтали: система (модели) ® взаимодействия ® свойства ® законы. На
примере атома было показано, как это делать. В
данной статье речь пойдет о молекуле. Попытаемся
проиллюстрировать на молекулярном уровне
организации вещества принципы системного
подхода для описания моделей молекул,
взаимодействий, характерных для молекул, свойств
и законов, которым подчиняются движения и
взаимодействия молекул в той
последовательности, которая предлагалась для
атома.
Модели. Модель – это
объект-заменитель объекта-оригинала,
отображающий некоторые свойства оригинала.
Добавим, что модель имеет несомненные
преимущества перед оригиналом своей
доступностью, обозримостью, легкостью в
обращении. Молекула – это динамическая система,
состоящая из двух или большего числа ядер, в поле
которых движутся электроны. Ученикам 8-го класса
можно предложить такое определение (модель): молекула
– это система, состоящая из двух или большего
числа ядер и электронов, движущихся вокруг ядер.
Молекула – динамическая
система. Для подтверждения этого достаточно
обратиться к строению атома и вспомнить теорему
Ирншоу [см. 1]. Молекула потому и устойчива, что
притягивающиеся и отталкивающиеся заряженные
части молекулы находятся в непрерывном и
бесконечном движении.
В научной и учебной
литературе часто встречается такая фраза:
«молекула состоит из атомов». Ее не следует
понимать буквально. Однако школьнику,
начинающему изучать химию в восьмом классе,
следует подсказать, что атомы, соединяясь друг с
другом, теряют свою индивидуальность в молекуле.
И слово «состоит» здесь содержит глубокий смысл.
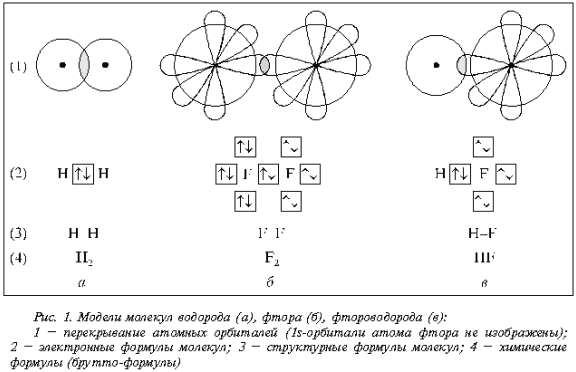
На рис. 1 представлены модели
молекул водорода, фтора и фтороводорода.
Сопоставление моделей чрезвычайно полезно
учащимся в преддверии обсуждения химических
превращений и составления уравнений химических
реакций. Скажем, химические формулы Н2, F2,
НF и LiF ничего не говорят о различиях в их
структуре. Это – эмпирические формулы
(брутто-формулы). Они предназначены для того,
чтобы указать, какие атомы и в каком соотношении
входят в состав химического соединения. И если Н2,
F2 и НF – молекулы с неполярной и полярной
ковалентными связями, то LiF (рис. 2) представляет
собой ионную пару в кристалле и расплаве и
ковалентную молекулу в газе.
Множественность описания
cостояний молекул, например молекул Н2, F2
и НF, различными моделями – непременное 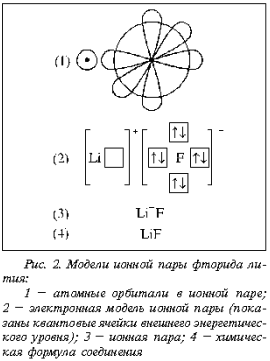
зависимости от целей, которые ставятся при
описании состояний молекул, используются
различные модели. Например, перекрывание
электронных орбиталей (см. рис. 1, модели 1)
позволяет показать, что ядра атомов удерживаются
на некотором расстоянии друг от друга, благодаря
«концентрированию» отрицательно заряженного
электронного облака между ядрами. Именно это
обстоятельство обеспечивает устойчивость
молекул. Модели 1 (см. рис. 1) довольно громоздкие.
Этого неудобства можно избежать, используя
модели 2 (см. рис. 1). Они наглядно демонстрируют
участие пары электронов в образовании
химической связи. Модели 3 (см. рис. 1) удобны тем,
что в них ковалентная связь между конкретными
атомами изображается обычной чертой. Наконец,
модели 4 (см. рис. 1) – общепринятые и чаще всего
используемые химические формулы соединений.
Модели, отражающие состояние ионной пары LiF (см.
рис. 2), выполняют ту же функцию.
Различие между ионной и
ковалентной связями ученики легко понимают. В
ионной паре нет перекрывания электронных
орбиталей (на самом деле, как показывает метод
молекулярных орбиталей, любая ионная связь
содержит определенный вклад ковалентной связи).
Ионы удерживаются относительно друг друга за
счет электростатического притяжения. В молекуле
химическая связь обусловлена перекрыванием
атомных орбиталей и соответственно образованием
общей электронной пары. Позже, когда будет
рассматриваться макроуровень организации
вещества, легко показать, что в ионных кристаллах
не существует «насыщаемости» ионных связей.
Простейшие модели молекул
позволяют решить важную в педагогическом
отношении задачу – сформировать у учеников
представление о молекулах как целостных
системах.
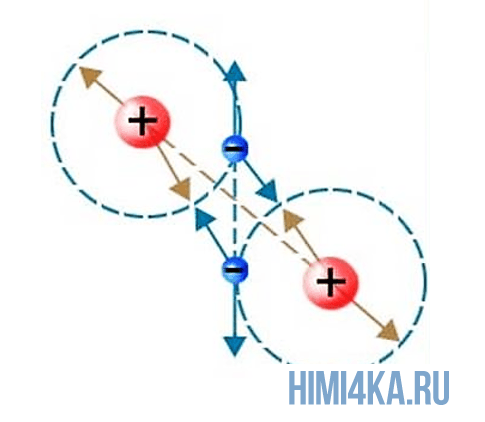
Взаимодействие. Взаимодействие
– воздействие тел или частиц друг на друга.
Взаимодействия в молекуле сводятся к притяжению
ядро-электрон и отталкиванию ядро-ядро и
электрон-электрон.
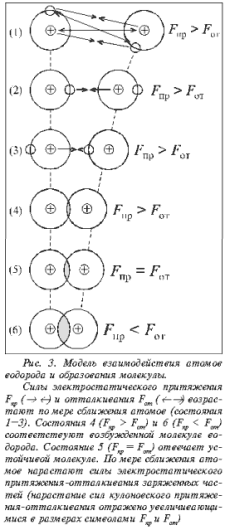
притяжение-отталкивание двух сближающихся
атомов водорода (рис. 3). В состоянии 1
взаимодействия между атомами обозначены
стрелками, направленными навстречу друг к другу (® ¬) –
притяжение, а также друг от друга (¬ ®) – отталкивание.
Взаимодействие между ядром и электроном внутри
индивидуального атома не обозначено и не
учитывается. Знак заряда на орбитали указывает
не положение электрона, а смещение плотности
электронного облака к тому или иному «краю»
орбитали. Например, состояние 2 (см. рис. 3)
показывает, что наибольшая электронная
плотность справа от ядра в обоих атомах; через
мгновение (см. рис. 3, состояние 3) – слева от ядра в
том и другом атомах.
Согласованное изменение
электронной плотности приводит к тому, что на
расстояниях, соответствующих существованию
индивидуальных атомов, силы электростатического
притяжения (Fпр) больше сил
электростатического отталкивания (Fот).
По мере сближения атомов
происходит перекрывание электронных орбиталей.
Ядра атомов еще больше сближаются в силу того
обстоятельства, что между ядрами возникает
постоянное отрицательно заряженное электронное
облако высокой плотности (см. рис. 3, состояние 4).
Точнее, электронное облако охватывает теперь оба
ядра, но наибольшая плотность электронного
облака сосредоточена между ядрами. Сближение
ядер будет происходить до тех пор, пока силы
электростатического притяжения не
уравновесятся силами электростатического
отталкивания (см. рис. 3, состояние 5).
Из двух систем – атомов –
образовалась одна система – молекула. В молекуле
силы электростатического притяжения и
отталкивания становятся равными в условиях,
когда перекрывание орбиталей приведет к
сближению ядер на расстояние, соответствующее
длине химической связи. При растяжении (см. рис. 3,
состояние 4) или сжатии (см. рис. 3, состояние 6)
химической связи возникает неравенство сил
притяжения и отталкивания, и молекула становится
неустойчивой. Индивидуальность атомов в
молекуле исчезла.
Новое образование находится в
устойчивом состоянии и изменить его может лишь
внешнее воздействие, например соударение с
какой-либо микрочастицей.
Сжатие и растяжение
химической связи (изменение расстояния между
ядрами) произойдет только при внешнем
воздействии, благодаря которому будут
преодолены силы отталкивания или притяжения,
позволяющие переместить заряды на некоторое
расстояние (большее или меньшее средней длины
химической связи). При этом совершается работа,
связанная с увеличением 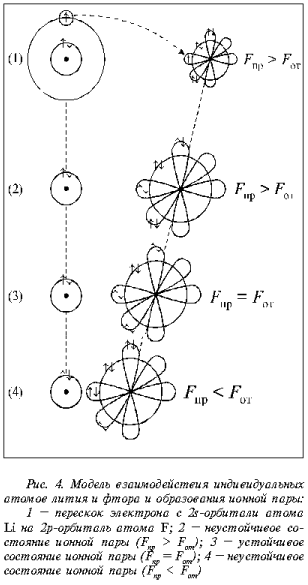
уменьшением перекрывания атомных орбиталей.
Молекула переходит в возбужденное состояние.
Двухатомная возбужденная молекула напоминает
колеблющиеся на пружинке (химическая связь)
шарики (ядра атомов). Шарики то сближаются, то
удаляются и будут находиться в таком состоянии
до тех пор, пока не представится случай
обменяться энергией с окружающей средой.
Рассмотрим взаимодействие
между двумя атомами при образовании ионной пары
LiF как фрагмента кристаллической решетки (рис. 4).
В ходе сближения атомов лития и фтора атом лития
не способен удержать единственный электрон,
расположенный на 2s-орбитали. Предложите
ученикам сравнить размеры атомов лития и фтора и
напомните им, что заряд ядра атома лития +3, а
фтора +9. Ответ на вопрос, почему атом лития отдает
электрон при сближении с атомом фтора, должен
быть таким: потому, что силы электростатического
притяжения электронов ядром атома фтора больше,
чем у лития. К тому же у фтора есть свободное
место для размещения электрона на 2p-орбитали.
Электрон с 2s-орбитали лития переходит на 2p-орбиталь
атома фтора.
При переходе электрона
изменяются размеры образовавшихся ионов: ион
лития примерно в два раза меньше атома лития (он
потерял электрон с 2s-орбитали); ион фтора
увеличился в размерах примерно в два раза по
сравнению с атомом фтора, т. к. приобрел
дополнительно один электрон (из-за возросшего
электростатического отталкивания p-электронов
орбитали «раздвинулись», увеличились в
размерах). Электростатическое притяжение ионов
(см. рис. 4, состояние 2), когда Fпр > Fот,
сближает их на расстояние, где силы притяжения
становятся равными силам отталкивания Fпр
= Fот (см. рис. 4, состояние 3). Если ионы
продолжают сближение (см. рис. 4, состояние 4), то
возрастают силы электростатического притяжения
и отталкивания так, что последние становятся
больше сил притяжения Fпр < Fот
. В этом случае ионы стремятся перейти в
устойчивое состояние (см. рис. 4, состояние 3).
Электростатическое
взаимодействие позволяет понять механизм
химических превращений. В молекулах происходит
разрыв или образование химических связей.
Химические связи рвутся или образуются
по-разному. Характер разрыва и образования
связей зависит от взаимодействующих молекул или
атомов и природы химической связи.
Ковалентная неполярная
химическая связь – это вид взаимодействия,
обусловленный совместным использованием пары
электронов обоими атомами в равной степени.
Такая связь существует в молекулах водорода и
фтора (см. рис. 1, а, б).
Ковалентная полярная
химическая связь – это вид взаимодействия,
обусловленный совместным использованием пары
электронов обоими атомами в равной степени.
В молекуле фтороводорода электронная пара
смещена к атому фтора (см. рис. 1, в).
Объединение двух
противоположно заряженных ионов представляет
собой ионную пару. Химическая связь,
обусловленная электростатическим притяжением
противоположно заряженных ионов, называется
ионной связью. Такая связь представлена в
ионной паре LiF (см. рис. 2).
Знание структуры атомных
орбиталей, приведенное в разделе, посвященном
атомному уровню организации вещества [см. 1],
позволяет ученикам самостоятельно строить
графические модели простейших двух- и
трехатомных молекул.
Следует обратить их внимание
на следующие условия образования химической
связи:
1) в образовании химической
связи участвуют электроны, расположенные на
орбиталях внешнего (высшего) энергетического
уровня;
2) химическая связь образуется при участии пары
электронов с противоположными спинами;
3) при наличии вакантных орбиталей возможно
увеличение числа неспаренных электронов в атоме,
способных принимать участие в образовании
химических связей (атомы углерода, серы и др.).
Школьники подготовлены к
тому, чтобы понять причины образования атомом
определенного числа ковалентных химических
связей. Например, известна химическая
брутто-формула молекулы Н2S, содержащей две
ковалентные связи. Предлагается построить
графическую модель молекулы, опираясь на уже
известную схему построения моделей,
представленную на рис. 3, и учитывая указанные
выше условия.
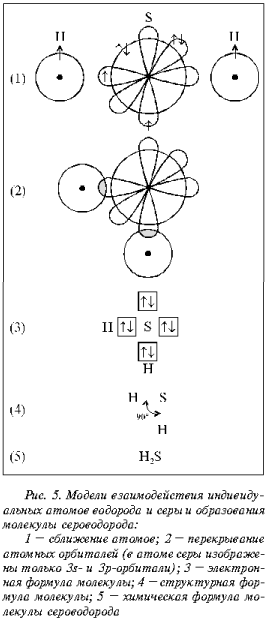
последовательность операций, представленных на
рис. 5, которая дает правильное решение в рамках
известной им процедуры. Какие выводы вытекают
при анализе полученной графической модели
молекулы Н2S? Во-первых, при построении
модели используются неспаренные электроны
атомов водорода и серы для образования
химической связи. Во-вторых, по числу неспаренных
электронов можно заключить, что атом серы
способен участвовать в образовании двух
химических связей. В-третьих, химические связи
расположены под углом 90°.
На вопрос, какой электронной и
структурной формулами можно представить
молекулу Н2О, ученики смогут ответить:
молекула Н2О имеет структуру, аналогичную
структуре Н2S. Ответ не противоречит тем
приемам построения моделей, которые они освоили.
Полезно сообщить школьникам,
что модели совершенствуются в соответствии с
экспериментальными данными. А эксперимент
показывает, что угол между химическими связями в
молекуле Н2О составляет 104,5° и причины
этого будут рассмотрены в 9-м классе (понятие о
гибридизации).
Понимание всегда
обеспечивает запоминание, запоминание не всегда
означает понимание. Поэтому неплохо было бы
убедиться в силе «синтетического мышления»
учеников. Предложите им построить электронные и
структурные формулы по брутто-формулам таких
изолированных молекул, как О2, N2, NН3,
HNO3, CО, СО2, СН4, НСl, SО2, SО3,
Н2SO3, Н2SO4. (На самом деле
предлагается построить электронные и
графические формулы молекул по брутто-формулам.
То, что выше называется структурной формулой, на
самом деле представляет собой не структурную, а
графическую формулу, т. к. в формуле не
указывается взаимное расположение химических
связей в трехмерной системе координат.)
Напомните, что в моделях атомов следует
использовать только квантовые ячейки внешнего
энергетического уровня с его подуровнями, что
связи в молекуле, представленной в виде
электронной формулы, следует изображать с
помощью электронных пар (Ї) или точек (··) и только потом в виде структурных
формул.
Школьники будут создавать
свои «молекулярные шедевры» до тех пор, пока не
поймут, что необходимо выполнять все условия
построения электронной или структурной модели
молекулы. При этом учителю придется подсказать
некоторые особенности построения моделей
молекул азота и азотной кислоты. Ученики при
поддержке учителя смогут построить модели
молекул исключительно с ковалентными связями,
основываясь на методе валентных связей,
утверждающем, что ковалентная связь образуется
обязательно при участии пары электронов с
противоположными спинами. Они еще не знают, что
химические связи в молекулах неравноценны, хотя
все связи обозначены одинаково, т. е. черточками.
Они еще не знают, что окружающая среда (множество
других молекул в газе, жидкости или твердом теле)
изменяет состояние молекул, что некоторые
химические соединения чрезвычайно неустойчивы.
Для молекул кислорода и
оксида углерода (II) модели, построенные по методу
валентных связей, не объясняют ряд чрезвычайно
важных свойств этих молекул (явление
парамагнетизма, тот факт, что связь в СО по
прочности соответствует тройной связи). Такова
судьба моделей. Модель может отразить только
некоторые свойства объекта-оригинала. Поэтому
приходится для рассмотрения многих свойств
прибегать к множеству моделей (системный
принцип множественности описания объекта
различными моделями). Это еще предстоит узнать и
понять.
Но школьники уже будут
способны объяснить, почему атом водорода всегда
образует одну, а атом кислорода – две химические
связи, почему атом углерода способен
образовывать две и четыре химические связи, а
атом серы – две, четыре и шесть химических
связей. Им станет понятно, почему атом серы в
сероводороде (Н2S) соединен с двумя атомами
водорода, в сернистой кислоте (Н2SO3) –
с тремя атомами кислорода, а в серной кислоте (Н2SO4)
– c четырьмя атомами кислорода. Они обнаружат,
что атом в молекуле проявляет свойство, которое
отсутствует у индивидуального атома, –
валентность.
Валентность – свойство
атомных частиц образовывать химические связи
при взаимодействии между собой.
Количественной мерой этого свойства является
число химических связей, которыми данный атом
соединен с другими. Валентность – не постоянная
величина и зависит не только от природы
атомов-партнеров, но и от условий образования
химического соединения. Валентность атома
определяется числом его неспаренных электронов,
неподеленных электронных пар и вакантных
орбиталей в основном или низших возбужденных
состояниях, участвующих в образовании
химических связей [2].
Свойства. Свойство – это
отношение или результат взаимодействия
интересующего нас объекта и окружающей среды. Чем
больше различных отношений, тем больше
обнаруживается свойств, присущих интересующему
нас объекту. Для молекулы из множества свойств
выделим только некоторые. При взаимодействии с
окружающей средой молекула проявляет свойства
изменять состав, структуру и энергетическое
состояние. С молекулой так же, как и атомом,
ничего не происходит до тех пор, пока на нее не
будет оказано воздействие извне. В роли
окружающей среды выступает или вещество (другие
атомы, молекулы или элементарные частицы,
например электрон) [3], или поле (например кванты
электромагнитного излучения – фотоны).
Рассмотрение свойств молекул открывает дорогу к
пониманию химических превращений вещества любой
степени сложности, включая живые системы.
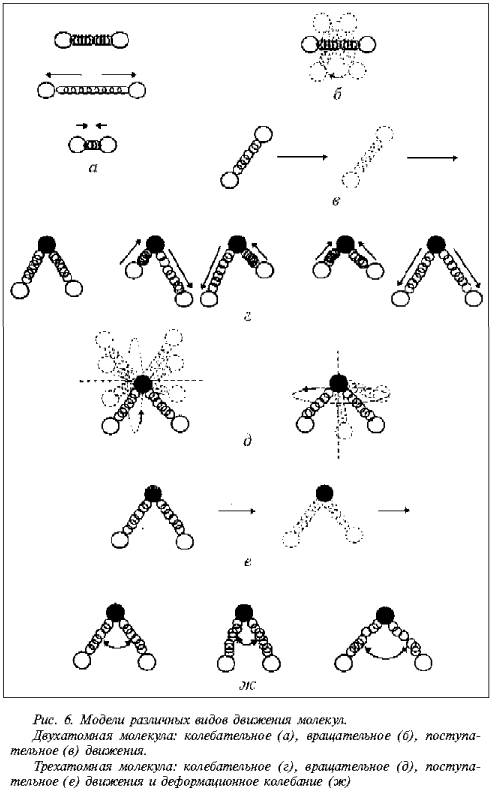
Свойство молекулы
обмениваться энергией с окружающей средой без
изменения структуры и состава рассмотрим на
моделях различных видов движения двух- и
трехатомных молекул (рис. 6).
За счет соударения, за счет
обмена энергией с другими микрочастицами
молекула способна изменять интенсивность
различных видов движений, в том числе
колебательного и деформационного (изменения
величины валентного угла).
Свойства молекулы изменять
состав и структуру проявляются в химической
реакции. Реакция рекомбинации атомов водорода
или реакция термической диссоциации молекулы
водорода (см. рис. 3) возможны только при обмене
энергией участников реакции с частицами
окружающей среды, но для модельного
представления химической реакции это
обстоятельство может во внимание не приниматься.
Химическая реакция сводится к
электростатическому притяжению-отталкиванию
заряженных частей, составляющих атомы и
молекулы.
Перекрывание электронных
орбиталей приводит в действие эффект, который
восьмиклассникам объясняется как согласованное
движение пары электронов, участвующей в
образовании химической связи. Согласованное
движение состоит в том, что электроны не мешают
друг другу при совместном перемещении в поле
двух ядер. (Так происходит механическое движение
двух сцепленных зубьями шестеренок. Они не
мешают друг другу только в том случае, если одна
из них вращается по часовой, а другая – против
часовой стрелки.) Пара электронов, участвующая в
образовании химической связи, перемещается не
только в поле ядер, но и относительно друг друга
без помех. Такое движение электронов уже
обсуждалось при изучении атомного уровня
организации вещества [см. 1].
Итак, химическая реакция –
это процесс образования и разрыва химических
связей, в результате которого изменяется состав
и структура микросистем (атомов и молекул),
участвующих в процессе.
Химическую связь, которая
подвергается разрыву, можно назвать
«реакционным центром». Например, такую роль
выполняет химическая связь (пара электронов) при
распаде молекулы водорода на атомы. При
рекомбинации (реакция 1) роль реакционных центров
в индивидуальных атомах выполняют неспаренные
электроны (1s-орбиталь). Взаимодействия между
микросистемами, представленными на рис. 3,
запишем в виде химического уравнения:
Первичным актом рекомбинации
является образование общей электронной пары.
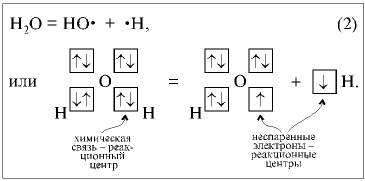
Первичным актом термической
диссоциации молекулы воды в газовой фазе
является разрыв ковалентной связи О–Н,
распаривание электронов по реакции:
Что объединяет обе реакции?
Участники реакции остаются электронейтральными
в результате объединения электронов в общую
электронную пару [реакция (1)] или распаривания
электронов [реакция (2)]. Такие реакции называются гомолитическими
реакциями.
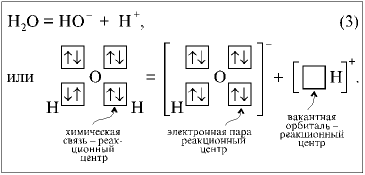
Диссоциация молекулы Н2О
в жидкой фазе связана с разрывом ковалентной
связи и образованием ионов:
Роль реакционного центра в
прямой реакции выполняет химическая связь. В
обратной реакции такая роль принадлежит
электронной паре в ионе НО– и вакантной
орбитали в ионе Н+.
Заметим, что положительно
заряженный ион Н+ есть не что иное, как
элементарная частица (протон – ядро атома
водорода). Элементарная частица не способна
существовать самостоятельно в окружении других
молекул. Более того, приведенная выше реакция
диссоциации на ионы энергетически не выгодна и
не реализуется в том виде, в котором она
представлена. Это – модель химического
превращения, отражающая лишь способность
молекулы разрывать химическую связь без
распаривания электронов. Фактически реакция
диссоциации Н2О идет в результате
бимолекулярного взаимодействия:
Реакция, в которой разрыв
химической связи в молекуле происходит с
сохранением электронной пары у одного из атомов,
называется гетеролитической. При этом, как мы
видим на примере реакции (3), образуются
заряженные микросистемы-ионы.
Почему гетеролитический
разрыв может привести к появлению ионов? Чтобы
ученики убедились в неизбежности появления
зарядов в одних случаях и отсутствия таковых в
других, придется хотя бы раз посчитать
количество положительных и отрицательных
зарядов в каждой из микросистем – участниц
процесса.
Изменяется ли состав молекул
в результате химической реакций? Изменяется ли
структура молекул в результате химической
реакции? На оба вопроса ученики дадут
положительный ответ. Образно говоря, химическая
реакция – это всегда «молекулярная катастрофа».
Законы. Взаимодействия в
молекуле подчиняются квантовым правилам.
Ограничимся одним из них – принципом запрета
Паули. Для восьмиклассника он может быть
сформулирован так: на одной орбитали может
находиться не более двух электронов с
противоположными спинами.
Применительно к молекуле
принцип запрета Паули ограничивает число
электронов, которые располагаются на двух
перекрывающихся орбиталях. Таких электронов не
может быть больше двух. Например, квантовая
ячейка атома водорода содержит один электрон.
Если два атома водорода объединяются в молекулу,
они объединяют свои квантовые ячейки в одну.
Сколько электронов может быть в объединенной
квантовой ячейке в соответствии с принципом
запрета Паули? Два и не больше. А не может ли
химическая связь образоваться при участии
одного электрона? С позиции метода валентных
связей такой случай невозможен (с позиций метода
молекулярных орбиталей возможен, т. к. в методе
молекулярных орбиталей отсутствует понятие
«химическая связь»).
Какая цель реализуется при
изучении молекулярного уровня организации
вещества в последовательности: модель –
взаимодействия – свойства – законы? Главная
цель состоит в том, чтобы исключить механическое
запоминание, к которому неизбежно вынуждает
учащихся традиционный способ изложения
материала в школьных учебниках, изданных в
последние годы [4, 5].
Вот примеры, показывающие, как
нежелательно начинать изучение химии в 8-м
классе. На с. 23 учебника [4] предлагаются
упражнения по выводу формулы сложного вещества.
«Пример 2. Вывести формулу соединения серы с
кислородом, если массовые доли серы и кислорода
соответственно составляют 50%». С помощью
значений молярных масс устанавливается: «Числа
атомов серы и кислорода в оксиде серы относятся
как 1:2. Ответ: формула соединения – SO2».
Понимают ли учащиеся, судя только по
эмпирической формуле, почему атомы проявляют
свойство соединяться в таком соотношении? Понять
нельзя, можно запомнить, что на один атом серы
приходится два атома кислорода.
Там же на с. 24 в задании 9
предлагается вывести формулу соединения серы с
кислородом, если в соединении содержится 40% S и 60%
O. Предполагается, что ученики установят
соотношение атомов серы и кислорода, равное 1:3, и
напишут эмпирическую формулу SO3. Понимают
ли школьники теперь, почему атомы проявляют
свойство соединяться в таком соотношении? Понять
нельзя, можно запомнить, что на один атом серы
иногда приходится не только два, но и три атома
кислорода.
Использование эмпирических
формул не оправдывается введением понятия
«степень окисления» [см. 4, с. 24]. Возникает вопрос:
почему присвоили такие положительные или
отрицательные числа элементам в соединении? Эти
вопросы остаются без ответа. Все задания и
лабораторные опыты проводятся почти так же, как и
во времена Ж.Л.Пруста и Дж.Дальтона.
Открываем учебник химии [5]. На
с. 28 приводится реакция: СН4 + 2О2 = СО2
+ 2H2O, и ее модель в виде прижатых друг к
другу шариков, изображающих атомы в
молекулах-участниках реакции. Подпись под
рисунком в виде вопроса гласит: «вы видели, как
горит метан?» Видели, но ничего не поняли. Такие
шарики мог позволить себе рисовать Демокрит на
основании умозрительных заключений о том, что
мир дискретен. Но он только предполагал, а мы
кое-что знаем о том, как устроен мир атомов и
молекул.
Нельзя начинать процесс
обучения химии с эмпирических формул и
химических уравнений. Перед эмпирическими
формулами и уравнениями должен быть рассмотрен
материал огромной важности для понимания
химических состояний и превращений – атомный и
молекулярный уровни организации вещества.
Мы же не пытаемся в
органической химии писать соединения в виде
эмпирических формул. Такие формулы не позволяют
обнаружить в молекулах функциональные группы
или, по-другому, предполагаемые реакционные
центры. Обстоятельства вынуждают
химиков-органиков рисовать структурные формулы.
В данном случае те же обстоятельства в еще
большей степени обязывают прибегать к написанию
структурных формул для восьмиклассников, чтобы
показать им, как взаимодействуют между собой
молекулы, какие функциональные группы для этого
используются.
Программа курса химии 8-го
класса включает лабораторные работы и
демонстрационные опыты. Использование учебного
времени так, как это предлагается в учебниках [4,
5], не рационально.
Какая рациональность в том,
чтобы через несколько уроков проводить
лабораторные работы и показывать
демонстрационные опыты, не объяснив структуру
атомов и молекул? Ребятам всегда интересны
химические превращения, цветные реакции. Но для
них лабораторные опыты представляются чем-то
вроде демонстраций иллюзионистов Кио или
Копперфилда. Красиво и таинственно. Через
некоторое время они обнаруживают, что количество
эмпирических формул и химических реакций с
использованием эмпирических формул нарастает.
Запомнить эмпирические формулы в виде различных
сочетаний латинских букв можно, но неинтересно,
потому что непонятно. Не помогает введение
понятия «валентность» [cм. 5, с. 25]. Почему у одних
атомов валентность равна двум, у других – трем, у
третьих – четырем, а у некоторых – единице?
Остается одно: если нельзя понять такую химию,
можно хотя бы развлечься – прилить, отлить,
отфильтровать, осадить (как во времена алхимии)
или прожечь штаны соседу по парте. Опыты
забудутся, а понимания как не было, так и нет. Вот
в этом и состоит потеря времени, нерациональное
его использование.
Авторы учебника [6] отошли от
традиционного метода изложения. Чтобы включить
рациональный способ мышления, они на первое
место выдвинули вполне очевидное положение о
том, что необходимо прежде всего понять, почему
так устроена и так действует микросистема. В этом
и состоит экономия времени, рациональное его
использование. Объяснение структуры атомов и
молекул оборачивается несомненной пользой.
Ребята начинают, к великой радости учителя,
осмысленно писать химические реакции и
наблюдать химические превращения в лабораторных
опытах со знанием дела.
Могут возразить: у нас
прекрасные учебники и программы, ученики наших
школ прекрасно выступают на химических
олимпиадах, демонстрируя недюжинные
способности. Да, это так. Но готовятся они к таким
олимпиадам, как правило, не по школьным
учебникам. И учатся наиболее способные из них не
в соответствии со школьными программами, а
вопреки им. Главным образом – самостоятельно при
обязательной поддержке и консультациях
школьного учителя. И серьезно овладевают
знаниями не столько в процессе обучения в классе,
сколько дополнительно вне классных занятий.
В заключение отметим, что
предлагаемая в статье последовательность
изучения молекулярного уровня организации
вещества позволяет в доступной форме показать
восьмиклассникам природу химического
превращения.
Модели атомов и молекул,
модели взаимодействий микросистем позволяют
ответить на вопрос не как устроен мир, а почему
так устроен мир: почему атомы в молекулах
соединяются определенным образом, почему
валентность атомов не только принимает
определенные значения, но и меняется. Изучение
химии становится интересным и увлекательным,
потому что дети сначала понимают, а потом
запоминают. Когда делаешь усилие, чтобы понять,
запоминание уже не требует таких усилий, оно
становится естественным, самопроизвольным
процессом.
Язык квантовой механики,
переведенный на язык моделей, доступный
пониманию учеников 8-го класса, позволяет
быстрыми шагами перейти к изучению макросистем
(твердого, жидкого и газообразного состояний), о
которых будет рассказано в следующей статье.
Л и т е р а т у р а
1. Яблоков В.А. Атом. Газета
«Химия», № 47, 1998.
2. Крестов Г.А., Березин Б.Д. Основные понятия
современной химии. 2-е изд., испр. Л.: Химия, 1986, с. 20.
3. Яблоков В.А. Вещество. Газета «Химия», № 39,
1998.
4. Ахметов Н.С. Химия. Учебник для
общеобразовательных учреждений. М.: Просвещение,
1996.
5. Гузей Л.С., Сорокин В.В., Суровцева Р.П. Химия.
Учебник для 8 класса общеобразовательных
учреждений. М.: Просвещение, 1995.
6. Сатбалдина С.Т., Лидин Р.А. Химия. Пробный
учебник для 8 класса общеобразовательных учебных
заведений. М.: Просвещение, 1993.
В.А.Яблоков, профессор
Нижегородского архитектурно-строительного
университета
(Нижний Новгород)
Вещества состоят из молекул, а они, в свою очередь, сформированы химическими элементами. Схемы образования таких связей зависят от типа материй. В любом виде связывания участвуют свободные электроны, находящиеся на внешнем уровне атомов. Зная механизм образования молекул, можно составить их структурную формулу.
Оглавление:
- Электронная пара
- Ионная схема
- Металлическая решетка
Электронная пара
Ковалентная (атомная) химическая связь осуществляется между двумя атомами при помощи общей электронной пары. В этом случае электронные облака элементов перекрываются, каждый получает электроны, нужные для завершения своего внешнего энергетического уровня. Благодаря этому объединению атомы удерживаются вместе. Есть два механизма образования атомной связи:
- Обменный — оба атома предоставляют по одному неспаренному электрону для образования общей пары.
- Донорно-акцепторный — один элемент отдает неподеленную электронную пару, а второй предоставляет свободную орбиталь.
В зависимости от электроотрицательности элементы могут владеть электронной парой в равной степени или один из атомов будет сильнее притягивать ее.
Атомная неполярная
Это вид связи возникает между одинаковыми атомами. Для нее характерно равномерное владение электронами обоими элементами. Их заряд не меняется. Таким способом образуются простые вещества, например, Cl2.
Схему образования молекулы хлора можно описать следующим образом: на внешнем уровне у атома хлора расположены семь электронов, то есть для завершения не хватает одного. Любой элемент отдает по одному электрону для образования общей пары. Происходит перекрывание р-орбиталей и образование молекулы Cl2.
Электроотрицательность элементов, участвующих в создании ковалентной неполярной связи, одинаковая. Дипольный момент здесь равен 0. Атомы владеют электронами в равной степени, поэтому ни один не имеет заряда.
Ковалентная полярная
Этот тип ковалентной связи образуется между двумя элементами, электроотрицательность которых отличается незначительно. Как правило, это два неметалла. Полярной связь называют, поскольку общая пара смещается в сторону более электроотрицательного элемента. Сильный атом приобретает отрицательный заряд, а более слабый — положительный. Электроотрицательность атомов можно определить по специальной шкале. Вещества, образованные полярной связью, могут состоять из двух и более элементов, например:
- Бромистоводородная кислота HBr. Водород расположен в первом периоде, то есть у него есть только один энергетический уровень, на котором находится один электрон. У брома на внешнем уровне 7 электронов и требуется еще один. Оба атома отдают свои неспаренные частицы, получается общая пара. Но бром сильнее водорода, поэтому он тянет эту пару на себя, приобретая отрицательный заряд. Водород же становится положительно заряженным.
- Сероводород H2S. Сера находится в VI группе, значит, на внешнем уровне у нее шесть электронов, два из которых неспаренные. Каждый из них участвует в образовании общей пары с двумя атомами водорода. Атом серы, как самый электроотрицательный, оттягивает на себя обе пары, получая уловный заряд -2. Аналогично можно записать схему образования молекулы воды H2O.
- Аммиак NH3. У азота на внешней р-орбитали расположены три неспаренных электрона. Каждый из них связывается с одним атомом водорода. То есть молекула аммиака образована тремя ковалентными связями, смещенными в сторону азота.
В молекуле могут присутствовать два электроотрицательных атома, которые будут оттягивать на себя электронную плотность. Примером такого вещества служит фторид кислорода OF2. Кислород отдает по одному электрону в общую пару с атомами фтора, притягивающими отрицательный заряд к себе. Таким образом, фтор имеет условный заряд -1, у кислорода этот показатель равен +2.
Если схема образования ковалентной полярной связи протекает по донорно-акцепторному механизму, то связь будет двойной. Для примера можно рассмотреть молекулу углекислого газа CO2. Углерод на внешнем уровне имеет 4 электрона, а кислород — 6. Две неподеленные электронные пары от углерода соединяются со свободными орбиталями атомов кислорода. Структуральная формула линейна: О=С=О. Связь полярна, смещена в сторону кислорода. На углероде сосредоточен заряд +4, а на кислороде -2.
Ионная схема
Связь, которая возникает между ионами (частицами, приобретающими заряд в результате принятия или отдачи электронов) и имеет электростатическую природу, называется ионной. Схема образования химической связи ионного типа основана на передаче электронов от одного атома другому. После этого элементы превращаются в ионы с положительным и отрицательным зарядом. Противоположно заряженные частицы притягиваются друг к другу.
Ионное связывание образуется между металлом и неметаллом. Ярким примером их соединения является хлорид калия. Хлор, как все галогены, должен принять один электрон для завершения внешнего энергетического уровня. Калий — щелочной металл — на внешнем уровне имеет один электрон, который и отдает хлору. Потеряв отрицательную частицу, калий получает заряд +1, а хлор наоборот. Положительный ион притягивается к отрицательному, вместе они образуют соль KCl.
Другой пример ионной схемы связывания — это оксид марганца MgO. Марганец — элемент второй группы главной подгруппы, на внешнем уровне у него 2 электрона. Их забирает кислород для заполнения своей орбитали. После этого появляются ионы Mg (+2) и О (-2). Притягиваясь, они образуют оксид.
Электростатическое притяжение ионов очень сильное, поэтому температуры кипения и плавления этих веществ высокие.
Молекула с ионной связью имеет четкую структуру, где каждый ион окружен противоположно заряженными частицами. Этот тип характерен для солей, оксидов металлов и оснований. Соли аммония, не имеющие металла в составе, тоже образованы ионной связью.
Структура всех металлов представляет собой металлическую решетку с общими электронами. Такая связь носит название металлической. Атомы металлов имеют на внешнем уровне малое число электронов. Связь их с ядром ослабевает с ростом периода в таблице Менделеева. Из-за слабых сил притяжения неспаренные электроны могут легко отрываться от атома металла, превращая его в катион. Схема описывается уравнением Me(0) — ne = Me (+n), где n — число внешних электронов.
Металлическая связь представлена структурированной решеткой, на вершинах которой расположены атомы и катионы металла. Между этими вершинами движутся свободные электроны. Они то присоединяются к катиону, превращая его обратно в атом, то снова отрываются и передвигаются к следующему катиону. Эта динамическая система удерживается благодаря электростатическому притяжению.
Химическая связь — сила, удерживающая элементы вместе, образуя молекулу или кристалл. В ее образовании всегда задействованы неспаренные электроны и свободные орбитали атомов. Существует ионная связь, объединяющая металлы и неметаллы. Она может быть ковалентной или атомной, образующейся между двумя неметаллами, или металлической, удерживающей металлические решетки.
Механизмы образования ковалентной связи.



Химическая связь.
Разные вещества имеют различное строение. Из всех известных на сегодняшний день веществ только инертные газы существуют в виде свободных (изолированных) атомов, что обусловлено высокой устойчивостью их электронных структур. Все другие вещества (а их в настоящее время известно более 10 млн.) состоят из связанных атомов.
Примечание: курсивом выделены те части текста, которые можно не учить и не разбирать.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Таковы внешние уровни атомов благородных газов: у гелия на внешнем уровне два электрона (s 2 ), у остальных — по восемь электронов (ns 2 np 6 ). Внешние уровни атомов других элементов незавершенные и в процессе химического взаимодействия они завершаются.
Химическая связь образуется за счет валентных электронов, но осуществляется она по-разному. Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Ковалентная связь
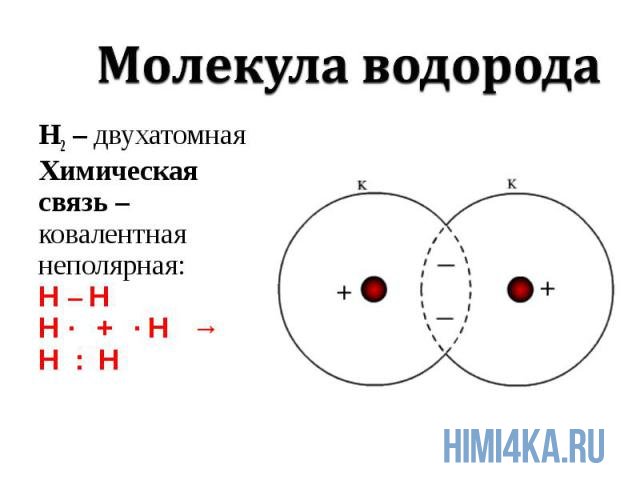
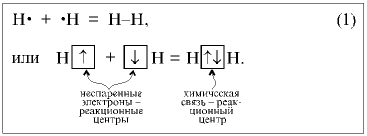
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей)
В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы Н2) это расстояние составляет 0,074 нм. Наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов (это происходит при образовании σ–связи). Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа гелия.
Изображать химические связи принято по-разному:
1) с помощью электронов в виде точек, поставленных у химического знака элемента. Тогда образование молекулы водорода можно показать схемой
2) часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом) (например, Н—Н), которая символизирует общую пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары:
Неподеленная пара электронов, в атоме их 3

неспаренный электрон общая или поделенная пара электронов
Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной; если больше, то кратной двойной (две общие электронные пары), тройной (три общие электронные пары).
Одинарная связь изображается одной черточкой (штрихом), двойная — двумя, тройная — тремя. Черточка между двумя атомами показывает, что у них пара электронов обобщена, в результате чего и образовалась химическая связь. С помощью таких черточек изображают структурные формулы молекул.
Итак, в молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов (s 2 p 6 ), причем два из них (электронная пара) в одинаковой мере принадлежат обоим атомам. Перекрывание электронных орбиталей при образовании молекулы показано на рис:
В молекуле азота N2 атомы имеют три общие электронные пары:
Очевидно, молекула азота прочнее молекулы водорода или хлора, чем и обусловлена значительная инертность азота в химических реакциях.
Химическая связь, осуществляемая электронными парами, называется ковалентной.
Механизмы образования ковалентной связи.
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков, — это обменный механизм образования ковалентной связи.
При обменном механизме атомы предоставляют в общее пользование одинаковое количество электронов.
Возможен и другой механизм ее образования — донорно-акцепторный. В этом случае химическая связь возникает за счет неподеленной электронной пары одного атома и свободной орбитали другого атома.
Рассмотрим в качестве примера механизм образования иона аммония NH4 +
При взаимодействии аммиака с НСl происходит химическая реакция:
NH3 + HCl = NH4Cl или в сокращенном ионном виде: NH3 + Н + = NH4 +
При этом в молекуле аммиака атом азота имеет неподеленную пару электронов ( двухэлектронное облако):

У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить как ?H +
При образовании иона аммония происходит перекрывание орбитали атома азота, занятой неподеленной электронной парой, с пустой орбиталью иона водорода (двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако). А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки ? часто опускается.
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т.е. предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным. Образованная таким путем ковалентная связь называется донорно-акцепторной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертая N—Н-связь в ионе аммония ничем не отличается от остальных трех.
Источник статьи: http://studopedia.ru/18_17240_mehanizmi-obrazovaniya-kovalentnoy-svyazi.html
Как написать механизм образования ковалентной связи
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар (Например, H 2, HCl , H 2 O , O 2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
А) КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ СВЯЗЬ (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, H 2, O 2, О3).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Электронная схема образования молекулы Cl 2:
Рассмотрим механизм образования молекулы кислорода:
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
В молекуле кратная, двойная связь:
Б) КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ (КПС) — образуют атомы разных неметаллов, отличающихся по значениям электроотрицательности (Например, HCl , H 2 O ) .
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl 3, разница в электроотрицательности ∆ Э.О. ∆ Э.О. = 3,16 ( Cl ) – 1,61( Al ) = 1,55
Электроотрицательность (ЭО) — это свойство атомов одного элемента притягивать к себе электроны от атомов других элементов.
Самый электроотрицательный элемент – фтор F
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
Таблица. Электроотрицательности ( ЭО ) некоторых элементов (приведены в порядке возрастания ЭО ).
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные не спаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Рассмотрим механизм образования молекулы хлороводорода:
Электронная схема образования молекулы Н Cl :
Структурная формула молекулы Н Cl :
— одинарная связь σ , смещение электронной плотности в сторону более электроотрицательного атома хлора (→)
Свойства ковалентной связи
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
С увеличением кратности связи энергия увеличивается, длина связи уменьшается и химическая активность падает:
по донорно-акцепторному механизму
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в молекуле аммиака NH 3 и четырёхвалентен в ионе аммония NH 4 + (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность* – обуславливает форму молекулы в пространстве.
* — подробнее будет изучено в старших классах. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей. (см. «гибридизация»)
Источник статьи: http://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no51-cast-2-kovalentnaa-svaz-polarnaa-i-nepolarnaa-kovalentnye-svazi
Ковалентная связь — полярная и неполярная, механизмы образования
Ковалентная связь (от латинского «со» совместно и «vales» имеющий силу) осуществляется за счет электронной пары, принадлежащей обоим атомам. Образуется между атомами неметаллов.
Электроотрицательность неметаллов довольно велика, так что при химическом взаимодействии двух атомов неметаллов полный перенос электронов от одного к другому (как в случае ионной связи) невозможен. В этом случае для выполнения правила октета необходимо объединение электронов.
В качестве примера обсудим взаимодействие атомов водорода и хлора:
Cl 1s 2 2s 2 2p 6 3s 2 3p 5 — семь электронов на внешнем уровне
Каждому из двух атомов недостает по одному электрону для того, чтобы иметь завершенную внешнюю электронную оболочку. И каждый из атомов выделяет „в общее пользование” по одному электрону. Тем самым правило октета оказывается выполненным. Лучше всего изображать это с помощью формул Льюиса:
Обобществленные электроны принадлежат теперь обоим атомам. Атом водорода имеет два электрона (свой собственный и обобществленный электрон атома хлора), а атом хлора — восемь электронов (свои плюс обобществленный электрон атома водорода). Эти два обобществленных электрона образуют ковалентную связь между атомами водорода и хлора. Образовавшаяся при связывании двух атомов частица называется молекулой.
Неполярная ковалентная связь
Ковалентная связь может образоваться и между двумя одинаковыми атомами. Например:
Эта схема объясняет, почему водород и хлор существуют в виде двухатомных молекул. Благодаря спариванию и обобществлению двух электронов удается выполнить правило октета для обоих атомов.
Помимо одинарных связей может образовываться двойная или тройная ковалентная связь, как, например, в молекулах кислорода О2 или азота N2. Атомы азота имеют по пять валентных электронов, следовательно, для завершения оболочки требуется еще по три электрона. Это достигается обобществлением трех пар электронов, как показано ниже:
Ковалентные соединения — обычно газы, жидкости или сравнительно низкоплавкие твердые вещества. Одним из редких исключений является алмаз, который плавится выше 3 500 °С. Это объясняется строением алмаза, который представляет собой сплошную решетку ковалентно связанных атомов углерода, а не совокупность отдельных молекул. Фактически любой кристалл алмаза, независимо от его размера, представляет собой одну огромную молекулу.
Ковалентная связь возникает при объединении электронов двух атомов неметаллов. Возникшая при этом структура называется молекулой.
Полярная ковалентная связь
В большинстве случаев два ковалентно связанных атома имеют разную электроотрицательность и обобществленные электроны не принадлежат двум атомам в равной степени. Большую часть времени они находятся ближе к одному атому, чем к другому. В молекуле хлороводорода, например, электроны, образующие ковалентную связь, располагаются ближе к атому хлора, поскольку его электроотрицательность выше, чем у водорода. Однако разница в способности притягивать электроны не столь велика, чтобы произошел полный перенос электрона с атома водорода на атом хлора. Поэтому связь между атомами водорода и хлора можно рассматривать как нечто среднее между ионной связью (полный перенос электрона) и неполярной ковалентной связью (симметричное расположение пары электронов между двумя атомами). Частичный заряд на атомах обозначается греческой буквой δ. Такая связь называется полярной ковалентной связью, а о молекуле хлороводорода говорят, что она полярна, т. е. имеет положительно заряженный конец (атом водорода) и отрицательно заряженный конец (атом хлора).
В таблице ниже перечислены основные типы связей и примеры веществ:
Обменный и донорно-акцепторный механизм образования ковалентной связи
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару.
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Источник статьи: http://himege.ru/covalent-bond/