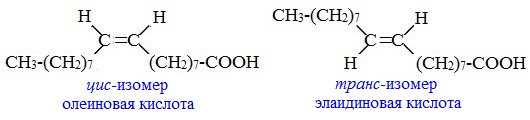…
Изомерия карбоновых кислот
Для карбоновых кислот характерны структурная, геометрическая и оптическая виды изомерии.
А) Структурная изомерия
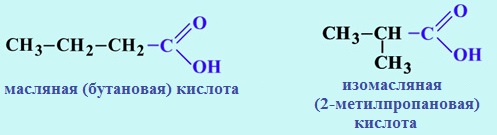
- Изомерия углеродного скелета (начиная с C4), например, валериановая и 2,2-диметилпропановая кислоты:
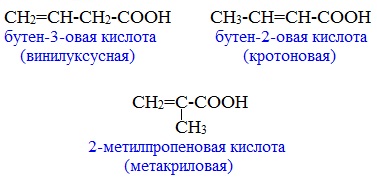
- Изомерия положения кратной связи (для ненасыщенных кислот), например, 2-бутеновая кислота и 2-метилпропеновая кислота:
- Изомерия положения заместителей или функциональных групп (для кислот, имеющих заместители и функциональные группы), например, молочная и гидракриловая кислоты (2- и 3- гидроксипропановые кислоты) и α- и β-аланин (α- и β-аминопропановые кислоты):
- Межклассовая изомерия со сложными эфирами карбоновых кислот (начиная с C2), например валериановая кислота и этиловый эфир пропановой кислоты:
Б) Пространственная изомерия
- Цис-, транс-изомерия характерна для непредельных кислот, например цис-2-бутеновая (изокротоновая) кислота и транс-2-бутеновая (кротоновая) кислота:
- Оптическая изомерия характерна для карбоновых кислот, имеющих асимметрический атом углерода, например D- и L- изомеры молочной кислоты:
Номенклатура карбоновых кислот
Карбоновым кислотам удобно давать названия, используя правила систематической номенклатуры ИЮПАК, также возможно использовать правила рациональной номенклатуры. Кроме этого некоторые кислоты имеют тривиальные названия. Тривиальные названия кислот приведены в разделе Изомерия и номенклатура органических соединений.
При составлении названий по рациональной номенклатуре изначально исходили из того, что все кислоты рассматривали, как производные уксусной кислоты, например, диметилуксусная кислота, диметилэтилуксусная кислота, фенилуксусная кислота. Позже было принято к названию углеводород радикала, прибавлть карбоновая кислота. Например, этанкарбоновая кислота, этиленкарбоновая кислота:
По систематической номенклатуре (ИЮПАК):
- Выбирать следует наиболее длинную цепь. За основу названия берут углеводород с тем же количеством атомов углерода, в конце прибавляют –овая кислота (для одноосновных кислот), диовая (для двухосновных кислот) и т.д.
- Нумерацию цепи начинают с карбоксильного углерода, если при этом используют арабские цифры. Если в названии используют латинские греческие буквы, то нумерацию начинают со следующего после карбоксильной группы атома углерода. Например, 2,3-диметилбутановая кислота и β-аминопропановая кислота:
- Если в молекуле имеются кратные связи, то выбирают цепь, включающую эти связи. При составлении названия указывают положение и число кратных связей, например, 2,3-диметил-3-пентеновая кислота:
- Если молекула кислоты включает функциональные группы, то выбирают цепь, содержащую все функциональные группы и в названии упоминают их в порядке старшинства. Например: β-окси-α-аминопроропионовая кислота:
Изомерия карбоновых кислот
Для карбоновых кислот характерна структурная и пространственная изомерия.
1. Структурная изомерия
а) Изомерия углеродного скелета (начиная с C4)
Изомерия углеродного скелета начинается с бутановой кислоты С3Н7СООН, которая существует в виде двух изомеров:
б) Межклассовая изомерия (начиная с C2)
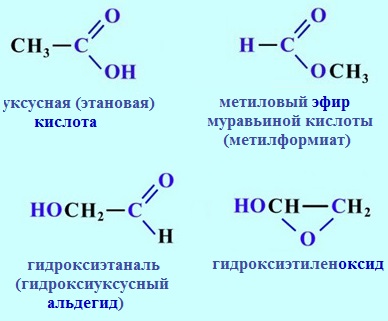
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
в) Изомерия положения кратной связи
Этот вид изомерии характерен для непредельных карбоновых кислот. Например, кротоновая кислота имеет три изомера:
Изомеры валериановой кислоты
2. Пространственная изомерия
а) Оптическая
Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами.
Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН существует в виде двух оптических изомеров:
б) Цис- транс – изомерия (геометрическая изомерия)
Этот вид изомерии характерен для непредельных карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН существует два геометрических изомера:
Карбоновые кислоты
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Классификация карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
Например, уксусная кислота
- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
Например, щавелевая кислота
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — CnH2nО2.
Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.

Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды — реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С — образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная —
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)

Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Межклассовая изомерия

4.3
Средняя оценка: 4.3
Всего получено оценок: 285.
4.3
Средняя оценка: 4.3
Всего получено оценок: 285.
Один из видов структурной изомерии является межклассовая изомерия. В этом случае образуются изомеры между двумя классами органических веществ.
Изомерия
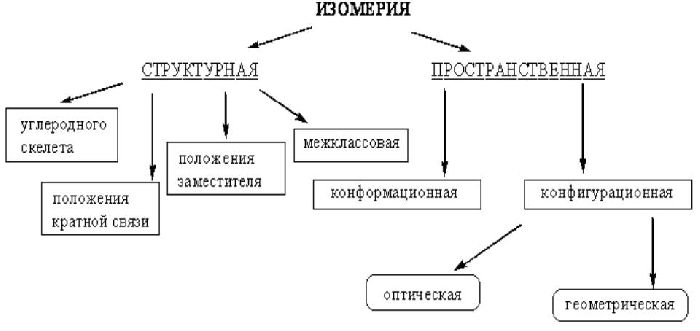
Вещества, сходные по содержанию и количеству атомов, но разные по структурному или пространственному строению, называются изомерами. Выделяют два типа изомерии:
- структурная;
- пространственная.
Структурная изомерия может происходить:
- по углеродному скелету
- по положению групп, связей или заместителей.
В некоторых случаях при перемещении функциональной группы образуется вещество другого класса. В этом случае говорят о межклассовой изомерии, которая также является структурной изомерией. Например, при перемещении гидроксильной группы из этанола (CH3-CH2-OH) образуется диметиловый эфир (CH3-O-CH3).
Пространственная изомерия показывает, как располагаются атомы углеродной цепочки в пространстве, и бывает двух видов:
- оптическая или зеркальная;
- геометрическая или цис-транс-изомерия.
При оптической изомерии образуются молекулы, будто являющиеся зеркальным отражением друг друга. Цис-транс-изомеры различаются положением заместителей по отношению к плоскости, делящей молекулу пополам. Если по одну сторону находятся одинаковые радикалы, такие изомеры называются цис-изомерами. Если одинаковые радикалы лежат по разным сторонам плоскости, они называются транс-изомерами.
Чем длиннее цепь, тем больше изомеров может образовывать вещество.
Межклассовые изомеры
При перемещении в углеродном скелете функциональной группы образуется новое вещество, которое относится к другому классу органических соединений. При этом у изомеров абсолютно одинаковые общие формулы.
В таблице наглядно показано, между какими классами веществ образуется изомерия, а также приведены примеры межклассовой изомерии.
|
Классы, образующие изомерию |
Общая формула |
Примеры |
|
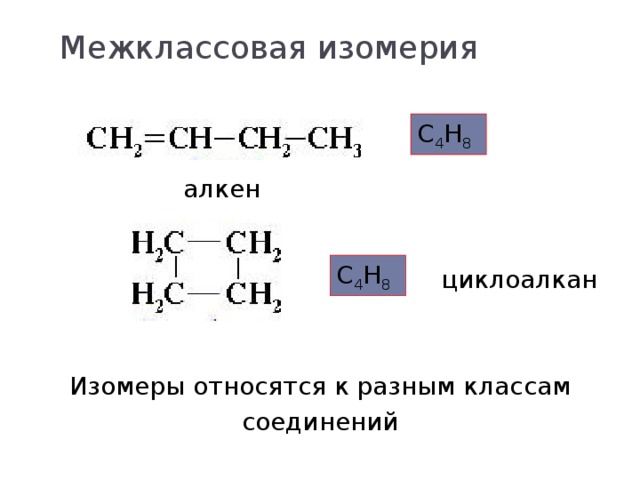
Алкены и циклоалканы |
CnH2n |
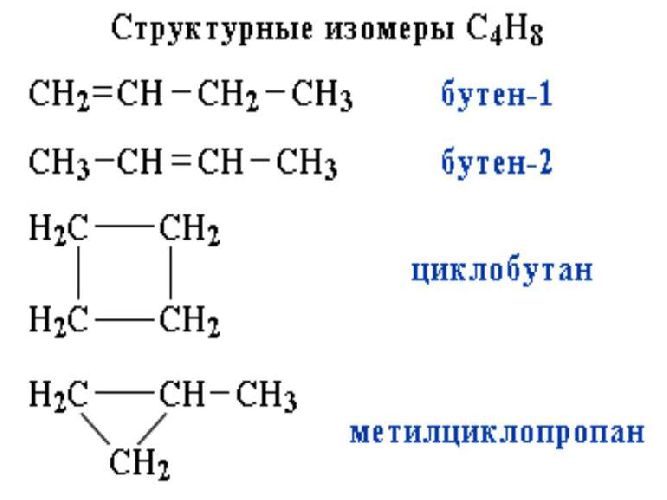
Бутен-1 (CH2=CH-CH2-CH3) и циклобутан (C4H8) |
|
Алкадиены и алкины |
CnH2n-2 |
Бутадиен-1,3 (CH2=CH-CH=CH2) и бутин-1 (CH≡C-CH2-CH3) |
|
Одноатомные спирты и простые эфиры |
CnH2n+2O |
Бутанол-1 (CH3-CH2-CH2-CH2OH) и метилпропиловый эфир (CH3-O-CH2-CH2-CH3) |
|
Альдегиды и кетоны |
CnH2nO |
Бутаналь (CH3-CH2-CH2-COH) и бутанон-2 (CH2-CO-CH2-CH2-CH3) |
|
Карбоновые кислоты и сложные эфиры |
CnH2nO2 |
Бутановая кислота (CH3-CH2-CH2-COOH) и пропилформиат (COOH-CH2-CH2-CH3) |
|
Нитросоединения и аминокислоты |
CnH2n+1NO2 |
Нитробутан (CH3-CH2-CH2-CH2NO2) и альфа-аминобутановая кислота (CH3-CH2-CH-(NH2)COOH) |
Среди всех классов органических веществ алканы не образуют межклассовую изомерию.
Что мы узнали?
Некоторые классы органических веществ могут образовывать межклассовую изомерию при перемещении функциональной группы. Межклассовая изомерия является разновидностью структурной изомерии. Классы, образующие межклассовые изомеры: алкены с циклоалканами, алкадиены с алкинами, одноатомные спирты с простыми эфирами, альдегиды с кетонами, карбоновые кислоты со сложными эфирами, нитросоединения с аминокислотами.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 285.
А какая ваша оценка?