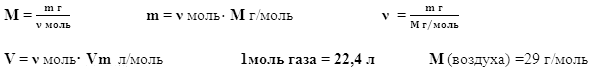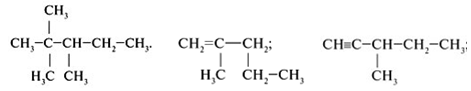МБОУ БГО «Борисоглебская
гимназия №1»
Моделирование молекул органических и неорганических соединений
Работу выполнила:
Кучкурда Юлия, обучающаяся 9 «А» класса,
Фомина Екатерина, обучающаяся 7 «А» класса,
МБОУ БГО «Борисоглебская гимназия №1»
Руководитель:
Рязанова Ирина Сергеевна,
учитель химии
МБОУ БГО «Борисоглебская гимназия №1»
2015г.
Оглавление
Введение:
Цель
работы и задачи
Методика
исследования
Что такое
моделирование?
Моделирование
Органические и
неорганические вещества, которые получились в ходе моделирования.
Вывод
Заключение
Список литературы
Введение:
Моделирование (лат. modus –
мера, образ, способ) издавна применялось в научном познании. Например,
возникновение представлений Демокрита и Эпикура об атомах, их форме, и способах
соединения, об атомных вихрях и ливнях, объяснения физических свойств различных
веществ с помощью представления о круглых и гладких или крючковатых частицах,
сцеп ленных между собой. Эти представления являются прообразами современных
моделей, отражающих ядерно-электронное строение атома. В науке Нового времени
первоначально применялись различные механические модели. Постепенно метод
моделирования стал приобретать все большее распространение, проникая во все
отрасли научного знания. XX век принес методу моделирования новые успехи,
связанные с расцветом кибернетики.
Моделирование на современном
этапе приобрело значение общенаучного метода. Его особенностью является то, что
для изучения объекта используется опосредующее звено – объект-заместитель.
Исходный объект исследования при моделировании называется оригиналом,
объект-заместитель – моделью.
По мнению большинства
выдающихся химиков, в том числе лауреата нобелевской премии Г. Сиборга,
теоретическое моделирование является основным методом познания в химии.
Сущность химических явлений скрыта от непосредственного наблюдения
исследователя, поэтому познание осуществляют путем построения модели невидимого
объекта по косвенным данным.
В данной работе мы
смоделируем пространственные модели органических и неорганических соединений и
сравним их.
Цель работы заключается в сборе моделей химических веществ органической и
неорганической химии, изучении их строения и в создании текстовых и виртуальных проектов.
Для реализации данной цели, мы поставили такие задачи:
1.
собрать материал по заданной
теме;
2.
собрать модели молекул;
3.
изучить их строение;
4.
произвести распределение
информации по информативным блокам;
5.
произвести эстетическое
оформление проекта.
Актуальность данной работы
заключается в том, что при изучении химии пространственное воображение
играет большую роль и из-за неразвитости этого компонента учащиеся воспринимают
тему «Химическая связь» достаточно тяжело, как следствие этого возникают
затруднения при изучении классов веществ неорганической и органической химии, химических
реакций.
Методика исследования
1.
Для сбора информации применялся
поисково-аналитический метод, информация бралась из современного источника —
интернета (Yandex, Google).
2.
Для составления слайдов
презентации использовались следующие программы:
1.
для написания текста – Microsoft Office Word 2010;
2.
для демонстрации слайдов— Microsoft Office PowerPoint 2010;
3.
для эстетического восприятия— Microsoft Office PowerPoint 2010.
Что такое моделирование?
Модели́рование — исследование объектов познания на их моделях; построение и изучение моделей
реально существующих объектов, процессов или явлений с целью получения объяснений этих
явлений, а также для предсказания явлений, интересующих исследователя.
В силу многозначности
понятия «модель» в науке и технике не существует единой классификации видов моделирования:
классификацию можно проводить по характеру моделей, по характеру моделируемых
объектов, по сферам приложения моделирования (в технике, физических науках,
кибернетике и т. д.).
В настоящее время по
технологии моделирования и области применения выделяют такие основные виды
моделирования:
1.
Информационное моделирование
2.
Компьютерное моделирование
3.
Математическое моделирование
4.
Математико-картографическое моделирование
5.
Молекулярное моделирование
6.
Цифровое моделирование
7.
Логическое моделирование
8.
Психологическое моделирование
9.
Статистическое моделирование
10.
Структурное моделирование
11.
Физическое моделирование
12.
Имитационное моделирование
13.
Эволюционное моделирование
14.
Графическое и геометрическое моделирование и др.
В данной работе мы будем
использовать такой вид моделирования, как молекулярное моделирование.
Процесс моделирования
включает три элемента:
1.
субъект (исследователь),
2.
объект исследования,
3.
модель, определяющую (отражающую) отношения
познающего субъекта и познаваемого объекта.
Материальное
(экспериментальное) моделирование широко используется в химии для познания и
изучения строения веществ и особенностей протекания химических реакций, для
выявления оптимальных условий химико-технологических процессов и др.
Методы
молекулярного моделирования используются в компьютерной
химии, вычислительной биологии и науке о материалах для изучения как
индивидуальных молекул, так и взаимодействия в молекулярных системах.
Расчеты
простейших систем при молекулярном моделировании могут быть выполнены вручную,
но из-за большого объема вычислений при моделировании систем, представляющих
практический интерес, особенно при исследовании молекулярной динамики, используются
компьютерные методы расчета и визуализации, эта техника получила название
компьютерного молекулярного моделирования.
Общей
чертой методов молекулярного моделирования является атомистический уровень
описания молекулярных систем — наименьшими частицами являются атомы или
небольшие группы атомов. В этом состоит отличие молекулярного моделирования от квантовой химии, где в явном виде
учитываются и электроны. Таким образом, преимуществом молекулярного
моделирования является меньшая сложность в описании систем, позволяющая
рассмотрение большего числа частиц при расчётах.
Моделирование
Используя школьный набор для
моделирования органических и неорганических веществ, мы сконструировали модели
различных молекул, например таких как, фуллерен, вода, соляная кислота, оксид
фосфора….
1.

Наборы предназначены для
индивидуальной работы учащихся или работы в малых группах. В комплект для
класса входят по 10 наборов 3053 и 3054.
В состав наборов входят
модели атомов и соединительные элементы – 124 для 3053 и 116 для 3054. На
каждой модели атома проставлен соответствующий химический символ. Цветные
маркировки атомов соответствуют принятым международным соглашениям.
2.
Правила построения моделей молекул
С помощью отдельных
элементов данных конструкторов можно создать модели различных молекул. При
сборке модели штырьки, выступающие из шариков, следует до упора вставлять в
соединительные элементы. Гибкие соединительные элементы позволяют моделировать
двойные и тройные связи. По окончании работы детали конструктора следует
сложить в коробки в соответствии со схемой их расположения. Тогда будет легко
проверить, все ли детали на месте.
Молекулярные модели,
построенные с помощью наборов 3053 и 3054, наглядно продемонстрируют
стехиометрическую валентность и пространственное расположение атомов, входящих
в молекулы.
Так как модели отражают
далеко не все реальные аспекты в строении молекул, следует иметь в виду
следующее:
1.
С помощью моделей можно представлять только
молекулы с ковалентными связями.
2.
Модели не дают представления об относительных
размерах отдельных атомов и значения углов между ними.
3.
В правильно собранной молекуле все муфты должны
быть заняты соединительными элементами; свободная муфта означает неспаренный
электрон (например, при построении аллотропных модификаций углерода и
органических радикалов)
4.
С помощью конструктора может быть
продемонстрировано строение ионов. В этом случае каждая свободная муфта
означает отсутствующий электрон, а молекула со свободной муфтой означает,
соответственно, катион – положительно заряженный ион.
Каждый соединительный
элемент означает связующую электронную пару, а молекула со свободным с одного
конца соединительным элементом означает, соответственно, анион (отрицательно
заряженный ион).
1.
Для построения моделей ароматических соединений
следует использовать особые бензольные модели (набор 3054), наиболее адекватно
передающие пространственные соотношения атомов в молекуле бензола.
2.
С помощью данного конструктора нельзя
проиллюстрировать:
3.
Структуру ионных соединений (например, кристаллов NaCl);
4.
Соединения с водородными связями (например,
полипептидную цепь).
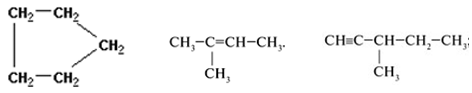
Органические и неорганические вещества,
которые получились в ходе моделирования.
В ходе процесса
моделирования молекул мы получили множество веществ. Их мы разделили на 2
группы: органические и неорганические вещества.
Органические вещества:
пенициллановая кислота, циклогексан, метан, метилоранж, этилен, ацителен,
гидразин, фруктоза, уксусная кислота, глицерин, метан, фуллерен,.

вещества: хлорид натрия, углекислый газ, оксид фосфора (V),
нитрат калия, фосфат натрия, вода, оксид азота (V), азот,
озон, хлор, перекись водорода, фосфорная кислота, хлорид натрия, аммиак, оксид
серы (VI), соляная кислота, гидроксид калия,
Вывод:
В ходе работы мы сделали такие вывод:
1.
Стержневые и шаростержневые модели молекул
неорганических веществ, построенные в данной работе, формируют пространственное
воображение учащихся и помогают лучшему усвоению программного материала по
химии. Учащиеся легче усваивают процесс образования сложных веществ при
протекании химических реакций.
Заключение:
На сегодняшний день
моделирование все чаще применяется в жизни. Совершенно очевидна актуальность
исследований в этой области. Роль молекулярного моделирования, как для
фундаментальных, так и для прикладных исследований в области молекулярной
биологии, химии и биохимии неуклонно растёт. Это связано и с
совершенствованием математического аппарата, и с ростом производительности
вычислительной техники, и накоплением огромного количества фактического
материала, требующего анализа. Предвидеть все возможные химические превращения
и смоделировать их – задача будущего.
Список
литературы:
1.
О. С. Габриелян «Химия: Учебник для 8 классов
общеобразовательных учереждений.» — М.: Дрофа, 2001.
2.
О. С. Габриелян «Химия: Учебник для 9 классов
общеобразовательных учереждений.» — М.: Дрофа, 2001.
3.
Х.Д.Хёльтье, В. Зиппль, Д. Роньян, Г. Фолькерс
«Молекулярное моделирование.» — М.: Бином, 2010.
4.
URL:http://greenfuture.ru/profile/Homa/Молекулярное%20моделирование%20и%20конструирование/++tool++%20%20tool%20%20type3/
5.
URL:https://ru.wikipedia.org/wiki/%CC%EE%EB%E5%EA%F3%EB%FF%F0%ED%EE%E5_%EC%EE%E4%E5%EB%E8%F0%EE%E2%E0%ED%E8%E5
Данная работа проводится с учащимися, которые
пришли получать профессиональное образование.
Очень часто знания по химии у них слабые, поэтому
нет заинтересованности к предмету. Но в каждом
ученике есть желание учиться. Даже
слабоуспевающий, ученик проявляет интерес к
предмету, когда ему что-нибудь удается сделать
самому.
Задания в работе составлены с учетом пробелов в
знаниях. Каткий теоретический материал
позволяет быстро вспомнить необходимые понятия,
что помогает учащимся выполнить работу. Построив
модели молекул, ребятам легче написать
структурные формулы. Для более сильных учащихся,
которые быстрее выполняют практическую часть
работы, даны расчетные задачи. Каждый учащийся
при выполнении работы добивается результата:
одни успевают построить модели молекул, что
делают с удовольствием, другие выполнить большую
часть работы, третьи делают все задания, и оценку
получает каждый учащийся.
Цели урока:
- формирование навыков самостоятельной работы;
- обобщить и систематизировать знания учащихся о
теории строения органических соединений; - закрепить умение составлять структурные
формулы углеводородов; - отработать навыки давать названия по
международной номенклатуре; - повторить решение задач на определение
массовой доли элемента в веществе; - развивать внимание и творческую активность;
- развивать логическое мышление;
- воспитывать чувство ответственности.
Практическая работа
“Изготовление моделей молекул
органических веществ.
Составление структурных формул углеводородов”.
Цель работы:
- Научиться составлять модели молекул
органических веществ. - Научиться записывать структурные формулы
углеводородов и назвать их по международной
номенклатуре.
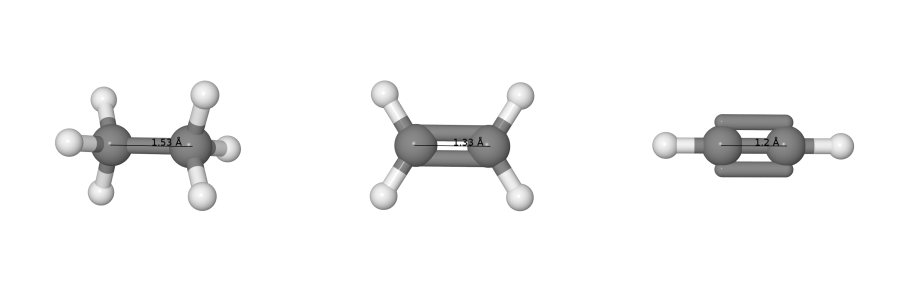
Теоретический материал. Углеводороды это
органические вещества, состоящие из атомов
углерода и водорода. Атом углерода во всех
органических соединениях четырехвалентен. Атомы
углерода могут образовывать цепочки прямые,
разветвленные, замкнутые. Свойства веществ
завися не только от качественного и
количественного состава, но и от порядка
соединения атомов между собой. Вещества, имеющие
одинаковую молекулярную формулу, но разное
строение называются изомерами. Приставки
указывают количество ди – два, три – три, тетра
— четыре; цикло — означает замкнутый.
Суффиксы в названии углеводородов указывают на
наличие кратной связи:
ан одинарная связь между атомами углерода (С
С);
ен двойная связь между атомами углерода (С =
С);
ин тройная связь между атомами углерода (СС);
диен две двойных связи между атомами углерода (С
= СС = С);
Радикалы: метил -СН3; этил -С2Н5;
хлор -Сl; бром -Br.
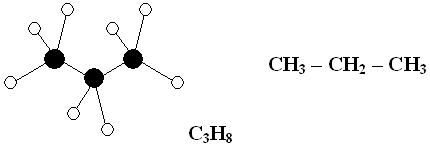
Пример. Составьте модель молекулы пропана.
Молекула пропана C3H8 содержит
три атома углерода и восемь атомов водорода.
Атомы углерода соединены между собой. Суффикс
– ан указывает на наличие одинарной связи
между атомами углерода. Атомы углерода
располагаются под углом 10928 минут.
Молекула имеет форму пирамиды. Атомы углерода
изображайте черными кругами, а атомы водорода –
белыми, атомы хлора – зелеными.
При изображении моделей соблюдайте
соотношение размеров атомов.
Молярную массу находим, пользуясь
периодической таблицей
М (С3Н8 ) = 12 · 3 + 1 · 8 = 44 г/моль.
Что бы назвать углеводород надо:
- Выбрать самую длинную цепочку.
- Пронумеровать, начиная с того края, к которому
ближе радикал или кратная связь. - Указать радикал, если радикалов несколько
указывают каждый. (Цифра перед названием). - Назвать радикал, начиная с меньшего радикала.
- Назвать самую длинную цепочку.
- Указать положение кратной связи. (Цифра после
названия).
Пример
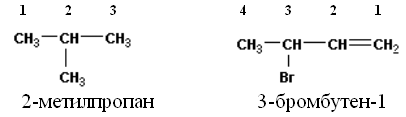
При составлении формул по названию надо:
- Определить число атомов углерода в цепочке.
- Определить положение кратной связи. (Цифра
после названия). - Определить положение радикалов. (Цифра перед
названием). - Записать формулы радикалов.
- В последнюю очередь определить количество и
расставить атомы водорода.
Массовая доля элемента определяется по
формуле:
где
– массовая
доля химического элемента;
n – число атомов химического элемента;
Ar – относительная атомная масса химического
элемента;
Mr – относительная молекулярная масса.
При решении задачи примените формулы расчета:
Относительная плотность газа Dг показывает
во сколько раз плотность одного газа больше
плотности другого газа. D(Н2) —
относительная плотность по водороду. D(воздуха)
— относительная плотность по воздуху.
Оборудование: Набор шаростержневых
моделей молекул, пластилин разных цветов, спички,
таблица “Предельные углеводороды”,
периодическая таблица. Индивидуальные задания.
Ход работы. Выполнение заданий по
вариантам.
Вариант №1.
Задание №1. Составьте модели молекул: а)
бутана, б) циклопропана. Зарисуйте модели молекул
в тетради. Напишите структурные формулы этих
веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества:
Задание №3. Составьве структтурные формулы
веществ:
а) бутен-2, напишите его изомер;
б) 3,3 — диметилпентин-1.
Задание №4. Решите задачи:
Задача 1 Определить массовую долю углерода и
водорода в метане.
Задача 2. Сажа применяется для производства
резины. Определить сколько г сажи (С) можно
получить при разложении 22 г пропана?
Вариант №2.
Задание №1. Составьте модели молекул: а)
2-метилпропана, б) циклобутана. Зарисуйте модели
молекул в тетради. Напишите структурные формулы
этих веществ. Найдите их молекулярные массы.
Задание №2. Назовите вещества:
Задание №3 Составьве структурные формулы
веществ:
а) 2-метилбутен-1, напишите его изомер;
б) пропин.
Задание №4. Решите задачи:
Задача 1. Определить массовую долю углерода и
водорода в этилене.
Задача 2. Сажа применяется для производства
резины. Определить массу сажи (С), которую можно
получить при разложении 36г пентана?
Вариант №3.
Задание №1. Составьте модели молекул: а)
1,2-дихлорэтана, б) метилциклопропана
Зарисуйте модели молекул в тетради. Напишите
структурные формулы этих веществ. Определите во
сколько раз дихлорэтан тяжелее воздуха?
Задание №2. Назовите вещества:
Задание №3. Составьве структурные формулы
веществ:
а) 2-метилбутен-2 напишите его изомер;
б) 3,4-диметилпентин-1.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу
вещества, содержащего 92,3% углерода и 7,7% водорода.
Относительная плотность по водороду равна 13.
Задача 2. Какой объем водорода выделится при
разложении 29 г бутана (н.у.)?
Вариант №4.
Задание №1. Составьте модели молекул: а)
2,3-диметилбутана, б) хлорциклопропана. Зарисуйте
модели молекул в тетради. Напишите структурные
формулы этих веществ. Найдите их молекулярные
массы.
Задание №2. Назовите вещества
Задание №3. Составьве структурные формулы
веществ:
а) 2-метибутадиентен-1,3; напишите изомер.
б) 4-метилпентин-2.
Задание №4. Решите задачи:
Задача 1. Найти молекулярную формулу
вещества, содержащего 92,3% углерода и 7,7% водорода.
Относительная плотность по водороду равна 39.
Задача 2. Какой объем углекислого газа
выделится при полном сгорании 72 г автомобильного
топлива, состоящего из пропана?
Приложение
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Изготовление моделей молекул органических веществ
Содержание
-
1.
Презентация по химии Изготовление моделей молекул органических веществ -
2.
Цель работы: Научиться составлять модели молекул органических -
3.
Теоретический материалУглеводороды это органические вещества, состоящие из -
4.
Теоретический материалСуффиксы в названии углеводородов указывают на -
5.
Теоретический материалРадикалы: метил -СН3; этил -С2Н5; хлор -Сl; бром -Br. -
6.
ЗаданиеНапишите структурную формулу пропана. Составьте модель молекулы -
7.
ЗаданиеНапишите структурную формулу 2-метилпропана. Составьте модель молекулы -
8.
Задание1 вариант: составьте модели молекул: а) бутана, -
9.
Задание1 вариант: Определить массовую долю углерода и -
10.
Спасибо за внимание! -
11.
Решение задач1. Выведите формулу вещества, содержащего 82,75% -
12.
Ответ: гептан 2. В углеводороде массовая доля -
13.
Ответ: пентан3. Массовая доля углерода в углеводороде -
14.
Ответ: бутен 4. Массовая доля углерода в
Цель работы: Научиться составлять модели молекул органических веществ. Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Слайд 1Практическая работа
“Изготовление моделей молекул органических веществ.
Составление структурных формул углеводородов”.
Слайд 2Цель работы:
Научиться составлять модели молекул органических веществ.
Научиться записывать
структурные формулы углеводородов и назвать их по международной номенклатуре.

Слайд 3Теоретический материал
Углеводороды это органические вещества, состоящие из атомов … и …
Атом
углерода во всех органических соединениях имеет валентность …
Атомы углерода могут образовывать цепочки….
Свойства веществ завися не только от качественного и количественного состава, но и от …
Вещества, имеющие одинаковую молекулярную формулу, но разное строение называются…
Приставки указывают количество ди – два, три – три, тетра — четыре; цикло — означает замкнутый.

Слайд 4Теоретический материал
Суффиксы в названии углеводородов указывают на наличие кратной связи:
ан одинарная
связь между атомами углерода (С — С);
ен двойная связь между атомами углерода (С = С);
ин тройная связь между атомами углерода (С ≡ С);
диен две двойных связи между атомами углерода (С = С — С = С);

Слайд 5Теоретический материал
Радикалы:
метил -СН3;
этил -С2Н5;
хлор -Сl;
бром -Br.

Слайд 6Задание
Напишите структурную формулу пропана.
Составьте модель молекулы пропана.
Вычислите молярную массу
молекулы пропана.
Вычислите массовую долю углерода в пропане.

Слайд 7Задание
Напишите структурную формулу 2-метилпропана.
Составьте модель молекулы 2-метилпропана.
Вычислите молярную массу
молекулы 2-метилпропана.
Вычислите массовую долю С и Н в молекуле.

Слайд 8Задание
1 вариант: составьте модели молекул: а) бутана, б) циклопропана. Напишите структурные
формулы этих веществ. Найдите их молекулярные массы.
2 вариант: составьте модели молекул: а) 2-метилпентана, б) циклобутана. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.
3 вариант: составьте модели молекул: а) хлорэтана, б) гексана. Напишите структурные формулы этих веществ. Найдите их молекулярные массы.

Слайд 9Задание
1 вариант: Определить массовую долю углерода и водорода в бутане.
2
вариант: Определить массовую долю углерода и водорода в 2-метилпентане.
3 вариант: Определить массовую долю углерода и водорода в хлорэтане.

Слайд 11Решение задач
1. Выведите формулу вещества, содержащего 82,75% углерода и 17,25 %
водорода. Относительная плотность паров этого вещества по воздуху равна 2.

Слайд 12Ответ: гептан
2. В углеводороде массовая доля углерода равна 84%. Относительная
плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Ответ: гептан

Слайд 13Ответ: пентан
3. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров
углеводорода по водороду равна 36. Определите формулу.
Ответ: пентан

Слайд 14Ответ: бутен
4. Массовая доля углерода в углеводороде составляет 85,7%. Плотность
паров углеводорода по воздуху равна 1,931. Определите формулу
Ответ: бутен

Время на прочтение
23 мин
Количество просмотров 2.7K
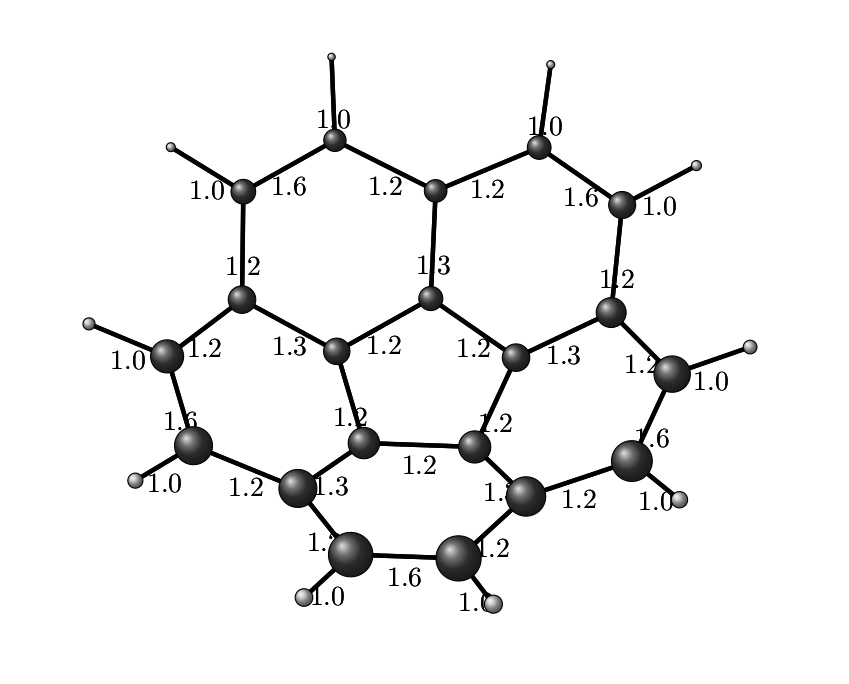
Иногда перед некоторыми химиками может встать задача получить картинку с публикационным качеством, на которой будет молекула, и над каждой связью будет подписан её порядок. В этом посте, на примере кораннулена, мы познакомимся с простейшими (полуэмпирическими) квантово-химическими расчётами, визуализацией молекул, узнаем про порядки связей, и напишем питоновский скрипт, который будет генерировать из результатов наших расчётов картинку при помощи LaTeX-овского пакета TikZ картинку, которую уже почти-почти можно вставлять в статью. Всё это под катом 
Глава 1. В которой у нас встают волосы дыбом
Вроде мы себе со школы представляем, что есть молекулы, в них могут быть одинарные, двойные, тройные связи, всё такое. Но на самом деле, все эти концепции верны только когда в образовании химической связи участвуют только два атома. В случае же более сложных химических связей (сопряжённые, трёхцентровые, и прочие извращённые), все эти понятия очень сильно размазываются.
Но всё равно, существуют способы каждую химическую связь охарактеризовать, приписав ей порядок связи. Грубо говоря, порядок связи между двумя атомами — это число пар электронов, которые держат эту пару атомов вместе. Электроны описываются квантовой механикой, и в приниципе, решить задачу о квантовом состоянии электронов (в низшем по энергии состоянии) для любой сейчас не вызывает никаких сложностей. Зная же состояние всех электронов в молекуле (или электронную волновую функцию), мы можем применить её для расчёта порядка связи между каждой парой атомов (даже между несвязанными).
Если мы посчитаем все эти порядки связей, мы наверное захотим их визуализировать. И если с целыми порядками связей всё понятно (одинарная — одна палочка между атомами, двойная — две, тройная — три, см. рисунок выше), то что делать в случае, если порядок связи равен 1.3, уже не так очевидно. Поэтому самым простым решением было бы изобразить все связи в молекулах черточками, а порядок связи подписать сверху.
Но каким бы очевидным это всё ни было для нас, мало какой визуализатор молекул с такой задачей справится. Из тех, что я знаю, это только GaussView, который, за несколько тысяч у.е. своей стоимости, сможет построить абсолютно некрасивую и непубликабельную картинку, так что этот вариант мы отклоняем. Вместо этого, мы попробуем сами сгенерировать картинку в читаемом варианте при помощи LaTeX-овского безумно мощного пакета TikZ.
Глава 2. В которой мы знакомимся с визуализацией молекул
Чтобы что-то построить, нам надо выбрать молекулу, и что-то с ней сделать. Более интересными вариантами должны быть достаточно большие молекулы (чтобы имело смысл вообще заморачиваться со скриптами) и с достаточно извратными связями, например сопряжённые системы.
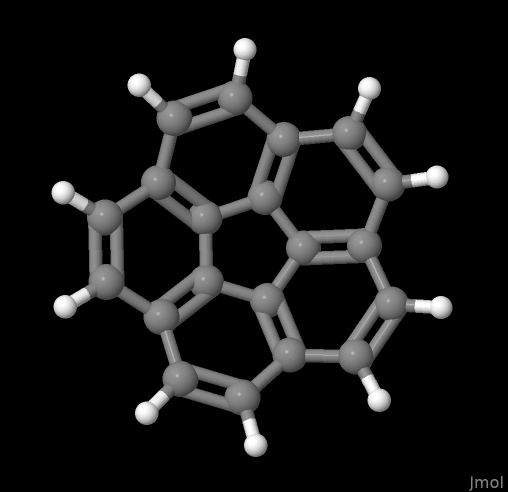
От этого всего, у меня в голове от этого всплыл класс молекул, называемых полициклические ароматические углеводороды (ПАУ). Что же означает это название?
-
«Полициклические» — значит они содержат в своей структуре несколько циклов, например, циклогексана, циклогексена, или бензола.
-
«Ароматические» означает, что хотя бы один из циклов должен быть сопряжённым так успешно, что образовалась бы ароматическая система, такая как в бензоле. Что такое ароматичность объяснить в двух словах очень сложно (несмотря на попытки школьного курса это сделать), и откровенно говоря, это определение ароматичности — это один из священных граалей современной химии. Почитать об этом поподробнее можно, например, в этой статье.
-
«Углеводороды» же — это самое простое. Это значит, что молекулы этого класса состоят из двух типов атомов: углерод (C) и водород (H).
Этот класс соединений очень важен как на Земле (ибо является одним из наиболее стрёмных загрязнителей воды и воздуха), так и под землёй (как один из заметных компонентов нефти), и даже давным-давно в одной далёкой-предалёкой галактике в космическом пространстве, где молекулы этого класса, по последним оценкам, ответственны за 10% всего запаса галактического углерода.
В качестве нашей пробной молекулы, выберем кораннулен (C20H10). Это очень красивая молекула, которая представляет собой пять бензольных колец, присоединённых, как лепестки цветка, к пятичленному циклу. Из-за стерического напряжения, эта молекула плоская, и напоминает чашечку. И в эту чашечку даже наливали воду (в количестве одной молекулы, см. картинку выше, выкусите, гомеопаты!).
Чтобы нам визуализировать молекулу, а после чего посчитать её электронную структуру, нам нужны координаты каждого атома. Для этого мы можем воспользоваться или программами-построителями молекулярных геометрий (например, Кемкрафтом, или Jmol-ом), или просто найти эти координаты в интернете. Неплохо можно разжиться на сайте NIST Chemistry Webbook. Почти для каждой молекулы в базе данных, там есть ссылка на скачивание «computed 3d SD file». Тыкая туда, мы скачаем файл в формате SDF. Файл по поиску «corannulene» дан тут:
файл 5821-51-2-3d.sdf
его скачали с NIST Chemistry Webbook
NIST 08021410203D 1 1.00000 -768.14928
Copyright by the U.S. Sec. Commerce on behalf of U.S.A. All rights reserved.
30 35 0 0 0 0 0 0 0 0999 V2000
2.3479 2.7598 -0.4735 C 0 0 0 0 0 0 0 0 0 0 0 0
2.3108 4.1732 -0.5616 C 0 0 0 0 0 0 0 0 0 0 0 0
3.6394 4.6362 -0.7268 C 0 0 0 0 0 0 0 0 0 0 0 0
4.4974 3.5091 -0.7410 C 0 0 0 0 0 0 0 0 0 0 0 0
3.6992 2.3494 -0.5843 C 0 0 0 0 0 0 0 0 0 0 0 0
1.3863 2.0195 0.1935 C 0 0 0 0 0 0 0 0 0 0 0 0
1.3101 4.9394 0.0122 C 0 0 0 0 0 0 0 0 0 0 0 0
4.1781 1.1717 -0.0353 C 0 0 0 0 0 0 0 0 0 0 0 0
5.8271 3.5678 -0.3589 C 0 0 0 0 0 0 0 0 0 0 0 0
4.0547 5.8962 -0.3297 C 0 0 0 0 0 0 0 0 0 0 0 0
0.2292 2.7852 0.6078 C 0 0 0 0 0 0 0 0 0 0 0 0
0.1931 4.1718 0.5217 C 0 0 0 0 0 0 0 0 0 0 0 0
1.6744 6.3236 0.2317 C 0 0 0 0 0 0 0 0 0 0 0 0
2.9776 6.7779 0.0694 C 0 0 0 0 0 0 0 0 0 0 0 0
5.4848 6.0167 -0.1373 C 0 0 0 0 0 0 0 0 0 0 0 0
6.3264 4.9110 -0.1513 C 0 0 0 0 0 0 0 0 0 0 0 0
1.8210 0.6936 0.5807 C 0 0 0 0 0 0 0 0 0 0 0 0
3.1467 0.2910 0.4720 C 0 0 0 0 0 0 0 0 0 0 0 0
5.6119 1.1509 0.1665 C 0 0 0 0 0 0 0 0 0 0 0 0
6.3949 2.2886 0.0128 C 0 0 0 0 0 0 0 0 0 0 0 0
-0.6061 2.2758 1.0834 H 0 0 0 0 0 0 0 0 0 0 0 0
-0.6692 4.6919 0.9333 H 0 0 0 0 0 0 0 0 0 0 0 0
0.9312 7.0163 0.6204 H 0 0 0 0 0 0 0 0 0 0 0 0
3.2019 7.8080 0.3376 H 0 0 0 0 0 0 0 0 0 0 0 0
5.9103 6.9859 0.1137 H 0 0 0 0 0 0 0 0 0 0 0 0
7.3769 5.0594 0.0892 H 0 0 0 0 0 0 0 0 0 0 0 0
1.1133 0.0161 1.0532 H 0 0 0 0 0 0 0 0 0 0 0 0
3.4230 -0.6854 0.8639 H 0 0 0 0 0 0 0 0 0 0 0 0
6.0864 0.2438 0.5345 H 0 0 0 0 0 0 0 0 0 0 0 0
7.4508 2.2264 0.2670 H 0 0 0 0 0 0 0 0 0 0 0 0
2 1 1 0
1 5 1 0
5 4 1 0
4 3 1 0
2 3 1 0
2 7 2 0
7 12 1 0
12 11 2 0
11 6 1 0
1 6 2 0
4 9 2 0
9 16 1 0
16 15 2 0
15 10 1 0
3 10 2 0
5 8 2 0
8 19 1 0
19 20 2 0
9 20 1 0
6 17 1 0
17 18 2 0
8 18 1 0
10 14 1 0
14 13 2 0
7 13 1 0
11 21 1 0
12 22 1 0
13 23 1 0
14 24 1 0
15 25 1 0
16 26 1 0
17 27 1 0
18 28 1 0
19 29 1 0
20 30 1 0
M END
> <COPYRIGHT>
Collection (C) 2016 copyright by the U.S. Secretary of Commerce on behalf of the United States of America. All rights reserved.
> <DATE>
2014-08-02
> <CAS.NUMBER>
5821-51-2
> <METHOD>
B3LYP/6-31G*
> <DIPOLE.MOMENT>
1.7256 debye
> <ELECTRONIC.ENERGY>
-768.149281981 hartree
> <IR.FREQUENCIES>
"Frequency (cm-1)" "Intensity (km/mol)"
140.9463 4.3688
142.1225 0.0234
142.4048 0.0012
282.0224 0.0000
282.2456 0.0000
311.8107 0.2249
312.3830 0.2255
409.5691 2.3881
409.7950 2.3915
438.7769 0.0000
438.8373 0.0000
452.9639 3.4550
453.1293 3.4725
542.0487 0.0001
547.5829 0.0002
547.6385 0.0000
559.9977 13.1405
605.0577 0.8047
612.4161 0.0001
612.5322 0.0000
648.1763 0.0001
648.4241 0.0001
649.6040 0.0000
673.0974 16.0743
673.1653 16.0396
759.3405 3.7537
759.4716 3.7365
772.4206 0.0000
772.7373 0.0000
812.4235 0.0001
812.6339 0.0000
833.7793 3.4835
833.8699 3.4724
856.2070 111.8882
869.7445 0.0162
869.8674 0.0150
937.3935 0.0000
953.5278 0.0002
960.1158 0.4483
960.1906 0.4495
968.6705 0.0001
968.8939 0.0004
1051.9088 1.2196
1091.4120 0.0000
1091.5541 0.0000
1171.6836 2.1672
1171.8624 3.5197
1171.9526 1.3649
1172.0671 1.7608
1197.1583 0.0000
1197.5385 0.0000
1224.1857 0.0001
1224.4120 0.0001
1244.7627 0.0000
1269.6389 1.0906
1342.9936 9.2123
1343.2742 9.1932
1391.6399 0.0001
1391.8987 0.0000
1440.8503 0.0001
1440.8972 0.0000
1458.5640 1.8664
1458.7683 1.8785
1480.2637 1.8568
1486.1287 2.7000
1486.1836 2.7010
1497.5004 0.0001
1497.7884 0.0001
1527.1617 0.0000
1668.3089 0.0041
1668.4748 0.0110
1669.7603 1.0670
1669.9892 1.0731
1671.5673 0.0030
3174.2046 0.3130
3174.9229 5.3562
3175.0279 5.6321
3175.6846 0.3267
3175.8603 0.0159
3191.4230 1.7604
3191.6544 0.1704
3192.6984 100.6297
3192.7960 102.6391
3194.2245 6.6723
> <ROTATIONAL.CONSTANTS>
0.50785 GHz
0.50779 GHz
0.26288 GHz
> <SOFTWARE>
Gaussian 09, Revision D.01
> <CONTRIBUTOR>
Ethan Ho
$$$$Там находятся координаты всех атомов молекулы, данные в ангстремах (1 Å = 10-10 м). Этот файл мы можем легко визуализировать любым молекулярным вьюером (хороший список есть в Википедии). Я это люблю делать в Jmol, упомянутом выше. Команда jmol 5821-51-2-3d.sdf & позволяет мне узреть сию красоту:
Всю эту молекулку можно теперь сохранять, покрутить и т.д. и т.п., сохранив в нужной конфигурации, используя кнопочкуmodel kit. Заметим, что тут у нас изображены порядки связей (одинарные и двойные черточки), что является результатом того, что они были в нашем изначальном SDF-файле.
После визуализации, выберем удобную для нас ориентацию, т.к. мы будем проецировать молекулу на плоскость xy (что мы и видим в Jmol). После чего вытащим руками геометрию молекулы в XYZ формате, и сохраним её в файл ini.xyz:
файл ini.xyz со структурой молекулы
30
C 1.69979 2.78101 -1.65228
C 1.35394 3.94963 -2.37448
C 2.55242 4.62236 -2.71788
C 3.63875 3.86951 -2.20816
C 3.11178 2.73154 -1.54944
C 0.85441 2.18448 -0.73191
C 0.14026 4.59911 -2.22325
C 3.77155 2.08239 -0.51937
C 4.86014 4.43362 -1.88024
C 2.61606 5.98885 -2.93335
C -0.48972 2.72307 -0.72415
C -0.82877 3.86975 -1.43236
C 0.14917 5.98162 -2.65393
C 1.32473 6.64151 -2.99106
C 3.94461 6.54944 -2.80136
C 5.01022 5.81082 -2.30138
C 1.52592 1.32553 0.22109
C 2.91115 1.27701 0.32197
C 5.13459 2.52641 -0.31466
C 5.65151 3.64279 -0.96086
H -1.24117 2.27461 -0.07791
H -1.83214 4.27256 -1.31201
H -0.77553 6.55407 -2.63124
H 1.27275 7.70397 -3.21872
H 4.10291 7.60441 -3.01443
H 5.95982 6.31750 -2.14339
H 0.93627 0.76426 0.94247
H 3.34968 0.67971 1.11834
H 5.75177 2.02999 0.43104
H 6.65244 3.97556 -0.69475 Этот файл мы всё также можем открывать Jmol-ом, или другим просмотрщиком молекул, но он нам понадобится для квантово-химических расчётов, т.е. для нахождения наиболее выгодной конфигурации электронов и их энергии.
Глава 3. В которой мы проводим квантово-химический расчёт
Итак, мы создали XYZ-файл ini.xyz, содержащий изначальные координаты молекулы. Теперь нам бы эту молекулу оптимизировать (т.е. найти оптимальное расположение всех атомов относительно друг друга, которое будет минимизировать энергию электронов, т.е. всех химических связей). Для этого мы можем воспользоваться программой XTB. Это не полновесная квантовая химия, а т.н. полуэмпирика, т.е. квантово-механический расчёт там происходит, но некоторые вещи хитренько запараметризованы. Подобные методы нужны в первую очередь для ускорения вычислений, что позволяет вычислять параметры гигантских систем в тысячи атомов.
После установки (по-сути прописывания пути к бинарнику) провести расчёт в XTB проще пареной репы:
-
Запускаем команду
xtb ini.xyz --ohess > output.log -
Ждём
-
Получаем результат
Заклинание «ohess» означет «optimization + hessian». Первое — это реально оптимизация энергии системы как функции координат атомов, а второе — это расчёт колебательных частот молекулы. Да, молекула колеблется, и чтобы узнать как это она делает, мы можем посчитать вторые производные (Гессиан) её энергии в точке минимума и в таком эффективном потенциале найти формы и частоты колебаний атомов. Полезная штука, которой мы не воспользуемся (но желающие могут их посмотреть в том же Jmol-е, открыв полученный файл g98.out).
Из кучи всяких файлов нас интересуют несколько. xtbopt.xyz — это там, где содержится оптимизированная геометрия молекулы, минимум на электронной поверхности потенциальной энергии. Этот файл мы переименуем в mol.xyz (вот он под спойлером).
файл mol.xyz
30
energy: -47.909984727343 gnorm: 0.000561323830 xtb: 6.4.1 (afa7bdf)
C 1.70342497008918 2.77120382029981 -1.67459989574751
C 1.35888198845737 3.93605651904526 -2.39411238929612
C 2.55320713127695 4.60662002508876 -2.73648638740711
C 3.63588083564752 3.85619478604766 -2.22858426799746
C 3.11068612200065 2.72184425174820 -1.57229992069963
C 0.86531732896573 2.19467015713543 -0.73988026274033
C 0.15592822786286 4.59298913710542 -2.22131034952792
C 3.76274802514278 2.09303373963485 -0.52926100615237
C 4.84408005491831 4.42856531897689 -1.88049627334238
C 2.61494436161795 5.97362661868611 -2.92622049178063
C -0.46023666409747 2.73788915472265 -0.72902661742635
C -0.79568990271412 3.87198196823774 -1.42956257287266
C 0.17248681723255 5.96311018441904 -2.63939045084267
C 1.33528769236052 6.61597608493287 -2.97271643766150
C 3.92951616360376 6.52499048543271 -2.78412401179422
C 4.98361507251879 5.79437063530864 -2.28963603342726
C 1.53562915869062 1.35451068920168 0.20727845907322
C 2.90574505520454 1.30644138413572 0.30686703629669
C 5.10743028420101 2.54260766563073 -0.32428692794655
C 5.61876291181198 3.64701225551270 -0.96325052396703
H -1.19874170458545 2.29409153379029 -0.07494466776196
H -1.78764656957806 4.28504174115813 -1.30476343298049
H -0.74868879805596 6.52904857077271 -2.60304052043814
H 1.29265341328483 7.67518070709473 -3.18821270199824
H 4.07652658282649 7.57755348473410 -2.98578625864465
H 5.92703793057654 6.29492483888218 -2.11767956737328
H 0.94303089560637 0.80961584278484 0.92983205611095
H 3.34832686183346 0.72523869909287 1.10467238401189
H 5.71098816523577 2.05170297389314 0.42731147860243
H 6.60865448964361 3.99053882857075 -0.69441367658131То, куда мы редиректнули всю выдачу (output.log) — это собственно лог программы, там много всякой полезной и бесполезной (нам) инфы. Например, там есть энергии орбиталей, частоты колебаний, термодинамические параметры молекулы и т.д. Но что мы хотим — это порядки связей, вытащенные из электронной плотности. XTB вычисляет т.н. порядки связей Уибера (Wiber bond orders, WBO), которые были введены в работе 1966-го года. Ищем в логе последний кусок такого вида:
Wiberg/Mayer (AO) data.
largest (>0.10) Wiberg bond orders for each atom
---------------------------------------------------------------------------
# Z sym total # sym WBO # sym WBO # sym WBO
---------------------------------------------------------------------------
1 6 C 3.984 -- 6 C 1.345 2 C 1.192 5 C 1.192
2 6 C 3.984 -- 7 C 1.345 3 C 1.192 1 C 1.192
3 6 C 3.984 -- 10 C 1.345 2 C 1.192 4 C 1.192
4 6 C 3.984 -- 9 C 1.345 5 C 1.192 3 C 1.192
5 6 C 3.984 -- 8 C 1.345 4 C 1.192 1 C 1.192
6 6 C 3.986 -- 1 C 1.345 17 C 1.220 11 C 1.220
7 6 C 3.986 -- 2 C 1.345 13 C 1.220 12 C 1.220
8 6 C 3.986 -- 5 C 1.345 19 C 1.220 18 C 1.220
9 6 C 3.986 -- 4 C 1.345 20 C 1.220 16 C 1.220
10 6 C 3.986 -- 3 C 1.345 14 C 1.220 15 C 1.220
11 6 C 3.980 -- 12 C 1.624 6 C 1.220 21 H 0.969
12 6 C 3.980 -- 11 C 1.624 7 C 1.220 22 H 0.969
13 6 C 3.980 -- 14 C 1.623 7 C 1.220 23 H 0.969
14 6 C 3.980 -- 13 C 1.623 10 C 1.220 24 H 0.969
15 6 C 3.980 -- 16 C 1.624 10 C 1.220 25 H 0.969
16 6 C 3.980 -- 15 C 1.624 9 C 1.220 26 H 0.969
17 6 C 3.980 -- 18 C 1.624 6 C 1.220 27 H 0.969
18 6 C 3.980 -- 17 C 1.624 8 C 1.220 28 H 0.969
19 6 C 3.980 -- 20 C 1.623 8 C 1.220 29 H 0.969
20 6 C 3.980 -- 19 C 1.623 9 C 1.220 30 H 0.969
21 1 H 0.998 -- 11 C 0.969
22 1 H 0.998 -- 12 C 0.969
23 1 H 0.998 -- 13 C 0.969
24 1 H 0.998 -- 14 C 0.969
25 1 H 0.998 -- 15 C 0.969
26 1 H 0.998 -- 16 C 0.969
27 1 H 0.998 -- 17 C 0.969
28 1 H 0.998 -- 18 C 0.969
29 1 H 0.998 -- 19 C 0.969
30 1 H 0.998 -- 20 C 0.969
---------------------------------------------------------------------------Собственно, столбцы WBO нам и нужны! Вырезаем их вместе с парами атомов (столбцы #) в отдельный файл «bonds.dat» в формате «<номер первого атома> <номер второго атома> <WBO этой пары атомов>«:
файл bonds.dat
1 6 1.345
2 7 1.345
3 10 1.345
4 9 1.345
5 8 1.345
6 1 1.345
7 2 1.345
8 5 1.345
9 4 1.345
10 3 1.345
11 12 1.624
12 11 1.624
13 14 1.624
14 13 1.624
15 16 1.624
16 15 1.624
17 18 1.624
18 17 1.624
19 20 1.624
20 19 1.624
21 11 0.969
22 12 0.969
23 13 0.969
24 14 0.969
25 15 0.969
26 16 0.969
27 17 0.969
28 18 0.969
29 19 0.969
30 20 0.969
1 5 1.192
2 3 1.192
3 4 1.192
4 3 1.192
5 1 1.192
6 17 1.220
7 12 1.220
8 18 1.220
9 16 1.220
10 15 1.220
11 6 1.220
12 7 1.220
13 7 1.220
14 10 1.220
15 10 1.220
16 9 1.220
17 6 1.220
18 8 1.220
19 8 1.220
20 9 1.220
1 2 1.192
2 1 1.192
3 2 1.192
4 5 1.192
5 4 1.192
6 11 1.220
7 13 1.220
8 19 1.220
9 20 1.220
10 14 1.220
11 21 0.969
12 22 0.969
13 23 0.969
14 24 0.969
15 25 0.969
16 26 0.969
17 27 0.969
18 28 0.969
19 29 0.969
20 30 0.969
И после всей этой подготовке можно приступать к построению картинки.
Глава 4. В которой мы генерируем TikZ-картинку
Собственно, имея файлы «mol.xyz» и «bonds.dat«, мы запускаем скрипт make_tikz_picture_bond_orders.py из-под спойлера, и получаем наш код.
скрипт make_tikz_picture_bond_orders.py
#! /usr/bin/python
import numpy as np
# сначала прочитаем файл с молекулярной геометрией
inpf = open("mol.xyz", "r") # открываем файл 'mol.xyz' в "read" режиме
count=0 # это просто счётчик строк
xyz = [] # здесь мы будем хранить x,y,z, координаты атомов
atn = [] # а здесь тип атома
for line in inpf: # идём по каждой строке файла
count+=1 # не забывая повышать счётчик
# первые 2 строки xyz-файла -- это число атомов и строка с описанием,
# их мы пропускам, т.к. координаты начинаются с 3й строки
if count>2:
words = line.split() # делим строку на слова
if len(words)>=4: # не обязательно, но вдруг что-то не так с файлом
# первое слово в строке -- тип атома,
# переводим его заодно в строчечные буквы, чтобы
# избежать разночтений
atn.append(words[0].lower())
# ну а потом остальные слова (координаты в ангстремах)
# сохраняем в лист, переводя их floats
xyz.append([float(word) for word in words[1:4]])
inpf.close() # ну и закрываем файл
# теперь читаем файл со связями и их порядками
inpf = open("bonds.dat", "r") # открываем файл 'bonds.dat' в "read" режиме
BondInd = [] # здесь мы будем хранить индексы атомов, между которыми есть связь
BondOrd = [] # а здесь численное значение для связи (предположительно, порядок связи)
for line in inpf: # идём по каждой строке файла
words = line.split() # делим строку на слова
if len(words)>=3: # не обязательно, но вдруг что-то не так с файлом
# индексы переводим в numpy.array, конвертируя str в int
# и убирая лишнюю единицу, т.к. в программах файлы нумеруют с 1,
# а у нас здесь индексы идут с 0
BondInd.append(np.array(words[:2], dtype=int)-1)
# а численное значение сохраняем отдельно, конвертируя str во float
BondOrd.append(float(words[2]))
inpf.close() # ну и закрываем файл
# открываем файл, куда будем всё писать, назовём его 'fig.tex'
outf = open("fig.tex", "w")
# это функция для строки, которая рисует связь в TikZ
# берёт два индекса, номера атомов из BondInd[n], i и j,
# а также значение порядка связи (bond order = bo).
def DrawBond(i,j,bo):
res = 'draw [ultra thick] '
res += ' (%7.4f,%7.4f) -- ' % (xyz[i][0],xyz[i][1]) # начало вектора
res += ' (%7.4f,%7.4f) ' % (xyz[j][0],xyz[j][1]) # конец вектора
res += ' node [pos=0.5,below] {%7.1f};' % (bo) # и подпись
return res
# Эти штуки мы считаем, чтобы получить перспективу
# берём среднее значение координаты z, чтобы
# получить референсное значение для перспективы
AvZ = np.mean([r[2] for r in xyz])
# и считаем амплитуду для координаты Z
ZAmp = np.abs(max([r[2] for r in xyz]) - min([r[2] for r in xyz]))
# молекула может быть плоской и вся лежать в плоскости XY,
# поэтому если изменение координаты Z слишком мало, то делить на околонулевое
# значение, наверное, не стоит. Поэтому ставим такой нижний порог на амплитуду,
# в 0.5 ангстрем
ZAmp = max(0.5,ZAmp)
# а это функция для рисования атома в виде шарика,
# нам нужен только индекс атома, i
def DrawAtom(i):
res = 'draw'
if atn[i] == 'c': # это мы рисуем углерод
Rad = 0.7 # ковалентный радиус углерода, в ангстремах
res += '[atomC] '
elif atn[i] == 'h': # это мы рисуем углерод
Rad = 0.25 # ковалентный радиус водорода, в ангстремах
res += '[atomH] '
else: # а это для не заданных атомов, какие-то рандомные настройки
Rad = 0.5
res += '[atomX3] '
# позиция атома -- это проекция на плоскось xy
x = xyz[i][0] # x-координата
y = xyz[i][1] # y-координата
# а это радиус атома на картинке, который зависит от перспективы
r = Rad * 0.3 * (1.0 + 0.9 * (xyz[i][2] - AvZ)/ZAmp)
res += '(%7.4f,%7.4f) circle (%.3f);' % (x,y, r)
return res
# собственно, это 'шапка' LaTeX-овского документа
# с настройками TikZ
# здесь мы задаём параметры для атомов C и H, но их можно и
# надобавлять других
HeadFile=r"""documentclass{article}
usepackage[utf8]{inputenc}
usepackage{tikz}
usepackage{xcolor}
usepackage{color}
begin{document}
begin{center}
begin{tikzpicture}[
>=stealth,
atomC/.style={shade, ball color=gray!50!black},
atomH/.style={shade, ball color=white!50!gray},
atomX3/.style={shade, ball color=orange!50!white},
scale=1.
]
"""
# а это низ LaTeX-овского документа
TailFile='''
end{tikzpicture}
end{center}
end{document}
'''
# теперь начинаем запись LaTeX-овского документа
outf.write(HeadFile) # начинаем с шапки
# потом идём по всем связям
for n,bo in enumerate(BondOrd):
# при помощи функции DrawBond получаем
# TikZ команду для рисования связи
line = DrawBond(BondInd[n][0],BondInd[n][1],bo)
outf.write(line+"n")
# а теперь рисуем поверх шарики атомов
for n in range(0,len(atn)):
line = DrawAtom(n)
outf.write(line+"n")
# не забываем низ файла.
outf.write(TailFile)
outf.close() # и закрыть файл
Этот монстр создаст файл fig.tex из файлов mol.xyz и bonds.dat.
Содержимое этого кода тупо, банально и плохо написано, но всё же прокомментируем что он делает.
-
Сначала он читает геометрию молекулы и связи в этой молекулы, заданные в наших файлах
mol.xyzиbonds.dat. Складируем это всё в несколько списков. -
Выкатывем шапку LaTeX-овского документа в файл
fig.tex, которые и является нашим искомым результатом. -
Начинаем генерировать команды построения связей, каркас молекулы. Для этого у нас есть команды TikZ вида
draw [ultra thick] (x1,y1) -- (x2,y2) node [pos=0.5,below] {WBO};Эта команда рисует линию от точки(x1,y1)к точке(x2,y2), а ещё посередине линии (pos=0.5— это позиция на половине, снизу) выдаст надписьWBO. В принципе, этого достаточно уже для наших целей, но в целях дополнительного украшательства есть следующий шаг. -
Сверху позиций атомов нарисуем шарики, да не просто так, а с перспективой. Для этого нам нужна команда вида
draw[atomType] (x,y) circle (r);atomType— это стиль шарика, который мы пре-задали в шапке LaTeX-овского документа, поскольку у нас только углерод и водород, их только мы и определили.(x,y)— это позиция центра шара (проекция молекулы на плоскость xy). Ну аr— это радиус шара, с помощью которого мы создаём перспективу, отображая осьzна рисунке. То, как мы вычисляем этот радиус поговорим ниже. -
Ну и в конце добавляем «хвост» LaTeX-овского документа, чтобы он у нас вообще скомпилировался.
В результате мы получаем LaTeX-овский код в файле fig.tex с картинкой, генерируемой пакетом TikZ.
полученный LaTeX-овский код
documentclass{article}
usepackage[utf8]{inputenc}
usepackage{tikz}
usepackage{xcolor}
usepackage{color}
begin{document}
begin{center}
begin{tikzpicture}[
>=stealth,
atomC/.style={shade, ball color=gray!50!black},
atomH/.style={shade, ball color=white!50!gray},
atomX3/.style={shade, ball color=orange!50!white},
scale=1.
]
draw [ultra thick] ( 1.7034, 2.7712) -- ( 0.8653, 2.1947) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 1.3589, 3.9361) -- ( 0.1559, 4.5930) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 2.5532, 4.6066) -- ( 2.6149, 5.9736) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 3.6359, 3.8562) -- ( 4.8441, 4.4286) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 3.1107, 2.7218) -- ( 3.7627, 2.0930) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 0.8653, 2.1947) -- ( 1.7034, 2.7712) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 0.1559, 4.5930) -- ( 1.3589, 3.9361) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 3.7627, 2.0930) -- ( 3.1107, 2.7218) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 4.8441, 4.4286) -- ( 3.6359, 3.8562) node [pos=0.5,below] { 1.3};
draw [ultra thick] ( 2.6149, 5.9736) -- ( 2.5532, 4.6066) node [pos=0.5,below] { 1.3};
draw [ultra thick] (-0.4602, 2.7379) -- (-0.7957, 3.8720) node [pos=0.5,below] { 1.6};
draw [ultra thick] (-0.7957, 3.8720) -- (-0.4602, 2.7379) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 0.1725, 5.9631) -- ( 1.3353, 6.6160) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 1.3353, 6.6160) -- ( 0.1725, 5.9631) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 3.9295, 6.5250) -- ( 4.9836, 5.7944) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 4.9836, 5.7944) -- ( 3.9295, 6.5250) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 1.5356, 1.3545) -- ( 2.9057, 1.3064) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 2.9057, 1.3064) -- ( 1.5356, 1.3545) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 5.1074, 2.5426) -- ( 5.6188, 3.6470) node [pos=0.5,below] { 1.6};
draw [ultra thick] ( 5.6188, 3.6470) -- ( 5.1074, 2.5426) node [pos=0.5,below] { 1.6};
draw [ultra thick] (-1.1987, 2.2941) -- (-0.4602, 2.7379) node [pos=0.5,below] { 1.0};
draw [ultra thick] (-1.7876, 4.2850) -- (-0.7957, 3.8720) node [pos=0.5,below] { 1.0};
draw [ultra thick] (-0.7487, 6.5290) -- ( 0.1725, 5.9631) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 1.2927, 7.6752) -- ( 1.3353, 6.6160) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 4.0765, 7.5776) -- ( 3.9295, 6.5250) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 5.9270, 6.2949) -- ( 4.9836, 5.7944) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 0.9430, 0.8096) -- ( 1.5356, 1.3545) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 3.3483, 0.7252) -- ( 2.9057, 1.3064) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 5.7110, 2.0517) -- ( 5.1074, 2.5426) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 6.6087, 3.9905) -- ( 5.6188, 3.6470) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 1.7034, 2.7712) -- ( 3.1107, 2.7218) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 1.3589, 3.9361) -- ( 2.5532, 4.6066) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 2.5532, 4.6066) -- ( 3.6359, 3.8562) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.6359, 3.8562) -- ( 2.5532, 4.6066) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.1107, 2.7218) -- ( 1.7034, 2.7712) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 0.8653, 2.1947) -- ( 1.5356, 1.3545) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 0.1559, 4.5930) -- (-0.7957, 3.8720) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.7627, 2.0930) -- ( 2.9057, 1.3064) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 4.8441, 4.4286) -- ( 4.9836, 5.7944) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 2.6149, 5.9736) -- ( 3.9295, 6.5250) node [pos=0.5,below] { 1.2};
draw [ultra thick] (-0.4602, 2.7379) -- ( 0.8653, 2.1947) node [pos=0.5,below] { 1.2};
draw [ultra thick] (-0.7957, 3.8720) -- ( 0.1559, 4.5930) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 0.1725, 5.9631) -- ( 0.1559, 4.5930) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 1.3353, 6.6160) -- ( 2.6149, 5.9736) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.9295, 6.5250) -- ( 2.6149, 5.9736) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 4.9836, 5.7944) -- ( 4.8441, 4.4286) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 1.5356, 1.3545) -- ( 0.8653, 2.1947) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 2.9057, 1.3064) -- ( 3.7627, 2.0930) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 5.1074, 2.5426) -- ( 3.7627, 2.0930) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 5.6188, 3.6470) -- ( 4.8441, 4.4286) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 1.7034, 2.7712) -- ( 1.3589, 3.9361) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 1.3589, 3.9361) -- ( 1.7034, 2.7712) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 2.5532, 4.6066) -- ( 1.3589, 3.9361) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.6359, 3.8562) -- ( 3.1107, 2.7218) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.1107, 2.7218) -- ( 3.6359, 3.8562) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 0.8653, 2.1947) -- (-0.4602, 2.7379) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 0.1559, 4.5930) -- ( 0.1725, 5.9631) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 3.7627, 2.0930) -- ( 5.1074, 2.5426) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 4.8441, 4.4286) -- ( 5.6188, 3.6470) node [pos=0.5,below] { 1.2};
draw [ultra thick] ( 2.6149, 5.9736) -- ( 1.3353, 6.6160) node [pos=0.5,below] { 1.2};
draw [ultra thick] (-0.4602, 2.7379) -- (-1.1987, 2.2941) node [pos=0.5,below] { 1.0};
draw [ultra thick] (-0.7957, 3.8720) -- (-1.7876, 4.2850) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 0.1725, 5.9631) -- (-0.7487, 6.5290) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 1.3353, 6.6160) -- ( 1.2927, 7.6752) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 3.9295, 6.5250) -- ( 4.0765, 7.5776) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 4.9836, 5.7944) -- ( 5.9270, 6.2949) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 1.5356, 1.3545) -- ( 0.9430, 0.8096) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 2.9057, 1.3064) -- ( 3.3483, 0.7252) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 5.1074, 2.5426) -- ( 5.7110, 2.0517) node [pos=0.5,below] { 1.0};
draw [ultra thick] ( 5.6188, 3.6470) -- ( 6.6087, 3.9905) node [pos=0.5,below] { 1.0};
draw[atomC] ( 1.7034, 2.7712) circle (0.199);
draw[atomC] ( 1.3589, 3.9361) circle (0.168);
draw[atomC] ( 2.5532, 4.6066) circle (0.153);
draw[atomC] ( 3.6359, 3.8562) circle (0.175);
draw[atomC] ( 3.1107, 2.7218) circle (0.204);
draw[atomC] ( 0.8653, 2.1947) circle (0.241);
draw[atomC] ( 0.1559, 4.5930) circle (0.175);
draw[atomC] ( 3.7627, 2.0930) circle (0.250);
draw[atomC] ( 4.8441, 4.4286) circle (0.190);
draw[atomC] ( 2.6149, 5.9736) circle (0.144);
draw[atomC] (-0.4602, 2.7379) circle (0.241);
draw[atomC] (-0.7957, 3.8720) circle (0.210);
draw[atomC] ( 0.1725, 5.9631) circle (0.157);
draw[atomC] ( 1.3353, 6.6160) circle (0.142);
draw[atomC] ( 3.9295, 6.5250) circle (0.151);
draw[atomC] ( 4.9836, 5.7944) circle (0.172);
draw[atomC] ( 1.5356, 1.3545) circle (0.282);
draw[atomC] ( 2.9057, 1.3064) circle (0.287);
draw[atomC] ( 5.1074, 2.5426) circle (0.259);
draw[atomC] ( 5.6188, 3.6470) circle (0.231);
draw[atomH] (-1.1987, 2.2941) circle (0.096);
draw[atomH] (-1.7876, 4.2850) circle (0.077);
draw[atomH] (-0.7487, 6.5290) circle (0.057);
draw[atomH] ( 1.2927, 7.6752) circle (0.047);
draw[atomH] ( 4.0765, 7.5776) circle (0.051);
draw[atomH] ( 5.9270, 6.2949) circle (0.064);
draw[atomH] ( 0.9430, 0.8096) circle (0.112);
draw[atomH] ( 3.3483, 0.7252) circle (0.115);
draw[atomH] ( 5.7110, 2.0517) circle (0.104);
draw[atomH] ( 6.6087, 3.9905) circle (0.087);
end{tikzpicture}
end{center}
end{document}
Теперь пару слов о перспективе. Радиусы атомов (r) вычисляются из z-координат атомов по формуле
Параметр R0 — это изначальный радиус атома, в качестве него я выбрал ковалентные радиусы углерода (0.7 Å) и водорода (0.25 Å). 0.3 и 0.9 — просто подгоночные параметры, A — это разность между максимальным и минимальным значением координат z всех атомов, а ⟨z⟩ — это среднее значение всех координат атомов, оно нужно чтобы в зависимости от расположения молекулы вдоль оси z у нас не уменьшались/увеличивались все размеры шариков. Естественно, молекула может оказаться плоской, и мы можем расположить её всю в плоскости xy, тогда параметр A окажется равным нулю, поэтому чтобы избежать деления на 0, мы задаём минимально возможное значение этого параметра, равное 0.5 Å.
Полученную последовательность команд мы можем обернуть в простейший Bash-евский скрипт.
#! /bin/bash
python3 make_tikz_picture_bond_orders.py
pdflatex fig.tex
evince fig.pdf &А вот и получившаяся картинка. В принципе, её можно редактировать как угодно: можно подправить TikZ-овский код, а можно её открыть в каком-нибудь Inkscape и допилить руками. Такое может быть даже проще и веселее.
Глава 5. Заключительная.
Конечно, полученный результат всё ещё самопальный отстой, но его можно допилить до ума средствами как самих Python-а/TikZ, так и постфактум, открыв pdf-ку в том же Inkscape. Но суть не в этом, главное, что из говна и палок всегда можно соорудить что-нибудь 
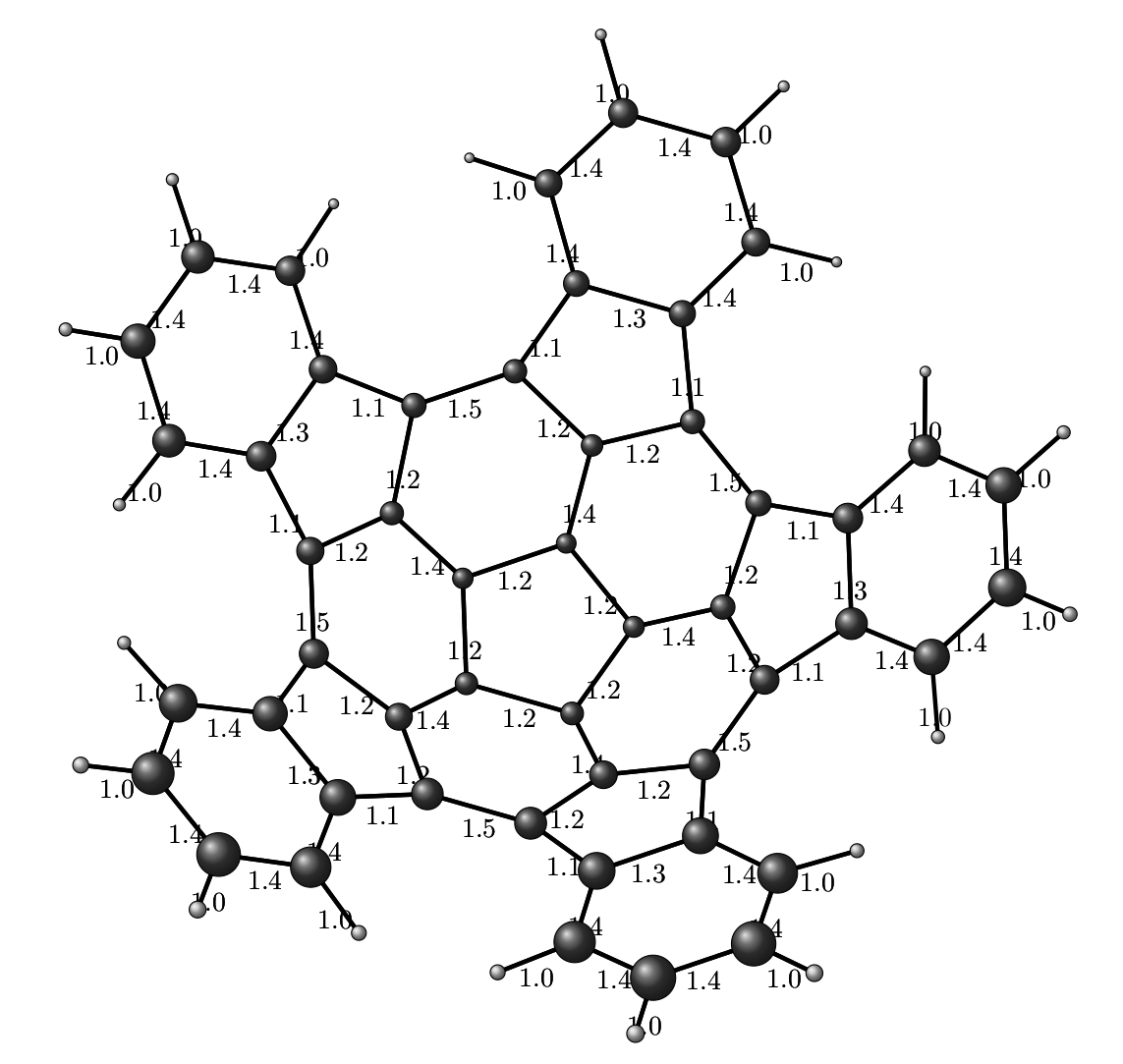
Ну и естественно, это всё мы можем применить и для куда больших монстров, например, молекул из этой вот статьи, типа C50H20.
mol.xyz
70
energy: -117.275352008181 gnorm: 0.000390187477 xtb: 6.3.3 (5b13467)
C -2.68077703943328 -2.91238079355590 0.68845892053073
C 0.27128316214264 0.37286677181363 -2.74314008247056
C 0.60507213164374 1.63822103018138 -2.32805604984469
C 1.14470546196813 -0.70663678298366 -2.43469769398305
C -1.06581084645995 -0.07976153594376 -2.56809812472648
C 1.77225930946232 3.34194992574212 -1.35390644484119
C -1.98283643251999 0.76217241732452 -1.98927003080863
C -1.01875800399212 -1.43900401441490 -2.15147212967076
C -3.55692461220946 -1.82950667221932 0.37905630355287
C -1.89176373398147 -1.86860332754445 -1.18289723879776
C 0.34741614781742 -1.82643527040481 -2.06902919428710
C -3.67216311210816 1.49892949580444 -0.64117931120830
C 0.75242813633749 -2.61847110182269 -1.02333569383271
C 2.29555737015994 -0.45112940559788 -1.73107322169934
C -2.87238808071641 2.62222207085053 -1.00799627676733
C 0.66463461520378 -3.86112902965567 0.89031958102536
C -0.18920704342200 -3.24531710310039 -0.12895583438488
C 2.05676673592769 -2.48502136815445 -0.42298550587013
C 3.95825068512170 -0.66497090027774 -0.18068279856657
C -1.69755571565036 2.15512408221106 -1.74879321174699
C -3.03679366568025 0.27415234921752 -1.13455439255542
C 2.00590199441865 -3.40709107355358 0.71472798937060
C -2.99082756412136 -1.05357171075259 -0.72758318373668
C -1.52370227486734 -2.86686273094032 -0.20948195675439
C -0.39146450717046 2.59725613007549 -1.91977290964893
C 3.91104920579450 0.69851566956800 -0.59860294748331
C 1.90335653160282 1.94647130553701 -1.78127674351813
C 0.40182204522241 3.73059083372130 -1.43661584908383
C 2.83556608650419 -1.39118412041965 -0.78017032846857
C 2.75652657231956 0.89199780089277 -1.47998501347163
H 0.71897816971423 6.94953967009544 -0.48148528448535
C 4.99431155891219 -1.09605306896690 0.62471035753650
C 2.72105457751250 4.26653693910675 -0.96296095556863
C 2.69348079643417 -4.80311075070405 2.53786543979124
C 0.04038665207252 5.02674475351316 -1.12474813797369
C 3.00350369902655 -3.89222211250683 1.53774104921398
H -4.82042850461680 5.07437609405038 0.24363138915910
H -4.49373585157531 -4.36091811325598 3.13578717982119
C 0.37989353033973 -4.78035006216538 1.88121158570339
C -3.03143028976537 -3.81288232917844 1.67539943210881
H 5.07666322596571 -2.12973220473117 0.91419866700697
H 1.16610201764482 -5.96608912900056 3.47724162265726
C 1.39404265134009 -5.24298807813292 2.70798189193439
C -4.22237245502503 -3.65015380568231 2.36912651549759
C -4.74523454500569 -1.69470802282653 1.07018658671297
H -6.00451448165837 -2.49367353365328 2.60227071341764
C -4.86275930627008 1.69930182583409 0.02982253863623
H -0.61535214349515 -5.17261507331524 2.00242406849407
C -3.29834565540937 3.89653803853535 -0.68769832762239
C 4.90198296445000 1.57101884068675 -0.19276970635118
H -2.73557885272309 4.76143849008124 -0.99481217498725
C -4.48985271871798 4.07512095504141 0.00114134487655
H 6.70052705225601 1.80716708714242 0.93899270887624
H 3.08207991140213 6.27938902195787 -0.33886179434377
C 1.00704259699109 5.93589682978381 -0.71842348790248
H -0.97982786218491 5.35578076402524 -1.22462642034273
C -5.26468521546126 2.98685996970108 0.35651988760019
H -5.50538400831336 0.87121774308353 0.27556339882176
H 4.02976647919106 -3.60017823056423 1.39430701088472
H 3.47890531662068 -5.18317486268750 3.17445966634839
H 3.76631271635534 4.00982807793270 -0.93818051057439
C 2.33474085104098 5.55937632045060 -0.63829226138629
H -5.44356464835715 -0.91358199001587 0.82268906061483
C -5.07119650320345 -2.60105093221218 2.06937269377368
H -6.19951205810888 3.13743613055288 0.87615264205200
H 6.78191855437962 -0.54394998060052 1.65962919313397
C 5.92542821547799 1.12146646469345 0.62975329785856
H 4.91319519878343 2.59233680788850 -0.53315466435521
H -2.40926221725034 -4.66382359262515 1.89422285207033
C 5.97115702191632 -0.19949789292965 1.03464030503872bonds.dat
1 40 1.425
2 3 1.377
3 2 1.377
4 14 1.377
5 7 1.377
6 33 1.425
7 5 1.377
8 10 1.377
9 45 1.425
10 8 1.377
11 13 1.377
12 47 1.425
13 11 1.377
14 4 1.377
15 49 1.425
16 39 1.425
17 24 1.471
18 29 1.471
19 32 1.425
20 25 1.471
21 23 1.471
22 36 1.425
23 21 1.471
24 17 1.471
25 20 1.471
26 50 1.425
27 30 1.471
28 35 1.425
29 18 1.471
30 27 1.471
31 55 0.971
32 19 1.425
33 6 1.425
34 43 1.446
35 28 1.425
36 22 1.425
37 52 0.971
38 44 0.971
39 16 1.425
40 1 1.425
41 32 0.955
42 43 0.971
43 34 1.446
44 64 1.446
45 9 1.425
46 64 0.971
47 12 1.425
48 39 0.955
49 15 1.425
50 26 1.425
51 49 0.955
52 57 1.446
53 67 0.971
54 62 0.971
55 62 1.446
56 35 0.955
57 52 1.446
58 47 0.955
59 36 0.955
60 34 0.971
61 33 0.955
62 55 1.446
63 45 0.955
64 44 1.446
65 57 0.971
66 70 0.971
67 70 1.446
68 50 0.955
69 40 0.955
70 67 1.446
1 9 1.268
2 4 1.162
3 27 1.167
4 2 1.162
5 8 1.162
6 28 1.268
7 21 1.167
8 5 1.162
9 1 1.268
10 24 1.167
11 8 1.162
12 15 1.268
13 17 1.167
14 30 1.167
15 12 1.268
16 22 1.268
17 13 1.167
18 13 1.167
19 26 1.268
20 7 1.167
21 7 1.167
22 16 1.268
23 10 1.167
24 10 1.167
25 3 1.167
26 19 1.268
27 3 1.167
28 6 1.268
29 14 1.167
30 14 1.167
32 70 1.415
33 62 1.415
34 36 1.415
35 55 1.415
36 34 1.415
39 43 1.415
40 44 1.415
43 39 1.415
44 40 1.415
45 64 1.415
47 57 1.415
49 52 1.415
50 67 1.415
52 49 1.415
55 35 1.415
57 47 1.415
62 33 1.415
64 45 1.415
67 50 1.415
70 32 1.415
1 24 1.081
2 5 1.162
3 25 1.167
4 11 1.162
5 2 1.162
6 27 1.081
7 20 1.167
8 11 1.162
9 23 1.081
10 23 1.167
11 4 1.162
12 21 1.081
13 18 1.167
14 29 1.167
15 20 1.081
16 17 1.081
17 16 1.081
18 22 1.081
19 29 1.081
20 15 1.081
21 12 1.081
22 18 1.081
23 9 1.081
24 1 1.081
25 28 1.081
26 30 1.081
27 6 1.081
28 25 1.081
29 19 1.081
30 26 1.081
33 61 0.955
34 60 0.971
35 56 0.955
36 59 0.955
39 48 0.955
40 69 0.955
43 42 0.971
44 38 0.971
45 63 0.955
47 58 0.955
49 51 0.955
50 68 0.955
52 37 0.971
55 31 0.971
57 65 0.971
62 54 0.971
64 46 0.971
67 53 0.971
70 66 0.971Конструирование моделей молекул на уроках химии.
Современный этап развития российского образования можно считать уникальным. Сегодня рядом с простыми классными досками появились интерактивные, и учителю не приходится рисовать на доске модели молекул, структурные формулы, чтобы ученик смог представить, как они выглядят в пространстве.
С рождения ребенок знакомится с игрушками, которые помогают ему ориентироваться в пространстве, представлять окружающие предметы — это модели животных, домов, зданий. Затем он учится сам строить из кубиков, конструкторов эти предметы. Помогают ему в этом сначала родители, потом воспитатель в детском саду. Вот ребенок пошел в школу. В начальной и средней школе ученик под руководством учителя конструирует более сложные предметы. В этом ему помогают уроки технологии, рисования, черчения. Предмет химии — один из последних предметов, вводимых в курс школьной программы, когда у учащихся уже сформировано начальное представление об окружающем мире. Химия только продолжает развивать интеллект учащегося, его логическое, образное мышления. Именно на этом предмете продолжается развитие пространственного мышления.
Если учитель говорит просто о непонятном, ученику скучно, и смысл урока утрачивается. И вот здесь на помощь приходит моделирование молекул. Модель — это искусственный предмет (явление), копирующий реальный предмет (явление). С помощью пространственных материальных моделей можно приблизить школьника к пониманию того, как устроен невидимый микромир. Материальные модели ученик может взять в руки, собрать и разобрать, тем самым подкрепив абстрактные химические формулы наглядными.
Моделирование и конструирование как методика обучения давно используется в школе, применяются различные учебные модели молекул. Большинство детей даже старшего школьного возраста длительное время остаются, как говорят психологи, кинестетиками. Поэтому им особенно полезна и важна такая форма деятельности как конструирование. Еще недавно на уроках мы строили модели молекул из разноцветных шариков — «атомов», которые соединяются друг с другом с помощью стержней, образуя «молекулы». Это так называемые шаростержневые модели. Но сегодня для развития пространственного мышления на уроках химии учителя все чаще используют информационные технологии. При этом современные информационные технологии сами становятся инструментом познания, обучения, выполняя такие функции, как обобщающую, исследовательскую, развивающую, воспитывающую и контрольно-корректирующую. На смену простым наглядным пособиям приходят анимации, подвижные схемы, появляющиеся и исчезающие иллюстрации, что помогает заглянуть в невидимый химический мир, невозможный для рассмотрения в реальных условиях; виртуальное преобразование предметов в пространстве и плоскости.
Виртуальное практическое действие, плоскостное и пространственное моделирование объектов, автоматизация отдельных операций можно найти в электронных образовательных ресурсах при выполнении лабораторных работ на конструирование молекул с помощью программы OMS — клиента (эти модули я нахожу в Федеральном центре информационно-образовательных ресурсов). Работа с этими модулями позволяет учащимся не только рассматривать и вращать модели молекул в 3D плоскости, но и дает возможность построения и проектирования молекул, что позволяет на уровне понимания закрепить закономерности построения молекул и их пространственного строения.
Конструирование, проводимое в этом режиме, позволяет школьнику избегать трудностей при восприятии строения органических молекул, разобраться в таких вопросах, как изомерия и номенклатура. Например, вещество, записанное следующим образом: учащиеся ошибочно называют 1-метилэтан, хотя под углом 900 находится продолжение молекулы, а не метильный радикал. Вращение молекулы позволяет «увидеть» молекулу и дать правильное название.
На основе электронного издания для 8-11 классов, разработанного в лаборатории систем мультимедиа МарГТУ, мной была разработана программа элективного курса «Виртуальная лаборатория» для учащихся 10 класса. Данный курс, являясь интеграционным, развивает содержание базовых курсов «Химия» и «Информатика», удовлетворяет познавательные потребности учащихся, развивает многие универсальные учебные действия. Электронное издание включает: виртуальную лабораторию, конструктор молекул, тренажер для решения химических задач, тесты, таблицы, хрестоматию, видеофрагменты, коллекцию иллюстраций. «Конструктор молекул» предназначен для построения трехмерных моделей органических и неорганических молекул. Особый интерес вызывают у ребят творческие задания, носящие исследовательский характер, таких, как самостоятельную разработку моделей молекул соединений, обладающих заданными свойствами, или, наоборот, прогнозирование свойств соединения, модель молекулы которого создана самим учеником.
Залог успешного внедрения средств ИКТ в образовательный процесс заложен в хорошо известных принципах педагогики сотрудничества, которые можно перефразировать следующим образом: «Не к компьютеру за готовыми знаниями, а вместе с компьютером за новыми знаниями».
Список литературы
1. Артеменко В. П., Информационные технологии на уроке химии, 2006г.
2. Букреева Р.В., Быканова Т.А., Уроки новых технологий по химии, Воронеж, 1997 г.
3. Рубинштейн С.Л. основы общей психологии. -2-ое изд., М.: Учпедгиз, 1946. -704 с.
4. Якиманская И. С. Знание и мышление школьника. М., 1985.
5. Якиманская И.С. Развитие пространственного мышления школьников.- Науч.-исслед. ин-т общей и пед. психологии Акад. пед. наук СССР.- М.: Педагогика, 1980. — 240 с.
Интернет-ресурсы:
http://fcior.edu.ru