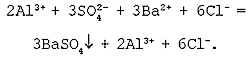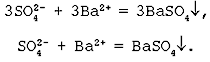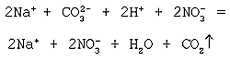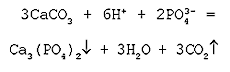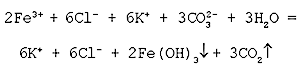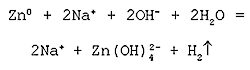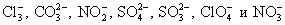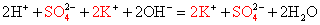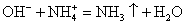Составление молекулярных уравнений по ионно-молекулярным
Чтобы составить
молекулярное уравнение по сокращенному
ионно-молекулярному, необходимо
определить, какой сильный электролит
соответствует каждому иону, так как
ионы – это остатки сильных электролитов.
Пример.
Составьте по два молекулярных уравнения,
которые выражаются следующим
ионно-молекулярным уравнением:
Zn2+
+ CO32–
= ZnCO3
Решение.
При составлении молекулярных уравнений
следует подобрать к ионам Zn2+
и СО32–
сильные электролиты:
Zn2+:
растворимые соли ZnSO4,
ZnCl2,
Zn(NO3)2;
CO32–:
растворимые
соли
Na2CO3,
K2CO3,
(NH4)2CO3.
ZnSO4
+ Na2CO3
= ZnCO3
+ Na2SO4
ZnCl2
+ (NH4)2CO3
= ZnCO3
+ 2NH4Cl
5.3. Гидролиз солей Ионное произведение воды. Водородный показатель
Вода слабо диссоциирует
на ионы Н+
и ОН–:
Н2О
Н+
+ ОН–
При диссоциации
абсолютно чистой воды концентрации Н+
и ОН–
равны. Концентрацию ионов выражают в
моль/л. Установлено, что при 298 К
Н+
= ОН–
= 10–7
моль/л.
Произведение Н+
• ОН–
называется ионным
произведением воды
и численно равно 10–14
при 298 К.
Кв
= Н+
• ОН–
= 10–14
В кислом растворе
Н+>10–7
моль/л, ОН–<10–7
моль/л.
В щелочном растворе
Н+<10–7
моль/л, ОН–>10–7
моль/л.
Для характеристики
среды, кислотности, щелочности введено
понятие водородного
показателя рН,
который равен отрицательному десятичному
логарифму концентрации ионов водорода
рН = -lg[H+]
В нейтральном растворе
рН=7;
в кислых растворах
рН<7;
в щелочных растворах
рН>7.
рОН – гидроксильный
показатель, он равен
рОН = -lg[OH–]
рН + рОН = 14
Реакцию среды на
практике можно определить при помощи
кислотно-основных индикаторов, которые
меняют свой цвет в зависимости от рН
раствора. К наиболее распространенным
относятся лакмус, фенолфталеин и
метилоранж.
Окраска индикаторов
в различных средах
|
Индикатор |
Цвет |
||
|
в |
в |
в |
|
|
Метилоранж |
красный |
оранжевый |
желтый |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Лакмус |
красный |
фиолетовый |
синий |
Типы гидролиза солей
Химическое взаимодействие
ионов соли с ионами воды, приводящее к
образованию слабого электролита и
сопровождающееся изменением рН раствора,
называется гидролизом
солей.
Любую соль можно
представить как продукт взаимодействия
кислоты и основания. Тип гидролиза соли
зависит от природы основания и кислоты,
образующих соль. Возможны 3 типа гидролиза
солей.
Гидролиз по аниону
идет, если соль образована катионом
сильного основания и анионом слабой
кислоты.
Например, соль СН3СООNa
образована сильным основанием NaOH и
слабой одноосновной кислотой СН3СООН.
Гидролизу подвергается ион слабого
электролита СН3СОО–.
Ионно-молекулярное
уравнение гидролиза соли:
СН3СОО–
+ НОН
СН3СООН
+ ОН–
Ионы Н+
воды связываются с анионами СН3СОО–
в слабый электролит СН3СООН,
ионы ОН–
накапливаются в растворе, создавая
щелочную среду (рН>7).
Молекулярное уравнение
гидролиза соли:
CH3COONa
+ H2O
CH3COOH
+ NaOH
Гидролиз солей
многоосновных кислот протекает по
стадиям, образуя в качестве промежуточных
продуктов кислые соли.
Например, соль K2S
образована сильным основанием КОН и
слабой двухосновной кислотой H2S.
Гидролиз этой соли протекает в две
стадии.
1 стадия:
S2–
+ HOH
HS–
+ OH–
K2S
+ H2O
KHS + KOH
2 стадия:
HS-–
+ HOH
H2S
+ OH–
KHS
+ H2O
H2S
+ KOH
Реакция среды щелочная
(pH>7),
т.к. в растворе накапливаются ОН–-ионы.
Гидролиз соли идет тем сильнее, чем
меньше константа диссоциации образующейся
при гидролизе слабой кислоты (табл.3).
Таким образом, водные растворы солей,
образованных сильным основанием и
слабой кислотой, характеризуются
щелочной реакцией среды.
Гидролиз по катиону
идет, если соль образована катионом
слабого основания и анионом сильной
кислоты. Например, соль CuSO4
образована слабым двухкислотным
основанием Cu(OH)2
и сильной кислотой H2SO4.
Гидролиз идет по катиону Cu2+
и протекает в две стадии с образованием
в качестве промежуточного продукта
основной соли.
1 стадия: Cu2+
+ HOH
CuOH+
+ H+
2CuSO4
+ 2H2O
(CuOH)2SO4
+ H2SO4
2 стадия:
CuOH+
+ HOH
Cu(OH)2
+ H+
(CuOH)2SO4
+ 2H2O
2Cu(OH)2
+ H2SO4
Ионы водорода Н+
накапливаются в растворе, создавая
кислую среду (рН<7). Чем меньше константа
диссоциации образующегося при гидролизе
основания, тем сильнее идет гидролиз.
Таким образом, водные
растворы солей, образованных слабым
основанием и сильной кислотой,
характеризуются кислой реакцией среды.
Гидролиз по катиону
и аниону идет,
если соль образована катионом слабого
основания и анионом слабой кислоты.
Например, соль CH3COONH4
образована слабым основанием NH4OH
и слабой кислотой СН3СООН.
Гидролиз идет по катиону NH4+
и аниону СН3СОО–:
NH4+
+ CH3COO–
+ HOH
NH4OH
+ CH3COOH
Водные растворы такого
типа солей, в зависимости от степени
диссоциации образующихся слабых
электролитов имеют нейтральную,
слабокислую или слабощелочную среду.
При смешивании растворов
солей, например CrCl3
и Na2S
каждая из солей гидролизуется необратимо
до конца с образованием слабого основания
и слабой кислоты.
Гидролиз соли CrCl3
идет по катиону:
Cr3+
+ HOH
CrOH2+
+ H+
Гидролиз соли Na2S
идет по аниону:
S2–
+ HOH
HS–
+ OH–
При смешивании растворов
солей CrCl3
и Na2S
происходит взаимное усиление гидролиза
каждой из солей, так как ионы Н+
и ОН–
образуют слабый электролит Н2О
и ионное равновесие каждой соли смещается
в сторону образования конечных продуктов:
гидроксида хрома Cr(OH)3
и сероводородной кислоты H2S.
Ионно-молекулярное
уравнение совместного гидролиза солей:
2Cr3+
+ 3S2–
+ 6H2O
= 2Cr(OH)3
+ 3H2S
Молекулярное
уравнение:
2CrCl3
+ 3Na2S
+ 6H2O
= 2Cr(OH)3
+ 3H2S
+ 6NaCl
Соли,
образованные катионами сильных оснований
и анионами сильных кислот, гидролизу
не подвергаются, так как ни один из ионов
соли не образует с ионами Н+
и ОН–
воды слабых электролитов. Водные растворы
таких солей имеют нейтральную среду.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
переписка с читателем
Реакции ионного обмена и
условия их протекания до конца
В курсе химии средней школы первоначальное
знакомство с реакциями обмена у школьников
происходит в 8-м классе. Здесь дается понятие
реакций обмена как реакций, при которых два
сложных вещества обмениваются своими составными
частями. А уже в курсе химии 9-го класса
акцентируется внимание учащихся на том, что это
тип реакций, протекающих без изменения степеней
окисления элементов у веществ. В нашей школе
химия преподается по учебнику Ф.Г.Фельдмана и
Г.Е.Рудзитиса, естественно, с дополнительным
включением всех недостающих тем и вопросов в
соответствии с госстандартом. Для облегчения
работы с материалами курса «Химия-9» я уже в 8-м
классе изучаю этот материал в полном объеме, с
подробным разбором сложных примеров реакций
ионного обмена. А сэкономленное время использую
в 9-м классе на изучение органической химии (хотя
считаю введение ее в программу на этой ступени
изучения химии нецелесообразным).
Предлагаю свой вариант изложения этой темы в 8-м
классе с большим числом примеров и трехуровневой
проверочной работой.
Правила написания уравнений реакций в ионном
виде
Записывают формулы
веществ, вступивших в реакцию, ставят знак
«равно» и записывают формулы образовавшихся
веществ. Расставляют коэффициенты.
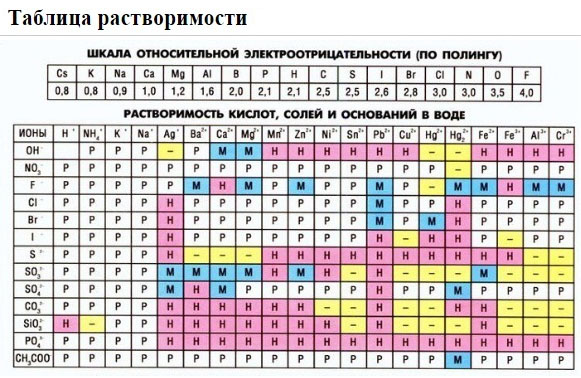
Пользуясь таблицей
растворимости, записывают в ионном виде формулы
веществ, обозначенных в таблице растворимости
буквой «Р» (хорошо растворимые в воде),
исключение – гидроксид кальция, который, хотя и
обозначен буквой «М», все же в водном растворе
хорошо диссоциирует на ионы.
Нужно помнить, что на ионы
не разлагаются металлы, оксиды металлов и
неметаллов, вода, газообразные вещества,
нерастворимые в воде соединения, обозначенные в
таблице растворимости буквой «Н». Формулы этих
веществ записывают в молекулярном виде. Получают
полное ионное уравнение.
Сокращают одинаковые ионы
до знака «равно» и после него в уравнении.
Получают сокращенное ионное уравнение.
Условия, при которых реакции ионного обмена
протекают до конца
1. Если в результате реакции выделяется
малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с
кислотой:
Неизменность степеней окисления элементов во
всех веществах до и после реакции говорит о том,
что реакции обмена не являются
окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl–
= K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
Молекулярное уравнение реакции основного
оксида с кислотой:
CaO + 2HNO3 = Ca(NO3)2 + H2O.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Молекулярное уравнение реакции
нерастворимого основания с кислотой:
3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2 + 6H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
совпадает с сокращенным ионным уравнением.
Молекулярное уравнение реакции амфотерного
оксида с кислотой:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Полное ионное уравнение реакции:
Al2O3 + 6H+ + 6Cl–
= 2Al3+ + 6Cl– + 3H2O.
Cокращенное ионное уравнение реакции:
Al2O3 + 6H+ = 2Al3+ + 3H2O.
2. Если в результате реакции выделяется
нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой
соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2.
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH–
= 2K+ + 2Cl– + Cu(OH)2.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2.
Молекулярное уравнение реакции двух
растворимых солей:
Al2(SO4)3 + 3BaCl2 = 3BaSO4 +
2AlCl3.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции
нерастворимого основания с кислотой:
Fe(OH)3 + H3PO4 = FePO4 + 3H2O.
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
реакции совпадает с сокращенным. Эта реакция
протекает до конца, о чем свидетельствуют сразу
два факта: образование вещества, нерастворимого
в воде, и выделение воды.
3. Если в результате реакции выделяется
газообразное вещество.
Молекулярное уравнение реакции растворимой
соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+
+ 2Cl– + H2S.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S.
Молекулярное уравнение реакции растворимой
соли (карбоната) с кислотой:
Na2CO3 + 2HNO3 = 2NaNO3 + H2O +
CO2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца
свидетельствуют два признака: выделение воды и
газа – оксида углерода(IV).
Молекулярное уравнение реакции
нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2 + 3H2O + 3CO2
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение
реакции совпадает с сокращенным уравнением. Эта
реакция протекает до конца, о чем
свидетельствуют сразу три признака: выделение
газа, образование осадка и выделение воды.
Запись сложных химических уравнений реакций в
ионном виде
Молекулярное уравнение реакции обмена с
участием воды:
2FeCl3 + 3K2CO3 + 3H2O = 6KCl + 2Fe(ОН)3 + 3СО2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Данная реакция ионного обмена протекает до
конца, о чем свидетельствуют сразу два признака:
выделение газа и образование осадка.
Молекулярное уравнение реакции
металлического цинка с водной щелочью:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции амфотерного
оксида с водной щелочью:
Al2O3 + 6KOH + 3H2O = 2K3[Al(OH)6].
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
Молекулярное уравнение реакции
нерастворимого карбоната с растворимой в воде
солью:
СaCO3 + CuCl2 + H2O = Cu(OH)2 + CaCl2 + CO2
Полное ионное уравнение реакции:
СaCO3 + Cu2+ + 2Cl– + H2O =
Cu(OH)2+ Ca2+
+ 2Cl– + CO2
Cокращенное ионное уравнение реакции:
СaCO3 + Cu2+ + H2O = Cu(OH)2 + Ca2+ + CO2
Проверочная работа по теме «Ионный обмен»
Вариант на оценку «5»
1. Приведите полные ионные и молекулярные
уравнения реакций, соответствующие сокращенным
ионным уравнениям:
ZnO + 2H+ = Zn2+ + H2O,
3Na2O + 6H+ = 6Na+ + 3H2O,
Ag+ + Cl– = AlCl,
2. Приведите по одному примеру реакции ионного
обмена, протекающей до конца с: а) выделением
воды; б) образованием осадка; в) одновременным
выделением газа и воды.
Вариант на оценку «4»
1. Напишите в молекулярном, полном и сокращенном
ионных видах следующие уравнения реакций:
K2O + HNO3 = … ,
CaCO3 + HCl = … ,
Al(OH)3 + H3PO4 = … .
2. Приведите пример реакции, для которой полное
ионное уравнение совпадает с сокращенным.
Вариант на оценку «3»
1. Назовите условия, при которых реакции ионного
обмена протекают до конца, приведите по одному
примеру на каждое условие.
2. Покажите на конкретных примерах, что реакции
ионного обмена не являются
окислительно-восстановительными.
ЛИТЕРАТУРА
Рудзитис Г.Е., Фельдман Ф.Г. Химия-8, 9. М.:
Просвещение, 1990;
Глинка Н.Л. Общая химия. Л.: Химия, 1988;
Макареня А.А. Повторим химию. М.: Высшая
школа, 1989;
Романцева Л.М. Сборник задач и упражнений по
общей химии. М.: Высшая школа, 1991.
В.А.ДЕМИДОВ,
учитель химии
Синегорской средней школы
(Нагорский р-н, Кировская обл.)
Статьи
Основное общее образование
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
06 июня 2019
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).

Химия. 8 класс. Учебник
Учебник написан преподавателями химического факультета МГУ им. М.В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать ее в классах и школах с углубленным изучением естественно-научных предметов.
Купить
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

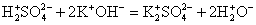
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.

АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
-
Записываем молекулярное уравнение химического процесса.
H2SO4 + KOH = K2SO4 + H2O
-
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
H2SO4 + 2KOH = K2SO4 + 2H2O
-
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
- растворимые соли;
- сильные кислоты (H2SO4, HNO3, HCl и др.);
- растворимые в воде основания.
Записываем в виде молекул:
- нерастворимые соли;
- слабые кислоты, щелочи, вода;
- оксиды;
- газы;
- простые вещества;
- большинство органических соединений.
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
-
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
-
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
-
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
2H + 2OH = 2H2O
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
-
Записываем молекулярное уравнение, проверяем коэффициенты.
KOH + NH4Cl = KCl + NH4OH
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
KOH (p) + NH4Cl (p) = KCl (p) + NH3↑+ H2O
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
-
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
-
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
-
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Что происходит?
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
-
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
-
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
-
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
#ADVERTISING_INSERT#
Реакции ионного обмена и условия их протекания
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
Примеры:
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
II. РИО, идущие с образованием осадка
Посмотрите видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Запишем реакцию: CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Правила написания уравнений реакций в ионном виде
Интерактивное объяснение алгоритма
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
|
На ионы диссоциируют |
|
|
Реагенты (исходные вещества) |
Продукты реакции |
|
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания (включая Ca(OH)2 – M) |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑ H2SO3 ↔ H2O + SO2↑ NH4OH↔ H2O + NH3↑ H2S↑ (сероводород сам выделяется в виде газа) |
Р — растворимое вещество;
М — малорастворимое вещество;
ТР — таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
|
1) Записываем уравнение РИО в молекулярном виде: |
Взаимодействие сульфата меди (II) и гидроксида натрия: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ |
|
2) Используя ТР указываем растворимость веществ воде: — Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓ — Если продукт является газом, справа от химической формулы ставим знак ↑ |
Р Р Р Н CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Молекулярный вид |
|
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице — ПАМЯТКЕ |
Cu2+ + SO42- + 2Na+ + 2OH— = 2Na+ + 2SO4 + Cu(OH)2↓ Полный ионный вид |
|
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. Помните! РИО необратима и практически осуществима, если в продуктах образуются: газ, вода, осадок |
Cu2+ + 2OH+ = Cu(OH)2↓ Краткий ионный вид Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓ |
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
б) Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl— = 3BaSO4↓ + 2Al3+ + 6Cl—
в) Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + H3PO4 (р) = FePO4↓ + 3H2O
б) Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3H2O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
III. РИО, идущие с образованием газа
Посмотрите опыт: “Реакции ионного обмена, идущие с выделением газа»
Na2CO3 + 2HСl = 2NaCl + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2Cl— = 2Na+ + CO2↑ + H2O + 2Cl—
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S↑
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2↓ + 3H2O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3H2O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
IV. РИО, идущие с образованием малодиссоциирующего вещества
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3— = Ca2+ + 2NO3— + H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓ + 6H2O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
Решение
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + NH4Cl = KCl + NH4OH
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
KOH (p) + NH4Cl (p) = KCl (p) + NH3 ↑+ H2O
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH— + NH4+ + Cl— = K+ + Cl— + NH3 ↑+ H2O
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH— + NH4+ = NH3 ↑+ H2O
— Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Задание №2. Дана схема: 2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
— Используя ТР подбираем реагенты — растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота — H3PO4 (p) и соль -K2CO3 (p).
— Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
— Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
— Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
— Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
Решение
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ — неэлектролит, на ионы не диссоциирует,
мд — малодиссоциирующее вещество, на ионы не раскладываем, вода — признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43— + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ -> 2Na+ + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
“Взаимодействие карбоната натрия с серной кислотой”
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
“Осаждение сульфата бария”
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
VII. Тренажеры
Тренажер №1: «Реакции ионного обмена»
Интерактивное задание LearningApps.org по теме: “Реакции между ионами”
ЦОРы
Видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Видео-опыт: “Реакции ионного обмена, идущие с выделением газа»
Видео-опыт: “Реакция нейтрализации”