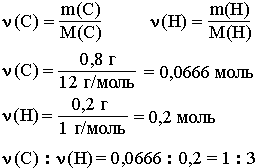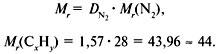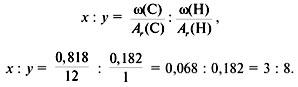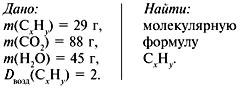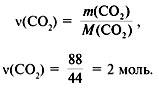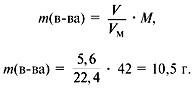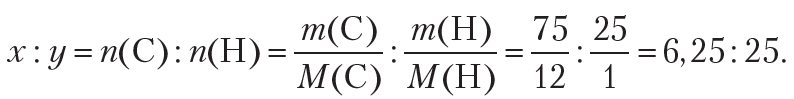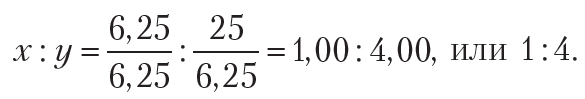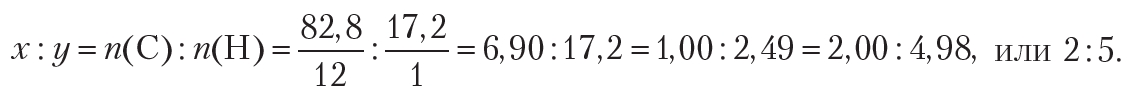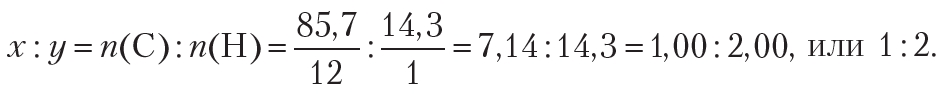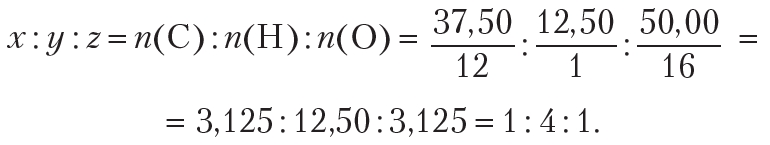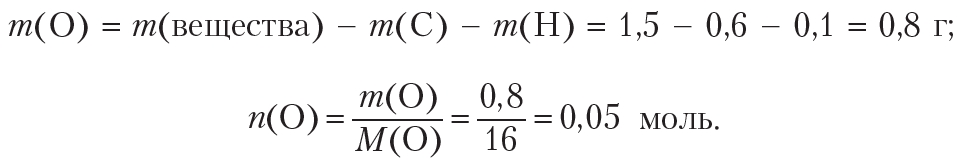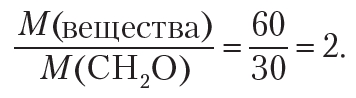определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like empirical formula, molecular formula, structural formula, and condensed formula. Let’s discuss the molecular formula and its calculation with examples in detail in this article.
What is Molecular Formula?
The molecular formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. The molecular formula helps in determining whether a chemical compound is a binary compound, ternary compound, quaternary compound, or has even more elements depending upon the number of elements in a molecule. A molecular formula is always a multiple of the empirical formula, where an empirical formula for a chemical compound is defined as a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula. Though molecular formulae are simple and easy to understand, they lack the knowledge concerning the atomic arrangement and bonding that is presented in a molecular formula. A molecular formula gives more information about a molecule than its empirical formula, however, it is more difficult to establish.
Relation between Molecular Formula and Empirical Formula
The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound. For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO. Here, the n-factor is 2. The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different. For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
M = n × E
where,
M is the molecular formula
n is the ratio of molar mass and empirical formula mass
E is the empirical formula
How to Calculate Molecular Formula?
The molecular formula of a chemical compound can be found in the following ways:
Using Composition and Molecular Weight
Step 1: Multiply the molecular weight with the given component percentage.
Step 2: Divide each value obtained by the atomic weight of that atom.
Step 3: Round off the obtained values to the closest whole number. Finally, write the molecular formula.
Example: A compound is composed of 82.78% nitrogen and 17.22% hydrogen. If its molecular weight is 17.031 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 17.031 g/mol
Nitrogen percentage in the given compound = 82.78%
Hydrogen percentage in the given compound = 17.22%
Step 1: Multiply the molecular weight with the given component percentage.
Nitrogen = 17.031 × (82.78/100) = 14.0982
Hydrogen = 17.031 × (17.22/100) = 2.9327
Step 2: Divide each value obtained by the atomic weight of that atom.
Nitrogen: 14.0982/14.0067 = 1.00654
Hydrogen: 2.9327/1.00794 = 2.90960
Step 3: Round off the obtained values to the closest whole number.
Nitrogen: 1
Hydrogen: 3
Thus, the molecular formula of the given compound is NH3.
Using Empirical Formula and Molecular Weight
Step 1: Calculate the empirical formula mass from the given empirical formula.
Step 2: Find the n-factor by using its formula. n = Molar Mass/Empirical Formula Mass
Step 3: Now, multiply all the subscripts in the empirical formula by n and the resultant formula is the required molecular formula.
Example: The empirical formula of a compound of carbon, hydrogen, and oxygen is HO. If its molar mass is 34.014 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
Step 1: First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 15.9994
= 2.01588 + 31.9988
= 17.007 g/mol
Step 2: Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/17.007 = 2
Step 3: Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (HO) = H2O2
Hence, the molecular formula of the compound is H2O2.
Solved Examples on Molecular Formula
Example 1: A compound is composed of 68.29% carbon, 12.02% hydrogen, and 21.69% oxygen. If its molecular weight is 86.136 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of a compound = 86.136 g/mol
Carbon percentage in the given compound = 68.29%
Hydrogen percentage in the given compound = 12.02%
Oxygen percentage in the given compound = 21.69%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 86.136 × (68.29/100) = 58.8223
Hydrogen =86.136 × (12.02/100) = 10.3535
Oxygen = 86.136 × (21.69/100) = 18.6828
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon: 58.8223 /12.0107 = 4.8973
Hydrogen: 10.3535/1.00794 = 10.2719
Oxygen: 18.6828/15.9994 = 1.1677
Step 3: Round off the obtained values to the closest whole number.
Carbon: 5
Hydrogen: 10
Oxygen: 1
Thus, the molecular formula of the given compound is C5H10O.
Example 2: Oxalic acid is composed of 27.42% carbon, 2.33% hydrogen, and 70.25% oxygen. If its molecular weight is 90.035 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of oxalic acid = 90.035 g/mol
Carbon percentage in oxalic acid = 27.42%
Hydrogen percentage in oxalic acid = 2.33%
Oxygen percentage in oxalic acid = 70.25%
Step 1: Multiply the molecular weight with the given component percentage.
Carbon = 90.035 × (27.42/100) = 24.6875
Hydrogen = 90.035 × (2.33/100) = 2.0978
Oxygen = 90.035 × (70.25/100) = 63.2496
Step 2: Divide each value obtained by the atomic weight of that atom.
Carbon = 24.6875/12.0107 = 2.0554
Hydrogen: 10.3535/1.00794 = 2.08127
Oxygen: 63.2496/15.9994 = 3.9532
Step 3: Round off the obtained values to the closest whole number.
Carbon: 2
Hydrogen: 2
Oxygen: 4
Thus, the molecular formula of the given compound is C2H2O4.
Example 3: The empirical formula of a compound of carbon, hydrogen, and oxygen is CH2O. If its molar mass is 60.052 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = CH2O
The molar mass of the compound = 60.052 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 12.0107 + 2 × 1.00794 + 15.9994
= 30.026 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 60.052/30.026 = 2
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 2 × (CH2O) = C2H4O2
Hence, the molecular formula of the compound is C2H4O2.
Example 4: Boric acid is composed of 21.14% boron, 4.65% hydrogen, and 74.21% oxygen. If its molecular weight is 61.83 g/mol, then find its molecular formula.
Solution:
Given data:
The molecular weight of boric acid = 61.83 g/mol
Boron percentage in boric acid = 27.42%
Hydrogen percentage in boric acid = 4.65%
Oxygen percentage in boric acid = 68.79%
Step 1: Multiply the molecular weight with the given component percentage.
Boron = 61.83 × (21.14/100) = 13.0709
Hydrogen = 61.83 × (4.65/100) = 2.8750
Oxygen = 61.83 × (74.21/100) = 45.8840
Step 2: Divide each value obtained by the atomic weight of that atom.
Boron: 13.6891/10.811 = 1.209
Hydrogen: 2.2568/1.00794 = 2.8524
Oxygen: 32.2320/15.9994 = 2.8679
Step 3: Round off the obtained values to the closest whole number.
Boron: 1
Hydrogen: 3
Oxygen: 3
Thus, the molecular formula of the given compound is H3BO3.
Example 5: The empirical formula of a compound that is composed of hydrogen, chlorine, and oxygen is HClO. If its molar mass is 52.46 g/mol, then determine the molecular formula of the compound.
Solution:
Given data:
The empirical formula of a compound = HClO
The molar mass of the compound = 52.46 g/mol
First, let’s calculate the empirical formula molar mass.
Empirical formula molar mass (EFM) = 1.00794 + 35.453 + 15.9994
= 52.460 g/mol
Now, divide the molar mass of the given compound by the empirical formula mass.
n = Molar mass/EMF = 52.460/52.46 = 1
Molecular Formula = n × (Empirical formula)
So, the molecular Formula of the given compound = 1 × (HClO) = HClO
Here, the empirical formula and the molecular formula of the given compound are the same.
Hence, the molecular formula of the compound is HClO.
FAQs on Molecular Formula
Question 1: What is meant by a chemical formula?
Answer:
A chemical formula is a way of describing the information about the chemical proportions of atoms that make up a certain chemical compound or molecule. It uses the symbols of the chemical element and numbers, and also occasionally uses other symbols such as brackets, dashes, square brackets, commas, plus (+), and minus (-) signs. There are different types of chemical formulae like the empirical formula, molecular formula, structural formula, and condensed formula.
Question 2: Define molecular formula and give an example.
Answer:
The Molecular Formula specifies the actual number of each type of atom in a molecule. For example, the molecular formula of benzene is C6H6, i.e., it is composed of six carbon and six hydrogen atoms. We need the molar mass of a compound to find the molecular formula of a compound, and it is often derived after obtaining the empirical formula.
Question 3: What is the difference between the empirical formula and the molecular formula?
Answer:
- The molecular formula specifies the actual number of each type of atom in a molecule, whereas an empirical formula for a chemical compound is a simple expression that represents the ratio of the elements in the compound.
- For example, the molecular formula of hydrogen peroxide is H2O2, whereas its empirical formula is HO.
- The empirical formula might be the same for different chemical compounds. For example, glucose, formaldehyde, and acetic acid have the same empirical formula, CH2O, but their molecular formulae are different.
- For some chemical compounds, both formulae are the same, like water (H2O), hypochlorous acid (HClO), formaldehyde (CH2O), methane (CH4), etc.
Question 4: What is the relationship between the empirical formula and the molecular formula?
Answer:
A molecular formula is always a multiple of the empirical formula and the relationship between the empirical formula and the molecular formula is given as follows:
Molecular Formula = n × (Empirical formula) (where n is a positive integer)
where “n” is the ratio of molar mass and empirical formula mass.
n = Molar Mass/Empirical Formula Mass
Question 5: What are the molecular formulae of glucose, dichlorine hexoxide, and dimethyl ether?
Answer:
Molecular formula of glucose = C6H12O6
Molecular formula of dichlorine hexoxide = Cl2O6
Molecular formula of dimethyl ether = C2H6O.
Related Resources
- Molecular Weight
- Chemical Formula of Common Compounds
- Molar Mass
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Установление формулы органического вещества
Установление строения химического соединения является предметом научного исследования. Сложность данной проблемы зависит от сложности строения соединения. Первым этапом исследования, как правило, является определение молекулярной формулы вещества. Рассмотрим некоторые способы установления формул органических веществ на достаточно простых примерах.
Пример 1. Более двух столетий назад химики уже умели определять качественный и количественный состав веществ. Например, было известно, что в состав одного из органических веществ входят углерод и водород, причём массовая доля углерода составляет 75 %, а водорода — 25 %. То есть в 100 г вещества содержится 75 г углерода и 25 г водорода. Используя эти данные, определите формулу органического вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его молекулярную формулу можно представить в виде CxHy. Таким образом, решение задачи сводится к нахождению индексов x и y в формуле вещества. Индексы x и y в формуле показывают количества атомов углерода и водорода в молекуле органического вещества, поэтому на первом этапе решения подобных задач необходимо найти простейшее целочисленное соотношение между количеством атомов углерода и водорода в неизвестном веществе:
x : y = n(C) : n(H).
По условию, масса атомов углерода равна 75 г, водорода — 25 г. Тогда:
Точность промежуточных вычислений должна соответствовать точности исходных данных, то есть промежуточные значения должны содержать не меньше значащих цифр, чем данные задачи.
Видно, что полученное соотношение не является целочисленным. Чтобы получить целочисленные значения индексов x и y, выполняют следующие действия: сначала все числа полученного соотношения делят на наименьшее (в одном случае уже будет единица), и при необходимости умножают полученные числа на натуральное число (2, 3 и т. д.) для получения целочисленного соотношения:
Тогда формула соединения — CH4. Это вещество нам хорошо известно, оно называется метан.
О т в е т: СН4.
Пример 2. Некоторое органическое вещество состоит из углерода и водорода. Массовая доля углерода в веществе составляет 82,8 %. Установите молекулярную формулу вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его формула — CxHy. В условии задачи даны массовые доли элементов в веществе. В таких случаях при решении задачи удобно рассмотреть определённую массу вещества, которую обычно принимают равной 100 г. В этом случае массовые доли элементов будут совпадать по величине с их массами. Тогда простейшее целочисленное соотношение индексов в формуле вещества:
Следовательно, простейшая формула органического вещества — С2Н5. Устойчивого органического вещества с такой формулой не существует. Действительно, формула С2Н5 соответствует этильному радикалу. Чтобы определить истинную формулу органического вещества, будем учитывать, что удвоение, утроение и т. д. индексов в формуле не изменяет соотношение между ними. Удвоив индексы в простейшей формуле С2Н5, получим формулу С4Н10. Эта формула соответствует углеводороду бутану. Таким образом, истинная формула вещества — С4Н10.
О т в е т: С4Н10.
В рассмотренных примерах для определения формулы органического вещества нам было достаточно знать лишь массовые доли элементов в веществе. В то же время, в некоторых случаях, зная лишь массовые доли элементов в веществе, можно определить только простейшую, но не истинную формулу. В таких случаях для установления истинной формулы необходимы дополнительные данные. Как правило, это сведения о молярной массе соединения.
Пример 3. Молярная масса углеводорода равна 42 г/моль. Массовая доля углерода в углеводороде составляет 85,7 %. Установите молекулярную формулу углеводорода.
Формула углеводорода — CxHy. Найдём простейшее целочисленное соотношение индексов в формуле вещества:
Следовательно, простейшая формула углеводорода — СН2. Удвоив индексы в простейшей формуле СН2, получим формулу С2Н4. Эта формула соответствует углеводороду этилену. Если утроить индексы в простейшей формуле СН2, то получится формула С3Н6. Данная формула соответствует углеводороду пропилену. То есть, найденному соотношению индексов соответствует множество веществ, поэтому в данном случае, используя лишь массовые доли элементов, невозможно установить истинную формулу вещества.
Для установления истинной формулы сравним молярную массу углеводорода с молярной массой простейшей формулы CH2:
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2 в 3 раза. Тогда истинная формула углеводорода — C3H6.
О т в е т: С3Н6.
В составе органических соединений, наряду с углеродом и водородом, часто присутствует кислород. Выведем молекулярную формулу кислородсодержащего соединения.
Пример 4. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Простейшее целочисленное соотношение индексов в формуле вещества:
Простейшая формула вещества СН4О. Этой молекулярной формуле соответствует метиловый спирт .
О т в е т: СН4О или .
В рассмотренных примерах для установления формул мы использовали сведения о массовых долях элементов в веществе. Формулу органического вещества можно вывести также на основании данных эксперимента по сжиганию определённой массы органического вещества.
Пример 5. В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.
Поскольку при сжигании вещества образовались только углекислый газ и вода, то в состав вещества могли входить лишь атомы углерода, водорода и кислорода. Тогда формула вещества — CxHyOz. Соотношение индексов в формуле будем находить из условия:
x : y : z = n(C) : n(H) : n(O).
Составим схему реакции:
Из схемы реакции видно, что углерод из органического вещества переходит в CO2, водород — в H2O. Таким образом количества углерода и водорода в CO2 и H2O будут такими же, как в органическом веществе.
Найдём количество углерода в CO2:
В молекуле воды содержится два атома водорода, следовательно, количество (моль) водорода в два раза больше количества воды:
Определим количество (моль) атомов кислорода в веществе. Для этого рассчитаем массы углерода и водорода в данной порции вещества:
Рассчитаем массу и количество кислорода в веществе:
Простейшее целочисленное соотношение индексов в формуле вещества:
x : y : z = n(C) : n(H) : n(O) = 0,05 : 0,1 : 0,05 = 1 : 2 : 1.
Таким образом, простейшая формула органического вещества СН2O.
Для установления истинной формулы сравним молярную массу вещества с молярной массой простейшей формулы — CH2O:
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2O в два раза. Тогда истинная формула вещества — C2H4O2. Одним из веществ, имеющих такую молекулярную формулу, является уксусная кислота СН3 — СООН.
О т в е т: C2H4O2.
Обобщим вышеизложенное. Зная количества (моль) элементов в веществе можно установить простейшую формулу вещества. Для вывода истинной формулы зачастую необходимы дополнительные данные, например сведения о молярной массе вещества.
Вывод формулы органического вещества обычно состоит из следующих этапов:
а) вычисление количества (моль) элементов в веществе;
б) определение простейшего целочисленного соотношения между вычисленными количествами элементов — установление простейшей формулы вещества;
в) установление истинной формулы вещества.
Для установления простейшей формулы достаточно знать количества (моль) элементов в веществе.
Для определения истинной формулы часто требуются дополнительные данные, например сведения о молярной массе вещества.
Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.