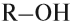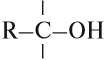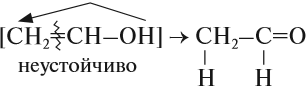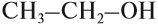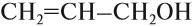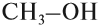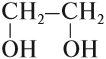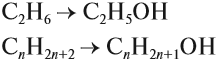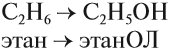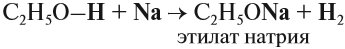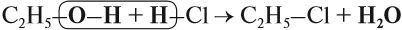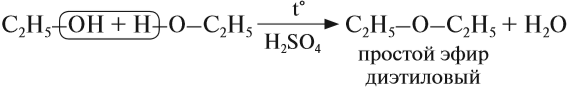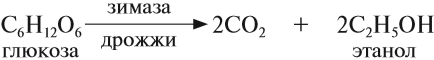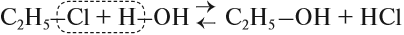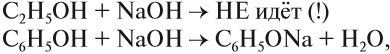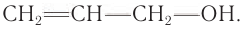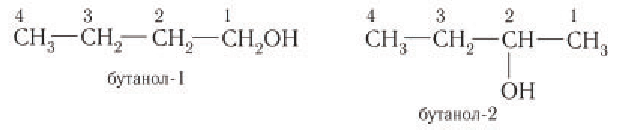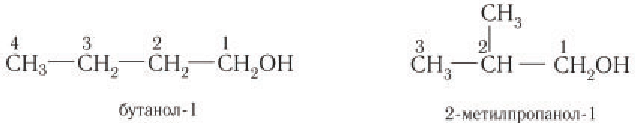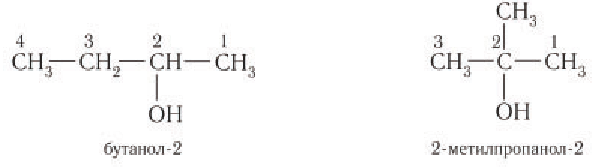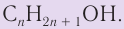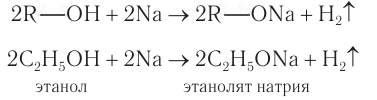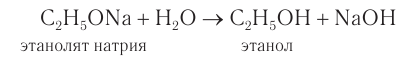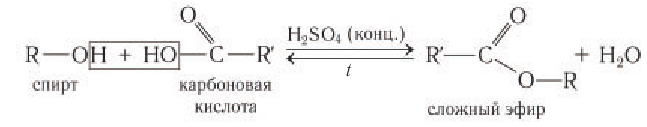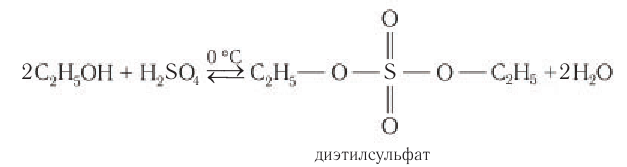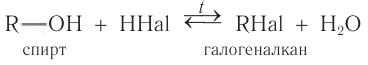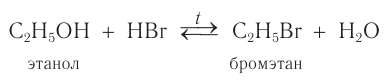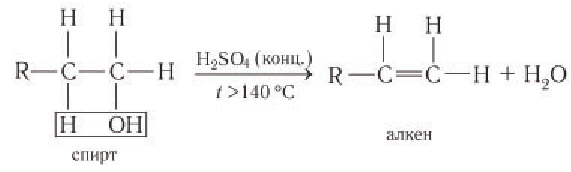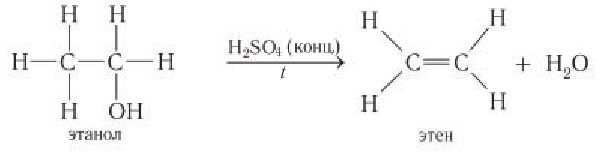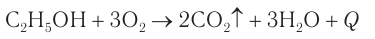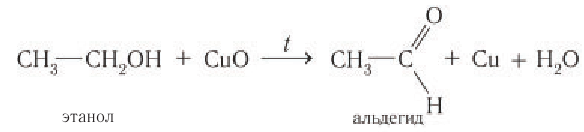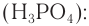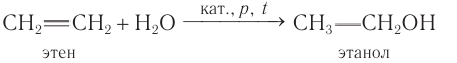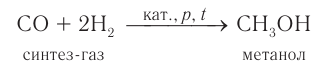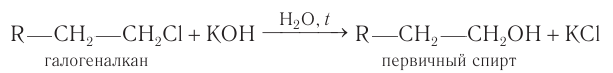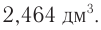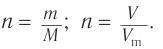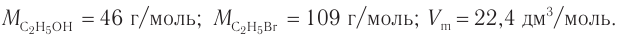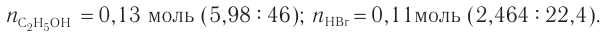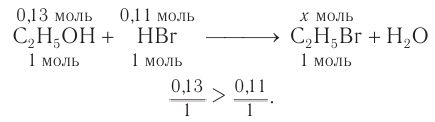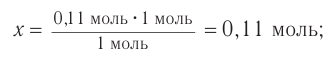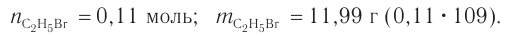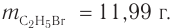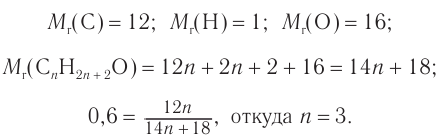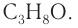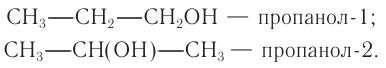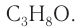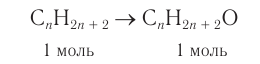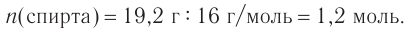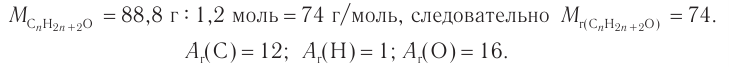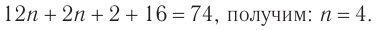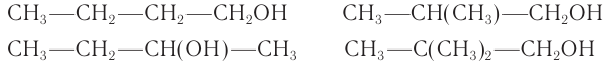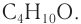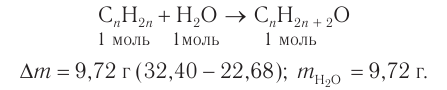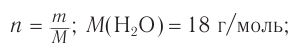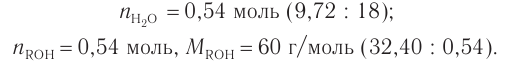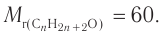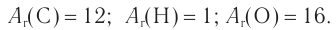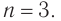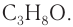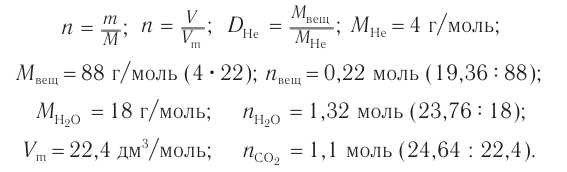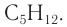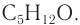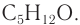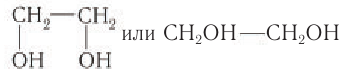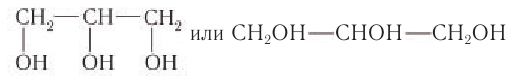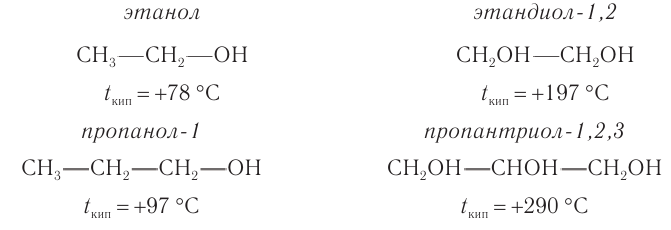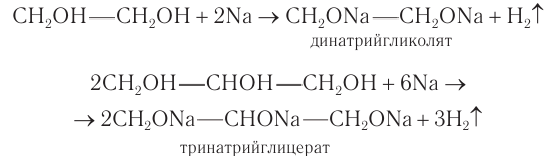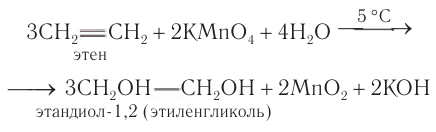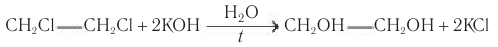Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства одноатомных спиртов
- Физические свойства
- Химические свойства
- Получение и применение спиртов (на примере этилового спирта)
- Многоатомные спирты
- Понятие о фенолах
- Выводы
Определение
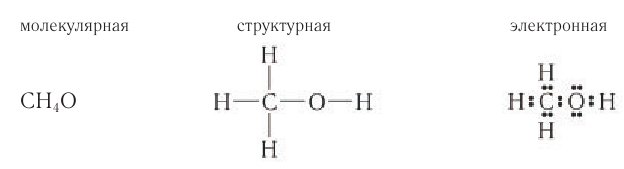
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:
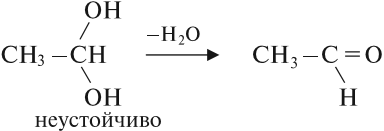
Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:
По строению углеводородного радикала спирты делят на:
- предельные
в углеводородном радикале, все связи простые;
- непредельные
в углеводородном радикале, есть кратная связь;
- ароматические
имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
- одноатомные
в состав молекулы входит одна гидроксогруппа ОН;
- многоатомные
в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:
Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:
Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):
Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.
Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти. Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов. В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.
Свойства одноатомных спиртов
Физические свойства
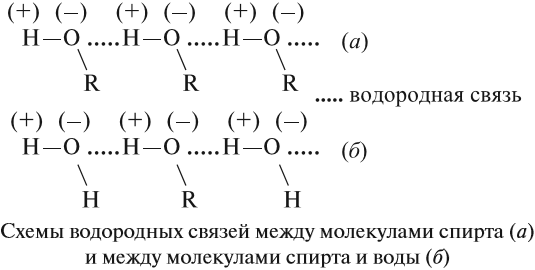
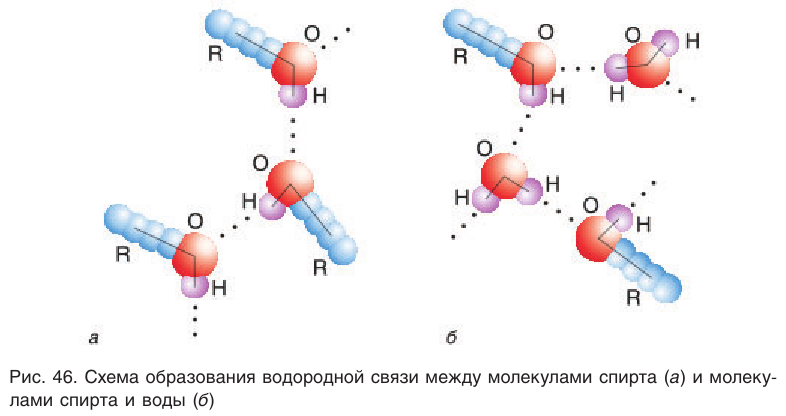
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
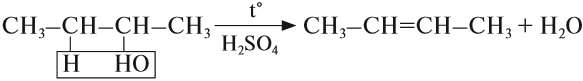
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
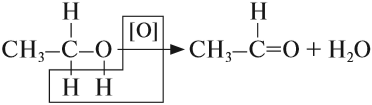
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
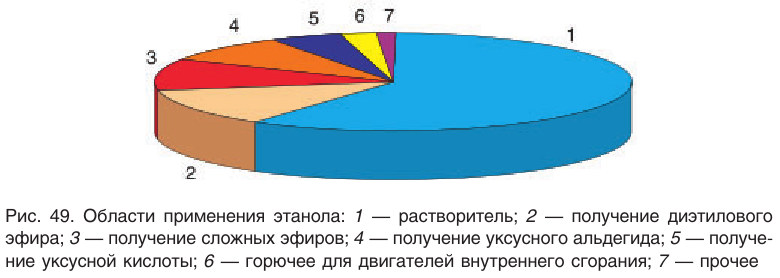
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
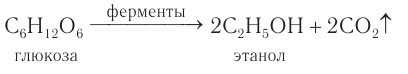
Пищевой и медицинский спирты получают брожением глюкозы:
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.
Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:
Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
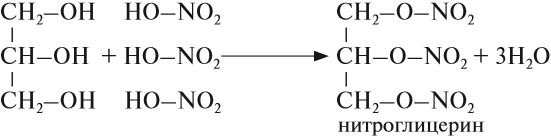
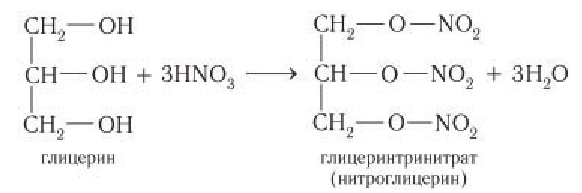
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
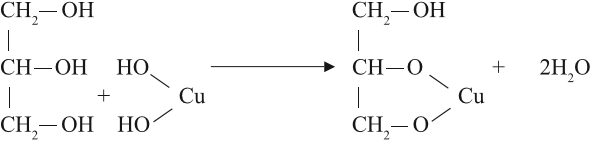
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
- с азотной кислотой;
- с Сu(ОН)2.
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).
Понятие о фенолах
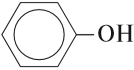
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
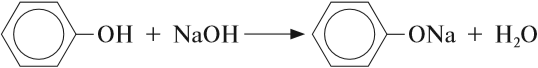
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
или
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
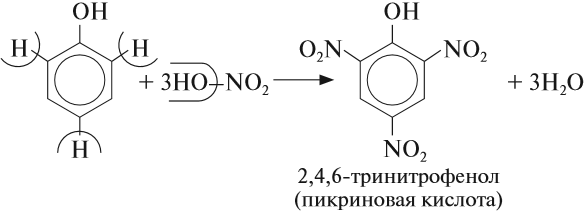
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:
Фенол применяют для дезинфекции и получения красителей и полимеров.
Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.
План урока:
Формула и строение спиртов
Классификация спиртов
Номенклатура спиртов
Изомерия спиртов
Методы получения спиртов
Физические свойства
Химические свойства
Применение спиртов
Формула и строение спиртов
Спирты из-за наличия функциональной группы -ОН можно рассматривать как производное воды Н-О-Н. Геометрическое строение воды и спиртов схоже. Угол связи R-O-H равен 109˚, при этом гидроксильный кислород находится в состоянии sp3-гибридизации.
Строение молекулы спирта
У спиртов особенное электронное строение. Алкоголи – дипольные молекулы, которые содержат связи C-H, C-O, O-H. Атом кислорода имеет частично отрицательный заряд, а атомы углерода и водорода – частично положительный. Связь О-Н имеет большую полярность, по сравнению со связью С-О. Это явление связано с разностью электроотрицательности кислорода и водорода. Но полярность связей недостаточна для диссоциации и образования ионов Н+. Поэтому можно сделать вывод, что спирты – неэлектролиты.
Формула спиртов: CnH2n+1OH
Классификация спиртов
В классификации спиртов заключены особенности строения молекул. По числу гидроксильных групп различают одноатомные, двухатомные, трехатомные и многоатомные спирты.
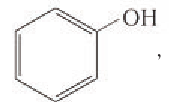
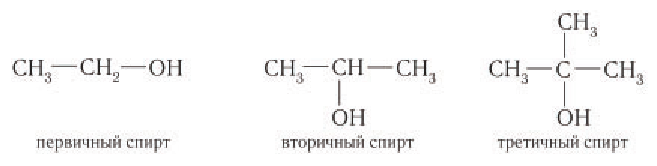
Также спирты классифицируют в зависимости от положения гидроксильной группы на первичные, вторичные и третичные.
Номенклатура спиртов
Для спиртов свойственно несколько типов номенклатуры.
- Тривиальная (историческая) номенклатура. Для простых спиртовых соединений свойственны упрощенные названия. В этом случае название радикала переводят в прилагательное с помощью окончания «овый» и добавляют слово «спирт». Например, CH3-CH2-CH2-OH – пропановый спирт.
У первых двух представителей гомологического ряда есть особенные исторические названия. Метанол – древесный спирт, а этанол – винный. Такие названия обусловлены историческим методом получения. Опьяняющие свойства этанола были известны не менее чем за 8000 лет до н.э.
- Систематическая номенклатура спиртов. Как правило, в химии используют именно этот вид номенклатуры. В одноатомных спиртах к названию радикала добавляется суффикс «ол», в двухатомных – «диол», в трехатомных – «триол». Положение гидроксигруппы обозначается наименьшим значением, если в составе спирта отсутствует карбонильная и/или карбоксильная группа.
Алгоритм названия спиртов
Систематическая номенклатура подчиняется определенному алгоритму.
- Выбор главной цепи в соединении.
- Нумерация начинается с того конца, к которому ближе функциональная группа.
- Название углеводородного радикала.
- Прибавление окончания «ол» и указание номера атома углерода, с которым связана гидроксогруппа.
Изомерия спиртов
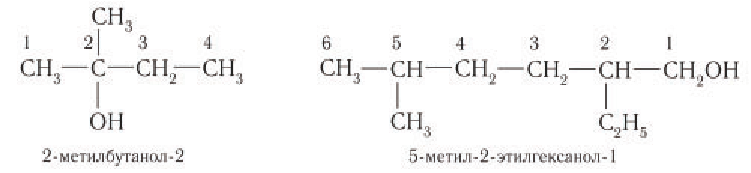
Для спиртов свойственно несколько видов изомерии – изомерия углеродного скелета, положения заместителя и межклассовая (с простыми эфирами). Изомерия углеродного скелета начинается с бутанола.
Типы изомерии спиртов
Способы получения спиртов
Существует несколько реакций получения спиртов.
Реакция проходит по правилу Марковникова, т.е. атом водорода присоединяется к более гидрированному атому углерода, а гидроксильная группа – к менее. Например, в молекуле CH3-CH2-CH=CH2 атом водорода Н+ примыкает к атому углерода, стоящему в СН2 у кратной связи, а гидроксильная группа ОН— – к СН.
Физические свойства
Физические свойства определяются особенностями строения молекулы спирта. Алкоголи – бесцветные жидкости с характерным запахом. Температуры плавления и кипения спиртов выше, чем у соответствующих представителей других классов веществ. По гомологическому ряду они увеличиваются.
Все алкоголи имеют плотность ниже единицы, т.е. они плавают на поверхности воды. Спирты растворимы в большинстве органических растворителях.
Особенность алкоголей заключается в том, что в гомологическом ряде нет газов. Агрегатное состояние спиртов – жидкое или твердое. Это связано с тем, что атом кислорода в гидроксильной группе обладает частично отрицательным зарядом, а атом водорода – частично положительным. Кислород притягивает положительно заряженные атомы и образует с ними водородные связи. Большое количество таких связей обеспечивает «прилипание» молекул спирта между собой и обуславливает особенное строение.
Из этилового спирта изготавливают алкогольные напитки. Несмотря на относительную безопасность употребления этанола, его систематическое употребление пагубно влияет на организм:
- 100 мл пива – гибель 3000 клеток головного мозга,
- 100 мл вина – гибель 5000 клеток головного мозга,
- 100 мл водки – гибель 7500 клеток головного мозга.
В алкогольные напитки вместо этанола могут добавлять метанол, который опасен для жизни. Эти два спирта отличаются по характеру пламени:
- метиловый горит зеленым пламенем,
- этиловый – синим.
Но при наличии примесей в метаноле, зеленое пламя может и не появиться.
Химические свойства
Реакции замещения
- Замещение водорода в гидроксильной группе
- Взаимодействие с активными металлами (например, с натрием)
Реакция проводится в безводной среде. В воде алкоголяты металлов полностью гидролизуются.
2CH3-CH2-O[H] + 2Na → 2CH3-CH2-ONa + H2
- Взаимодействие с кислотами (этерификация)
CH3-O[H + HO]-NO2→ CH3-O-NO2 + H2O
- Замещение гидроксигруппы
- Взаимодействие с галогеноводородами при нагревании
CH3-CH2-[OH + H]Br→ CH3-CH2-Br + H2O
- Взаимодействие с аммиаком
Реакция идет при пропускании смеси паров спирта с аммиаком при 300˚С над оксидом алюминия.
CH3-CH2-[OH +H]-NH2→CH3-CH2-NH2 + H2O
При избытке в спирте алкильных радикалов в молекуле аммиака могут замещаться два или три атома водорода.
2CH3-CH2-[OH + H]-NH2 → C2H5-NH-C2H5 + 2H2O
Реакции отщепления
- Дегидратация
- Межмолекулярная дегидратация в присутствии концентрированной серной кислоты и при 140˚С
CH3-CH2-O[H + НО]-СН2-СН3→С2Н5-О-С2Н5 + Н2О
CH3-O[H + HO]-CH2-CH3→ CH3-O-C2H5 + H2O
- Внутримолекулярная дегидратация в присутствии концентрированной серной кислоты и при 170˚С
OH]-CH2-CH2-[H →CH2=CH2 + H2O
Для метанола не характерна внутримолекулярная дегидратация. Реакция вторичных и третичных спиртов проходит по правилу Зайцева. Т.е. при отщеплении воды от спирта атом водорода отрывается от соседнего менее гидрированного атома углерода. Например, в молекуле CH3-CH2-CH(OH)-CH3 атом водорода Н+ отщепляется от атома углерода в СН3, находящегося вблизи гидроксильной группы.
CH3-CH(OH)-CH2-CH3→CH3-CH=CH-CH3 + H2O
- Дегидрирование в присутствии катализатора меди и под действием нагревания
Реакции окисления
- Полное окисление (горение)
CH3-CH2-OH + 3О2→ 2СО2 + 3Н2О
Неполное окисление
Качественная реакция на многоатомные спирты
Качественная реакция – химическое превращение, которое сопровождается характерными признаками. С ее помощью можно распознать определенное вещество.Строение многоатомных спиртов, т.е. присутствие в молекуле нескольких гидроксильных групп, обуславливает образование при взаимодействии со свежеполученным осадком гидроксида меди (II) растворимых в воде комплексов василькового цвета.
Строение одноатомных спиртов такая качественная реакция не подтверждает.
Применение спиртов
Метанол, или древесный спирт, опасен для употребления. Он был получен путем перегонки твердых древесных пород. Этот одноатомный спирт недобросовестные производители алкогольных напитков применяют вместо этанола, что провоцирует гибель потребителей. Древесный спирт в организме под влиянием фермента алкогольдегидрогеназы преобразуется в формальдегид и муравьиную кислоту, которые провоцируют слепоту. 50 мл метанола – смертельная доза. Метанол непросто отличить от этанола, т.к. они имеют схожий запах и вид.
Применение метилового спирта
Области применения этилового спирта разнообразны. Этиловый спирт используют в получении синтетического каучука, лекарственных препаратов и применяют как растворитель. Этанол используется в изготовлении алкоголя. При попадании в организм он снижает болевые ощущения, уменьшает торможения в коре головного мозга, ускоряет мочеобразование, провоцирует расширение кровеносных сосудов. При больших количествах этанола происходит его окисление до ацетальдегида, что вызывает тяжелые отравления.
При систематическом употреблении алкоголя снижается работоспособность головного мозга, а клетки печени погибают. Дети и подростки, употребляющие алкоголь, подвержены инфекционным заболеваниям. Продолжительность жизни пьющих людей меньше на 10-12 лет по сравнению с людьми, ведущих здоровый образ жизни.
Применение этилового спирта.
Практическое применение трехатомный спирт глицерин нашел в косметической, медицинской и пищевой промышленности. Он смягчает и успокаивает кожу. Также глицерин входит в состав зубной пасты, что предотвращает ее высыхание.
Применение глицерина
Многоатомный спирт глицерин также применяют в промышленной отрасли для предотвращения кристаллизации продуктов. Его используют как увлажнитель для табака. Он входит в состав клеев и предохраняет их от слишком быстрого высыхания.
…
Спирты (алкоголи) – это углеводороды, строение которых отражается наличием по крайней мере одной гидроксильной группы –ОН, присоединенной к углеводородной цепи. Далее детально рассмотрим какова классификация, строение, изомерия и номенклатура спиртов.
Классификация спиртов
Классификация по строению связанной с ОН – группой углеводородной цепи:
• Предельные спирты. Гидроксильная группа связанна насыщенной углеродной цепью, например, этанол, изопропанол, третбутанол, вторбутанол:
• Непредельные спирты. Гидроксильная группа связанна с углеродной цепью, в составе которой имеется одна или несколько кратных связей, например, аллиловый и пропаргиловый спирты:
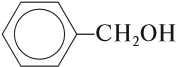
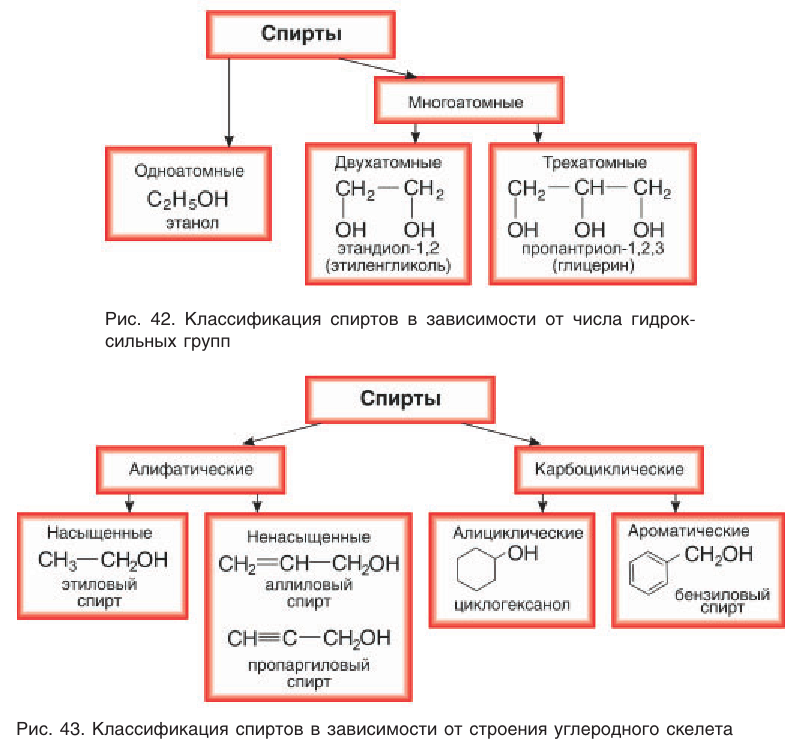
• Ароматические спирты. Группа – CH2OH связанна с ароматической структурой, например, бензиловый спирт, 1-фенилэтанол-1, 2-метил-2-фенилпропанол:
Классификация по количеству ОН – групп в молекуле
• Одноатомные спирты. В молекуле присутствует только одна гидроксильная группа, например, третбутанол, пропинол, бензиловый спирт (структурные формулы представлены выше).
• Многоатомные спирты. В молекуле присутствует более двух гидроксильных групп, например, этиленгликоль (1,2-этандиол), глицерин (1,2,3-пропантриол), пинакон (2,3-диметилбутандиол-2,3):
Многоатомные спирты, в молекуле которых каждая группа – ОН соединена с различными атомами углерода стабильны.
Если две ОН – группы находятся у одного атома углерода, то такие соединения не отличаются стабильностью. В этом случае происходит отщепление молекулы воды и переход в более устойчивый альдегид.
Молекул спиртов, в которых у одного атома углерода находятся одновременно три ОН – группы не существуют.
Классификация спиртов по характеру связанного с гидроксильной группой углеродного атома
• Первичные. ОН — группа связана с первичным атомом углерода (т.е. связанным еще с одним атомом углерода), например, пентанол-1, 2-метилбутанол-1:
• Вторичные. ОН — группа связана со вторичным атомом углерода (атом углерода связан с двумя другими атомами углерода), например, втор-пропанол, втор-бутанол, 1,2-диметилбутанол-1:
• Третичные. ОН-группа связана с третичным атомом углерода (связанным с тремя другими атомами углерода), например, трет-бутанол, 1,1,2-триметилбутанол-1:
Гидроксильные группы аналогично называют первичной, вторичной и третичной.
Молекулы многоатомных спиртов одновременно могут содержать и первичные и вторичные группы ОН, например, в глицерине две ОН – группы – первичные и одна вторичная.
Общая молекулярная формула спиртов:
• Насыщенные одноатомные спирты — CnH2n+1OH
• Ненасыщенные одноатомные спирты (одна двойная связь) – CnH2n-1OH
• Многоатомные насыщенные спирты — CnH2n+1(OH)k, где k – целое число более 2.
Строение спиртов
В молекуле предельного спирта атомы углерода и кислорода находятся в состоянии sp3 – гибридизации.
Две гибридные орбитали атома кислорода заняты неподеленными электронными парами, две другие свободны для связывания с другими атомами:
Для примера приведем строение этанола:
Угол Н-С-Н составляет 109,5°, С-O-H – 108,9° (в молекуле воды угол Н-О-Н равен 104,5°).
Изомерия и номенклатура спиртов
Изомерия спиртов зависит от строения углеродной цепи (изомерия углеродного скелета) и положения —ОН в цепи (функциональная изомерия). Кроме этого, для них характерна межклассовая изомерия (спирты изомерны простым эфирам).
Например, соединение состава С4Н10О имеет следующие изомеры:
Как и другие органические соединения, спирты называют как по правилам рациональной номенклатуры (как замещенные метилового спирта — карбuнола), так и номенклатуры ИЮПАК. Для некоторых из них существуют тривиальные названия.
Наиболее часто используется систематическая номенклатура ИЮПАК. В общем виде, используя правила этой номенклатуры, название можно построить в несколько этапов:
• Назвать самую длинную углеродную цепь, содержащую атом углерода, несущий группу —OH.
• Отбросить окончание -ан от названия соответствующего алкана и добавить суффикс -ол. Если гидроксильных групп несколько, до добавить числительное, показывающее количество ОН-групп (-диол, -триол и т.д.)
• Найти и пронумеровать самую длинную углеродную цепь, начиная с конца, ближайшего к группе —OH.
• При необходимости указать положение группы -OH.
• Назвать заместители, указать их количество и положение.
Например, назовем следующие соединения:
Самая длинная цепочка состоит из девяти атомов углерода, поэтому название корня – нона, суффикс -ол.
Группа —ОН находится у четвертого углеродного атома – нонанол — 4.
Также в данном соединении присутствует метильная и этильная группы у четвертого и шестого атомов углерода соответственно, а также атом хлора у третьего атома углерода.
Таким образом, полное название по системе IUPAC – 4-метил-6-этил-3-хлорнонанол-4
Нумеруем самую длинную цепочку с ближайшего к гидроксильной группе конца.
Она состоит из восьми атомов углерода, поэтому название корня – окта, суффикс -диол, т.к. в соединении содержится две ОН-группы.
Группы —ОН находятся у третьего и пятого углеродных атомов, значит это – октандиол – 3,5.
Также в данном соединении присутствуют две метильные группы у пятого и шестого атомов углерода.
Итак, полное название по систематической номенклатуре IUPAC – 5,6-диметилоктандиол-3,5.
В таблице ниже приведены тривиальные названия некоторых спиртов, названия по рациональной и систематической номенклатурам:
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
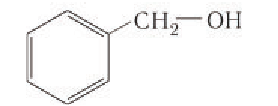
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация спиртов
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3.
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода. Например, этанол СН3–СН2–ОН.
- Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.
Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации.
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):
Изомерия спиртов
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
Например. Пропанол-1 и пропанол-2
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды.
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, этанол взаимодействует с калием с образованием этилата калия и водорода.
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
Например, этилат калия разлагается водой:
CH3OH > первичные спирты > вторичные спирты > третичные спирты
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди:
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
Например, этанол реагирует с бромоводородом.
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
третичные > вторичные > первичные > CH3OH.
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
Например, этиленгликоль реагирует с бромоводородом:
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
Например, при взаимодействии этанола с аммиаком образуется этиламин.
2.3. Этерификация (образование сложных эфиров)
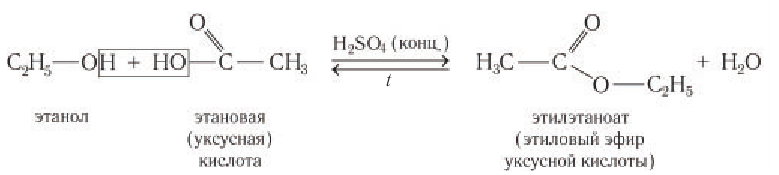
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля:
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат:
Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин):
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен:
В качестве катализатора этой реакции также используют оксид алюминия.
Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2:
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир:
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Первичный спирт → альдегид → карбоновая кислота
Метанол → формальдегид → углекислый газ
Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, этанол окисляется оксидом меди до уксусного альдегида
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
Например, при окислении пропанола-1 образуется пропаналь
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси.
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ
Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота
Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + 3n/2O2 → nCO2 + (n+1)H2O + Q
Например, уравнение сгорания метанола:
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Например, при дегидрировании этанола образуется этаналь
Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль)
Получение спиртов
1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол
Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана:
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Например, при взаимодействии этилена с водой образуется этиловый спирт.
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
Например, при гидрировании этаналя образуется этанол
Например: при гидрировании ацетона образуется изопропанол
Например, гидрирование диальдегида – один из способов получения этиленгликоля
4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).
5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат)
Содержание:
Спирты:
Углеводороды образуют различные функциональные производные при замещении в молекуле одного или нескольких атомов водорода на функциональную группу
Спирты и фенолы относятся к монофункциональным гидроксилпроизвод-ным углеводородов.
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
Классификация спиртов
В зависимости от числа гидроксильных групп в молекуле спирты подразделяют на одноатомные, двухатомные, трехатомные, четырехатомные и т. д. (рис. 42). Например:
Спирты, содержащие несколько гидроксильных групп, объединяют общим названием многоатомные спирты.
В зависимости от строения углеродного скелета различают спирты насыщенные, ненасыщенные, ароматические (рис. 43).
Насыщенные спирты — производные алканов, например 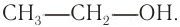
Некоторые одноатомные ненасыщенные спирты, содержащиеся в винограде, из которого производят вина, определяют характерный аромат ряда мускатных вин и рислингов. В процессе старения этих вин одноатомные спирты превращаются в двухатомные. По концентрации образовавшегося двухатомного спирта можно судить о степени старения вина.
К ароматическим относят спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, которые связаны друг с другом через атом углерода, например:
Если в молекулах органических соединений гидроксильные группы связаны непосредственно с атомом углерода бензольного кольца, например:
то такие соединения относят к другому классу органических соединений фенолам.
В лепестках розы (рис. 44) содержится ароматический фенилэтиловый спирт, формула которого 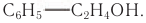
В зависимости от типа атома углерода, с которым связана гидроксильная группа, спирты классифицируют как первичные, вторичные, третичные.
Гидроксильная группа в молекулах первичных спиртов связана с первичным атомом углерода, в молекулах вторичных спиртов — с вторичным атомом углерода и в молекулах третичных спиртов — с третичным атомом углерода. Например:
Спирты — производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильную группу —ОН.
Спирты различают по числу гидроксильных групп (атомность спиртов), строению углеродного скелета, типу атома углерода, связанного с гидроксильной группой.
Насыщенные одноатомные спирты
Строение: Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу и содержатся только 
В органической химии известно большое число насыщенных одноатомных спиртов, химический состав и строение которых выражается общей формулой 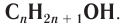
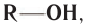
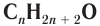
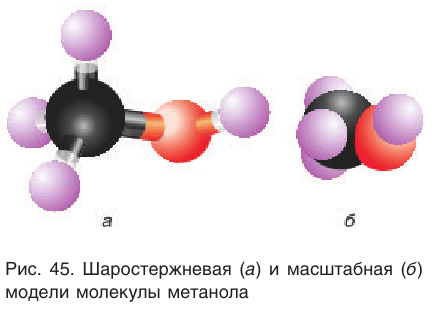
Простейшим представителем данного класса спиртов является метанол 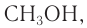
Шаростержневая и масштабная модели молекулы метанола представлены на рисунке 45.
Так как электронное строение алканов и соответствующих им алкильных групп вами уже изучено, то при изучении спиртов — производных алканов — будет рассматриваться только электронное строение функциональной группы спиртов 
В состав функциональной группы спиртов входит атом кислорода, который обладает большой электроотрицательностью и в силу этого оттягивает к себе электронную плотность 
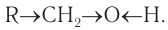
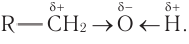
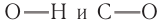
Номенклатура: По правилам номенклатуры ИЮПАК, названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов с добавлением суффикса -ол. Например, 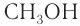
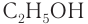
Систематическая номенклатура допускает употребление названий, связанных с названием алкильных групп, для низших членов ряда. Например,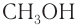
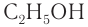
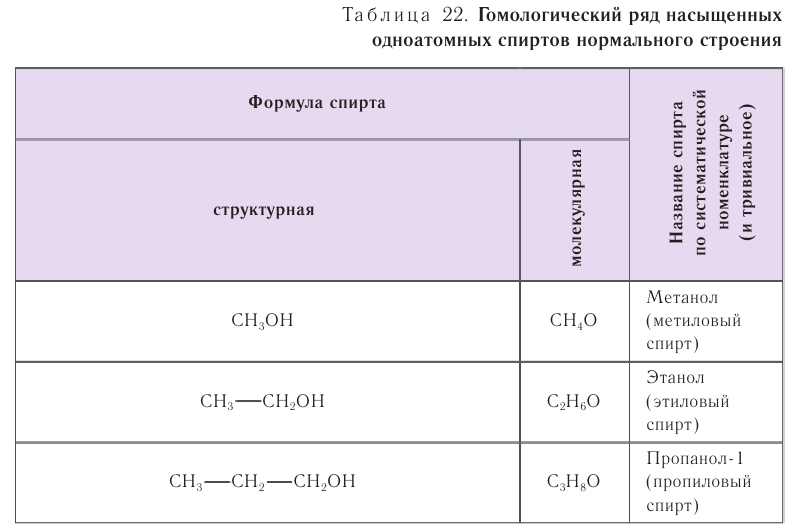
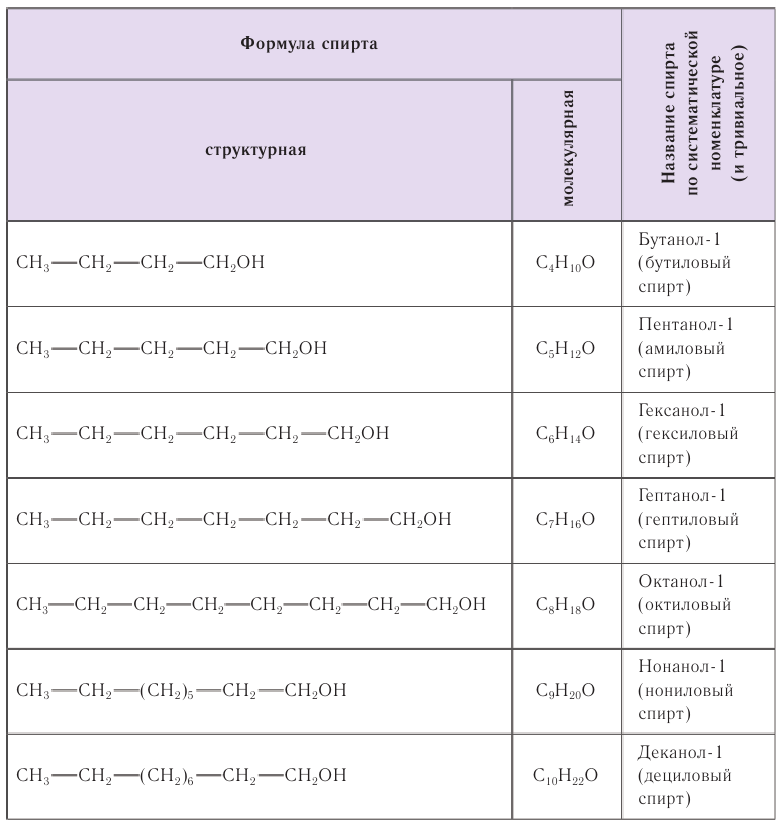
В таблице 22 приведены названия первых десяти представителей гомологического ряда спиртов, у которых функциональная группа —ОН находится у первичного атома углерода, по номенклатуре ИЮПАК и тривиальные.
При названии спиртов с неразветвленной углеродной цепью, начиная с пропанола, цифрой указывается атом углерода, с которым связана гидроксильная группа. Нумерация углеродных атомов начинается с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к названию соответствующего алкана, цифрой указывается положение гидроксильной группы в цепи. Например:
Для названий спиртов с разветвленной углеродной цепью выбирают самую длинную цепь, содержащую функциональную гидроксильную группу, и нумеруют с того конца, ближе к которому расположена гидроксильная группа. Названия спиртов образуют, добавляя суффикс -ол к назанию алкана, соответствующего самой длинной цепи, цифрой указываются атомы углерода, с которыми связана гидроксильная группа и заместители. Названия заместителей перечисляются в алфавитном порядке. Например:
Изомерия: Для насыщенных одноатомных спиртов характерна структурная изомерия. Структурная изомерия спиртов обусловлена изомерией углеродного скелета и изомерией положения гидроксильной группы. Первые два члена гомологического ряда — метанол 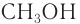
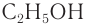
Рассмотрим примеры изомеров спиртов состава 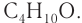
В зависимости от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта:
Общее число структурных изомеров спиртов состава 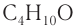
Физические свойства: Первые представители класса насыщенных одноатомных спиртов 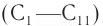
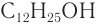
Низшие спирты обладают характерным алкогольным запахом, запах спиртов, стоящих в середине гомологического ряда, сильный и часто неприятный, а высшие спирты (более 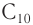
Низшие спирты (
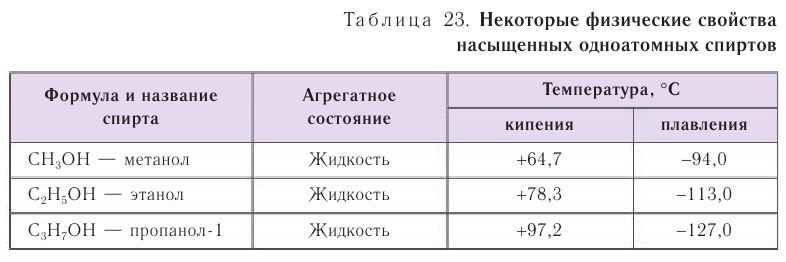
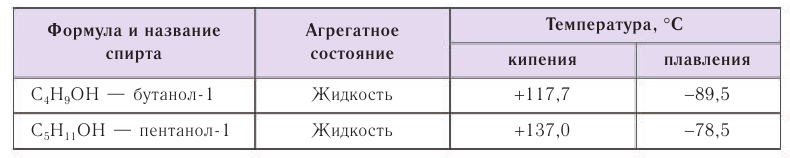
Спирты обладают аномально высокими температурами кипения по сравнению с представителями алканов с приблизительно такой же относительной молекулярной массой. Например, температура кипения этанола 78,3 °С, а пропана -42,2 °С. В таблице 23 приводятся температуры кипения, плавления и агрегатное состояние некоторых спиртов.
Причиной отсутствия газообразных спиртов при нормальных условиях, а также более высоких температур кипения спиртов по сравнению с алканами с одинаковой относительной молекулярной массой являются межмолекулярные водородные связи, характерные для спиртов. Как отмечалось, связь 
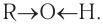
Образованием межмолекулярных водородных связей между молекулами спиртов и полярными молекулами воды (рис. 46, б) объясняется хорошая растворимость низших спиртов, в отличие от углеводородов, которые из-за малой полярности связей С—Н не образуют с водой водородных связей. С увеличением длины цепи алкильных групп растворимость спиртов понижается, и октанол уже не смешивается с водой.
Насыщенными одноатомными спиртами называют производные алканов, в молекулах которых один атом водорода замещен на гидроксильную группу.
Общая формула насыщенных одноатомных спиртов
Структурная изомерия спиртов обусловлена строением углеродного скелета и различным положением гидроксильной группы при одинаковой углеродной цепи.
На физические свойства спиртов большое влияние оказывает водородная связь между молекулами спиртов или молекулами спиртов и воды в их растворах.
Химические свойства спиртов
Характерные реакции спиртов определяются наличием в составе их молекул гидроксильиой группы, атом кислорода которой смещает электронную плотность как от атома водорода, так и от атома углерода. Такая поляризация может способствовать разрыву связей 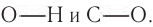
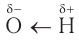
Рассмотрим важнейшие химические свойства спиртов на примере алифатических насыщенных одноатомных спиртов.
Взаимодействие со щелочными металлами: При взаимодействии щелочных металлов 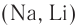

Спирты — очень слабые электролиты, слабее даже, чем вода. Поэтому алкокеиды (алкоголяты) легко разлагаются водой:
При взаимодействии с металлами у спиртов проявляются кислотные свойства, но к классу кислот спирты не относят, так как степень их диссоциации незначительна. Поэтому спирты с водными растворами щелочей взаимодействуют обратимо.
Взаимодействие с карбоновыми и кислородсодержащими минеральными кислотами с образованием сложных эфиров.
В реакции с карбоновыми кислотами от молекулы спирта отщепляется атом водорода, а от молекулы карбоновой кислоты — гидроксильная группа с образованием молекулы воды. Реакция обратима, но равновесие смещается вправо в присутствии концентрированной серной кислоты и при выводе воды из зоны реакции:
В реакциях с кислородсодержащими минеральными кислотами спирты образуют сложные эфиры этих кислот:
Взаимодействие с галогеноводородами с образованием галогеналканов
В реакции с галогеноводородами в молекуле спирта происходит разрыв связи 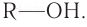
Данная реакция обратима. В этой реакции проявляются слабые основные свойства спирта.
При взаимодействии этанола с бромоводородом образуется бромэтан — тяжелая жидкость:
Внутримолекулярная дегидратация с образованием алкена
Первичные спирты дегидратируются под действием катализатора — концентрированной серной кислоты — при высоких температурах (выше 140 °С) с образованием алкена:
Реакция дегидратации обусловлена отщеплением водорода в виде протона и гидроксильной группы от соседних атомов углерода.
Например, в результате внутримолекулярного отщепления молекулы воды от молекулы этанола (под действием катализатора — концентрированной серной кислоты) образуется этен:
Реакции окисления
Спирты горят на воздухе или в кислороде некоптящим пламенем с выделением большого количества теплоты (рис. 48):
С более слабым, чем кислород, окислителем, например с оксидом меди(II), происходит частичное окисление спиртов, при этом первичные спирты окисляются до альдегидов.
Если в пробирку с этанолом опустить раскаленную скрученную в спираль медную проволоку, покрытую черным налетом оксида меди(II), то черный налет на проволоке исчезает. Спираль приобретает розово-красный цвет, при этом чувствуется неприятный запах образовавшегося альдегида:
Под действием таких окислителей, как подкисленный раствор перманганата калия или дихромата калия, первичные спирты окисляются до карбоновых кислот.
Кислотно-основные свойства насыщенных одноатомных спиртов обусловлены наличием в их молекулах функциональной гидроксильной группы.
Спирты взаимодействуют со щелочными металлами, галогеноводородами, карбоновыми и минеральными кислотами; вступают в реакции дегидратации и окисления.
Получение и применение спиртов
Получение: Для промышленного получения спиртов используют ненасыщенные углеводороды, извлекаемые из нефтепродуктов, или галогеналканы.
Познакомимся с основными общими промышленными и лабораторными способами получения насыщенных одноатомных спиртов и специфическими способами получения этанола и метанола.
1) Одним из наиболее важных общих промышленных способов получения спиртов является гидратация алкенов.
Этанол получают гидратацией этена водяными парами при повышенной температуре (280—300 °С), повышенном давлении (7—8 мПа) и в присутствии катализатора
Спирт, полученный из этена, называют синтетическим.
2) В пищевой промышленности этанол получают характерным только для него способом при спиртовом брожении глюкозы под действием ферментов, выделяемых некоторыми видами дрожжевых грибков:
Брожению подвергают виноградный сок, содержащий глюкозу, а также картофельный крахмал, который превращается в глюкозу под действием особого фермента. Этанол, полученный при ферментативном расщеплении различных пищевых продуктов, используют в основном для изготовления спиртных напитков.
В промышленности этанол производят гидролизным способом из древесных опилок, отходов целлюлозно-бумажной промышленности и т. д. Содержащуюся в древесине целлюлозу подвергают гидролизу с образованием глюкозы, которую далее подвергают брожению, и получают этанол, называемый гидролизным спиртом.
3) В промышленности метанол получают характерным только для него способом при взаимодействии водорода с угарным газом (СО) при повышенном давлении и высокой температуре в присутствии катализатора:
Смесь угарного газа и водорода, взятых в количественном соотношении 1 : 2, называют синтез-газом.
Историческое название метанола — древесный спирт. Оно указывает на старый способ получения спирта — сухую перегонку древесины твердых пород дерева (нагревание древесины без доступа воздуха).
Для получения спиртов в лаборатории используют галогеналканы.
При гидролизе моногалогеналканов с галогеном при первичном атоме углерода в водных растворах щелочей при нагревании образуются первичные спирты:
Гидролиз галогеналканов, проводимый в присутствии щелочи, является практически необратимым процессом и используется как общий метод получения первичных насыщенных спиртов в лаборатории.
Применение: Спирты находят широкое применение. В химической промышленности спирты — исходные вещества для разнообразных синтезов. Во многих производствах спирты применяют в качестве растворителей. Рассмотрим несколько примеров промышленного использования важнейших насыщенных одноатомных спиртов.
Метанол (метиловый спирт) 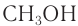
Метанол — прекрасный растворитель для многих органических и неорганических веществ.
Необходимо знать, что метанол — сильнейший яд. Употребление даже нескольких граммов метанола приводит к слепоте, а затем и смерти. Вот поэтому на банках, в которых хранится этот спирт, используемый для технических нужд, имеется надпись: «Метанол — яд». Это должно служить серьезным предостережением при работе с ним.
Этанол (этиловый спирт) 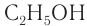
Этанол является исходным веществом в промышленном органическом синтезе (диэтиловый эфир, этилацетат и другие эфиры и т. д.), окислением этанола получают пищевую уксусную кислоту.
Спирт-ректификат, получаемый в промышленности, представляет собой смесь этанола (массовая доля 95,6 %) и воды (массовая доля 4,4 %). Безводный спирт называют абсолютным спиртом.
Следует помнить, что этанол — своего рода наркотик, возбуждающе действующий на организм человека. Даже небольшие дозы снижают остроту зрения, замедляют реакции и уменьшают способность здраво рассуждать. Длительное употребление спирта вызывает тяжелые заболевания нервной и сердечно-сосудистой систем, разрушение печени и приводит к преждевременной смерти.
В этанол, применяемый для технических целей, специально добавляют небольшие количества трудноотделяемых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатуратом. Употребление денатурата смертельно опасно.
Другие (низшие) спирты используются в качестве растворителей при изготовлении различных лаков и красок на предприятиях лакокрасочной промышленности, одним из которых является ОАО «Лакокраска» в Лиде.
Высшие спирты (
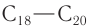


Ненасыщенный аллиловый спирт 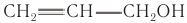
В промышленном масштабе этанол получают гидратацией этена, гидролизным способом, в процессе спиртового брожения глюкозы.
Метанол в промышленных масштабах в основном получают из синтез-газа.
В лаборатории первичные насыщенные одноатомные спирты получают в процессе щелочного гидролиза моногалогеналканов.
Спирты используют для синтеза многих органических веществ.
Решение расчетных задач
В параграфе рассмотрены образцы решения задач таких типов, как расчеты по химическим уравнениям, если одно из реагирующих веществ взято в избытке, и определение молекулярных формул органических веществ на основании качественного и количественного состава.
Пример 1.
Определите массу бромэтана, полученного в реакции, для которой был взят этанол массой 5,98 г и бромоводород объемом (н. у.)
Решение
1. Общие формулы, используемые при расчетах:
2. Значения молярных масс веществ, молярный объем:
3. Определяем химические количества спирта и бромоводорода, взятых для реакции:
4. На основе анализа уравнения реакции определяем, какое из веществ взято в избытке, а затем рассчитываем химическое количество и массу продукта реакции:
Следовательно, спирт взят в избытке. Расчеты продукта реакции проводятся исходя из данных о химическом количестве хлороводорода:
Ответ:
Пример 2.
Массовая доля углерода в насыщенном одноатомном спирте равна 0,6. Определите молекулярную формулу спирта. Составьте структурные формулы возможных изомеров и назовите их по номенклатуре ИЮПАК.
Решение
1. Для решения задачи используем общую формулу 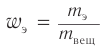
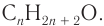
2. Определяем формулу искомого спирта.
Общая формула 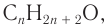
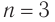
Изомеры:
Ответ:
Пример 3.
В результате ряда последовательных реакций из алкана массой 69,6 г получен первичный насыщенный одноатомный спирт массой 88,8 г с тем же числом атомов углерода в молекуле, что и у алкана (алкан 

Решение
1. Из алкана химическим количеством 1 моль получают спирт химическим количеством 1 моль:
2. Разница масс взятого и полученного веществ равна 19,2 г (88,8 — 69,6). Разница молярных масс спирта и алкана равна 16, что хорошо видно при анализе общих формул алканов и насыщенных одноатомных спиртов:
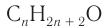
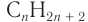
3. Используя общую формулу 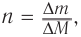
4. Зная химическое количество и массу спирта, определяем его молярную массу и молекулярную формулу:
Решая уравнение
Следовательно, молекулярная формула спирта — 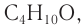
Ответ:
Пример 4.
При гидратации алкена массой 22,68 г получили вторичный насыщенный одноатомный спирт массой 32,40 г. Определите молекулярную формулу спирта, составьте структурную формулу и назовите спирт по номенклатуре ИЮПАК.
Решение
1. Анализ уравнения реакции гидратации, записанного в общем виде, показывает, что для гидратации алкена химическим количеством 1 моль требуется вода химическим количеством 1 моль. Следовательно, разница масс алкена и спирта и есть масса присоединенной воды:
2. Определяем химическое количество воды и спирта, далее молярную массу и молекулярную формулу спирта:
Следовательно,
Решая уравнение 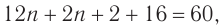
Молекулярная формула спирта — 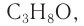
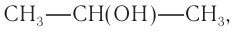
Ответ:
Пример 5.
Определите молекулярную формулу органического вещества, относительная плотность паров которого по гелию равна 22, если при сгорании его массой 19,36 г образовались углекислый газ объемом (н. у.) 2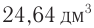
Решение
1. Определяем молярную массу неизвестного вещества, его химическое количество, а также химические количества образовавшихся оксида углерода (IV) и воды:
2. Проанализируем схему реакции горения вещества, предположив, что сожгли углеводород химическим количеством 1 моль. На основе данных о продуктах реакции рассчитаем количественный состав вещества:
Формула вещества —
3. Молярная масса вещества 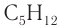
Ответ:
Многоатомные спирты
Строение: Производные углеводородов, в молекулах которых два и более атомов водорода у соседних атомов углерода замещены на гидроксильные группы, называют многоатомными спиртами.
Гидроксильные группы во всех устойчивых многоатомных спиртах связаны с соседними атомами углерода.
Простейшим представителем двухатомных спиртов (гликолей) является этиленгликоль, структурная формула которого:
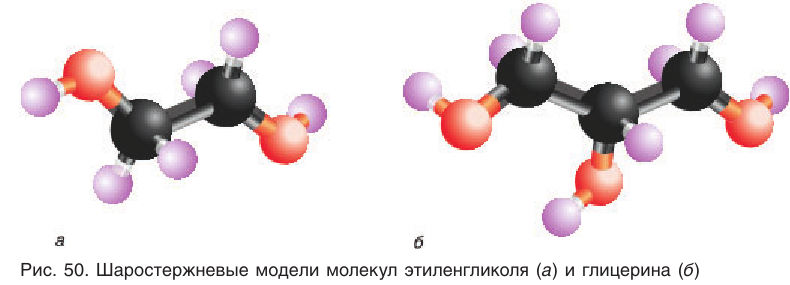
Шаростержневая модель молекулы этиленгликоля приведена на рисунке 50, а.
Простейшим представителем трехатомных спиртов (глицеринов) является глицерин (от греч. glykeros — сладкий), структурная формула которого:
Шаростержневая модель молекулы глицерина приведена на рисунке 50, б.
На примере этих двух спиртов вы познакомитесь с основными характеристиками многоатомных спиртов.
Номенклатура: По номенклатуре ИЮНАК двухатомный спирт 
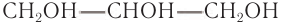
Физические свойства: Этиленгликоль и глицерин — бесцветные вязкие жидкости, тяжелее воды, неограниченно растворимы в воде, хорошо растворяются в этаноле. Эти свойства присущи и другим многоатомным спиртам.
Этиленгликоль ядовит, его водные растворы не кристаллизуются при низких температурах, что позволяет применять его как компонент незамерзающих жидкостей — антифризов. Глицерин имеет сладковатый вкус, гигроскопичен, нелетуч.
Впервые глицерин был получен из оливкового масла шведским химиком и фармацевтом К. Шееле в 1783 г.
Хорошая растворимость этиленгликоля и глицерина в воде объясняется наличием межмолекулярных водородных связей между молекулами спиртов и воды. Число таких связей больше, чем у одноатомных спиртов, из-за большего числа гидроксильных групп в молекулах.
Температуры кипения этих спиртов по сравнению с одноатомными спиртами с таким же числом атомов угелерода в молекуле намного выше:
Причиной более высоких температур кипения многоатомных спиртов является большее число межмолекулярных водородных связей между молекулами спиртов за счет большего числа гидроксильных групп в составе молекул.
Химические свойства: Для этиленгликоля и глицерина характерны все реакции одноатомных спиртов, обусловленные наличием функциональной группы —ОН, и особые свойства, обусловленные одновременным присутствием в молекуле нескольких гидроксильных групп.
1) Взаимодействие со щелочными металлами. Многоатомные спирты реагируют с активными металлами с образованием соединений, которые по аналогии с алкоголятами называют гликолятами и глицератами. Названия «гликоляты» и «глицераты» допускаются в номенклатуре ИЮНАК.
В реакциях могут участвовать одна или более гидроксильных групп. Многоатомные спирты, как и одноатомные, проявляют кислотные свойства в реакциях со щелочными металлами.
2) Взаимодействие с основаниями. В отличие от одноатомных спиртов, этиленгликоль и глицерин реагируют не только со щелочными металлами, но и с нерастворимыми гидроксидами тяжелых металлов. Такие реакции возможны для многоатомных спиртов, потому что из-за взаимного влияния гидроксильных групп в молекуле их кислотность выше, чем у одноатомных спиртов.
Если в стакан с раствором щелочи добавить несколько капель раствора сульфата меди(II) и к образовавшемуся гидроксиду меди(II) прилить многоатомный спирт, например глицерин, то образуется прозрачный раствор ярко-синего цвета (рис. 51). Цвет раствора обусловлен образованием комплексного соединения меди.
Реакция со свежеприготовленным гидроксидом меди(II) является качественной реакцией на многоатомные спирты с гидроксильными группами, находящимися у соседних атомов углерода. Из-за сложности строения образовавшегося глицерата меди уравнение реакции не приводится.
3) Образование сложных эфиров. Для многоатомных спиртов, как и для одноатомных, характерно образование сложных эфиров при взаимодействии с кислородсодержащими минеральными кислотами и карбоновыми кислотами. В частности, в реакции глицерина с избытком азотной кислоты в присутствии каталитических количеств серной кислоты образуется глицеринтринитрат, известный под названием нитроглицерин:
Название «нитроглицерин» относится к тривиальным названиям, оно не отражает строение вещества. Известно, что в химии к нитросоединениям относят вещества, в которых группа —
Реакцию глицерина с карбоновыми кислотами е образованием сложных эфиров вы будете рассматривать при изучении темы «Жиры».
Получение: Двухатомные и трехатомные спирты можно получать теми же способами, что и одноатомные спирты. В качестве исходных веществ используются алкены и галогеналканы.
Лабораторные способы: Общим способом получения гликолей является окисление алкенов раствором перманганата калия в слабощелочной или нейтральной среде:
Этиленмиколь также получают гидролизом соответствующего дигалогеналкана:
Промышленные способы. Глицерин получают в процессе гидролиза жиров и синтетическим способом из пропена, образующегося при крекинге нефтепродуктов.
Этиленгликоль в промышленных масштабах получают гидратацией эпоксида 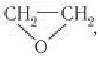
Применение: Этиленгликоль используют для синтеза полимерных материалов, синтетических волокон, например лавсана; в качестве антифризов (от анти — против и англ. freeze — морозить, замерзать) — жидкостей, добавляемых в воду, чтобы понизить температуру замерзания. Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей. Температура замерзания антифриза с объемной долей этиленгликоля 52,5 % равна -40 °С. Этиленгликоль применяют для получения пластификаторов (смягчителей), используемых в лакокрасочной промышленности.
Применение глицерина основано на его гигроскопичности. Его используют для приготовления мазей, в кожевенном производстве — для предохранения кож от высыхания, в текстильной промышленности — для отделки тканей с целью придания им мягкости и эластичности и др. Глицерин применяют при изготовлении косметики, где он играет роль смягчающего и успокаивающего средства; как добавку к зубной пасте, клеям, чтобы предохранить их от быстрого высыхания; для приготовления антифризов.
Незамерзание клеточной жидкости иногда объясняют усиленной выработкой глицерина в растительных клетках.
Большое количество глицерина идет на получение нитроглицерина, который служит сырьем при производстве бездымных порохов и динамита.
Нитроглицерин токсичен, но в малых дозах используется как лечебное средство, так как расширяет кровеносные сосуды сердечной мышцы и тем самым улучшает кровоснабжение сердца.
Многоатомными спиртами называют производные углеводородов, в молекулах которых содержится несколько гидроксильных групп, связанных с соседними атомами углерода.
Многоатомные спирты взаимодействуют с активными металлами, щелочами, гидроксидами тяжелых металлов, кислородсодержащими неорганическими кислотами и карбоновыми кислотами.
Реакция с гидроксидом меди(II) используется для качественного обнаружения многоатомных спиртов.
Этиленгликоль применяют для получения синтетического волокна лавсан, в качестве антифриза; глицерин используется во многих отраслях промышленности.
- Фенолы в химии
- Альдегиды в химии
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Теория химического строения органических соединений А. М. Бутлерова
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Ароматические углеводороды